胃乙醇脱氢酶δδ-ADH的原核表达及酶学性质
2019-10-30常开霞孙军勇李晓敏吴殿辉朱德伟
常开霞 ,孙军勇 ,李晓敏 ,吴殿辉 ,朱德伟 ,陆 健 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.江南大学 生物工程学院,江苏 无锡 214122)
乙醇脱氢酶(alcohol dehydrogenases,ADH,EC1.1.1.1)是一类以烟酰胺腺嘌呤二核苷酸(NAD)为辅酶、以锌原子为辅基的二聚体酶,是乙醇代谢的关键酶[1]。人体中,乙醇脱氢酶可催化乙醇转化为乙醛,乙醛由乙醛脱氢酶继续催化转化为乙酸,乙酸经过三羧酸循环途径转化为二氧化碳和水排出体外[2]。目前,人体内的乙醇脱氢酶有5大类:ADH I、ADH II、ADH III、ADH IV 和 ADH V, 其中 ADH IV 类由 δδ-ADH 组成,其亚基为 δ(或者 μ)[3-4]。 δδ-ADH是惟一不存在于肝脏的乙醇脱氢酶,它主要分布于胃粘膜细胞中[5]。
随着社交需要和生活压力的增大,一方面酒精饮品的消耗量不断增加,另一方面人们对解酒保肝类物质的需求日益迫切,因而用乙醇脱氢酶来研制解酒药将成为一项重要的应用和发展趋势[6]。目前国内关于人乙醇脱氢酶的研究主要集中在肝脏中的 ADH I类[7-8],其中 ADH1B*2、ADH1C*1 是 I类乙醇脱氢酶中活性最高的两种形式[9],它们也存在于胃粘膜或者胃肌肉细胞中[5]。实验证明[9],当乙醇浓度小于10 mmol/L时,ADH1B*2是各类人乙醇脱氢酶中活性最高的酶;但当乙醇浓度大于10 mmol/L时,δδ-ADH的活性最高。饮酒后,胃中乙醇浓度可达摩尔级水平。研究指出[10],当每千克体重饮入0.8 g纯乙醇时,胃腔中乙醇浓度可以达到1.5 mol/L。在饮酒后乙醇浓度较高的胃环境中,由于乙醇的底物抑制作用,ADH1B*2、ADH1C*1氧化乙醇的作用小于δδ-ADH,δδ-ADH很可能是人体内氧化高浓度乙醇作用最大的一种酶[5,11]。
由于大肠杆菌表达系统与其他表达系统相比具有培养简单、培养周期短、成本低,且目的基因有表达水平高、抗污染能力强等优点[12],因此,作者利用大肠杆菌表达载体对δδ-ADH进行外源表达并对该酶的最适作用温度、最适pH、温度稳定性、pH稳定性及乙醇耐受性进行研究,以期为δδ-ADH的进一步研究奠定一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 δδ-ADH的基因来源通过NCBI获得δδ-ADH编码基因ADH7的序列 (GenBank登录号:L47166.1),委托生工生物工程(上海)股份有限公司合成,5’端和3’端分别预设计酶切位点BamHI和SalI。
1.1.2 质粒及其他试剂质粒pMD19T-simple、pET-32a(+)、E.coliJM109、E.coliBL21(DE3):均由作者所在实验室保藏。细菌质粒提取试剂盒、质粒提取试剂盒、胶回收试剂盒,限制性内切酶、DNA聚合酶、T4连接酶、异丙基硫化-β-D-半乳糖苷(IPTG),DNA Marker、标准蛋白质 Marker:均购自大连宝生物技术有限公司;其他化学试剂:均为国产或进口分析纯。
1.2 方法
1.2.1 重组表达载体的构建为了提高酶切效率,首先将ADH7与克隆载体pMD19T-simple连接,获得重组质粒pMD19T-ADH7。利用BamHI和SalI将pMD19T-ADH7和pET-32a(+)分别进行双酶切后,回收目的片段ADH7和pET-32a(+)质粒片段,经T4连接酶连接构建重组表达载体pET-32a(+)-ADH7,并通过化学方法转化大肠杆菌E.coliBL21(DE3),将转化液涂布在含氨苄青霉素(100 μg/L)的LB固体培养基上,经37℃过夜培养后,挑选转化子进行菌落PCR验证。
菌落PCR反应时,首先经95℃预变性5 min,之后于94℃变性30 s,52℃退火30 s,72℃延伸1 min 20 s,循环30次,然后在72℃延伸10 min。最后PCR产物用1 g/dL的琼脂糖凝胶电泳检测。
1.2.2 大肠杆菌的诱导表达[2]挑取含重组表达质粒(pET-32a(+)-ADH7)及空质粒(pET-32a(+))的阳性转化子,分别接种于3 mL含100 μg/L氨苄青霉素的LB液体培养基中,37℃、200 r/min振荡培养过夜,然后按1%的接种体积分数进行扩大培养,当菌液浓度达到OD600值为0.6时加入IPTG (终浓度为1 mmol/L),并于37℃继续培养6 h。
1.2.3 包涵体的制备与目的蛋白质的纯化
1)包涵体的制备[13-14]:菌液离心后去上清液,用破胞液 (50 mmol/L Tris-HCl,150 mmol/L NaCl,10 mmol/L EDTA,pH 8.0)重悬菌体并将其冰浴超声破碎 14 min(超声 3 s,间隔 6 s,功率 350 W),8 000 r/min、4℃下离心15 min,收获粗包涵体沉淀。沉淀经包涵体洗涤液 (50 mmol/L Tris-HCl,150 mmol/L NaCl,2 mol/L尿素 ,0.5%Triton X-100,1 mmol/L EDTA,pH 8.0)冲洗一次,再经水洗一次后于8 000 r/min、4℃下离心15 min,收获的沉淀即为纯化的δδ-ADH包涵体,并利用含低浓度尿素的溶解液溶解包涵体,离心取上清液获得含有重组目的蛋白质的粗酶液。
2)目的蛋白质的纯化:载体 pET-32a(+)中含有S tag,His tag以及Trx tag三种标签(共18 000)。作者以His tag为纯化标签,选用1 mL HisTrapTMexcel亲和色谱柱对目的蛋白质进行分离纯化。上样前首先用结合液 (500 mmol/L NaCl,10 mmol/L咪唑,20 mmol/L磷酸钠缓冲液,pH 7.4)平衡镍柱,上样量10 mL,上样流速为0.5 mL/min。再用5倍柱体积的结合液冲洗,最后用15倍柱体积的洗脱缓冲液 (500 mmol/L NaCl,500 mmol/L 咪唑,20 mmol/L磷酸钠缓冲液,pH 7.4)线性梯度洗脱结合蛋白质,洗脱流速为1 mL/min。上样后开始收集流出液(每管收集1 mL),并通过SDS-PAGE电泳检验分离效果。
1.2.4 乙醇脱氢酶活性检测ADH催化乙醇脱氢生成乙醛的同时,NAD+被还原成NADH,鉴于NAD+和NADH分别在260 nm及340 nm处有各自的最大吸收峰,因此测定340 nm处吸光度的增加值可反映ADH的活性[2]。
乙醇脱氢酶δδ-ADH的酶活测定参照文献[11]中的方法并稍作修改,酶活测定前,先将一定体积的 0.1 mol/L 甘氨酸/NaOH(pH10.0)缓冲液、NAD+及乙醇溶液于25℃温浴5 min,以确保反应开始时混合液即达到所需温度。然后向混合液中加入酶液,于25℃反应5 min,沸水浴终止反应并用分光光度计在340 nm测定吸光值,见表1。酶活定义:一个乙醇脱氢酶酶活相当于25℃、1 min氧化NAD+生成1 μmol NADH所需的酶量。
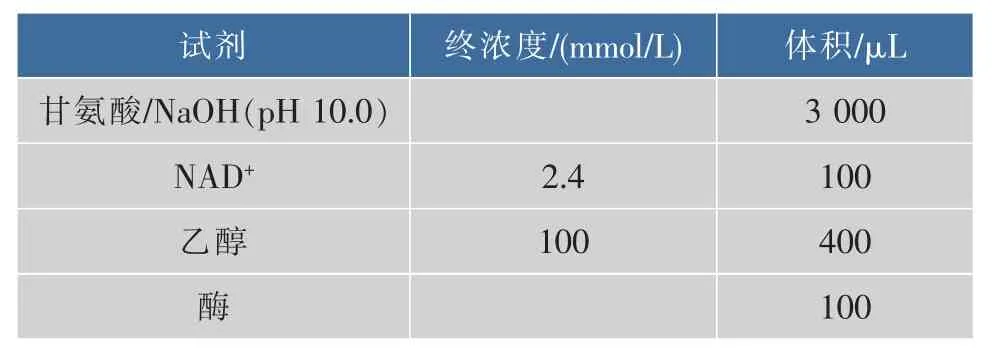
表1 乙醇脱氢酶酶活测定体系Table 1 Alcohol dehydrogenase enzyme activity assay system
采用考马斯亮蓝法[6]测定蛋白质质量浓度,根据以下公式[15]计算酶比活力:
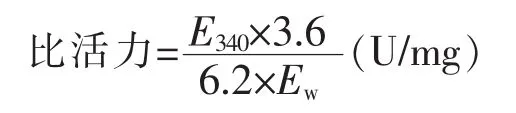
式中,E340:340 nm 处每分钟吸光值的增大值;Ew:100 μL 酶液中酶的质量 (mg);6.2:NADH 在 340 nm 下的毫摩尔吸光系数(mmol-1·cm-1);3.6:试液的总体积(mL)。
1.2.5 乙醇脱氢酶酶学性质研究对重组酶的Km、最适反应温度、最适反应pH、温度稳定性[16](温度范围30~50℃)、pH稳定性(广泛缓冲液pH范围3.0~11.0)、乙醇耐受性(0、500、1 000、1 500 mmol/L)进行研究,并计算相对酶活。
乙醇耐受性实验是将200 μL酶液分别与100 μL不同浓度的乙醇混合,使混合液中的乙醇终浓度分别为 0、500、1 000、1 500 mmol/L, 将混合液置于37℃水浴一定时间后取100 μL混合液测定剩余酶活。酶活测定时,加入反应体系中的乙醇浓度分别做相应调整,以确保参与反应的乙醇浓度一致且为100 mmol/L。
2 结果与分析
2.1 原核表达载体的构建及鉴定
将 δδ-ADH的编码基因 ADH7与 pMD19T-simple载体连接,转化E.coliJM109,选择阳性克隆进行酶切验证,结果见图1。得到一条1 100 bp大小的目的条带,与预期大小一致,测序结果证实重组质粒构建正确。

图1 pMD19T-ADH7双酶切电泳图Fig.1Plasmid pMD19T-ADH7 digested by double enzymes
将重组质粒pMD19T-ADH7转化E.coliBL21(DE3),涂布菌液于含有100 μg/L氨苄青霉素的LB固体培养基上,挑选转化子进行菌落PCR验证。由图2可知,转化子克隆出1 100 bp大小的条带,说明重组质粒转化成功。

图2 工程菌菌落PCR扩增产物电泳图Fig.2 PCR product of engineering bacteria colony
2.2 大肠杆菌的诱导表达及诱导条件优化
阳性菌(pET-32a(+)-ADH7)于 37 ℃经 IPTG(终浓度1 mmol/L)诱导6 h,对发酵液上清液、全细胞、细胞破碎上清液及包涵体进行SDS-PAGE电泳分析,见图3。 结果显示,与对照菌株(pET-32a(+))相比,阳性菌在59 000附近出现一条新带,且表达产物存在于阳性菌的包涵体中。经分析可知,产物大小符合目的蛋白质单亚基 (41 000)与融合标签(18 000)之和,与文献[17]报道相符,因此初步判定阳性菌的表达产物为目标蛋白质。

图3 SDS-PAGE电泳图谱Fig.3 SDS-PAGE of δδ-ADH in different conditions
大肠杆菌可以在短时间里大量表达重组蛋白质,但同时表达的蛋白质常常形成非活性的包涵体。包涵体形成与强的表达系统、高的诱导剂浓度以及相对较高的培养温度有关[18]。为探索增加细胞中可溶性目的蛋白质含量的诱导条件,将种子液接种于发酵培养基中摇床培养至OD600约为0.6后,对诱导剂浓度(IPTG 浓度分别为 0.05、0.1、0.5、1 mmol/L)、诱导温度(诱导温度分别为 15、20、25、30 ℃)及诱导时间(诱导时间分别为 2、4、6、8、10 h)进行了优化,结果显示降低IPTG浓度、降低诱导温度并不能增加细胞中可溶性目的蛋白质的含量。综合诱导剂成本及蛋白表达量,选择的诱导条件是IPTG浓度为0.1 mmol/L、诱导温度30℃、诱导时间为4 h。
2.3 重组δδ-ADH的纯化
前期实验采用传统的方法[13-14]制备粗酶液,即先用含2 mol/L尿素的包涵体洗涤液清洗杂蛋白质,再用含8 mol/L尿素的缓冲液溶解包涵体,然而溶解液经稀释复性后得到的粗酶液无活性。由于高浓度的变性剂会严重破坏重组蛋白质的二级结构,产生不可逆变性从而导致包涵体无法复性[19],因此改用低浓度的尿素溶解包涵体,得到了有活性的包涵体溶解液。
用1 mol/L的尿素溶解包涵体,将该包涵体溶解液于8 000 r/min离心15 min,收集上清液得到有活性的粗酶液,酶比活力为0.202 U/mg。这说明包涵体中本身存在着近似天然的蛋白质二级结构,它以介于变性和复性状态之间的中间体形式存在[20],而用低浓度尿素在溶解蛋白质聚集体的同时使蛋白质天然的二级结构得以保留,从而使粗酶液表现出了酶活性。粗酶液经镍柱亲和层析纯化,上样后开始收集流出液得到两个峰,见图4,穿透峰(第4~14管)和洗脱峰(第21~24管)。分别收集两个峰的流出液进行SDS-PAGE电泳检测,见图5。结果显示洗脱峰中含有目标蛋白质。
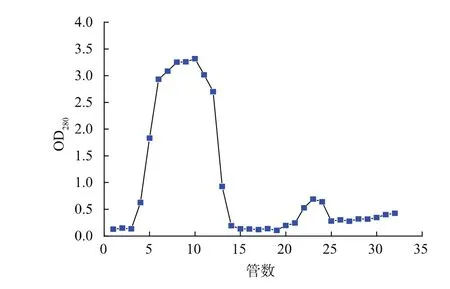
图4 HisTrapTMexcel色谱柱色谱图谱Fig.4 Profiles of HisTrapTMexcel chromatography of proteins extracted from recombinant strain

图5 乙醇脱氢酶δδ-ADH纯化后的SDS-PAGE电泳Fig.5 SDS-PAGE of δδ-ADH after purification
2.4 乙醇脱氢酶活性检测及酶学性质
对δδ-ADH的活性进行检测并对其酶学性质进行研究。结果表明,纯化后酶活为2.085 U/mg。利用不同浓度的乙醇(1、3、5、7、9、10 mmol/L)为底物,采用双倒数作图法(图6)所得方程为y=0.003 16+0.089 84x(r=0.997 0),求得 δδ-ADH 的米氏常数Km为 28.43 mmol/L,Vmax为 316.46 μmol/(L·min)。

图6 米氏常数的双倒数作图法Fig.6 Lineweaver-Burk plot for Km
温度对δδ-ADH活性的影响见图7。在25~40℃范围内,δδ-ADH的活性随着温度的升高而增高,在40℃时活性达到最大,超过40℃酶活不断下降。
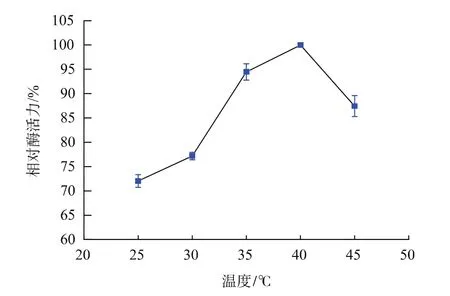
图7 乙醇脱氢酶δδ-ADH最适温度范围Fig.7 Optimal temperature of δδ-ADH
pH对δδ-ADH酶活力的影响见图8。在pH 3~5范围内,酶活仅为最高活性的10%左右,之后随着pH的升高,酶活也不断上升,pH 9.0时酶活达到最大值,当pH>9.0时酶活不断下降。Alberto Moreno[11]从人胃粘膜中分离到的δδ-ADH最适pH为9.9,随着pH的不断降低酶活不断下降,与本研究结果相近。
取相同体积的酶液(pH 9.0)在 30、40、50 ℃温浴,并分别于 15、30、60、90 min 时取样并检测酶活,以未温浴的酶活为100%作图。如图9所示,δδ-ADH的酶活变化趋势基本一致,在温浴15~30 min时,酶活下降较快;在50℃温浴60 min后,相对酶活约为47%,在40℃温浴60 min相对酶活为55%。

图8 乙醇脱氢酶δδ-ADH最适pH范围Fig.8 Optimal pH of δδ-ADH
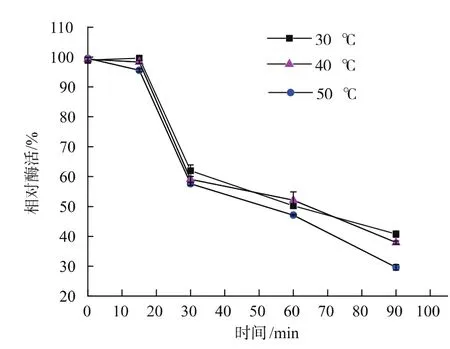
图9 乙醇脱氢酶δδ-ADH温度稳定性Fig.9 Effect of temperature on the stability of δδ-ADH
正常情况下,人体胃液的pH值范围是1.0~4.0,饮水或进食后可上升到3.0~5.0[21]。δδ-ADH对胃生理环境,尤其是对酸性环境的耐受性将影响其活性的发挥[2]。如图10所示,将δδ-ADH在不同pH(pH 3~11)的广泛缓冲液中于25℃保温30 min,在pH 6.0~11.0范围内酶活较稳定;pH 10.0时酶活力最高;pH 5.0条件下,相对酶活为60%;在pH 4.0以下,检测不到酶活。
取相同体积的酶液在0、500、10 00、1 500 mmol/L乙醇中37℃温浴,于10、20、30 min时取样检测酶活。如图11所示,在0 mmol/L乙醇中37℃温浴30 min的δδ-ADH的相对酶活为65.6%。在500 mmol/L乙醇中温浴10 min后,δδ-ADH的相对酶活下降至95%左右,温浴30 min后相对酶活为51.1%。在1 000、1 500 mmol/L乙醇中温浴10 min后,δδ-ADH酶活下降至60%左右,随着温浴时间的延长,酶活下降速率减慢,温浴30 min后相对酶活分别为45.4%和44.4%,说明δδ-ADH可在高浓度乙醇中保持一定活力。
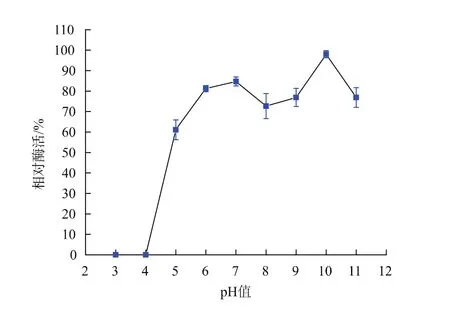
图10 乙醇脱氢酶δδ-ADH pH稳定性Fig.10 Effect of pH on the stability of δδ-ADH

图11 乙醇脱氢酶δδ-ADH的乙醇耐受性Fig.11 Effect of alcohol on the stability of δδ-ADH
3 结 语
作者通过构建pET-32a(+)-ADH7表达载体,将人胃来源的乙醇脱氢酶δδ-ADH在E.coliBL21(DE3)中进行外源表达。SDS-PAGE电泳结果显示,目的产物以包涵体形式存在,且其大小符合目的蛋白质单亚基(41 000)与融合标签(18 000)之和,即59 000。
包涵体用1 mol/L的尿素作初步的溶解处理,将此包涵体溶解液离心取上清液,得到有活性的δδ-ADH粗酶液,酶比活力为0.202 U/mg。粗酶液进一步经镍柱亲和层析纯化,纯化后酶的比活力为2.085 U/mg。在制备有活性的粗酶液的过程中,在用含低浓度尿素的缓冲液溶解包涵体前省略了传统方法中洗涤包涵体的步骤,因此粗酶液中含有较多杂蛋白质,由于尿素浓度较低,溶解液中目的蛋白质并不占主体地位。通过对工程菌进行高密度培养及优化包涵体溶解条件等途径以提高酶的得率,将是本研究继续努力的方向。
对δδ-ADH的酶学性质进行研究,结果表明,该酶的Km为 28.43 mmol/L,Vmax为 316.46 μmol/(L·min),最适温度为40℃,最适 pH为 9.0,在 30~50℃范围内较稳定,温浴60 min后相对酶活在47%以上;在pH 5.0~10.0较稳定,温育30 min后相对酶活在60%以上。此外,该酶能耐受一定浓度的乙醇,在500~1 500 mmol/L乙醇中保持30 min,相对酶活在45%以上。
然而,δδ-ADH在酸性环境下活性不高且稳定性差,其原因可能是δδ-ADH存在于胃粘膜细胞的细胞质中[1,5],正常的胃粘膜具有胃屏障功能,其中的一个重要作用是防止胃腔里的盐酸从胃腔回渗到胃粘膜细胞里[22],从而使δδ-ADH避免了直接暴露在酸性环境下。鉴于δδ-ADH的这一缺点,今后将通过酶的固定化、化学修饰或分子生物学等手段提高该酶在酸性条件下的稳定性,以扩大该酶的应用范围。
