紫阳富硒茶对人肝癌细胞凋亡过程的诱导
2019-10-30宋兵兵李建科刘颖沙刘美慧吴晓霞
宋兵兵,李建科*,2,刘颖沙,刘美慧,吴晓霞
(1.陕西师范大学 食品工程与营养科学学院,陕西 西安710119;2.陕西师范大学 食品加工副产物深度开发与高值化利用校级重点实验室,陕西 西安710119)
肝癌是全球十大常见癌症之一,是中国第二大常见恶性肿瘤[1]。原发性肝癌是临床上最为常见的恶性肿瘤之一,由于在其发生早期即可在肝内转移,一经发现即为中晚期,能够手术切除者不到20%,近年来全球的肝癌发病率并未得到有效控制[2]。目前研究表明,肿瘤的生长和增殖与细胞的凋亡水平密切相关[3]。因此,在癌症防治中,诱导肿瘤细胞凋亡已成为一个重要的策略,同时,在天然产物中寻找具有良好抑癌作用的物质,对于肝癌的防治尤为重要。
茶叶是世界三大饮料之一,我国是茶叶生产大国,茶叶在我国栽培历史悠久、种植范围广,从古至今一直受到人们的青睐。硒是人体必需的微量元素,人体中的硒主要来源于作物,通过富硒食品提高人体中硒含量的研究已成为人体硒营养改善的一个重要领域和热点[4]。许多研究结果表明,茶树有较强富集硒的能力,而茶树内总硒量的高低,主要取决于土壤中的含硒量,紫阳的地质构造古老而复杂,早生古代变质地层分布广泛,是我国少有的富硒岩层[5]。因此,紫阳富硒茶不仅具有普通绿茶的多酚类与咖啡碱等生物活性物质,而且富含对人体重要的硒元素,并且紫阳茶中硒含量丰富是国内首个通过科学鉴定和地理标志认证的天然富硒茶。为此,作者研究了紫阳富硒茶诱导人肝癌细胞凋亡的途径。
作者对紫阳富硒茶抑癌活性和诱导凋亡途径做了相关研究,对充分发掘紫阳富硒茶的食用及保健价值具有积极意义,为紫阳富硒茶的深度加工利用和开发新型抗肿瘤药物的研究提供一定的理论参考,同时,为肝癌的预防和治疗提供一定理论依据。
1 材料与方法
1.1 材料与试剂
人肝癌细胞HepG2:购买于第四军医大学细胞库的实验动物中心;细胞培养箱(Thermo,美国)、细胞培养基(RPMI-1640)、Hoechst33258 染液、RNase酶、荧光PI染液、Annexin V-FITC/PI细胞凋亡试剂盒、胎牛血清、胰蛋白酶、二甲基亚砜(DMSO):均购买于美国Sigma公司;青霉素,硫酸链霉素、没食子酸、硒标准液等其他试剂:均购买于南京建成生物有限公司。
1.2 紫阳富硒茶处理
紫阳富硒茶由中国陕西省紫阳县盘龙天然富硒绿茶有限公司提供,准确称取10 g干燥后的茶叶粉末,放入250 mL锥形瓶中,通过溶剂浸提法得紫阳富硒茶粗提物。最佳浸提富集条件如下:乙醇体积分数50%,温度80℃,浸提时间20 min,料液比1∶25。提取液过滤后通过旋转蒸发仪40℃浓缩,再经真空冷冻干燥得到粗提取物在-20℃避光保存备用。
1.3 试验方法
1.3.1 细胞培养将人肝癌细胞HepG2培养于RPMI-1640培养液 (含体积分数10%胎牛血清,青霉素和链霉素)中,在37℃体积分数5%CO2饱和湿度的细胞培养箱中培养,取对数生长期良好的细胞用于试验。
设置3组不同质量浓度梯度试验,试验处理组最终浓度分别为 200、400、800 μg/mL 的紫阳富硒茶提取物,阳性对照组为100 μg/mL的5-Fu,受试物通过无血清培养基溶解,所有实验均重复3次。
1.3.2 紫阳富硒茶中硒和茶多酚质量浓度的测定参考“GB 5009.93—2010食品中硒的测定”和“GB/T 8313—2008茶叶中茶多酚和儿茶素类含量的检测方法”[6-7],根据本试验情况进行相关调整得出标准曲线,从而计算紫阳富硒茶中硒和茶多酚质量浓度。
1.3.3 细胞增殖和抑制率的测定采用MTT法测定紫阳富硒茶对人肝癌细胞增殖的抑制效应。通过计数制成细胞密度为(5×103/mL)的细胞悬浮液接种于96孔板,培养24 h后,分别加入不同浓度的含紫阳富硒茶的新鲜培养液,并且每一组设5个复孔,同时设定空白和阳性对照组。将培养板继续放在细胞培养箱中培养24 h后,每孔加入20 μL MTT溶液,在培养箱中继续培养 4 h后加入 150 μL DMSO,用酶标仪在570 nm处对处理好的样品进行检测,按以下公式计算细胞存活率。

1.3.4 细胞形态分析通过Hoechst33258染色法检测凋亡细胞形态学的变化[8]。将人肝癌细胞接种于6孔板中(密度为4×105个/mL),在细胞培养箱中培养24 h后,分别加入含不同终浓度的紫阳富硒茶培养液,相同条件下继续培养24 h后弃掉6孔板中细胞培养液,用PBS缓慢洗两遍,每孔加4%多聚甲醛1 mL,放置在4℃中对细胞进行固定,l5 min后弃固定液,用PBS缓慢洗2次,每孔各加入1 mL质量浓度为5 μg/mL的Hoechst33258染液,室温染色10 min,再用PBS清洗2次后,置于倒置荧光显微镜下观察细胞形态变化并拍照。
1.3.5 流式细胞仪分析细胞周期的变化运用PI染色法,通过流式细胞仪测定细胞周期分布[9],将对数生长期的人肝癌细胞接种于50 mL的小培养瓶中(密度为3×105个/mL),培养24 h后加入不同终浓度的紫阳富硒茶和5-Fu,继续培养24 h后,分别消化、离心、收集细胞于75%的乙醇溶液中,在-20℃中固定4 h以上,然后离心收集细胞液,并用PBS清洗2次后,用PBS重悬细胞,然后加入RNase(1 mg/mL)和 PI(400 μg/mL),常温避光放置 30 min,最后通过流式细胞仪检测不同处理组的细胞周期分布情况。
1.3.6 流式细胞仪检测细胞凋亡通过Annexin V-FITC/PI双染法,运用流式细胞仪测定细胞凋亡率[10]。将人肝癌细胞接种于6孔板中(密度为4×105个/mL),在细胞培养箱中培养24 h后,分别加入含不同终浓度的紫阳富硒茶培养液和5-Fu,相同条件下继续培养24 h后弃掉培养液,用PBS缓慢洗两遍,消化、离心后收集细胞,然后用500 μL的结合液重悬细胞,再分别加5 μL的Annexin V-FITC和10 μL的PI染液,室温避光放置20 min后,利用流式细胞仪检测细胞凋亡情况。
2 结果与讨论
2.1 紫阳富硒茶中硒质量浓度的测定
在原子荧光分光光度计最佳仪器工作条件下,测定质量浓度分别为 0、1、2、4、8、10 μg/L 的硒标准溶液的荧光值,绘制出标准曲线,见图1。得到回归方程:y=125.87x+3.356 1,相关系数R2=0.999 6,线性回归良好。
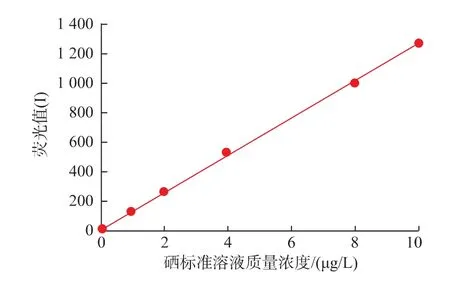
图1 硒质量浓度测定的标准曲线Fig.1 Standard curve of detecting the selenium content
通过测定和计算得:紫阳原茶叶中硒质量分数为0.489 mg/kg,浸提富集后茶叶中硒质量分数为1.667 mg/kg,根据国家农业行业标准《富硒茶》[11]中对富硒茶含硒量的范围要求 (0.25~4.00 mg/kg),可知富集后样品的硒质量分数达到较高富硒水平。
2.2 紫阳富硒茶中多酚含量的测定
以没食子酸为标准品,绘制出测定多酚的标准曲线见图2。
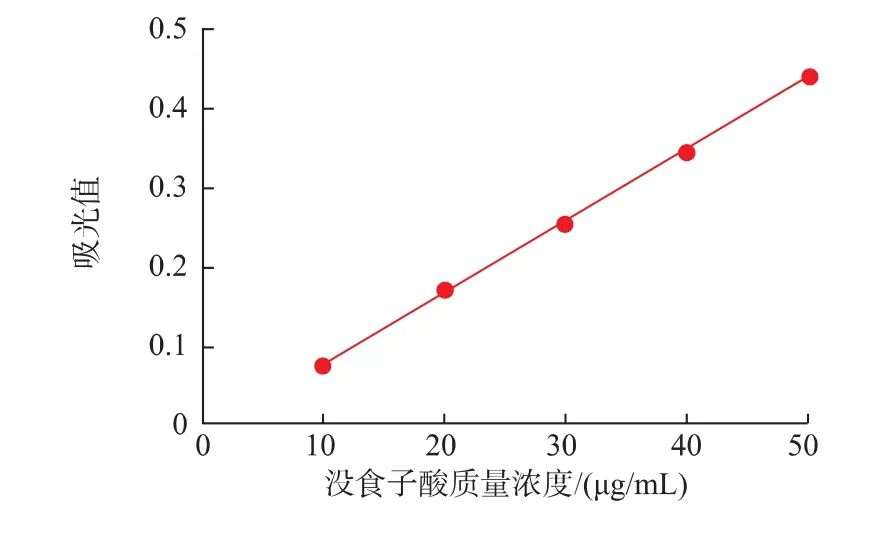
图2 茶多酚测定的标准曲线Fig.2 Standard curve of detecting the tea polyphenols
得到回归方程:y=0.009 2x-0.019 7,相关系数R2=0.999 5,线性回归良好。通过测定和计算得:紫阳原茶叶中多酚的质量分数为9.16%,浸提富集后紫阳茶中多酚的质量分数为34.75%。
2.3 紫阳富硒茶对人肝癌细胞存活率的影响
作为MTT的结果见图3。从图3可以看出,不同质量浓度的紫阳富硒茶对人肝癌细胞的生长均有一定的抑制作用,其抑制作用表现出一定的剂量依赖性,当质量浓度为 200、400、800 μg/mL 的紫阳富硒茶作用24 h后,人肝癌细胞的存活率分别为81.2%,60.8%、42.5%,而阳性对照5-Fu的细胞存活率58.2%。结果表明,800 μg/mL的紫阳富硒茶的抑制效果显著高于阳性对照5-Fu的抑制效果。
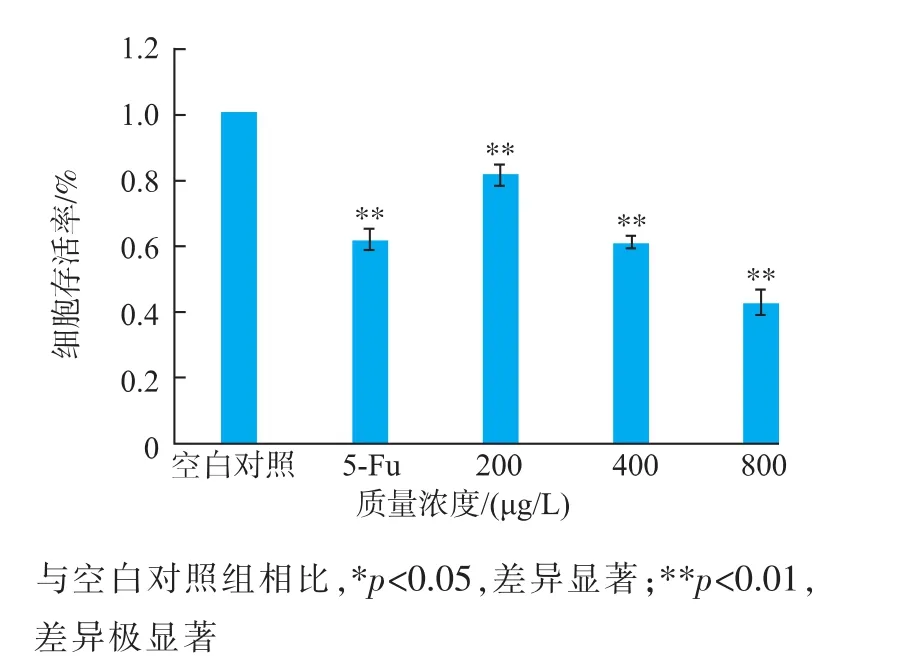
图3 MTT法检测不同质量浓度的紫阳富硒茶对人肝癌细胞存活率的影响Fig.3 Cell viability was determined by the MTT assay
2.4 紫阳富硒茶对人肝癌细胞形态学变化的影响
Hoechst33258染色法测定细胞形态变化的结果见图4。从图4可知,对照组的细胞大小均一、轮廓清楚、形态完整、呈现正常的圆形或者椭圆形态。与对照组相比,处理组细胞生长均受到明显抑制,细胞形态呈现出不规则的形态和深染色,有的发生明显的皱缩,甚至有的细胞还形成一些絮状的凋亡小体和细胞碎片。随紫阳富硒茶提取物质量浓度增加,细胞数目逐渐减少,核固缩、核碎裂的现象也更加明显,癌细胞呈现明显的凋亡状态。

图4 倒置荧光显微镜下观察不同质量浓度的紫阳富硒茶处理后人肝癌细胞的形态变化Fig.4 Morphological changes of HepG2 treated with the different concentrations of Ziyang se-rich tea
2.5 紫阳富硒茶对人肝癌细胞周期的影响
紫阳富硒茶对人肝癌细胞周期的影响见图5。当不同质量浓度的紫阳富硒茶作用于人肝癌细胞24 h后,伴随紫阳富硒茶质量浓度的增加,人肝癌细胞S期细胞数量增多,而G2期细胞数量显著减少。图5(a)表明:S期细胞由18.14%增加至35.27%(p<0.01),同时 G2期细胞由 11.39% 降低至0.28%。这表明:紫阳富硒茶能阻滞人肝癌细胞周期停滞在S期,细胞不能进入G2期,DNA合成无法完成,阻止细胞进行有丝分裂,从而抑制细胞的增殖。
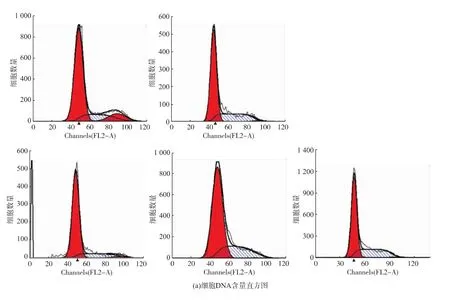
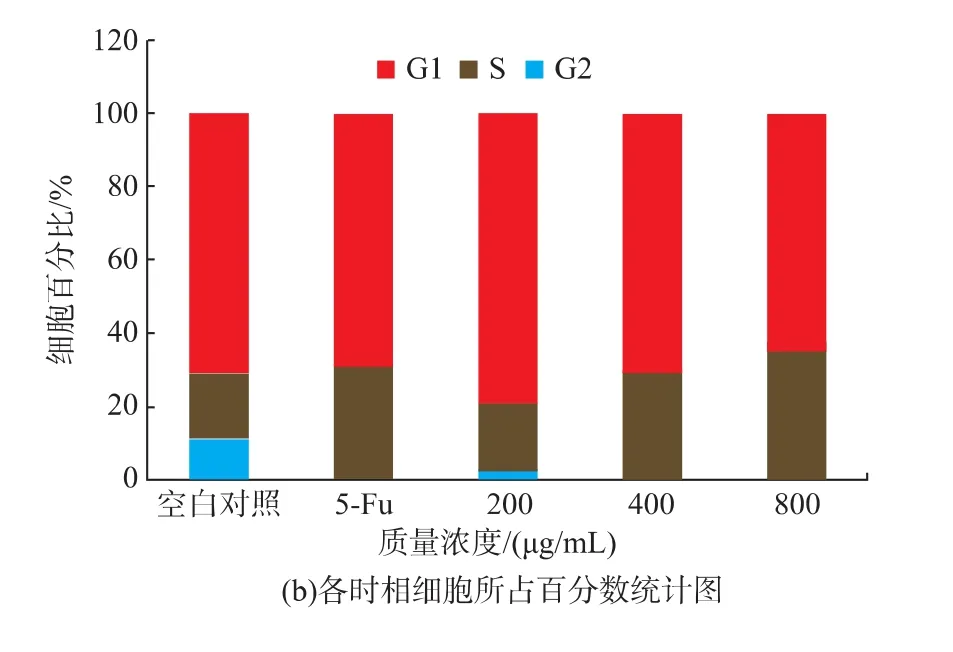
图5 不同质量浓度的紫阳富硒茶对人肝癌细胞周期分布的影响Fig.5 Cell-cycle analysis,HepG2 cells were treated with various concentrations of Ziyang se-rich tea
2.6 紫阳富硒茶对人肝癌细胞凋亡率的影响
Annexin V-FITC/PI双染法测定细胞凋亡率的结果见图6。当不同质量浓度的紫阳富硒茶作用于人肝癌细胞24 h后,处理组细胞凋亡率显著高于对照组,不同质量浓度的紫阳富硒茶处理组细胞凋亡率分别为 34.20%、45.37%、80.25%(P<0.01),具有剂量依赖关系。并且800 μg/mL处理组的凋亡率接近阳性对照组5-Fu的凋亡率84.70%。同时由细胞凋亡百分数统计图6(b)得知P<0.01,有极显著差异,表明紫阳富硒茶能诱导细胞凋亡并呈剂量依赖性。
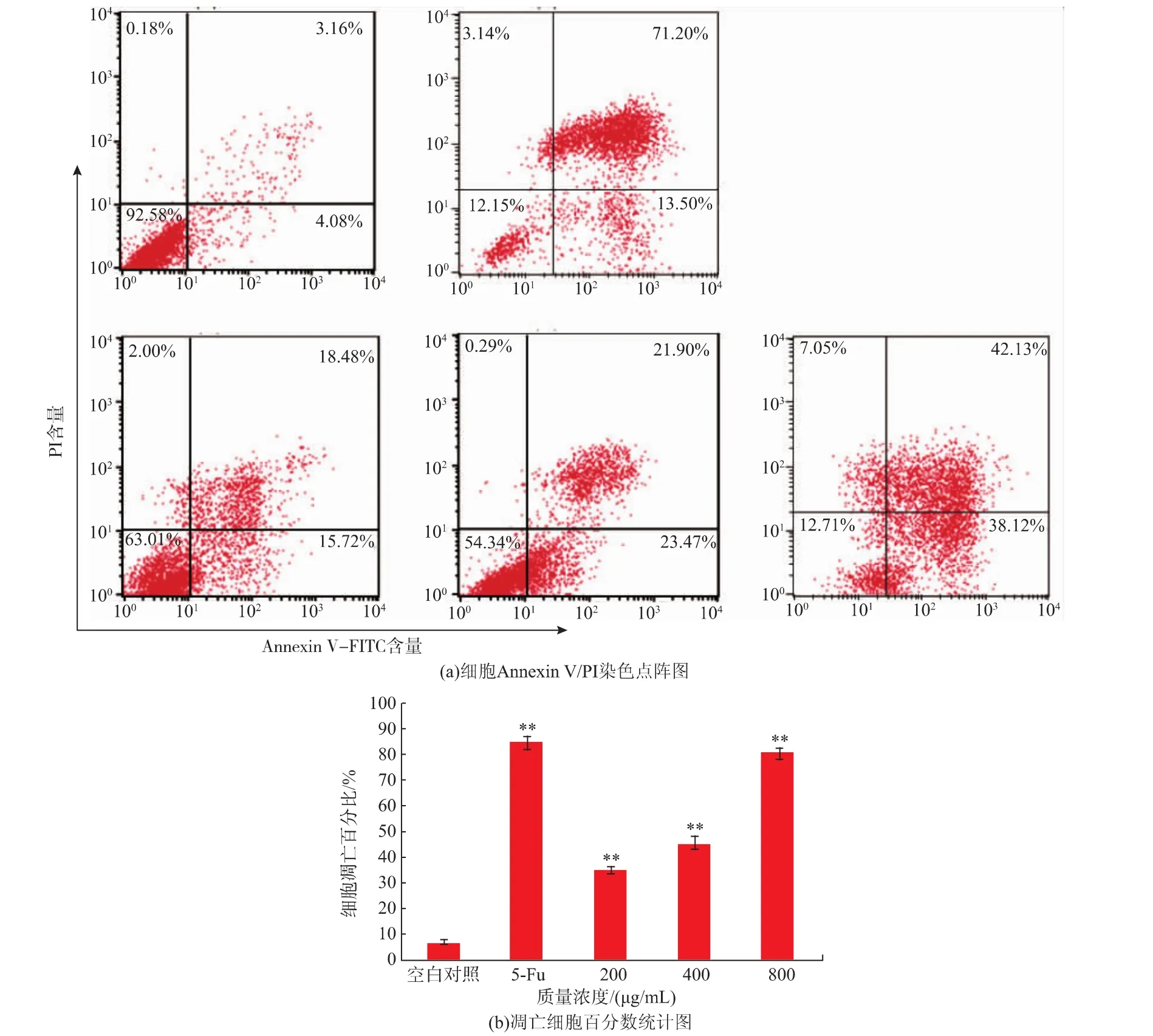
图6 不同质量浓度紫阳富硒茶对人肝癌细胞凋亡率的影响Fig.6 Apoptotic rates of HepG2 cells induced by the different concentrations of Ziyang se-rich tea
3 结 语
目前,化疗是治疗癌症的主要措施,它是通过化学药物来削弱和破坏癌细胞在体内的生长繁殖[12]。而细胞凋亡是在某些生理或病理条件下,细胞接受到某种信号所触发的并按一定程序缓慢死亡的过程,借此机体使不需要的细胞消亡,维持组织器官细胞数目恒定,从而维持生长平衡的过程[13]。从天然化合物中找寻具有抑癌活性成分的研究成为近年来的热点,已有研究表明,从一些天然产物中提取的有效成分不仅可显著诱导肿瘤细胞凋亡,而且毒副作用较低[14-15]。近年来研究发现,茶叶有多方面药理学价值,茶叶多酚具有较强的抗氧化、抗肿瘤和抑制胆固醇上升等功效[16],同时研究发现,硒有很高的营养学价值,并且富硒食品的功能性研究也是当今热点,而紫阳富硒茶同时含有硒和茶多酚等活性物质,因此,作者探讨了紫阳富硒茶诱导肝癌细胞的凋亡途径,试验发现紫阳富硒茶可显著抑制肝癌细胞增殖,通过阻滞细胞周期停滞,从而阻碍细胞内DNA合成并诱导凋亡,其可能原因是紫阳富硒茶中主要活性成分硒和茶多酚的协同作用,但其作用分子机制和凋亡通路需要进一步研究。
