β-甘露聚糖酶AuMan5Aloop/H321G在乳酸克鲁维酵母中的高效表达
2019-10-30唐诗涵李雪晴袁风娇李剑芳邬敏辰
唐诗涵, 李雪晴,袁风娇,李剑芳, 邬敏辰
(1.江南大学 食品学院,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡 214122)
内切型 β-1,4-D-甘露聚糖酶 (endo-β-1,4-D-mannanase,EC 3.2.1.78)简称 β-甘露聚糖酶,能特异性催化甘露聚糖分子主链β-1,4-D-糖苷键的水解,其产物为不同聚合度的甘露寡糖和少量单糖分子[1]。研究表明,甘露寡糖能有效促进人与动物肠道内双歧杆菌和乳酸杆菌等有益菌群的增殖,同时能抑制有害菌群的生长,从而增强机体的非特异性免疫力[2]。β-甘露聚糖酶广泛存在于各种生物体尤其是微生物和植物中,在食品、饲料、医药、生物能源和纸浆漂白等工业领域具有潜在的应用价值[3]。
迄今为止,已有众多β-甘露聚糖酶基因被克隆分析,并在多种表达体系中实现了异源表达,如毕赤酵母(Pichia pastoris)[4]、植物乳杆菌(Lactobacillus plantarum)[5]、大肠杆菌(Escherichia coli)[6]、里氏木霉 (Trichoderma reesei)[7]和枯草芽胞杆菌(Bacillus subtilis)[8]等体系。与毕赤酵母类似,乳酸克鲁维酵母(Kluyveromyces lactis)具有生长快、操作简便、分泌表达以及翻译后加工准确等特点。但毕赤酵母表达外源蛋白质需要甲醇诱导,因此其表达的蛋白质/酶存在一定的安全隐患;而乳酸克鲁维酵母是被美国FDA认证为 “一般认为安全”(generally recognized as safe,GRAS)的菌种,其所用诱导剂为食品级原料(如半乳糖等),因此借助其表达的蛋白质/酶可直接用于食品、饲料和医药等领域[9]。目前已有多种糖苷水解酶如α-淀粉酶、β-半乳糖苷酶和木聚糖酶等在乳酸克鲁维酵母中进行了表达[10],但未见有β-甘露聚糖酶在乳酸克鲁维酵母中表达的文献报道。
作者所在实验室前期将β-甘露聚糖酶基因Auman5A和突变基因Auman5Aloop/H321G分别在毕赤酵母GS115中成功实施了表达。酶学性质分析表明,突变酶AuMan5Aloop/H321G的温度特性(Topt和t1/270)及其催化效率 (kcat/Km)较原酶AuMan5A均有显著改善,分别达到 75 ℃、300 min 和 3 194 mL/(mg·s),具有较高的工业应用价值。而经毕赤酵母表达的AuMan5Aloop/H321G可能存在应用领域受限等问题,因此,本研究拟借助pKLAC1将Auman5Aloop/H321G在乳酸克鲁维酵母GG799中表达,并对转化子的发酵产酶工艺进行初步优化,为食品级β-甘露聚糖酶的工业化生产及应用奠定基础。
1 材料与方法
1.1 质粒、菌株和培养基
乳酸克鲁维酵母GG799和表达质粒pKLAC1:购自美国New England BioLabs公司;克隆质粒pUCm-T:购自上海Sangon公司;大肠杆菌JM109和 DH5α:购自 Novagen公司;重组表达质粒pPICZαA-Auman5Aloop/H321G:作者所在实验室构建和保存。
LB、YCB、YPD和YPG培养基的配制:参照K.lactis Protein Expression Kit(New England BioLabs公司,2005版)操作手册。
1.2 工具酶和试剂
ExTaq DNA聚合酶、限制性内切酶、T4 DNA连接酶、250 bp DNA Ladder Marker和低相对分子质量蛋白质Marker:均购自大连TaKaRa公司;EZ-10柱式DNA胶回收试剂盒:购自上海Sangon公司;标准D-甘露糖和角豆胶:Sigma公司产品;其它试剂均为国产或进口分析纯。
1.3 PCR引物设计及合成
根据表达质粒pKLAC1多克隆位点和Kex酶切位点以及Auman5Aloop/H321G或Auman5A核苷酸序列(GenBank登录号:HQ839639),设计一对 PCR 引物Xho-F和Not-R,用于目的基因的扩增;PCR引物IntPri-1、IntPri-2和IntPri-3,用于重组乳酸克鲁维酵母的分析。所有引物由上海Sangon公司合成,见表1。

表1 目的基因扩增和鉴定的PCR引物Table 1 PCR primers for the amplification and identification of Auman5Aloop/H321G
1.4 重组表达质粒的构建
以 pPICZαA-Auman5Aloop/H321G为模板、Xho-F 和Not-R为引物,PCR扩增目的基因Auman5Aloop/H321G:94℃预变性4 min;30个循环 (94℃ 30 s、55℃ 30 s和72℃ 70 s);72℃延长10 min。 将目的PCR产物与pUCm-T连接,转化大肠杆菌JM109,进行蓝白斑筛选、双酶切鉴定和DNA测序。将测序正确的pUCm-T-Auman5Aloop/H321G经XhoⅠ和NotⅠ双酶切,割胶回收目的条带,与经同样双酶切的pKLAC1连接,获重组表达质粒pKLAC1-Auman5Aloop/H321G,转化大肠杆菌DH5α,DNA测序验证。
1.5 乳酸克鲁维酵母转化子的筛选和表达
pKLAC1和pKLAC1-Auman5Aloop/H321G经SacⅠ线性化,分别电转化乳酸克鲁维酵母GG799感受态细胞,涂布于含5 mmol/L乙酰胺的YCB平板,30℃静置培养3 d。随机挑取生长良好的单菌落,接种于YPD液体培养基中,30℃、220 r/min培养至菌液OD600达1.3~1.5时,提取菌体基因组DNA。参照K.lactis Protein Expression Kit操作手册,以基因组DNA为模板,IntPri-1或IntPri-3和IntPri-2为上下游引物,PCR分析重组乳酸克鲁维酵母,筛选出若干整合有多拷贝目的基因Auman5Aloop/H321G的转化子;不含目的基因的转化子命名为GG799/pKLAC1(空白对照)。将多拷贝转化子和GG799/pKLAC1分别接种于YPD培养基中,于30℃、220 r/min培养24 h,以2%接种体积分数转接于30 mL YPG培养基中,在相同条件下诱导表达48 h,收集上清液测定β-甘露聚糖酶活性。选取成功表达reAuMan5Aloop/H321G且活性最高的乳酸克鲁维酵母转化子,命名为GG799/Auman5Aloop/H321G。
1.6 重组表达产物的分析
采用改良DNS法测定β-甘露聚糖酶活性。取2.4 mL、5 mg/mL 角豆胶溶液(用 pH 3.6、50 mmol/L柠檬酸-Na2HPO4缓冲液配制),65℃预热10 min,加入0.1 mL适当稀释的酶液,65℃准确反应15 min,加入2.5 mL DNS试剂,沸水浴显色7 min,测定OD540。在上述反应条件下,每分钟释放1 μmol还原糖(以D-甘露糖计)所需酶量定义为1个酶活性单位(U)。采用SDS-PAGE分析重组表达产物组成。以牛血清蛋白为标准,采用Bradford法分析重组表达产物浓度。
1.7 发酵产酶工艺的初步优化
1.7.1 诱导剂种类对产酶的影响分别用20 mg/mL乳糖、葡萄糖、麦芽糖和蔗糖替代YPG培养基中的半乳糖作为碳源和诱导剂,于30℃、220 r/min诱导表达96 h,取上清液测定β-甘露聚糖酶活性。
1.7.2 摇瓶装液量对产酶的影响在最适诱导剂条件下,将摇瓶的YPG装液量分别调整为20、30、40、50、60、70 mL/250 mL,其它条件同 1.7.1。
1.7.3 培养基初始pH对产酶的影响在最适诱导剂和装液量条件下,将YPG培养基的初始pH分别调整为 5.0、5.5、6.0、6.5、7.0、7.5,其它条件同 1.7.1。
1.7.4 诱导剂初始质量浓度对产酶的影响在以上各种最适条件下,调整发酵培养基中诱导剂的初始质量浓度为20、40、80 mg/mL,每24小时取上清液测定β-甘露聚糖酶酶活性,其它条件同1.7.1。
1.7.5 诱导剂添加方式对菌体生长和产酶的影响在以上各种最适条件下,设计4种诱导剂添加方式:(A)诱导剂初始质量浓度为40 mg/mL,后续发酵过程中不补加诱导剂;(B)诱导剂初始质量浓度为20 mg/mL,后续发酵过程中不补加诱导剂;(C)诱导剂初始质量浓度为40 mg/mL,每48小时补加诱导剂40 mg/mL;(D)诱导剂初始质量浓度为20 mg/mL,每24小时补加诱导剂20 mg/mL。其中补加的诱导剂母液质量浓度为400 mg/mL,在发酵过程中,每24小时取样监测酶活性、菌体生长量和诱导剂质量浓度变化。
2 结果与分析
2.1 重组表达质粒的构建
根据pKLAC1多克隆位点的特点,在上游引物Xho-F设计时引入了XhoⅠ位点和Kex切割信号肽α-MF的寡肽序列 (Lys-Arg)。 当目的基因Auman5Aloop/H321G借助XhoⅠ和NotⅠ位点克隆至pKLAC1的α-MF下游时,经诱导表达及翻译后加工,使表达产物reAuMan5Aloop/H321G拥有天然N末端,见图1。根据1.4所述方法,将Auman5Aloop/H321G与pKLAC1连接,并转化大肠杆菌DH5α,随后提取转化子的质粒DNA,采用HindⅢ和NotⅠ双酶切筛选重组质粒。结果表明,空质粒pKLAC1的双酶切产物有一条约300 bp的特异性条带;而重组质粒pKLAC1-Auman5Aloop/H321G的产物有一条约1 400 bp的条带,与预期相符。

图1 重组表达质粒pKLAC1-Auman5Aloop/H321G的构建Fig.1 Construction of a recombinant expression plasmid pKLAC1-Auman5Aloop/H321G
2.2 重组乳酸克鲁维酵母的构建及筛选
pKLAC1和pKLAC1-Auman5Aloop/H321G经线性化后,分别电转化乳酸克鲁维酵母GG799感受态细胞,经含有乙酰胺的YCB平板筛选阳性转化子。以阳性转化子基因组DNA为模板,引物IntPri-1和IntPri-2进行PCR鉴定,扩增出1.9 kb的片段,表明质粒pKLAC1和pKLAC1-Auman5Aloop/H321G均已成功整合至乳酸克鲁维酵母GG799基因组;引物IntPri-2和IntPri-3进行PCR鉴定,扩增出2.3 kb的片段,表明乳酸克鲁维酵母GG799基因组中的LAC4位点处整合有多拷贝串联的表达框,未扩增出2.3 kb片段转化子为单拷贝子。挑取表达目的基因的多拷贝子,经半乳糖诱导表达和酶活性分析获得产reAuMan5Aloop/H321G活性最高的转化子GG799/Auman5Aloop/H321G,上清液酶活性为 54.9 U/mL,空白对照GG799/pKLAC1发酵上清液未检测出β-甘露聚糖酶活性。结果表明,β-甘露聚糖酶基因Auman5Aloop/H321G成功在乳酸克鲁维酵母GG799中表达。
2.3 发酵产酶工艺的初步优化
2.3.1 诱导剂种类对GG799/Auman5Aloop/H321G产酶的影响重组乳酸克鲁维酵母可以利用多种诱导剂表达外源基因,诱导剂种类对其生长代谢和产酶有重要影响。如图2(a)所示,以半乳糖为诱导剂时,GG799/Auman5Aloop/H321G产β-甘露聚糖酶活力最高。由于在缺少诱导物的情况下,启动子LAC4不会被完全抑制[11],当其以半乳糖外的还原糖甚至非还原糖作诱导剂,GG799/Auman5Aloop/H321G也能表达外源基因。其中以乳糖作诱导剂时,达到了半乳糖作诱导剂时的73.1%,以麦芽糖为诱导剂时仅为半乳糖的38.7%。故选择半乳糖作为发酵培养基中的碳源和诱导剂。
2.3.2 摇瓶装液量对GG799/Auman5Aloop/H321G产酶的影响乳酸克鲁维酵母在生长过程中耗氧,溶解氧浓度对其产酶有很大影响,在摇瓶发酵条件下,溶氧可以通过改变摇瓶的装液量来调节。如图2(b)所示,GG799/Auman5Aloop/H321G产酶的产酶活力随着装液量的增加而逐渐提高,当装液量达到70 mL/250 mL时,产酶活力降低。由于摇瓶发酵时间长达96 h,水蒸汽挥发影响培养基中各组分比例,装液量过小会导致GG799/Auman5Aloop/H321G产酶活力较低;在摇瓶发酵后期,随着乳酸克鲁维酵母菌体的增加,耗氧量加大,当装液量的过高时溶氧量降低,从而影响GG799/Auman5Aloop/H321G产酶活力。当装液量为60 mL/250 mL时,GG799/Auman5Aloop/H321G产酶活力最高,故选取摇瓶装液量为60 mL/250 mL。
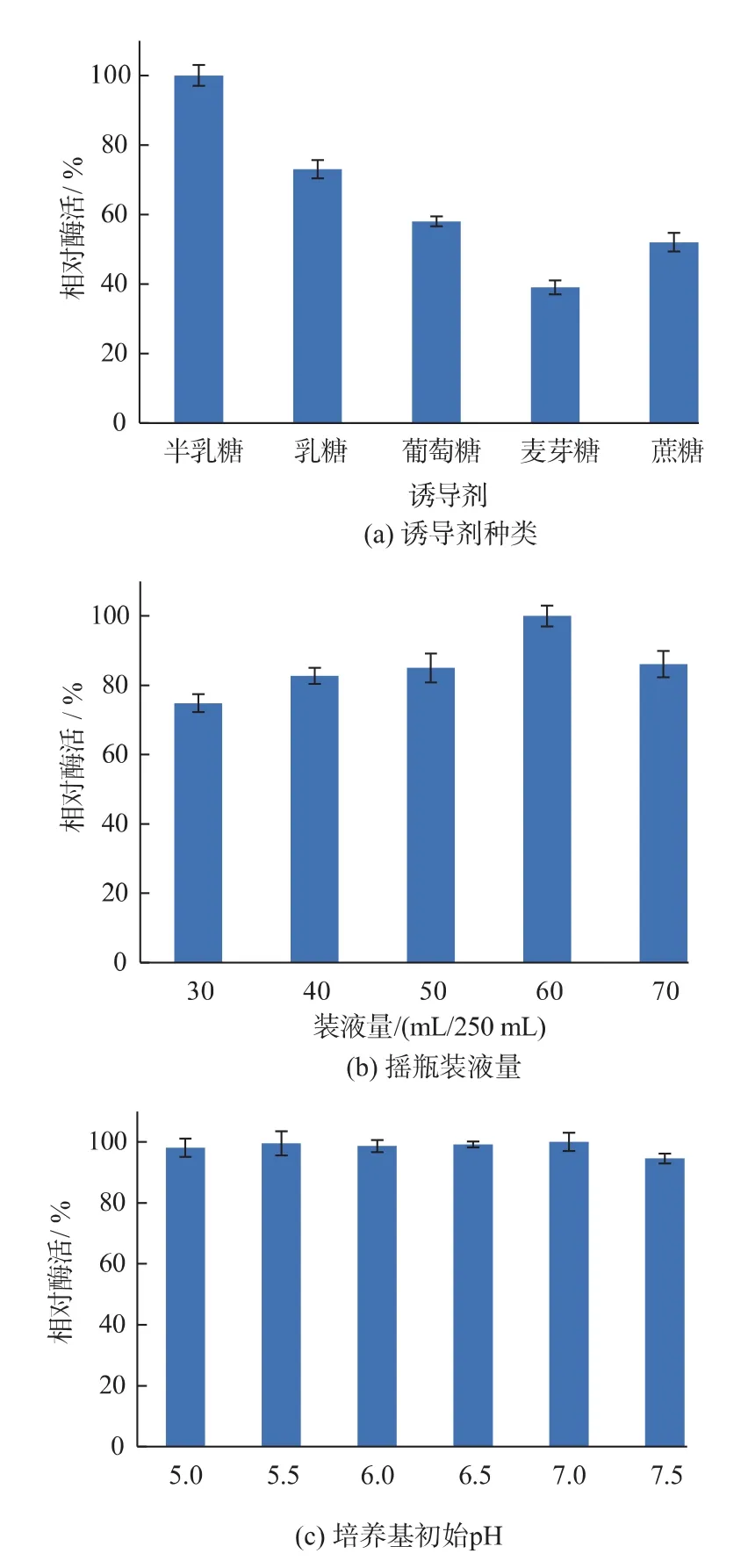
图2 诱导剂种类、摇瓶装液量以及培养基初始pH对GG799/Auman5Aloop/H321G产酶的影响Fig.2 Effects of inducers、medium volume and initial pH on the expression of GG799/Auman5Aloop/H321G
2.3.3 培养基初始pH对GG799/Auman5Aloop/H321G产酶的影响培养基pH主要从酶的活性、细胞膜所带电荷的状态、某些组分的解离以及代谢过程等方面影响酵母的生长代谢和发酵产物合成[12]。由于摇瓶中培养基的pH不受控制,故只考虑培养基初始pH对重组乳酸克鲁维酵母产酶活力的影响。由图2(c)可知,GG799/Auman5Aloop/H321G对pH的耐受范围较广,在所选pH 5.0~7.5范围内,产酶活力几乎不受影响,与王辉等[13]报道相符。培养基的自然pH在7.0左右,故选择发酵培养基初始pH为7.0。
2.3.4 诱导剂初始质量浓度对GG799/Auman5Aloop/H321G产酶的影响作为重组乳酸克鲁维酵母的碳源和重组蛋白质表达的诱导剂,半乳糖的添加量对其生长代谢和产酶有重要影响。如图3所示,半乳糖初始质量浓度为20 mg/mL时,GG799/Auman5Aloop/H321G产酶活力在48 h内迅速增加,48 h后趋于平衡,最终产酶活力54.9 U/mL;半乳糖初始质量浓度为40 mg/mL时,产酶活力在72 h内迅速增加,72 h后趋于平衡,最终产酶活力为70.2 U/mL,提高了27.8%;半乳糖初始质量浓度为80 mg/mL时,产酶活力在24 h内迅速增加,最终产酶活力仅为38.4 U/mL。结果表明,在发酵初期,产酶活力随着菌体的增长而迅速提高,发酵后期由于碳源等营养物质的消耗,产酶速率减缓。诱导剂初始质量浓度影响GG799/Auman5Aloop/H321G的产酶活力。

图3 半乳糖初始质量浓度对GG799/Auman5Aloop/H321G产酶的影响Fig.3 Effect of initial concentration of galactose on the expression of GG799/Auman5Aloop/H321G
2.3.5 诱导剂添加方式对GG799/Auman5Aloop/H321G菌体生长和产酶的影响为进一步优化重组乳酸克鲁维酵母摇瓶发酵工艺,按1.7.5方法设计4种诱导剂添加方式进行实验。如图4(a,b)所示,在未补加半乳糖的发酵过程中,发酵液半乳糖质量浓度在24 h内分别从40 mg/mL和20 mg/mL迅速降低至2 mg/mL和1 mg/mL;其后,半乳糖维持在低质量浓度水平,菌体浓度也趋于平衡,OD600最终为69.1(方式 A) >48.2(方式 B)。 如图 4(c) 所示,当每 48小时补加40 mg/mL半乳糖时,重组乳酸克鲁维酵母细胞在24 h内迅速增殖,48 h补加半乳糖后细胞继续增殖,96 h后 OD600达 99.6,GG799/Auman5Aloop/H321G产酶活力平稳上升,96 h后达到了96.1 U/mL,比未补加半乳糖方案A的70.2 U/mL提高了36.9%。如图4(d)所示,在每24小时补加20 mg/mL半乳糖时,重组乳酸克鲁维酵母菌体质量浓度在96 h内几乎为线性增殖至OD600为91.5,与添加方式C相当,GG799/Auman5Aloop/H321G产酶活力在48 h后大幅度上升,96 h后高达194.7 U/mL,比未优化前提高254.6%,表明诱导剂少量多次的补料方式,可有效调节半乳糖作为碳源和诱导剂的作用方式[14],从而调节重组乳酸克鲁维酵母的生长代谢和外源蛋白质的表达,实现β-甘露聚糖酶reAuMan5Aloop/H321G在乳酸克鲁维酵母的高效表达。

图4 半乳糖添加方式对GG799/Auman5Aloop/H321G菌体生长和产酶的影响Fig.4 Effects of fed strategy of galactose on the growth and expression of GG799/Auman5Aloop/H321G
2.4 重组表达产物的分析
利用SDS-PAGE分析重组乳酸克鲁维酵母的发酵上清液,GG799/Auman5Aloop/H321G的上清液在约55 000左右呈现一条特异性条带,而GG799/pKLAC1无此蛋白质条带,进一步说明β-甘露聚糖酶基因Auman5Aloop/H321G通过乳酸克鲁维酵母分泌表达。另外,优化后的GG799/Auman5Aloop/H321G的表达水平较之前有明显提升,见图5。
优化摇瓶发酵工艺后,GG799/Auman5Aloop/H321G发酵液中β-甘露聚糖酶reAuMan5Aloop/H321G表达量为327.2 mg/L,为优化前(87.4 mg/L)的 3.75倍,也高于表2中所报道重组乳酸克鲁维酵母外源蛋白质表达量。

图5 重组β-甘露聚糖酶表达的SDS-PAGE分析Fig.5 SDS-PAGE analysis of recombinant β-mannanases

表2 重组乳酸克鲁维酵母外源蛋白质表达量Table 2 Heterologous protein production in the yeast Kluyveromyces lactis
3 结语
将β-甘露聚糖酶突变体基因(Auman5Aloop/H321G)克隆至pKLAC1,并整合进入乳酸克鲁维酵母GG799,实现了其在乳酸克鲁维酵母中的表达。构建得到的重组菌株GG799/Auman5Aloop/H321G的产β-甘露聚糖酶reAuMan5Aloop/H321G活力为54.9 U/mL。以半乳糖为最优碳源和诱导剂,装液量为60 mL/250 mL,初始pH为7.0,初始半乳糖质量浓度为20 mg/mL,每24小时补加半乳糖至20 mg/mL的条件下,GG799/Auman5Aloop/H321G产酶活力达到194.7 U/mL,较优化前提高了254.6%,蛋白质表达量为327.2 mg/L,为优化前的3.75倍。本研究成功实现了Auman5Aloop/H321G在乳酸克鲁维酵母GG799中的高效异源表达,为制备食品、医药和饲料等加工领域的食品级β-甘露聚糖酶奠定了基础。
