毕赤酵母含硫氨基酸生物合成途径
2019-10-30张平平喜多岛敏彦高晓冬中西秀树
张平平,喜多岛敏彦,王 宁,高晓冬,中西秀树
(江南大学 生物工程学院,江苏 无锡214122)
硫元素在很多细胞代谢过程中扮演着重要的角色,参与细胞对外界的压力反应(如谷胱甘肽)、细胞内酶反应、次级代谢过程(葡糖异硫氰酸盐)等[1-2]。同样的含硫氨基酸作为细胞维持生长代谢的基础化合物也具有重要作用。在所有微生物中,合成含硫的氨基酸第一步均是从培养基中吸收无机硫,并通过一系列还原反应把无机硫还原成还原态的硫原子(S2-)[3],然后再合成有关的含硫氨基酸。
酵母作为一种硫酸盐还原菌,进化出了一系列利用自然界中无机硫合成自身代谢所需的有机硫化物的代谢途径,如半胱氨酸、甲硫氨酸、S-腺苷甲硫氨酸等。同样的,酵母也可以直接从培养基中吸收已有的有机硫化物如半胱氨酸、甲硫氨酸、S-腺苷甲硫氨酸等,从而进一步合成蛋白质、多肽、GSH等。
细胞利用无机硫合成含硫氨基酸的过程一般可分为两种:还原态的S2-与O-乙酰同型丝氨酸(O-Acetyl-L-Homoserine OAH)生成同型半胱氨酸,此过程叫OAH途径。另外一条途径则是S2-与O-乙酰丝氨酸(O-Acetyl-L-Serine OAS)生成半胱氨酸,这个过程叫OAS途径[4]。如图1(a)酿酒酵母(Saccharomyces cerevisiae)只有 OAH 途径,并且生成的同型半胱氨酸转化为半胱氨酸 (转硫途径)或者半胱氨酸转化为同型半胱氨酸 (逆转硫途径)[5],图 1(b)中多型汉逊酵母(Hansenula polymorpha)除了具有与酿酒酵母类似的转硫途径与逆转硫途径外只有 OAS途径。图 1(c)中栗酒裂殖酵母(Schizosaccharomyces pombe)含有 OAS途径和OAH途径,但是只有存在逆转硫途径[6-10]。
作者根据以上所描述的酵母与丝状真菌的含硫氨基酸的生物合成途径相关基因信息,对毕赤酵母基因组信息分析发现,毕赤酵母细胞中可能同时存在OAS途径、OAH途径、转硫途径及逆转硫途径。
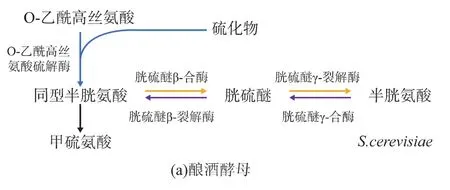
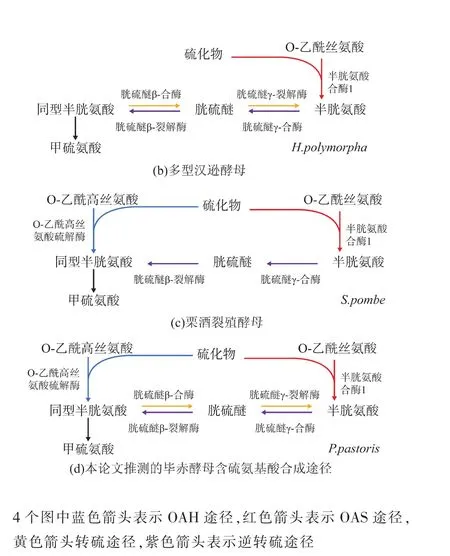
图1 不同类型酵母含硫氨基酸生物合成途径Fig.1 Different pathways of sulfur amino acid synthesis and transsulfuration in yeast species
1 材料与方法
1.1 菌株、质粒、培养基
菌株:毕赤酵母SMD1186(作者所在实验室保存)及以SMD1168为出发菌株构建的突变型菌株见表1。
质 粒 :pBlueScriptIISK (+ );pRS305K;pRS306H。
培养基:YPD (10 g/L酵母提取粉,20 g/L蛋白胨A,20 g/L葡萄糖),缺陷型培养基2×SC液体培养基(13.4 g/L无氨基酸酵母氮源,40 g/L葡萄糖)。用于基因敲出筛选的YPD抗性平板中,潮霉素及G418的终质量浓度分别为0.3 g/L和0.2 g/L。B培养基(不含任何硫源的合成培养基,可根据需要在B培养基中加入2 mol/L的无机硫源硫酸铵或者0.2 mol/L的有机硫如甲硫氨酸、半胱氨酸、胱硫醚作为硫源)。固体B培养基中用1 g/dL的琼脂糖代替琼脂以避免引入硫元素。根据SMD1186的表型,在培养基中补充20 mg/L组氨酸以维持酵母的基本生长需求。
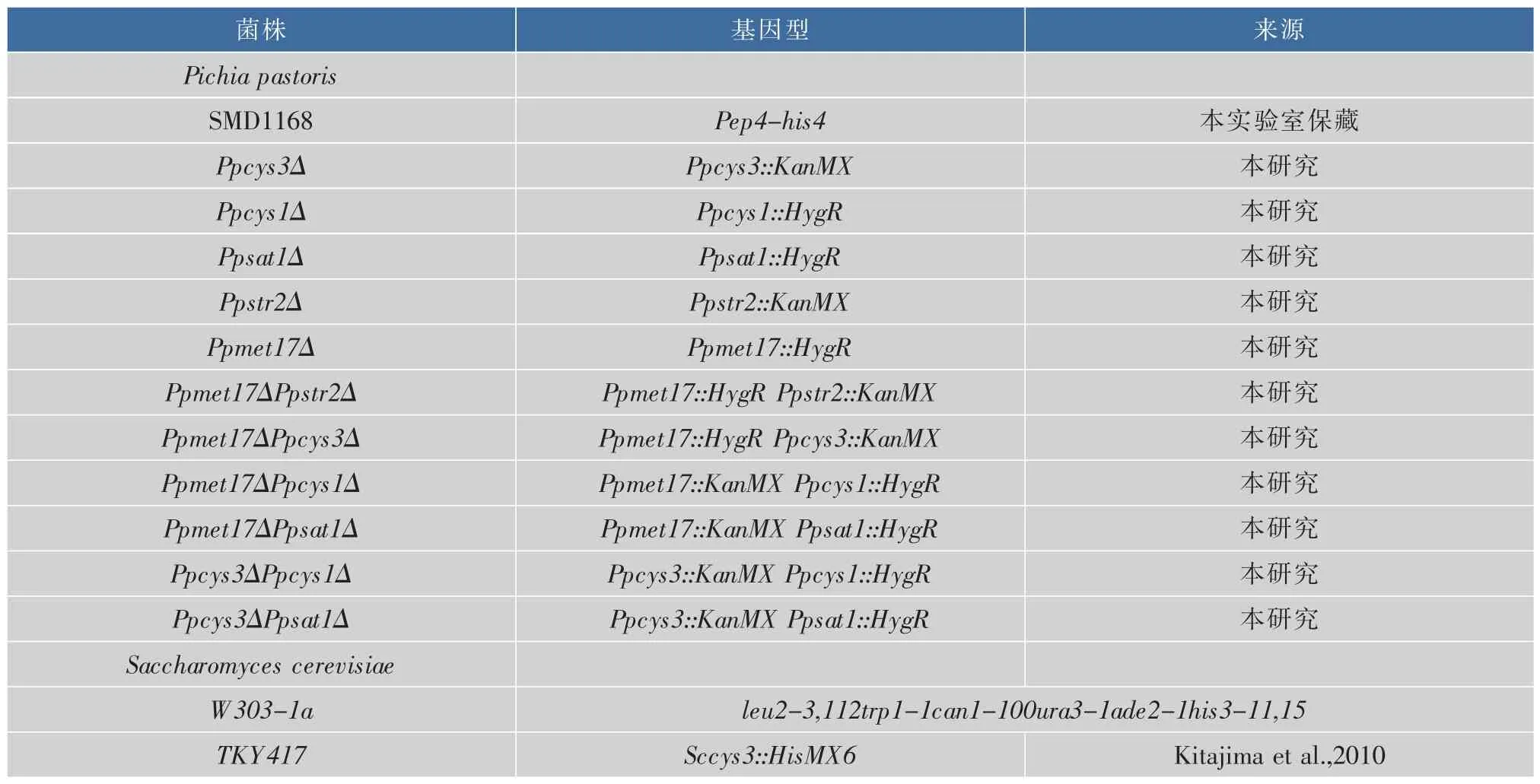
表1 本研究所用菌株Table 1 P.pastoris strains used in this study
1.2 试剂与溶液配制
潮霉素 B(Hygromycine B):英潍捷基(上海)贸易有限公司;G418:BBI Life sciences;硒代甲硫氨酸:L-Se-methionine,Sigima;PCR 产物纯化试剂盒、琼脂糖凝胶电泳胶回收试剂盒、质粒小量抽提试剂盒:生工生物工程(上海)有限公司;DNA连接酶、限制性内切酶:TaKaRa;48孔板:常州英德生物科技有限公司;96孔板:依科赛生物科技有限公司。
STES buffer:0.5 mol/L NaCl,0.2 mol/L Tris·HCl(pH 7.6),0.01 mol/L EDTA(pH 8.0),1g/L SDS 。TE buffer :Tris·HCl (pH 7.6),0.01 mmol/L EDTA(pH 8.0)
1.3 主要仪器
PCR仪器:日本TaKaRa公司;紫外分光光度计:美国GE;冷冻干燥机:日本EYELA;移液枪、台式高速冷冻离心机:德国Eppendorf;电转仪GenePulser Xcell及电极杯:美国 Bio-Rad;Nano drop 2000 spectrophotometer: 赛默飞 ;ImageQuant TMLAS 4000 mini:购于美国 GE。
1.4 含硫氨基酸生物合成途径相关基因敲除模板的构建
毕赤酵母基因序列来自于 JGI(http://genome.jgi.doe.gov/Picpa1/Picpa1.home.html)。构建基因敲除模板时,首先通过聚合酶链式反应技术(PCR)分别扩增得到目标基因起始密码子上游和终止密码子下游各500 bp的碱基序列,并通过基因克隆技术将500 bp的同源臂连接到选择标记基因的启动子前和终止子后,最终得到两端含有500 bp的同源臂、中间为选择标记基因的敲除模板。最后通过PCR得到模板DNA用于目标基因的敲除。根据标准的毕赤酵母基因敲除方法敲除相应的目标基因[11]。
1.5 毕赤酵母转化及重组子的筛选
1.5.1 毕赤酵母电转感受态的制备从平板上挑取单菌落接种到5 mL的YPD液体培养基中培养过夜,12 h后转接至50 mL的YPD液体培养基中扩大培养至OD600=1.3~1.5。 4℃、5 000g离心5 min,收集细胞,用40 mL预冷的ddH2O洗两次,5 000g离心5 min,收集细胞,用20 mL预冷的1 mol/L山梨醇重悬,4℃、5 000g离心5 min,收集细胞,最后用1 mL预冷的1 mol/L山梨醇重悬备用[12]。
1.5.2 酵母转化取80 μL电转感受态与20 μg的PCR产物混匀置于预冷的0.2 cm电极杯中,冰上放置5 min,用GenePulser Xcell电转仪在1 500 V、25 μF、200 Ω、5 ms条件下电击,立即加入 1 mL 预冷的1 mol/L山梨醇,用YPD液体培养基预培养3 h后收集细胞,涂布在筛选平板上[12]。
1.5.3 PCR筛选重组子从筛选平板上选取20个单菌落接种培养在YPD液体培养基中培养12 h,收集 2 mL菌液,用 500 μL STEs buffer重悬,9 000g离心 1 min,收集细胞,加入 30 μL STEs buffer与适量的玻璃珠,振荡破碎3 min后加入200 μL ddH2O 与 200 μL 苯酚氯仿异戊醇(25∶24g1),振荡2 min,15 000g离心 5 min后, 取 150 μL上清液,加入 15 μL 3 mol/L 醋酸钠(pH 5.2)和 375 μL 无水乙醇,4℃、15 000g离心5 min,去上清液,加入500 mL 70%乙醇,4℃、15 000g离心5 min,去上清液,60℃干燥后加入适量TE buffer,最后取1 μL基因组用于PCR验证。
1.6 突变菌株表型验证实验
将毕赤酵母突变型菌株与野生型菌株接种于5 mL YPD液体培养基,30℃过夜培养。取OD600=0.5的细胞悬液,离心收集细胞并用ddH2O洗涤两遍,最终用1 mL ddH2O重悬细胞。取3 μL菌液,在B培养基或者添加了相应硫源的B培养基平板上点板,30℃培养直到长出适当大小的菌落,用以验证表型。
1.7 Ppcys3Δ缺陷型菌株的硒代甲硫氨酸 (Semethionine)抗性实验
将Ppcys3Δ菌株与野生型菌株接种于5 mL YPD液体培养基,过夜培养。取OD600=1的细胞悬液1 mL,离心收集细胞并用ddH2O洗涤两遍。用ddH2O稀释菌体浓度至OD600=0.2,并以终浓度OD600=0.05的细胞量接种于48孔板中,在含有不同浓度硒代甲硫氨酸的SC甲硫氨酸缺陷型液体培养基中培养12 h。取200 μL菌液转移至96孔板中,并用酶标仪测细胞浓度,以验证菌株对硒代甲硫氨酸抗性。
2 结果与分析
2.1 生物信息学分析毕赤酵母的含硫氨基酸生物合成途径
根据JGI毕赤酵母基因组信息库信息以及已知的几种酵母和丝状真菌的含硫氨基酸生物合成途径相关基因信息,我们在毕赤酵母中发现了OAH途径、OAS途径、转硫途径及逆转硫途径相关酶的同源序列,因此作者模拟构建了毕赤酵母含硫氨基酸合成途径,见图2。
根据已有的研究表明,真菌的OAS途径首先是具有O-乙酰丝氨酸转移酶的Sat1p将底物丝氨酸O-乙酰化生成 O-乙酰丝氨酸 (O-Acetyl-LSerine),然后具有半胱氨酸合成酶活性的Cys1p利用S2-与O-乙酰丝氨酸合成半胱氨酸。通过运用已知真菌的Sat1p及Cys1p为模板检索毕赤酵母基因编码的蛋白质序列,发现在毕赤酵母中存在Sat1p及Cys1p的同源序列,这一结果暗示在毕赤酵母中可能存在OAS途径。
根据已有报道真菌的OAH途径:同型丝氨酸在Met2p(O-乙酰同丝氨酸转移酶)的催化作用下生成O-乙酰同型丝氨酸 (O-Acetyl-LHomoserine),而后Met17p(同型半胱氨酸合成酶)利用S2-与O-乙酰同型丝氨酸为底物合成同型半胱氨酸。因此利用已知真菌的Met2p及Met17p为模板检索毕赤酵母的蛋白质序列,发现毕赤酵母中存在Met17p及Met2p的同源序列。这一结果表明,在毕赤酵母中可能存在OAH途径。
将毕赤酵母的PpSat1p与多型汉逊酵母的HpSat1p及构巢曲霉中AnSat1p的序列对比,结果显示这三者之间的同源性高达71%(图3(a)),同样的方法比对毕赤酵母的PpCys1p、多型汉逊酵母的HpCys1p以及构巢曲霉的AnCysBp序列比对,结果表明这三者的同源性也高达69.6%的同源性 (图3(b))。 另外,毕赤酵母中发现的 PpMet2p和PpMet17p,通过与构巢曲霉及酿酒酵母的Met2p和Met17p对比发现,其同源性分别高达55.6%和63.2%。
同样我们还发现毕赤酵母中存在与转硫途径相关的蛋白质序列PpStr3p(同型半胱氨酸合成酶)和PpStr2p(胱硫醚-β-合成酶),以及与逆转硫途径相关的PpCys4p(胱硫醚合成酶)及PpCys3p(胱硫醚-β-裂解酶)的同源序列。
这些数据说明了在毕赤酵母中可能具有OAH途径、OAS途径、转硫途径及逆转硫途径。
2.2 基因敲除技术及表型分析证明毕赤酵母具有OAS途径及OAH途径
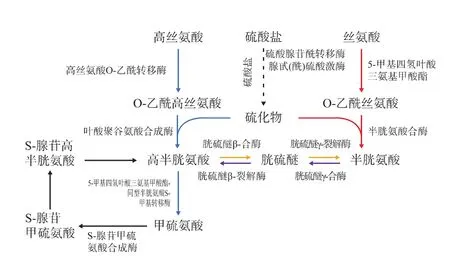
图2 毕赤酵母含硫氨基酸的生物合成途径Fig.2 Sulfur amino acids synthesize pathway in Pichia pastoris

图 3 毕赤酵母 PpSat1p(a) 和 PpCys1p(b)与其他酵母和真菌同源蛋白质序列比对Fig.3 Sequence alignments of PpSat1p (a) and PpCys1p(b) with other yeastand filamentous fungal homologs
为了验证毕赤酵母是否具有OAS途径及OAH途径,我们构建了一系列的突变菌株,并在以硫酸铵、甲硫氨酸、半胱氨酸及胱硫醚为惟一硫源的B培养基上验证生长表型。通过基因敲除技术首先对毕赤酵母Ppcys3敲除,构建Ppcys3Δ单缺陷型菌株。通过与酿酒酵母Sccys3Δ菌株在半胱氨酸缺陷型平板上划线对比(图 4(a)),酿酒酵母 Sccys3Δ 菌株在半胱氨酸的缺陷型平板表现出生长致死型[13],而毕赤酵母Ppcys3Δ则能够正常生长。这一现象表明,只具有OAH途径的酿酒酵母由于Sccys3基因敲除,不能合成半胱氨酸导致细胞死亡,而毕赤酵母却能通过其他途径合成半胱氨酸来维持细胞生长,这一表型充分证明毕赤酵母中存在OAH途径(图1(a))外还有存在另外一条含硫氨基酸的生物合成途径。
为了验证这一推论,构建Ppsat1ΔPpmet17Δ及Ppcys1ΔPpmet17Δ双突变株同时阻断可能存在的含硫氨基酸合成途径,并在补充了不同硫源的B培养基上验证其生长表型。
由图4(b)可知Ppsat1ΔPpmet17Δ 及Ppcys1ΔPpmet17Δ双缺陷型突变株在补充2 mmol/L硫酸铵的B培养基上表现出生长致死型,在补充了甲硫氨酸、半胱氨酸或者胱硫醚为硫源的培养基上细胞能够生长,而Ppsat1Δ、Ppmet17Δ及Ppcys1Δ单缺陷型菌株则能够与野生型细胞一样在所有的培养基上维持正常生长。
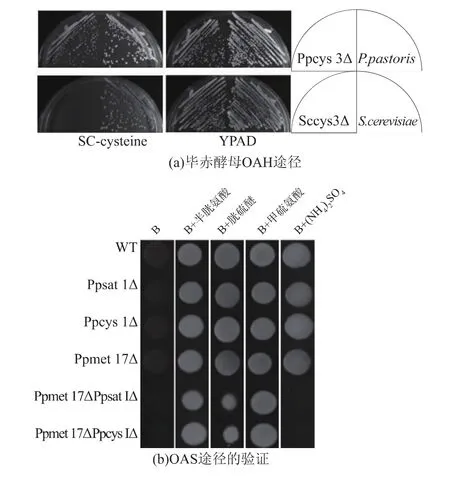
图4 毕赤酵母Ppcys3Δ与酿酒酵母Sccys3Δ表型比较Fig.4 Phenotype comparison about Ppcys3Δ and Sccys3Δ
这一生长表型表明,在毕赤酵母中具有OAS途径,同时也存在OAH途径。因为根据序列比对结果表明,PpMet17p是OAH途径的的关键酶,只敲除Ppmet17基因后细胞尽管失去了OAH途径,但是细胞可通过OAS途径合成维持细胞生长所需的含硫氨基酸。反之,如果只敲除了Ppsat1或者Ppcys1,细胞只能通过OAH途径来合成生长所需的含硫氨基酸。只有这样才能解释为什么Ppsat1Δ、Ppmet17Δ及Ppcys1Δ三株单缺陷型菌株可以以硫酸铵为惟一硫源维持细胞生长,而 Ppsat1ΔPpmet17Δ及Ppcys1ΔPpmet17Δ双缺陷型菌株却表现出生长致死型。
2.3 毕赤酵母转硫途径及逆转硫途径的验证
虽然不同的种属之间存在差异,但在大多数真菌中都有相似的转硫途径或者逆转硫途径。1)转硫途径:细胞通过OAH途径合成的同型半胱氨酸在PpCys4p(胱硫醚合成酶)的催化下生成胱硫醚,而后胱硫醚在PpCys3p(胱硫醚-β-裂解酶)的催化下合成半胱氨酸。2)逆转硫途径:细胞通过OAS途径合成的半胱氨酸在PpStr2p(胱硫醚-β-合成酶)的催化下合成胱硫醚,具有同型半胱氨酸合成酶活性的PpStr3p催化胱硫醚合成同型半胱氨酸。
为了证明毕赤酵母是否具有类似转硫途径与逆转硫途径,作者通过基因敲除Ppstr2、Ppmet17及Ppcys3基因,构建单突变菌株或者双突变菌株,并在添加了不同有机硫源或无机硫源的B培养基上验证生长表型,见图 5。 Ppstr2Δ与 Ppstr2 ΔPpmet17Δ对比,Ppstr2Δ不能在以半胱氨酸的为惟一硫源的平板上生长外,不论是在硫酸铵平板还是甲硫氨酸平板上都能生长。根据本研究推测的毕赤酵母逆转硫途径,PpStr2p是逆转硫途径中的关键酶,Ppstr2Δ菌株中由于胱硫醚-β-合成酶缺失,导致细胞不能利用半胱氨酸合成胱硫醚,进而不能合成甲硫氨酸,导致细胞死亡。而Ppstr2ΔPpmet17Δ则只能在含甲硫氨酸的B培养基上生长,而在以半胱氨酸或者硫酸铵为硫源的B培养基上细胞不能生长;这说明毕赤酵母细胞中存在逆转硫途径,因为敲除Ppmet17基因阻断了OAH途径,细胞还能利用OAS途径合成含硫氨基酸,但是合成的半胱氨酸由于Ppstr2基因被敲除导致胱硫醚-β-合成酶缺失,不能合成甲硫氨酸的前体物质胱硫醚,不能进一步合成甲硫氨酸,所以细胞死亡。
进一步研究Ppcys3Δ、Ppmet17Δ 及 Ppcys3 ΔPpmet17Δ生长表型对比。Ppcys3Δ与 Ppcys3 ΔPpmet17Δ能在硫酸铵及半胱氨酸平板上生长,但是不能在甲硫氨酸平板上生长。这一证据说明,在毕赤酵母中存在转硫途径与逆转硫途径,因为Ppcys3Δ与 Ppcys3ΔPpmet17Δ 一样,当 Ppcys3基因被敲除后,尽管细胞不能利用转硫途径合成半胱氨酸,但是细胞仍然可以利用OAS途径合成半胱氨酸,而后通过逆转硫途径合成甲硫氨酸。而Ppcys3ΔPpmet17Δ双缺陷型菌株,尽管Ppmet17基因被敲除失去了OAH途径,但是与Ppcys3Δ单缺陷型菌株一样还有OAS途径及逆转硫途径存在,所以细胞维持正常生长。
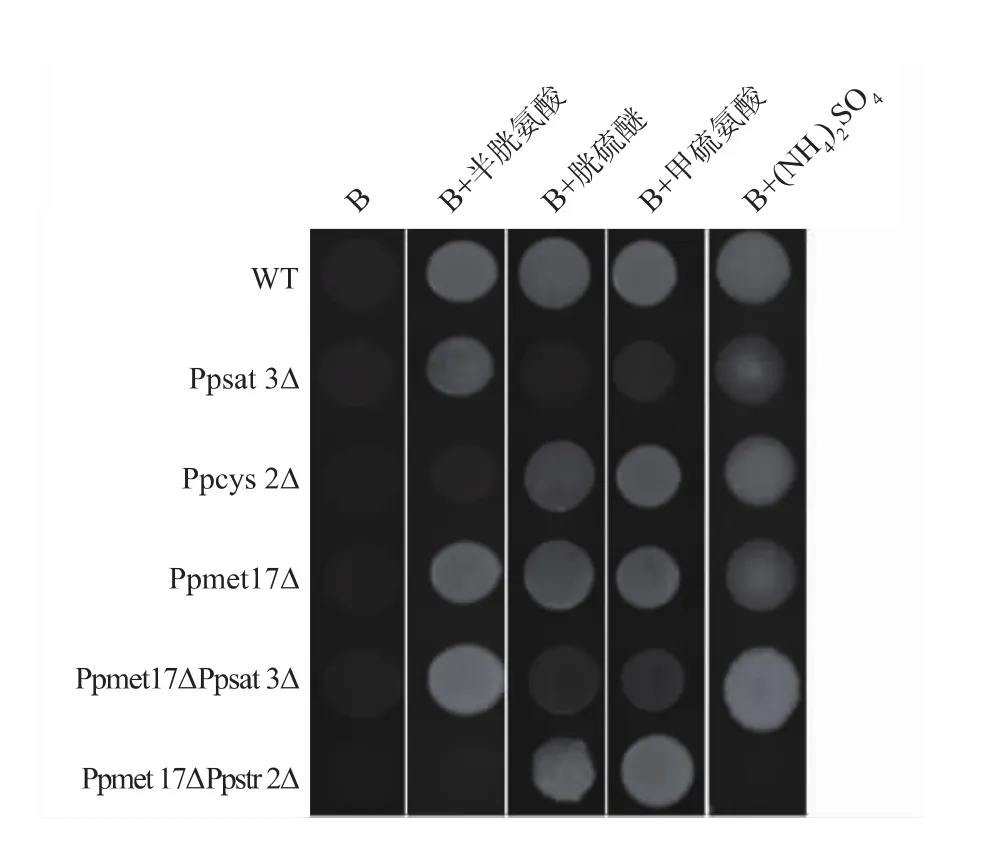
图5 毕赤酵母转硫途径与逆转硫途径的验证Fig.5 Validation of transsulfuration pathway and Reverse transsulfuration pathway in P.pastoris
3 结 语
作者根据遗传学及表型分析,确定毕赤酵母中存在以同型半胱氨酸为中心的甲硫氨酸和半胱氨酸合成途径,这与大多数半子囊酵母菌[14]中含硫氨基酸的生物合成类似。此过程中硫化物中的硫元素首先转移至三碳化合物生成同型半胱氨酸,然后通过甲基循环合成甲硫氨酸或者利用转硫途径合成半胱氨酸,最终合成GSH等物质[15]。此外在毕赤酵母中同时存在另一条以丝氨酸为底物的半胱氨酸合成途径,在大多数丝状真菌(如构巢曲霉和粗糙脉孢霉)及酵母(如多型汉逊酵母和栗酒裂殖酵母)都存在这条OAS途径[5-6]。毕赤酵母这种具有OAS途径及OAH途径的表达菌株在表达纯化硒代蛋白方面具有重要的意义。
