杨桃根多糖提取工艺优化及其体外活性
2019-10-16廖彭莹李典鹏扈芷怡陈慧萍杨小妹吴勇燕
廖彭莹, 李典鹏, 扈芷怡, 陈慧萍, 杨小妹, 吴勇燕
(1.广西中医药大学,广西 南宁530001;2.广西壮族自治区中国科学院广西植物研究所,广西植物功能物质研究与利用重点实验室,广西 桂林541006)
杨桃根为酢浆草科五敛子属植物杨桃Averrhoa carambola L.的根或根皮,其味酸、涩,性平,具有祛风除湿、行气止痛、涩精止带的功效[1],含有类型丰富的活性成分[2-6],其中多糖具有降血糖、抗氧化作用[5-7]。
糖尿病是以持续高血糖为主要生化特征的综合代谢性疾病,发病率持续增加,目前我国患病人数已居世界第一[8]。α-葡萄糖苷酶是食物中碳水化合物水解的关键酶,相关抑制剂通过抑制其活性来阻滞多糖、双糖水解,延缓葡萄糖吸收,从而使血糖平稳缓慢地维持在一定水平[9],部分植物多糖已证实具有较强抑制活性[10-12],但杨桃根多糖相关研究尚无报道。因此,本实验将优化杨根多糖提取工艺,并评价其体外活性,以期为该成分开发利用提供参考。
1 材料
1.1 仪器 RE-52AA 旋转蒸发器(上海亚荣生化仪器厂); 酶标仪 (美国伯腾仪器有限公司);BSA224S 电子天平(北京赛多利斯仪器系统有限公司);恒温水浴器(金坛市医疗仪器厂);PH 计(德国赛多利斯公司); 微量移液器 (德国Eppendorf 公司)。
1.2 药材 杨桃根于2015 年6 月采于广西南宁,经广西中医药大学朱意麟实验师鉴定为酢浆草科五敛子属植物杨桃Averrhoa carambola L.的根,粉碎过40 目筛后备用。
1.3 试剂 维生素C 购自天津博迪化工股份有限公司;1,1-二苯基-2-三硝基苯肼 (DPPH)、2,2-联 氮-二 (3-乙 基-苯 并 噻 唑-6-磺 酸) 二 铵 盐(ABTS) 购自上海伊卡生物技术有限公司;过硫酸钾购自中国医药集团上海化学试剂公司;α-葡萄糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷、阿卡波糖购自美国Sigma 公司;D-(+) -葡萄糖购自国药集团化学试剂有限公司。所有试剂均为分析纯。
2 方法与结果
2.1 药材预处理 称取药材粉末600 g, 加入3 000 mL 石油醚回流提取3 次,每次1 h,药渣挥干,加入95%乙醇3 000 mL 回流提取3 次,每次1 h,药渣挥干,得到药渣555 g。
2.2 多糖含有量测定
2.2.1 线性关系考察 精密吸取不同体积葡萄糖对照品溶液(0.10 mg/mL) 于50 mL 量瓶中,蒸馏水定容,摇匀,精密吸取2 mL 于10 mL 具塞试管中,加入苯酚1 mL、浓硫酸8 mL,摇匀,冷却,静置30 min;另取2 mL 蒸馏水同法操作,作为空白参比,在485 nm 波长下测定吸光度。以吸光度为纵坐标(A),溶液质量浓度为横坐标(X) 进行回归, 得方程为A =10.045X +0.054 06 (r =0.999 1),在0.010 ~0.060 mg/mL 范围内呈良好的线性关系。
2.2.2 方法学考察
2.2.2.1 精密度试验 精密吸取0.05 mg/mL 多糖溶液6 份,每份1.5 mL,置于10 mL 具塞试管中,按“2.2.1” 项下方法测定吸光度,测得其RSD 为0.40%,表明仪器精密度良好。
2.2.2.2 稳定性试验 精密吸取0.05 mg/mL 多糖溶液1.5 mL, 置于10 mL 具塞试管中, 按“2.2.1” 项下方法测定吸光度,每隔30 min 1 次,测得其RSD 为0.64%,表明溶液在3 h 内稳定性良好。
2.2.2.3 重复性试验 精密称取药材5 份,每份1 g,按“2.1” 项下方法预处理后将药渣挥干,加入50 mL 蒸馏水煎煮2 次,每次1 h,过滤得到水提液,定容至100 mL 量瓶中,精密量取1.5 mL 于10 mL 具塞试管中,按“2.2.1” 项下方法测定吸光度,测得其RSD 为1.57%,表明该方法重复性良好。
2.2.2.4 加样回收率试验 精密吸取5 份0.05 mg/mL多糖溶液,每份5 mL,加入0.1 mg/mL对照品溶液1.5 mL,定容至10 mL,按“2.2.1”项下方法测定吸光度,测得其平均加样回收率为98.10%,RSD 为5.51%。
2.3 单因素试验
2.3.1 提取时间 精密称取适量药渣(M1),置于250 mL 具塞锥形瓶中,加入料液比1 ∶30 的蒸馏水,超声(40 kHz、200 W) 处理20、30、40、50、60 min,每组平行3 次。所得提取液过滤,滤液减压浓缩至约10 ~15 mL,加入4 倍量无水乙醇至含醇量为80%,静置过夜,抽滤,沉淀用无水乙醇、乙醚、丙酮各5 ~10 mL 洗涤,减压干燥,得到多糖,精密称定质量(M2),计算提取率,公式为提取率=M2/M1×100%,结果见图1。由图可知,随着提取时间延长,多糖提取率逐渐上升,在50 min 时最高,为1.85%,但继续延长时反而明显下降,故选择30~50 min 作进一步优化。
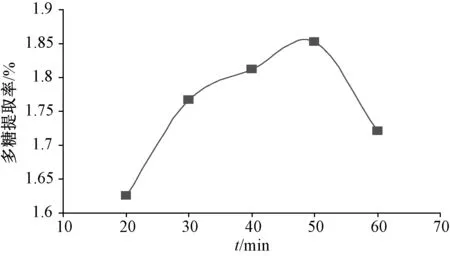
图1 提取时间对多糖提取率的影响Fig.1 Effect of extraction time on the extraction rate of polysaccharides
2.3.2 提取温度 精密称取适量药渣于250 mL 具塞锥形瓶中,加入料液比1 ∶30 的蒸馏水,提取温度50、60、70、80、90 ℃,超声处理30 min,每组平行3 次,提取液过滤,按“2.4.1” 项下方法计算多糖提取率,结果见图2。由图可知,随着提取温度升高,多糖提取率缓慢增加,在60 ~70 ℃之间最高,但继续升高时反而明显下降,故选择50~70 ℃作进一步优化。

图2 提取温度对多糖提取率的影响Fig.2 Effect of extraction temperature on the extraction rate of polysaccharides
2.3.3 料液比 精密称取适量药渣于250 mL 具塞锥形瓶中,加入料液比1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50 的蒸馏水,提取温度70 ℃,超声处理30 min, 每 组 平 行3 次, 提 取 液 过 滤, 按“2.3.1” 项下方法计算多糖提取率,结果见图3。由图可知,料液比1 ∶20、1 ∶40 时多糖提取率最高,但1 ∶50 时明显下降,可能是后期处理过程中提取液过多而造成多糖损失, 故选择料液比1 ∶20~1 ∶40 作进一步优化。

图3 料液比对多糖提取率的影响Fig.3 Effect of solid-liquid ratio on the extraction rate of polysaccharides
2.4 正交试验 在单因素试验基础上,选择提取时间 (30、 40、 50 min)、 提 取 温 度 (50、 60、70 ℃)、料液比(1 ∶20、1 ∶30、1 ∶40) 作为影响因素,多糖提取率作为评价指标,设计L9(34)正交试验,每组3 个平行。结果见表1,方差分析见表2。

表1 试验设计及结果Tab.1 Design and results of tests

表2 方差分析Tab.2 Analysis of variance
由表1 可知,各因素影响程度依次为提取温度>料液比>提取时间,最优工艺为A3B1C2,即提取温度70 ℃,提取时间30 min,料液比1 ∶30。由表2 可知, 提取温度、 料液比具有显著影响(P<0.05),而提取时间无显著影响(P>0.05)。
2.5 验证试验 按照优化工艺进行提取,平行3次,测得多糖提取率分别为1.92%、 1.87%、1.99%,平均1.93%,表明工艺稳定性良好。
2.6 多糖精制及光谱分析 采用Sevag 法对多糖溶液进行除蛋白[13],向脱蛋白多糖溶液中加入1%双氧水进行脱色,再向溶液中加入乙醇至含醇量为80%,4 ℃下静置过夜,离心,沉淀用丙酮、乙醇分别洗涤,50 ℃下烘干,即得精制多糖。然后,将其配成0.1 mg/mL,紫外分光光度法在200 ~400 nm波长范围内扫描,发现在260、280 nm 处均无明显吸收峰,表明不含核酸和蛋白质[14]。
2.7 多糖体外活性研究


图4 多糖对ABTS·+清除率的影响Fig.4 Effect of polysaccharides on the scavenging rate of ABTS·+
2.7.2 清除DPPH· 取多糖溶液、0.2 mmol/L DPPH 自由基溶液各100 μL,作为样品组;以等体积无水乙醇代替DPPH 自由基溶液,作为空白组;以等体积蒸馏水代替多糖溶液,作为对照组,每组平行3 次,混合均匀后常温下避光反应30 min,于517 nm 波长处测定吸光度,按“2.7.1” 项下方法计算清除率, 结果见图5。 由图可知, 在0.2 ~2.0 mg/mL范围内多糖对DPPH·的清除率随着其质量浓度增加而不断升高,EC50为0.33 mg/mL。


图5 多糖对DPPH·清除率的影响Fig.5 Effect of polysaccharides on the scavenging rate of DPPH·
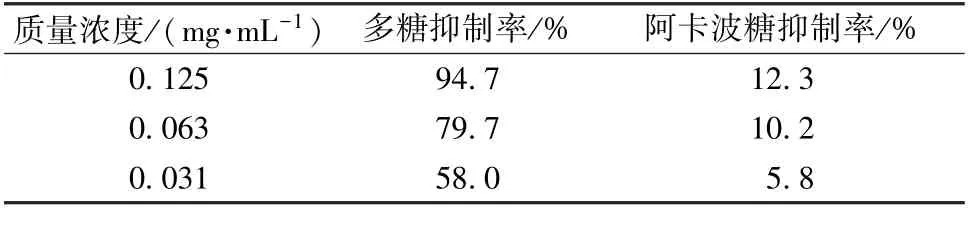
表3 多糖对α-葡萄糖苷酶的抑制作用Tab.3 Effect of polysaccharides on inhibiting α-glucosidase
3 讨论与结论
本实验通过正交试验优化杨桃根多糖提取工艺,发现该方法操作简便,易于推广应用。再对多糖进行精制处理和体外活性研究,发现该成分有较强的体外抗氧化活性,对ABTS·+的清除能力接近维生素C,而且同等质量浓度下对α-葡萄糖苷酶的体外抑制作用强于阳性对照药阿卡波糖。
α-葡萄糖苷酶抑制剂类药物已被推荐为治疗Ⅱ型糖尿病的一线用药,目前仅有阿卡波糖、伏格列波糖、米格列醇3 个药物成功上市,并应用于临床。本实验对杨桃根多糖抑制α-葡萄糖苷酶活性进行评价,从新角度发现了其医药价值。
致谢:感谢国家中医药管理局科研三级实验室中(壮) 药化学与质量分析实验室、广西高校中药提取纯化与质量分析重点实验室提供实验仪器及场所。
