产Surfactin芽孢杆菌的筛选及特性研究
2019-07-24李彦林张蔚李晓玉鲁心怡曹钰
李彦林,张蔚,李晓玉,鲁心怡,曹钰*
1(江南大学 生物工程学院,江苏 无锡,214122) 2(教育部工业生物技术重点实验室(江南大学),江苏 无锡,214122)
当前,全球表面活性剂的使用量大幅增加,每年化学和生物表面活性剂的全球市场价值超过200亿美元[1-2]。和化学表面活性剂相比,生物表面活性剂是微生物发酵产生的生物活性分子,具有较低的毒性和较高的生物降解性,并且能够在极端的温度、pH和盐度下保持表面活性[3]。
Surfactin是由C12—C17长链脂肪酸和7个氨基酸构成的环状脂肽,为研究最多的脂肽类表面活性剂之一,具有保湿[4]、抑菌[5]、抗炎[6]、抗肿瘤[7]等活性,甚至可以辅助治疗人类免疫缺陷病[8],在化妆品、食品、医药等领域具有广阔的应用前景。但其工业化进程受制于较高的生产成本。通常在发酵类产品的生产中,原材料成本约占总成本的41%[9]。因此使用廉价的工农业废弃物作为碳源来发酵生产surfactin,在降低生产成本方面扮演重要角色。目前已有以梨汁[10]、橄榄油场废料[11-12]、木薯废水[13]、白酒糟[14]、过期糖蜜[15]、豆渣[3]作为碳源的文献报道。啤酒糟(brewer's spent grain,BSG)是在啤酒生产环节麦芽汁加工过程残留的固体物质。全球每年BSG产量约3 860万t[16],其中我国年产量约1 000万t[17],具有丰富的资源。目前BSG主要用于动物饲料[18],亟待高附加值的开发利用。
本研究主要根据surfactin的表面活性性质,以及生产菌株具备的surfactin合成调控基因srfA,开展surfactin合成菌株的定向筛选,通过薄层层析(thin layer chromatography,TLC)和超高效液相色谱-电喷雾四级杆飞行时间质谱(ultra performance liquid chromatography/electrospray ionization quadrupole time-of-flight high-resolution/mass spectrometry,UPLC-ESI/Q-TOF/MS)进行产物的定性验证和定量分析,筛选利用BSG酶解液为碳源的surfactin高产菌株,并进行分子生物学鉴定。
1 材料与方法
1.1 材料与试剂
无锡雪浪山附近筛选得到的247株芽孢杆菌,实验室保藏。
surfactin(≥98%)标准品S3 523,美国sigma公司;甲醇、乙腈(HPLC级),赛默飞世尔科技有限公司;三氟乙酸(HPLC级),上海麦克林生化科技有限公司;普通PCR制剂,Takara公司;其他试剂,国药集团(上海)化学试剂有限公司。
1.2 培养基
LB培养基(g/L):蛋白胨10,酵母膏5,NaCl 10。制备固体培养基时添加2%营养琼脂,pH 7.0。
MSM培养基(g/L):葡萄糖40,NH4NO38,KH2PO44.08,Na2HPO45.68,MgSO4·7H2O 2.46×10-2,CaCl21.03×10-3,FeSO41.11×10-3,EDTA 1.18×10-3,pH7.0。
发酵培养基:用5 g/L预处理BSG的酶解液替代MSM培养基中葡萄糖。
1.3 仪器与设备
LDZX-50KBS高压蒸汽灭菌锅,上海申安医疗机械厂;T100 PCR仪,美国Bio-Rad公司;TGL-16C高速离心机,上海安亭科学仪器厂;GSP-9050MBE隔水式电热恒温培养箱,上海博迅实业有限公司;ZQZY-70B振荡培养箱,上海知楚仪器;PA2014N电子天平,梅特勒-托利多国际贸易(上海)有限公司;SW-CJ-2FD洁净工作台,苏净安泰空气技术有限公司;DCAT21表面张力动态接触角测量仪,德国Dataphysics公司;Chromaster高效液相色谱仪,日本日立公司;MALDI SYNAPT MS超高效液相色谱串联四极杆飞行时间质谱联用仪,美国waters公司。
1.4 方法
1.4.1 发酵上清液性质测定
基于surfactin的表面活性特性,通过无细胞发酵上清液排油活性、乳化指数及表面张力性质的测定,初步筛选产生物表面活性剂的菌株。即将筛选得到的247株芽孢杆菌接种于MSM培养基中30 ℃,200 r/min摇瓶培养96 h,发酵液于10 000 r/min离心5 min得到无细胞上清,进行性质测定。
1.4.1.1 排油活性(ODA)测定
取30 mL蒸馏水于培养皿中,加20 μL大豆油于蒸馏水表面,形成油层之后,滴加10 μL无细胞上清液,若能够形成透明圈,说明有表面活性物质产生,并记录透明圈直径大小。
1.4.1.2 乳化指数(E24)测定
以乳化指数来表征无细胞上清液的乳化能力。取2 mL大豆油于试管中,然后加入2 mL无细胞上清液,旋涡高速振荡2 min后,在室温下静置24 h,计算乳化指数E24:
(1)
式中:h1,乳化层高度;h2,液体总高度。
1.4.1.3 表面张力(SFT)测定
利用德国Dataphysics公司表面张力动态接触角测量仪测定无细胞上清液表面张力。取40 mL无细胞上清液于烧杯中,放置到张力计检测品台上,按照说明书方法进行操作。测定不同样品之间需用无菌的MSM培养基进行洗涤后测定。
1.4.2srfA基因特异PCR分析
经过发酵液性质测定,选择初步确定能产表面活性剂的菌株。进行srfA基因检测,进一步确定菌株是否具有合成surfactin合成酶的能力。PCR扩增引物及条件参照文献[19]。
1.4.3 发酵产物分析
向无细胞上清液中添加5 mol/L的HCl调节pH至2.0,放于4 ℃冰箱过夜,10 000 r/min离心5 min,弃上清,沉淀用甲醇溶解后备用。
1.4.3.1 薄层层析(TLC)
通过TLC初步半定性半定量surfactin的产生,使用Merck硅胶60荧光薄层层析铝箔板F254进行薄层层析,流动相为V(氯仿)∶V(甲醇)∶V(乙酸)=80∶10∶10,surfactin标品作为对照。
1.4.3.2 UPLC-ESI/Q-TOF MS条件
液相条件:使用Waters C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相A为含有体积分数为0.1%甲酸的色谱乙腈溶液,流动相B为含有体积分数为0.1%甲酸的水溶液,V(A)∶V(B)=90∶10等度洗脱;柱温30 ℃,流速为0.3 mL/min;进样体积5 μL。
质谱条件:电喷雾离子源(ESI),正离子检测模式;离子源温度为20 ℃;毛细管电压3 000 V;锥孔电压30 V;去溶剂气体流速500 L/h;去溶剂温度500 ℃;锥孔气流50 L/h;范围m/z500~1 500,检测时间20 min。
1.4.4 surfactin定量检测
采用高效液相色谱仪对surfactin进行定量测定。色谱柱:Agilent C18色谱柱(250 mm×4.6 mm,5 μm);流动相A为含有体积分数为0.1%三氟乙酸的色谱乙腈溶液,流动相B为含有体积分数为0.1%三氟乙酸水溶液,V(A)∶V(B)=90∶10等度洗脱;柱温30 ℃,流速为1 mL/min;检测波长205 nm;进样体积20 μL。
1.4.5 利用预处理BSG酶解液中发酵生产surfactin
参考文献[20]BSG酶解条件,酶解完成后,100 ℃灭酶10 min,酶解液处理方式分为2种,一种是10 000 r/min离心5 min,得到BSG酶解上清液(supernatant of enzymatic hydrolysate of BSG,SEH-BSG),另一种纱布过滤得到BSG酶解滤液(filtrate of enzymatic hydrolysate of BSG,FEH-BSG),配制发酵培养基,121 ℃灭菌20 min。按照10%接种量接入菌株,30 ℃,200 r/min培养96 h,测定surfactin产量,选出利用BSG酶解液最好的菌株。
1.4.6 发酵产物纯化及保湿性测定
发酵产物纯化方法参照文献[21],保湿性测定参照文献[22]。
1.4.7 菌株鉴定
1.4.7.1 菌株形态观察
活化菌株,挑取芽孢杆菌新鲜培养物,进行革兰氏染色和芽孢杆菌显微形态观察;同时在LB平板划线,培养观察菌落形态。
1.4.7.2 菌株16S rDNA分析
采用细菌基因组抽提盒提取芽孢杆菌总DNA,使用通用引物27F和1 492R对菌株16S rDNA进行PCR扩增,目标片段1 500 bp左右,PCR条件为:95 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,进行30个循环,72 ℃修复延伸5 min,10 ℃保温。PCR产出纯化后,由苏州金唯智生物科技有限公司进行测序。
2 结果与分析
2.1 产surfactin菌株定向筛选
2.1.1 基于发酵上清液表面活性特性的初筛
Surfactin是一种生物表面活性剂,具有表面活性剂的典型特征,即排油活性(ODA)、乳化指数(E24)和降低水表面张力(SFT),SFT值越低,表明表面活性越强,ODA与E24值越大。据此,从247株芽孢杆菌的MSM培养基发酵培养上清液中共筛选出17株同时具有上述3种特性的菌株,测定结果如图1。
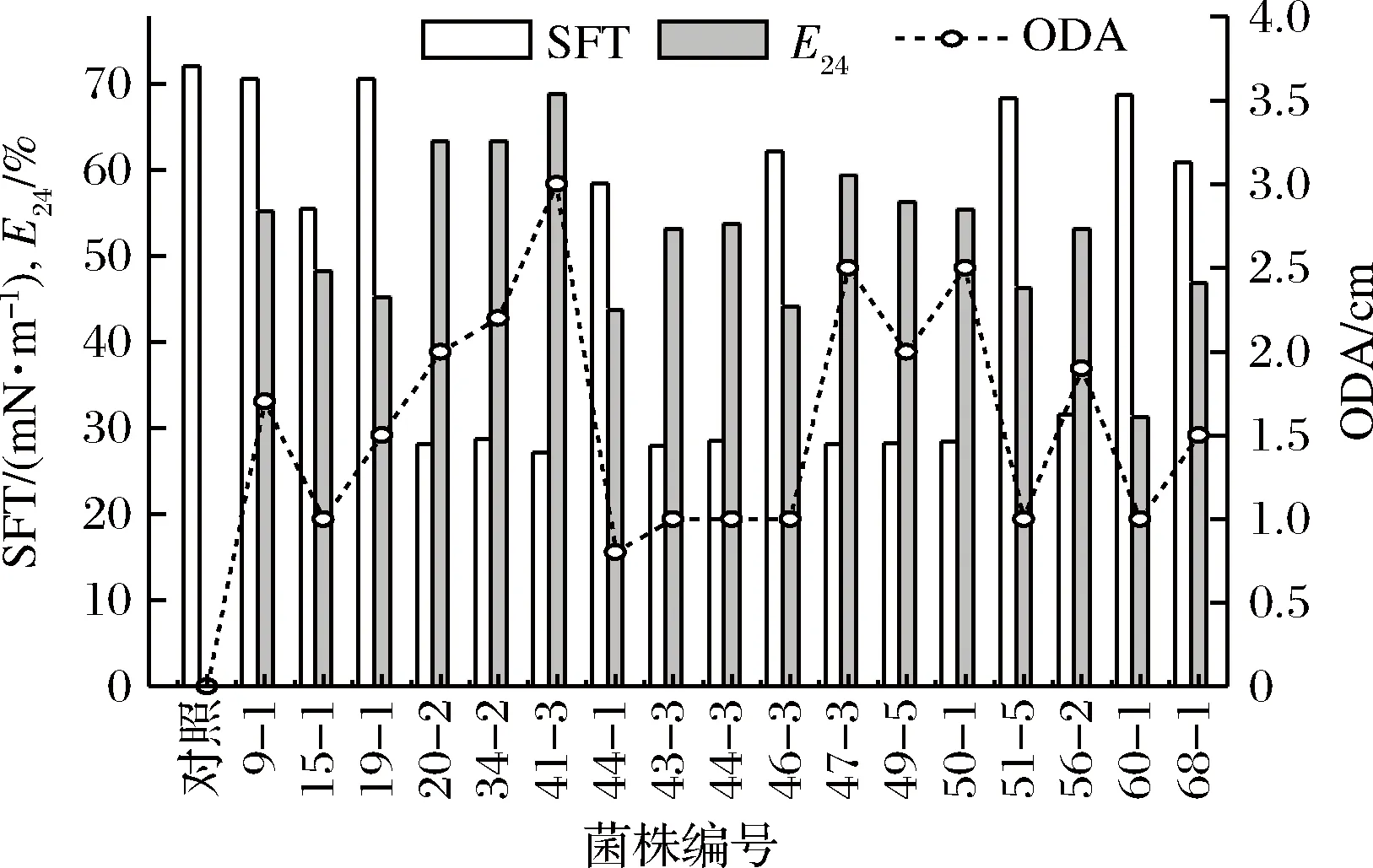
图1 不同菌株发酵上清液的表面活性特性分析Fig.1 The surface activity parameters of different strains’ fermentation supernatant
以无菌的MSM培养基为对照,发现菌株41-3发酵液降低培养基SFT值,提高培养基ODA和E24值效果最好,表明该菌株合成生物表面活性剂能力最强,有可能是surfactin高产菌株。
2.1.2 基于菌株srfA基因特异PCR的复筛
由于srfA是编码surfactin合成酶的基因,缺失srfA基因,surfactin将不能合成。具有表面活性剂典型特征的17株芽孢杆菌进行srfA基因检测,如图2所示,发现有8株芽孢杆菌srfA基因阳性,编号分别为20-2,41-3,43-3,44-3,47-3,49-5,50-1,56-2。
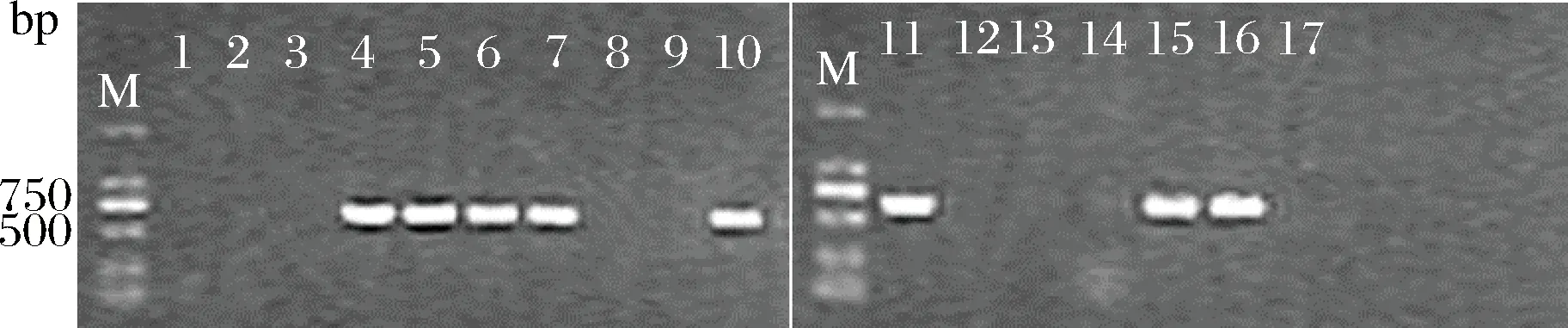
M-maker2000;1~17分别代表菌株9-1,19-1,34-2,41-3,20-2,43-3,44-3,15-1,44-1,47-3,49-5,51-5,46-3,68-1,50-1,56-2,60-1图2 不同菌株srfA基因特异性PCR分析Fig.2 Analysis of srfA gene specific PCR in different strains
2.2 利用BSG的高产菌株的选择
将srfA基因检测阳性的8株芽孢杆菌接种到基础培养基中30 ℃培养96 h,经酸沉,甲醇溶解,通过TLC和UPLC-ESI/Q-TOF MS定性分析菌株的发酵产物中是否含有surfactin。通过HPLC定量测定surfactin。
2.2.1 发酵产物的定性分析
2.2.1.1 TLC法定性分析发酵产物
如图3所示,菌株41-3发酵液提取物和sigma公司surfactin标品(S3 523)经薄层层析板的条带一致,有相同的Rf值。表明发酵液中含有surfactin。故进一步进行UPLC-ESI/Q-TOF MS分析,以明确该产物是否为surfactin。

1- surfactin标品(S3 523);2-菌株41-3发酵液提取物图3 紫外254nm波长下样品的TLC分析结果Fig.3 TLC results of samples at UV 254 nm
2.2.1.2 菌株41-3发酵液提取物中surfactin定性分析
利用UPLC-ESI/Q-TOF MS液质连用法,对菌株41-3发酵液提取物中的surfactin进行定性分析。结果见图4。从图4可见,surfactin标品(S3 523,Sigma公司)和菌株41-3发酵提取物均为一些同系物,其[M+H]+峰均位于1 008、1 022、1 036、1 050、1 064m/z,[M+Na]+峰均位于在m/z1 030、1 044、1 058、1 072、1 086,分别代表C13—C17surfactin同系物。
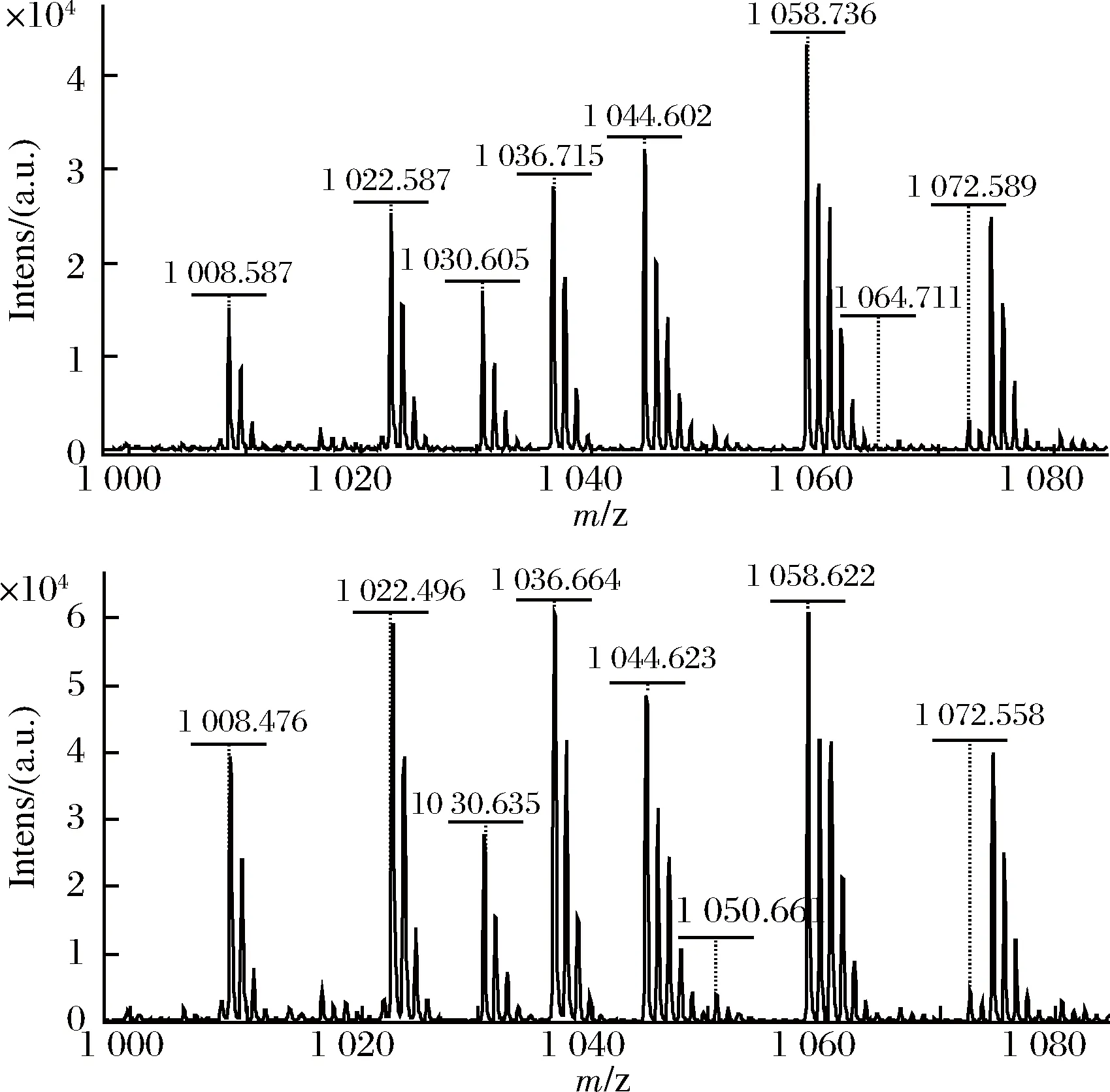
a-surfactin标准品;b-菌株41-3发酵提取物图4 液质联用分析样品的[M+H]+和[M+Na]+质谱图Fig.4 Comparison of [M+H]+ and [M+Na]+ spectra of samples by LC/MS analysis
2.2.2 surfactin高产菌株的筛选
根据不同浓度的surfactin标品配置的标准溶液,绘制出surfactin标准曲线。得到surfactin浓度与峰面积的对应关系:
Y=2×10-5X峰面积-0.966 7,R2=0.999 1
(2)
式中:Y,surfactin浓度质量浓度,g/L;X,峰面积。
对8株产surfactin的菌株以MSM培养30 ℃,200 r/min发酵96 h,HPLC测定其产量,结果见图5。其中菌株41-3 surfactin产量最高,达到541.32 mg/L。其次为菌株43-3,其surfactin产量达到258.39 mg/L,其余菌株发酵产量均不到100 mg/L。据文献报道,通常天然分离的芽孢杆菌surfactin产量为100 mg/L左右,而菌株41-3 surfactin产量达到541.32 mg/L,故选用菌株41-3作进一步研究。
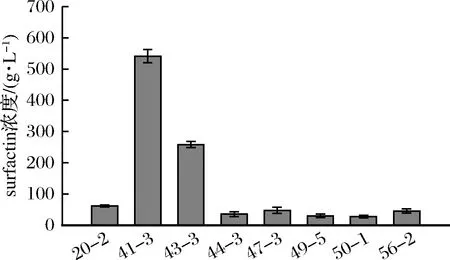
图5 不同菌株在MSM中surfactin产量Fig.5 Surfactin production of different strains in MSM
2.2.3 利用BSG产surfactin菌株surfactin产量及同系物成分分析
2.2.3.1 利用BSG产surfactin菌株surfactin产量
为考察菌株对BSG的发酵利用情况,采用10 g/L的NaOH稀碱溶液预处理BSG,去除木质素便于纤维素酶更好地水解纤维素,以酶解液中的还原糖供菌株生长和发酵并生产surfactin。选取菌株在MSM培养基中surfactin产量最高的菌株41-3和43-3,进行BSG发酵试验,结果见表1。
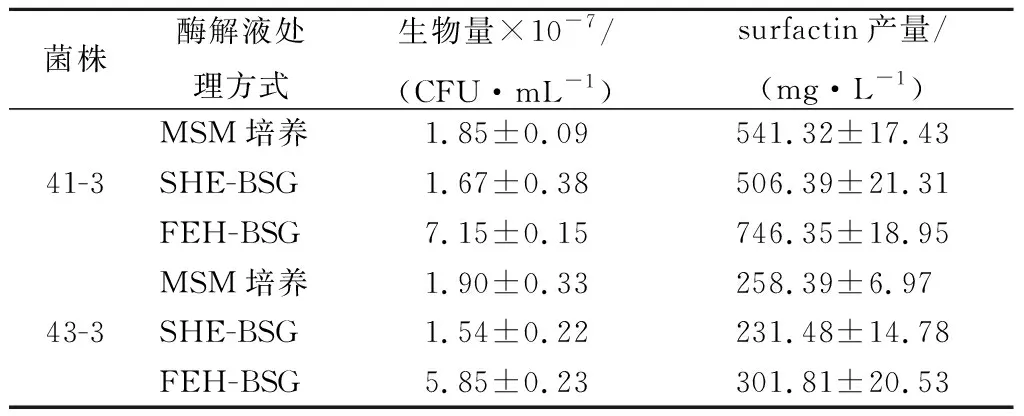
表1 菌株利用BSG酶解液发酵试验Table 1 Fermentation results by using BSG enzymatic hydrolysate
从表1中看出,相比于MSM培养基,菌株41-3和43-3在SHE-BSG酶解液(无固形物)中培养,surfactin产量分别下降了34.93 mg/L、26.89 mg/L。然而,菌株41-3和43-3在FEH-BSG酶解液(含固形物)中培养,surfactin产量相比于MSM培养基均有提高,特别是菌株41-3 surfactin产量达到746.35 mg/L,提高了1.38倍,同时生物量和MSM培养基培养相比,也从1.85×107CFU/mL提高到7.15×107CFU/mL。可能原因是BSG酶解完成后,FEH-BSG酶解液含有固体BSG颗粒,而且有报道称,固体物质能够使菌体吸附,提高生物量,进而提高surfactin产量[23]。
2.2.3.2 不同碳源条件下发酵产物中surfactin同系物分析
根据UPLC-ESI/Q-TOF MS样品出峰时间和质荷比对应关系,对发酵产物中的surfactin各同系物的相对含量进行分析,结果见表2。
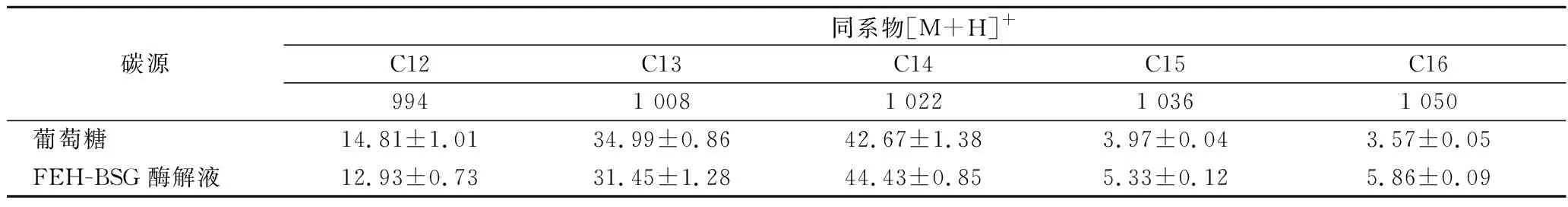
表2 利用不同碳源发酵产的surfactin同系物分析Table 2 Analysis of surfactin homologues produced by fermented with different carbon sources
从表2可以看出,菌株41-3产生的surfactin同系物中,以脂肪酸链为C14和C13的surfactin为主,两者含量约占75%。利用FEH-BSG酶解液和利用葡萄糖发酵生产surfactin相比,surfactin的合成向更长链脂肪酸surfactin迁移。有文献报道,surfactin的表面活性会随着脂肪酸链的增长而显著提高,同时其乳化,保湿性能也有所增强[24-25]。分别以FEH-BSG酶解液和葡萄糖为碳源发酵,对获得的surfactin进行表面活性特性分析,结果见表3。利用前者生产的surfactin同系物的表面张力、乳化指数以及保湿性均优于后者,其中,表面张力降低了6.31%,乳化指数和保湿性分别提高了7.53%和48.04%。因此,FEH-BSG酶解液作为碳源时不仅提高了surfactin产量,也增强了surfactin的表面活性性能,可以作为葡萄糖的替代品用来发酵生产surfactin。
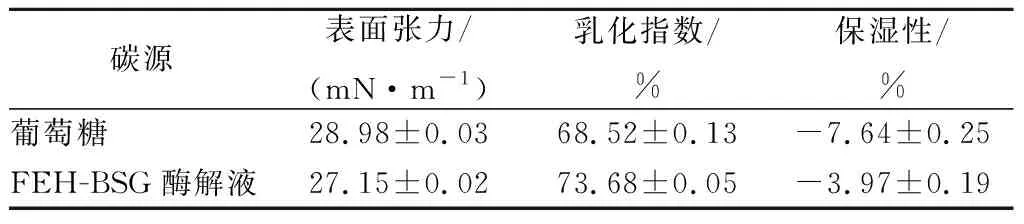
表3 利用不同碳源发酵产的surfactin表面活性分析Table 3 Surface activity analysis of surfactin produced by fermented with different carbon sources
2.2.4 高产surfactin菌株鉴定
2.2.4.1 菌株41-3形态观察
菌株41-3为革兰氏阳性菌,菌落易挑起,呈白色,表面粗糙不透明。菌体细胞呈杆状,能够形成芽孢,芽孢呈椭圆状,位于细胞中央。图6-a为菌株平板形态,图6-b为菌株细胞革兰氏染色后油镜下的显微镜形态。
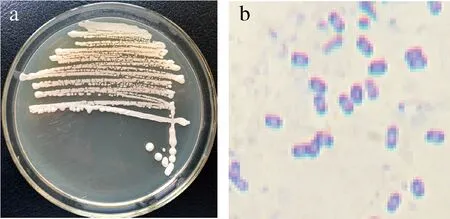
a-平板菌落形态;b-细胞显微形态图6 菌株41-3平板菌落形态和细胞显微形态Fig.6 Colony morphology and cell microscopic morphology of strain 41-3
2.2.4.2 菌株41-3分子生物学鉴定
以通用引物27F和1 492R对41-3菌株16s rDNA进行PCR扩增,扩增产物经琼脂糖凝胶电泳,得到大约为1 500 bp的条带,如图7。
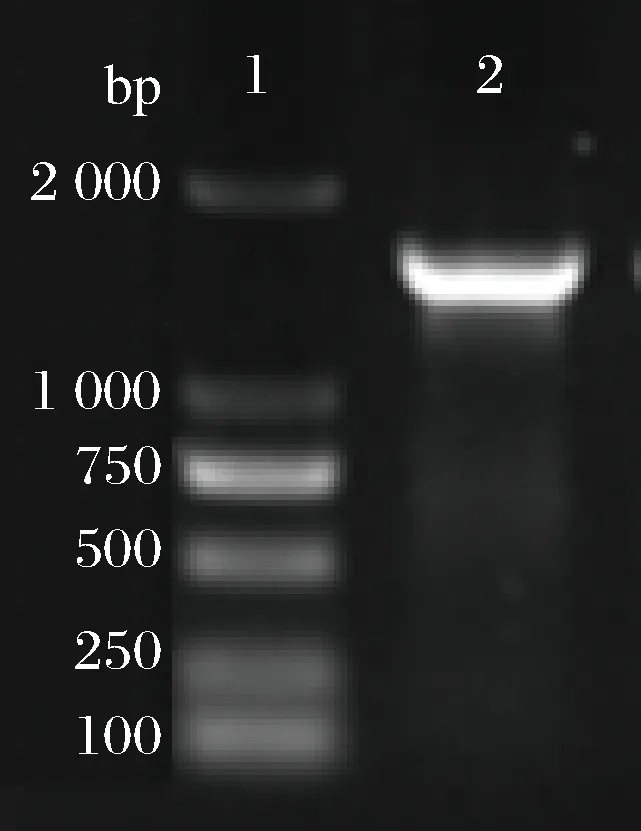
1- DNA分子标记;2- PCR产物图7 菌株41-3 16S rDNA的PCR结果Fig.7 16S rDNA PCR results of strain 41-3
PCR产物经纯化后,送样测序,经过NCBI数据库BLAST序列进行同源性比对,发现41-3菌株与Bacillussubtilis具有99%的同源性,亲缘关系最近,由此可确定菌株41-3菌株为Bacillussubtilis(枯草芽孢杆菌)。在NCBI数据库中下载相似度高的序列,利用MEG6软件构建进化树,如图8。

图8 菌株41-3进化树Fig.8 The phylogenetic tree of strain 41-3
3 结论
Surfactin是目前发现的最有效的生物表面活性剂,但生产成本过高限制了其工业化生产,筛选高产surfactin生产菌株及降低生产原料成本势在必行。
本研究根据surfactin性质及其编码基因,通过TLC和UPLC-ESI/Q-TOF MS定性定量分析,筛选分离得到1株surfactin产量较高的菌株41-3。经过形态学观察和16S rDNA分子生物学实验,菌株41-3为枯草芽孢杆菌(Bacillussubtilis)。另外,在MSM培养基中,枯草芽孢杆菌41-3surfactin产量为541.32 mg/L。然而,使用BSG酶解液作为碳源发酵生产surfactin,surfactin产量提高了1.38倍,达到746.35 mg/L。经过同系物分析比较,以BSG酶解液为碳源生产surfactin,长脂肪链的同系物含量提高,意味着BSG不仅仅可以作为碳源生产surfactin,而且surfactin的生物活性也随着长脂肪链的同系物含量提高而增强。
