磷脂酶D的重组表达及其在磷脂酰丝氨酸合成中的应用
2019-07-24侯海娟龚劲松翟珅徐敏周文斌陈杰鹏段丽丽张晓梅许正宏史劲松
侯海娟,龚劲松,翟珅,徐敏,周文斌,陈杰鹏,段丽丽,张晓梅,许正宏,2,史劲松*
1(江南大学 药学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)3(广东双骏生物科技有限公司,广东 汕头,515071)
磷脂酰丝氨酸(phosphatidylserine,PS)于1942年由JORDI FLOCH首次从牛脑中提取出来,随后对其进行了分子结构的定性分析[1]。它是磷脂中一种能够调控膜蛋白功能状态的磷脂[2],在细胞膜的磷脂双分子层中占有10%~20%[3],由于能够改善记忆力,并对抑郁症有良好的抑制作用[4],被称为“脑专一性营养物质”[5-6], PS在功能食品和制药领域有着广阔的应用前景[7-8]。近年来,人们对PS的关注度越来越高。
PS对人体生命活动具有关键作用,但其在自然界中的含量较少,随着目前人们对PS需求量日益增加,高效制备PS的方法越来越受到广泛关注。国内外已有不少学者对PS的制备方法进行研究,目前主要有提取法和生物酶转化法。提取法是指通过有机溶剂从植物种籽和动物细胞中萃取获得PS,酶转化法是指利用磷脂酶D(phospholipase D,PLD)的转磷脂酰作用,生物催化合成PS。由于提取法获得的PS得率较低,且具有携带疯牛病等动物流行病毒的安全风险,而酶转化法具备成本较低、操作简单、反应工艺绿色环保等优点,逐渐成为了合成PS的理想方法[9-11]。
PLD (EC3.1.4.4)具备水解磷酸二酯键和碱基互换的能力[12]。存在于植物、动物和微生物中,对于细胞信号传导、脂质代谢及生物膜形成等代谢过程具有重要作用[13-15]。在众多细菌来源的PLD中,链霉菌来源的PLD在磷脂合成中具有更好的应用潜力[16]。PLD的催化反应分为2种:一种是催化底物磷脂酰胆碱(phosphatidylcholine, PC)的磷酸酯键发生水解反应生成磷脂酸(phosphatidic acid, PA)和羟基化合物胆碱;另一种是催化羟基化合物与磷脂酰基团发生碱基互换反应,也就是磷脂酰基转移反应[17-18]。酰基转移反应可利用底物磷脂酰胆碱合成稀有磷脂,例如磷脂酰乙醇胺(phosphatidylethanolamine, PE)、磷脂酰肌醇(phosphatidylinositol, PI)、磷脂酰丝氨酸(PS)等[19-21]。
早期对PLD的研究主要集中于野生菌培养发酵条件的优化[22-25]。但由于野生菌发酵周期长,培养条件复杂,越来越多的研究者采用异源表达的方法生产PLD[26]。ZAMBONELLI等[27]以StreptomycesPMF的全基因组为模板,扩增获得了一段PLD序列,并将其表达在E.coliBL21(DE3)pLysE中,酶活为0.015 U/mL。本研究为实现PLD应用于生物催化制备PS,尝试将来源于链霉菌的PLD基因在研究相对成熟的大肠杆菌体系中进行异源表达和表征,并探究PLD在有机相-水相双向体系下的PS合成工艺条件,为生物法制备PS奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
克隆宿主E.coliJM109、表达宿主E.coliBL21(DE3)、载体pET-28a(+)均为本研究室保藏。
1.1.2 主要仪器与试剂
Waters 1525液相仪,美国Waters公司;大豆卵磷脂PC60(PC含量为60%)、胆碱氧化酶、过氧化物酶、磷脂酰丝氨酸(PS,99%),美国Sigma-Aldrich公司;酵母粉、蛋白胨,Thermo Scientific公司;其他试剂均为国产分析纯和化学纯。
底物卵磷脂溶液:称取88 mg PC60溶于10 mL底物缓冲液(40 mmol/L Tris-HCl pH 7.5)。
4-氨基安替比林溶液(4-ATT):0.058 g溶于40 mL Tris-HCl (40 mmol/L,pH 7.5)。
苯酚溶液:0.247 g溶于40 mL Tris-HCl (40 mmol/L,pH 7.5)。
反应终止液:100 mmol/L EDTA溶于40 mmol/L Tris-HCl (pH 7.5)。
过氧化物酶溶液(12.5 U/mL):总酶活50 U的过氧化物酶粉末溶于4 mL超纯水中。
胆碱氧化酶溶液(12.5 U/mL):总酶活50 U的胆碱氧化酶粉末溶于4 mL超纯水中。
1.1.3 培养基
LB培养基:质量浓度10 g/L NaCl、10 g/L蛋白胨、5 g/L酵母粉;调节pH为7.0。灭菌条件:121 ℃,20 min。
1.2 方法
1.2.1 构建重组质粒pET-28a(+)-sspld
以实验室前期保藏的1条具有良好磷脂酰水解活力的来源于链霉菌(Streptomycessp.)的磷脂酶D编码序列为模板,设计携带BamHI和HindIII酶切位点的引物,sspldF (CGG GAT CCA TGG CAC GTC ATC CG)、sspldR (CCA AGC TTT TAA TCC TGA CAA AT) 扩增目的基因。扩增产物以琼脂糖凝胶电泳进行验证,回收,与本实验中选用的表达质粒pET-28a(+)在37℃进行双酶切后连接,转化E.coliJM109感受态细胞,取单菌落进行菌落PCR,提取重组质粒后进行酶切和测序验证。
1.2.2 表达重组质粒pET-28a(+)-sspld
将重组质粒转化E.coliBL21,转化子接种于LB培养基培养至OD600达到0.6~0.8时,加入终浓度为0.5 mmol/L的IPTG,25 ℃摇床培养8 h,离心收集菌体。用缓冲液洗涤重悬菌体,并进行超声破碎,离心后获得的上清液即为含PLD的粗酶液。
1.2.3 酶活检测
60 ℃条件下,40 μL酶液与60 μL底物卵磷脂溶液反应20 min,加入50 μL反应终止液后于100 ℃沸水浴5 min,6 000 r/min离心5 min,吸取上清加入60 μL胆碱氧化酶、200 μL苯酚溶液、200 μL 4-氨基安替比林溶液和40 μL过氧化物酶,反应液于37 ℃反应20 min。取反应液于OD505处测定吸光值。酶活定义:每小时催化1 μmol胆碱所用酶液即为1个酶活单位(U/mL)。
1.2.4 培养条件优化
依次对初始诱导条件(25 ℃摇床培养8 h, OD600达到0.6~0.8时加入终浓度为0.5 mmol/L的IPTG)进行优化。设置其他条件不变,改变诱导温度(15、20、25、30、35 ℃);在最佳诱导温度下设置其他条件不变,改变诱导时间(8、10、12、14、16 h);设置IPTG浓度不变,在最优诱导温度和诱导时间下改变加入诱导剂时的初始菌体浓度OD600(0.6、0.8、1.0、1.2、1.4);在前面3种最优条件下,改变IPTG浓度(0.05、0.1、0.2、0.5、1.0 mmol/L)。
1.2.5 酶学性质
最适pH值和pH稳定性:配制不同缓冲液体系(pH 4.0~10.0, pH值间隔0.5),替代标准PLD酶活检测方法中所使用的pH 7.5,40 mmol/L的Tris-HCl缓冲液,以酶活力最高的样品为对照,设置值为100%;将酶液分别在不同pH值下放置60 min,进行残余酶活的检测,以未经任何处理的酶液作为对照。
最适温度和温度稳定性:在初始缓冲液体系中,取适量酶液分别测定其在不同温度下(20~80 ℃,间隔5 ℃)的酶活力,以酶活测定最高值作为100%;将酶液分别在不同温度下放置60 min后进行残余酶活的测定,以未经任何处理的酶液作为对照。
金属离子及化学试剂:将NaCl、KCl、LiCl、CoCl2、MnCl2、CaCl2、MgCl2、CuCl2、FeCl3、FeCl2、BaCl2、AgCl3、ZnSO4、Al2(SO4)3、β-巯基乙醇、DTT、SDS、PMSF、EDTA等化学试剂分别配制成10、50 mmol/L母液,在酶液中分别加入适量母液,使其终浓度分别为1、5 mmol/L。于4 ℃条件下放置60 min后,测定酶的残留活性,并以无上述试剂加入的酶液为对照,计算酶的相对活性。
1.2.6 产物PS的检测分析
采用HPLC检测,色谱柱:Vensil XBP Silica(5 μm,250 mm×4.6 mm);流动相:V(正己烷)∶V(异丙醇)∶V(25 mmol/L乙酸铵溶液)=8∶8∶1;柱温:30 ℃;流速:1 mL/min;进样量:10 μL;检测器:ELSD蒸发光检测器;漂移管温度:65 ℃;雾化器氮气流速:1.8 SLPM。
1.2.7 PS的制备工艺优化
初始催化体系:有机相为8 mL乙酸乙酯,PC60质量浓度为8 mg/mL;水相为8 mL粗酶液,其中包含200 mgL-丝氨酸;两相液体混合反应12 h。PS即存在于有机相中。
工艺优化:对不同的催化条件进行优化,包括有机溶剂的种类(乙醚、正己烷、乙酸乙酯、氯仿),底物浓度比(L-Ser∶PC,1∶2、1∶1、2∶1、3∶1、4∶1、5∶1、6∶1),有机相和水相体积比(4∶4、4∶3、4∶2、4∶1)以及反应温度(25、30、35、40、45、50 ℃)。PS产率定义:HPLC检测到的PS浓度与初始投入的PC60浓度的百分比。
2 结果与分析
2.1 重组菌株的构建
通过PCR扩增获得携带有酶切位点的sspld序列,电泳分析显示目的基因大小为1 600 bp左右,如图1-a所示。
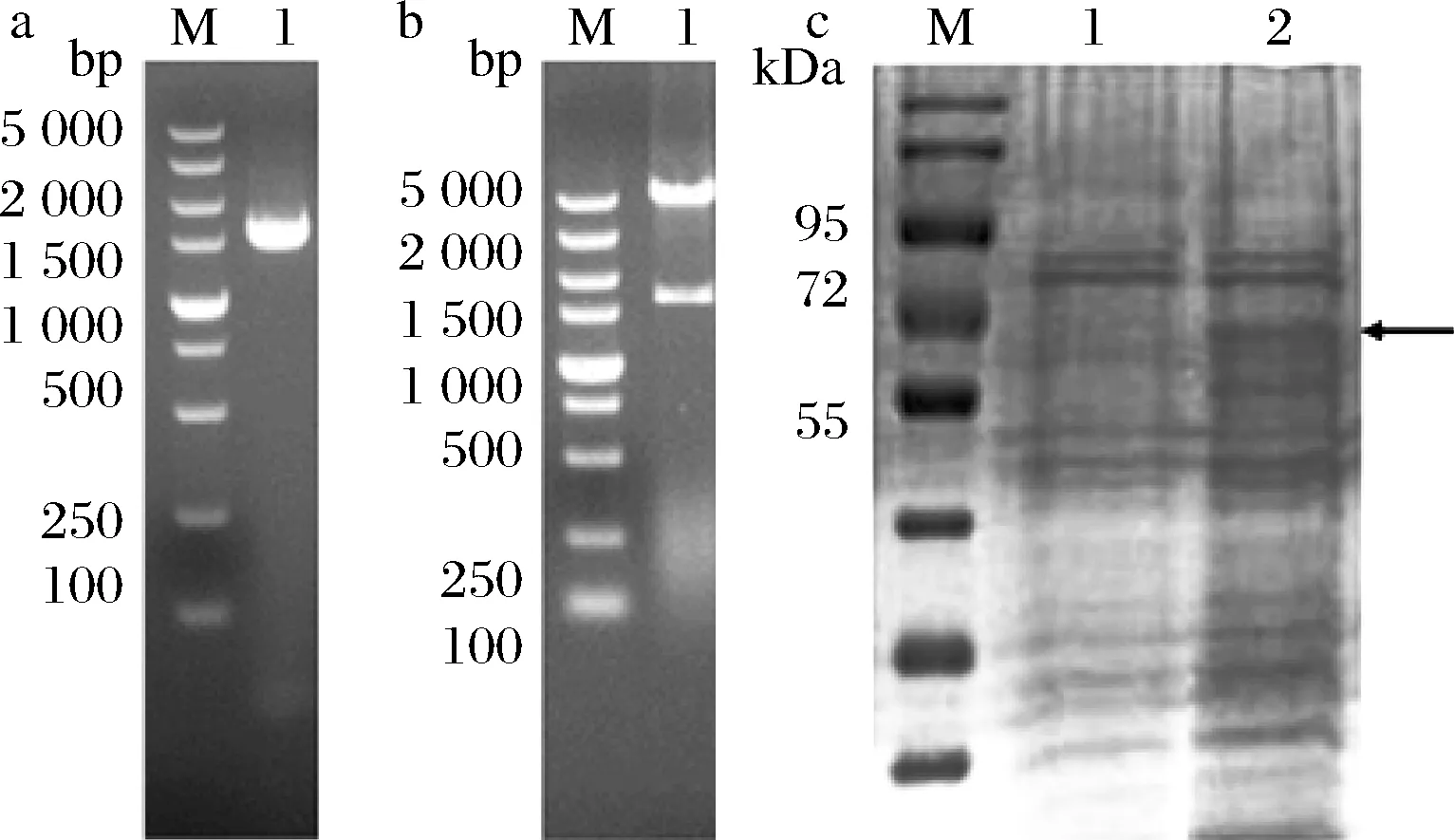
图1 重组质粒PCR验证(a),重组质粒双酶切产物核酸电泳图(b)和重组菌的SDS-PAGE分析(c)Fig.1 PCR amplification of the pld gene (a), restriction endonucleases digestive identification of recombinant plasmids (b) and SDS-PAGE analysis of recombinant strains (c)注:图1-a中,M-Marker;1-sspld;图1-b中,M-Marker;1- sspld;图1-c中,M-Marker;1-E. coli BL21/pET-28a(+);2-E. coli BL21/pET-28a(+)-sspld
双酶切验证结果如图1-b所示,在1 600 bp左右有目的条带存在,5 000 bp位置处条带与表达载体pET-28a(+)大小一致。结合测序结果,表明重组质粒构建成功。将其转化E.coliBL21,经菌液PCR、提取质粒酶切及测序验证,获得阳性转化子,并接种于LB培养基发酵诱导产酶。重组菌株E.coliBL21/pET-28a(+)-sspld发酵酶液经分子量分析,结果如图1-c所示,蛋白大小约为60 kDa,与其理论值一致。酶活检测结果显示以卵磷脂为底物其酶活能达到17.07 U/mL。
2.2 重组菌株诱导条件优化
诱导条件的改变对菌体的生长速度和产酶有着重要影响。由图2可知,初始诱导温度为20 ℃时发酵酶活最高。加入IPTG的最佳时间应为重组菌生长至OD600为1.0。当IPTG终浓度为0.5 mmol/L时,重组菌诱导发酵所产PLD的酶活可达最高。重组菌在诱导14 h时酶活达到最高,继续增加诱导时间,酶活逐渐降低。最终,重组菌经优化后酶活最高可达38.58 U/mL,是优化前的2.26倍。
2.3 酶学性质研究
2.3.1 最适反应pH和pH稳定性
本研究首先对粗酶液的最适反应pH以及在不同pH下的酶活稳定性进行了评价。由图3可知,PLD粗酶液的最适pH反应为7.5。在pH 4.0~7.5,相对酶活随着pH的增加而增加,而在pH高于7.5时,相对酶活则开始下降,因此中性条件更适合重组酶反应,强酸强碱条件容易使酶变性失活,这与来源于StreptomycesPMF的PLD性质相似[27]。考察pH稳定性的结果表明,PLD粗酶液在pH 6.5~8.5比较稳定,残余酶活保持在80%以上。
2.3.2 最适反应温度和温度稳定性
由图4可知,PLD重组菌的最适反应温度为60 ℃。在20~60 ℃,相对酶活随着温度的增加逐渐增加,而在更高温度条件下,相对酶活开始缓慢下降,可能是因为在过高温度下,酶蛋白的空间结构迅速被破坏,使得酶活大幅度降低[28]。磷脂酶D重组菌在55 ℃以内较稳定,在55 ℃时的残余酶活为69%,但在高于60 ℃条件下残余酶活则急剧下降。
2.3.3 金属离子及化学试剂对酶活的影响
金属离子对酶活也会产生重要影响,由表1可知,在加入蛋白抑制剂后,磷脂酶D粗酶液酶活被2-ME、DTT、SDS和PMSF部分抑制,而被EDTA几乎完全抑制,在5 mmol/L的EDTA作用下,酶活仅为对照的6%。在加入金属离子后,Mg2+、Na+和Mn2+在1和5 mmol/L下对酶活均没有明显影响;K+、Cu2+、Li+、Ba2+、Ca2+、Co2+、Fe3+、Zn2+和Al3+对酶活具有促进作用。Ca2+对酶活的促进作用最为明显,5 mmol/L的Ca2+可使酶活提高至对照的134%。

图2 诱导温度(a), OD600 (b), IPTG浓度(c)和诱导时间(d)对酶活的影响Fig.2 Effect of induction temperature (a), induction opportunity (b), IPTG concentration (c) and induction time (d) on PLD activity

图3 pH及稳定性对酶活的影响Fig.3 Effect of pH and pH stability on PLD activity and stability
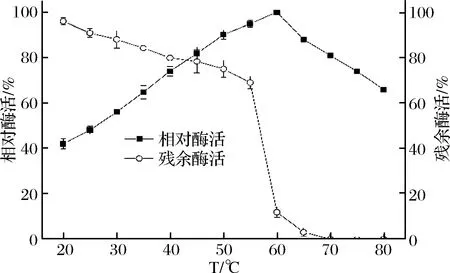
图4 温度及稳定性对酶活的影响Fig.4 Effect of temperature and temperature stability on PLD activity and stability

表1 金属离子及化学试剂对PLD酶活影响Table 1 Effects of met al ion and chemical reagents on PLD activity
2.4 PS的制备工艺优化
为筛选出PLD催化制备PS的最适条件,本研究对转化条件中的有机溶剂种类、有机相与水相体积比、底物L-Ser与PC60的浓度比、转化温度4个因素进行了系统优化,结果如图5所示。以乙酸乙酯为有机相时的PS转化率最高,约为14.2%,因此将乙酸乙酯作为催化反应中的有机相。有机相与水相比例为4∶2,即有机相为8 mL,水相为4 mL时,PS的转化率最高,因此选择有机相与水相比例为4∶2作为反应体系中两相体积比。随着L-ser与PC60浓度比增加,PS转化率逐渐增大,当比例为5∶1,即PC60质量浓度为8 mg/mL,L-ser质量浓度为40 mg/mL时,转化率达到最高,因此选择反应体系中底物L-ser和PC60的最适浓度比为5∶1。在此基础上对转化温度进行了考察,结果显示当反应温度为40 ℃时,PS转化率达到最高为28%,此时PS产量为1.34 g/L。

图5 不同有机溶剂(a),有机相与水相体积比(b),底物浓度比(c)和温度(d)对PS转化率的影响Fig.5 Effect of different organic solvents (a), organic and aqueous phase volume ratio(b), substrate concentration ratio (c) and temperature (d) on PS yield
3 结论
近年来,PS广泛应用于医疗、保健行业,主要用于治疗脑衰老和修复脑损伤,且疗效显著。PLD因其较高的转磷脂酰基活性,宽泛的反应温度和pH值,被广泛用于磷脂类产品的合成。目前制备PS的方法主要为PLD的生物转化法。本研究首先实现了PLD在大肠杆菌中的异源表达,并对重组菌产酶诱导条件进行了初步优化,酶活可达38.58 U/mL。为了评估生物催化剂的应用性能,了解重组菌的催化性质和特点,并为其生物转化应用奠定基础,本研究进一步对重组PLD的催化性质进行了考察。最后通过对有机溶剂种类、有机相与水相体积比、底物浓度比及转化温度这些转化条件的优化,以PLD为催化剂制备PS最高产量达1.34 g/L。该PLD具有良好的碱基互换能力,在催化产生稀有磷脂方面具有良好的应用前景。
