制备MRI双靶向分子示踪剂细胞黏附分子-微米级氧化铁颗粒及体外实验
2019-06-24钟嘉宝潘爱珍高明勇黄穗乔
黎 成,卜 超,苏 赟,钟嘉宝,潘爱珍,高明勇,黄穗乔*
(1.佛山市第一人民医院放射科,广东 佛山 528000;2.中山大学附属孙逸仙纪念医院放射科,广东 广州 510120;3.佛山市南海区第五人民医院内科,广东 佛山 528200)
放射性脑损伤(radiation-induced brain injury, RBI)是头颈部恶性肿瘤经放射治疗后出现的严重临床并发症之一,在放射治疗患者中发病率约1.9%~2.5%[1],严重影响其生存质量及预后[2],但放射治疗仍是部分头颈部恶性肿瘤的首选治疗手段,使早期诊断及治疗RBI成为亟待解决的问题。目前诊断RBI主要依靠临床病史及影像学检查。近年来,fMRI技术和PET的发展及应用提高了RBI的早期检出率及诊断准确率,但是其图像空间分辨率低,缺乏特异性[3-5]。本课题组在前期研究[6]中应用细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)抗体链接荧光标记的微米级氧化铁颗粒(microparticles of iron oxide, MPIO),合成单靶向分子示踪剂ICAM-MPIO,发现对早期诊断RBI有一定应用价值。在此基础上,本研究利用ICAM-1抗体、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)抗体及MPIO制备MRI单靶向分子示踪剂ICAM-MPIO、VCAM-MPIO及双靶向分子示踪剂细胞黏附分子(cell adhesion molecule, CAM)-MPIO,评估其与体外细胞结合的特异性及效率,为后续动物实验及靶向药物研究提供依据。
1 材料与方法
1.1 实验试剂及仪器 人脐静脉内皮细胞株EA.hy926(武汉普诺赛生命科技有限公司);MPIO(Bangs Lab,1毫升/支,质量浓度10 mg/ml,粒径0.50~2.00 μm(平均约1.63 μm,铁含量约42.5%);小鼠抗人ICAM-1/VCAM-1单克隆抗体及相应的二抗、DAPI(4',6-diamidino-2-phenylindole, 4',6-二脒基-2-苯基吲哚)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α;R&D System);琼脂糖(上海碧云天生物科技有限公司);2-吗啉乙磺酸(Sigma);磁珠分选仪(Invitrogen);CO2培养箱(HeraeusBB16);倒置相差显微镜(Nikon);激光共聚焦显微镜(Zeiss)。
1.2 制备 MRI靶向分子示踪剂ICAM-MPIO、VCAM-MPIO及CAM-MPIO 加入2-吗啉乙磺酸激活MPIO微球表面的羧基基团,再分别加入小鼠抗人ICAM-1、VCAM-1单克隆抗体(制备ICAM-MPIO、VCAM-MPIO),或同时加入小鼠抗人ICAM-1和VCAM-1单克隆抗体(制备CAM-MPIO),37℃下不断旋转孵育20 h,待其充分反应后加入终止反应液。采用磁珠分选仪收集MPIO,弃去上清液,加入pH=7.4的PBS缓冲液(含0.5%牛血清白蛋白和0.05%吐温20)充分阻断未反应的活性羧基位点,最后用储存液重悬并4℃条件下保存。以上所有操作均在避光条件下完成。
1.3 TNF-α激活人脐静脉内皮细胞表面ICAM-1及VCAM-1抗体表达情况 将不同浓度(1、5、10、20、50 ng/ml)TNF-α加入人脐静脉内皮细胞中(实验组),对照组则加入等量PBS缓冲液;以Western-Blot法检测细胞表面ICAM-1及VCAM-1抗体的表达,计算ICAM-1和VCAM-1与内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)的相对表达量。免疫荧光实验中,实验组的细胞加入10 ng/ml的TNF-α,对照组则加入等量PBS缓冲液,均分别加入ICAM-1、VCAM-1抗体及相应的二抗,用DAPI将细胞核染成蓝色,在激光共聚焦显微镜下观察细胞核周围绿色荧光、红色荧光分布情况。
1.4 靶向分子示踪剂与体外细胞特异性结合普鲁士蓝染色实验 将人脐静脉内皮细胞分为3个实验组(TNF-α激活人脐静脉内皮细胞后分别与CAM-MPIO、VCAM-MPIO、ICAM-MPIO共同孵育),对照组(无TNF-α+CAM-MPIO)及竞争抑制组(TNF-α+足量的游离ICAM-1及VCAM-1抗体+CAM-MPIO,以阻断细胞表面ICAM-1及VCAM-1抗体的结合位点)。实验组及竞争抑制组细胞用浓度为10 ng/ml的TNF-α刺激人脐静脉内皮细胞,对照组则加入等量PBS缓冲液,与相应靶向分子示踪剂充分结合后,进行普鲁士蓝染色,在倒置相差显微镜下观察细胞表面铁染色情况。
1.5 靶向分子示踪剂与体外细胞特异性结合免疫荧光实验 实验分组同1.4,实验组及竞争抑制组细胞用浓度为20 ng/ml的TNF-α刺激人脐静脉内皮细胞,对照组则加入等量PBS缓冲液,与相应靶向分子示踪剂充分结合后,在激光共聚焦显微镜下观察细胞周围黄色荧光分布情况。利用Image J软件(V1.8.0)测量各组细胞周围黄色荧光面积。
1.6 靶向分子示踪剂与体外细胞特异性结合MR扫描 实验分组同1.4,实验组及竞争抑制组用浓度为10 ng/ml的TNF-α刺激人脐静脉内皮细胞,对照组则加入等量PBS缓冲液,与不同浓度(0、0.1、1、2、5、10 μg/ml)的靶向分子示踪剂充分结合,然后用2%琼脂糖溶液(使用时加热至液态)重悬,充分冷却后进行MR扫描。
采用Philips Gvroscar Intera 1.5T MR扫描仪,扫描序列包括FSE序列T2WI及T2-mapping。T2WI:TR 2 000 ms,TE 100 ms,FOV 80 mm×80 mm,矩阵256×256,层厚2 mm;T2-mapping:TR 2 000 ms,TE 20 ms,FOV 80 mm×80 mm,矩阵256×256,层厚1.5 mm。采用Image J软件处理T2-mapping图像,观察T2WI和T2-mapping伪彩图。

2 结果
2.1 TNF-α激活人脐静脉内皮细胞表面ICAM-1及VCAM-1抗体表达情况 经Western-Blot实验获取各组条带及分析灰度值,ICAM-1/GAPDH和VCAM-1/GAPDH相对表达量先随TNF-α浓度增高而增高,TNF-α浓度为10 ng/ml时相对表达量最高,分别为对照组(浓度为0)的(2.38±0.71)倍和(2.67±0.67)倍,之后随浓度升高而有所下降,见表1、图1。

表1 实验组不同浓度TNF-α刺激内皮细胞表面和对照组的VCAM-1及ICAM-1相对表达量(±s)
注:*:与对照组比较,P<0.05
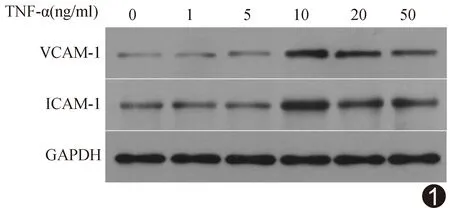
图1 不同浓度TNF-α刺激人脐静脉内皮细胞表面ICAM-1及VCAM-1表达Western-Blot条带图
激光共聚焦显微镜下观察,实验组视野内蓝色荧光的细胞核周围可见弥漫分布不同强度的绿色荧光或红色荧光,而对照组视野内蓝色荧光的细胞核周围仅见散在分布的点状绿色荧光或红色荧光(图2),实验组的荧光强度均明显强于对照组。
2.2 靶向分子示踪剂与体外细胞特异性结合普鲁士蓝染色结果 倒置相差显微镜下观察,MPIO微球中的铁颗粒被普鲁士蓝染液染成蓝色,3个实验组细胞表面见大量散在分布点状蓝染铁颗粒,且CAM-MPIO组蓝染铁颗粒分布较ICAM-MPIO组、VCAM-MPIO组明显增多,而对照组、竞争抑制组细胞周围仅见散在少量点状蓝染铁颗粒分布,见图3。
2.3 靶向分子示踪剂与体外细胞特异性结合免疫荧光实验结果 激光共聚焦显微镜下观察,3个实验组细胞周围见明显点状、斑片状黄色荧光,而对照组及竞争抑制组细胞周围几乎未见明确黄色荧光分布,见图4。各组间细胞周围黄色荧光面积总体差异有统计学意义(F=201.57,P<0.01),对照组与竞争抑制组、ICAM-MPIO组与VCAM-MPIO组间差异均无统计学意义(P=0.98、0.56),余组间两两比较差异均有统计学意义(P均<0.01),见图5。CAM-MPIO组的细胞周围黄色荧光面积分别为ICAM-MPIO、VCAM-MPIO组的(2.00±0.31)倍和(2.46±0.45)倍。
2.4 靶向分子示踪剂与体外细胞特异性结合MRI结果 3个实验组T2WI信号强度和T2值随靶向分子示踪剂浓度增高呈不同程度减低,以CAM-MPIO组减低为著;竞争抑制组及对照组T2WI信号强度及T2值略有减低;见图6、7。
3 讨论
RBI早期病理生理表现为照射野内脑组织的炎症过程,主要为小胶质细胞激活,释放大量促炎症因子如白介素-1β、白介素-6、TNF-α,环氧合酶-2等,促炎因子、细胞因子分泌,介导炎症细胞穿过内皮细胞间隙到达组织发挥作用,损伤脑组织[7]。在众多细胞因子中,ICAM-1、VCAM-1发挥重要作用,研究[8-9]表明,在射线诱导下,ICAM-1、VCAM-1表达明显上调,从而介导炎性损伤过程。本研究以TNF-α代替射线,诱导内皮细胞发生炎性损伤,结果显示在TNF-α刺激下,内皮细胞表面ICAM-1及VCAM-1表达明显上调,且呈浓度依赖性,与既往研究[6]结果一致,提示ICAM-1及VCAM-1可作为识别血管内皮细胞炎症损伤的靶点,有望早期发现以此为病理基础的病变如RBI等。

图2 TNF-α刺激人脐静脉内皮细胞免疫荧光实验 A、B.ICAM-1表达,对照组(A)细胞核周围见散在少量绿色荧光,实验组(B)细胞核周围见大量绿色荧光; C、D.VCAM-1表达,对照组(C)细胞核周围见散在斑点状红色荧光,实验组(D)细胞核周围见大量红色荧光
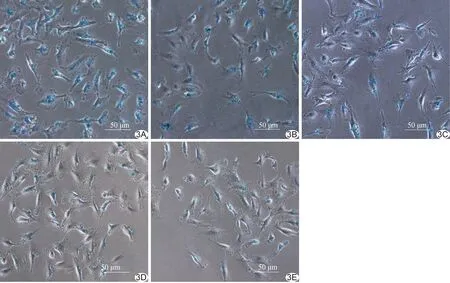
图3普鲁士蓝染色显示靶向分子示踪剂与体外细胞特异性结合情况 A~C.分别为CAM-MPIO组、VCAM-MPIO组和ICAM-MPIO组,均可见大量蓝染的铁颗粒位于细胞膜上,CAM-MPIO组最多; D、E.分别为竞争抑制组和对照组,均可见散在少量蓝染的铁颗粒
MPIO作为靶向分子示踪剂载体,与ICAM-1或VCAM-1结合,已广泛应用于分子MRI研究。Deddens等[10]观察小鼠脑卒中模型,发现ICAM-MPIO的脑血管炎症分子成像效果优于脂质体标记的钆对比剂;而McAteer等[11-12]发现双靶向分子示踪剂较单靶向分子示踪剂更有助于动脉硬化斑块的成像及活动性评估。
本研究采用化学缩合方法成功制备双靶向分子示踪剂CAM-MPIO及单靶向分子示踪剂ICAM-MPIO、VCAM-MPIO。在靶向分子示踪剂与内皮细胞结合实验中,经普鲁士蓝染色发现TNF-α激活的内皮细胞周围分布大量蓝染MPIO微球,免疫荧光实验发现被激活内皮细胞表面分布大量带黄色荧光的MPIO微球,T2WI信号强度及T2值随靶向分子示踪剂浓度增加而减低,表明合成的靶向分子示踪剂均可特异性地与被激活的内皮细胞结合,既可进行光学成像,又可进行MR成像。比较免疫荧光实验各组细胞周围的黄色荧光面积,CAM-MPIO组荧光面积明显大于ICAM-MPIO、VCAM-MPIO组,提示双靶向分子示踪剂与内皮细胞结合数量多于单靶向分子示踪剂,间接反映双靶向分子示踪剂与内皮细胞的结合效果优于单靶向分子示踪剂,为下一步应用上述合成的双靶向分子示踪剂进行小鼠RBI模型无创性早期影像学诊断研究提供了理论基础。
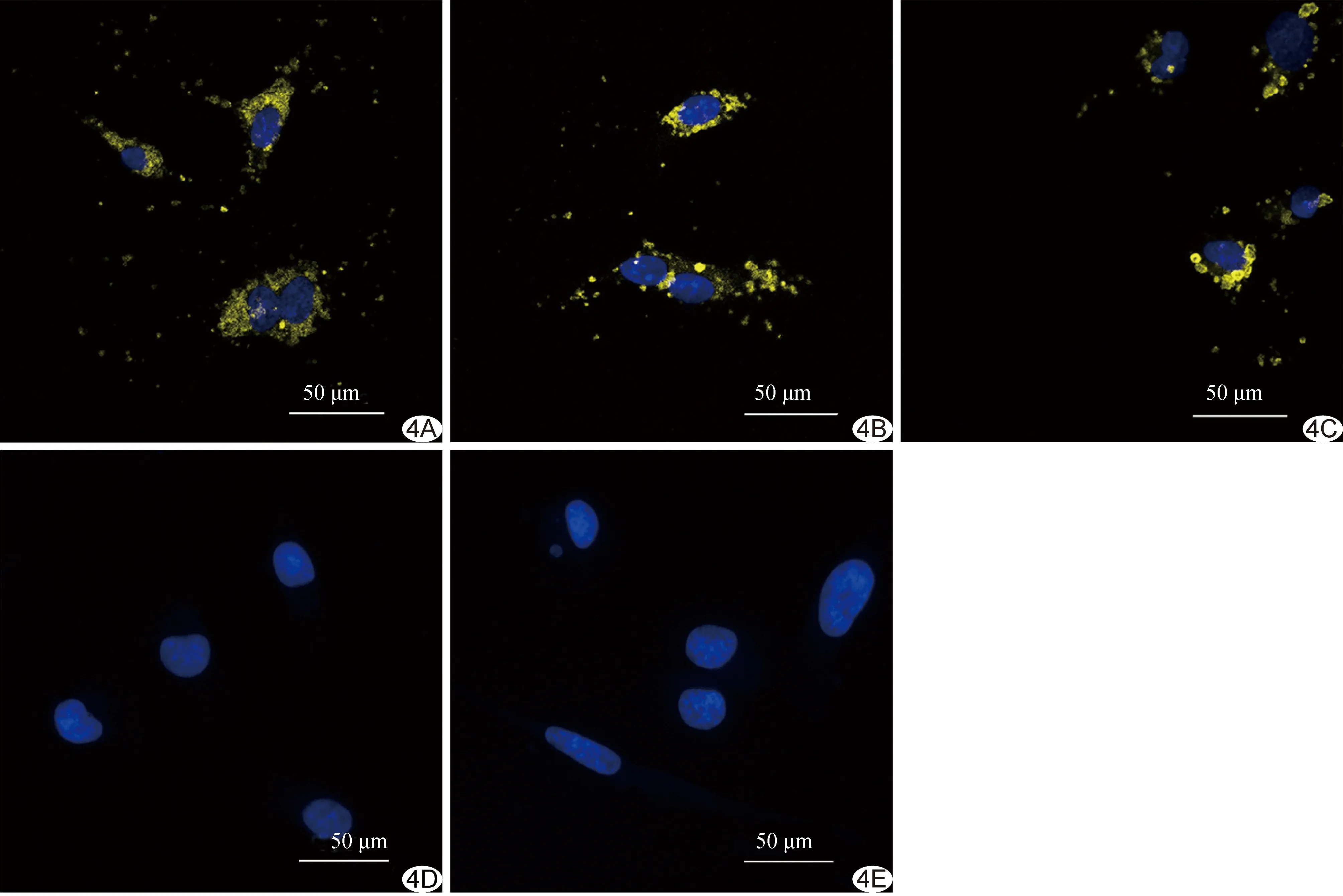
图4免疫荧光实验显示靶向分子示踪剂与体外细胞特异性结合情况 A~C.分别为CAM-MPIO组、ICAM-MPIO组和VCAM-MPIO组,细胞周围均见大量黄色荧光分布; D、E.分别为竞争抑制组和对照组,细胞周围几乎未见明确黄色荧光分布
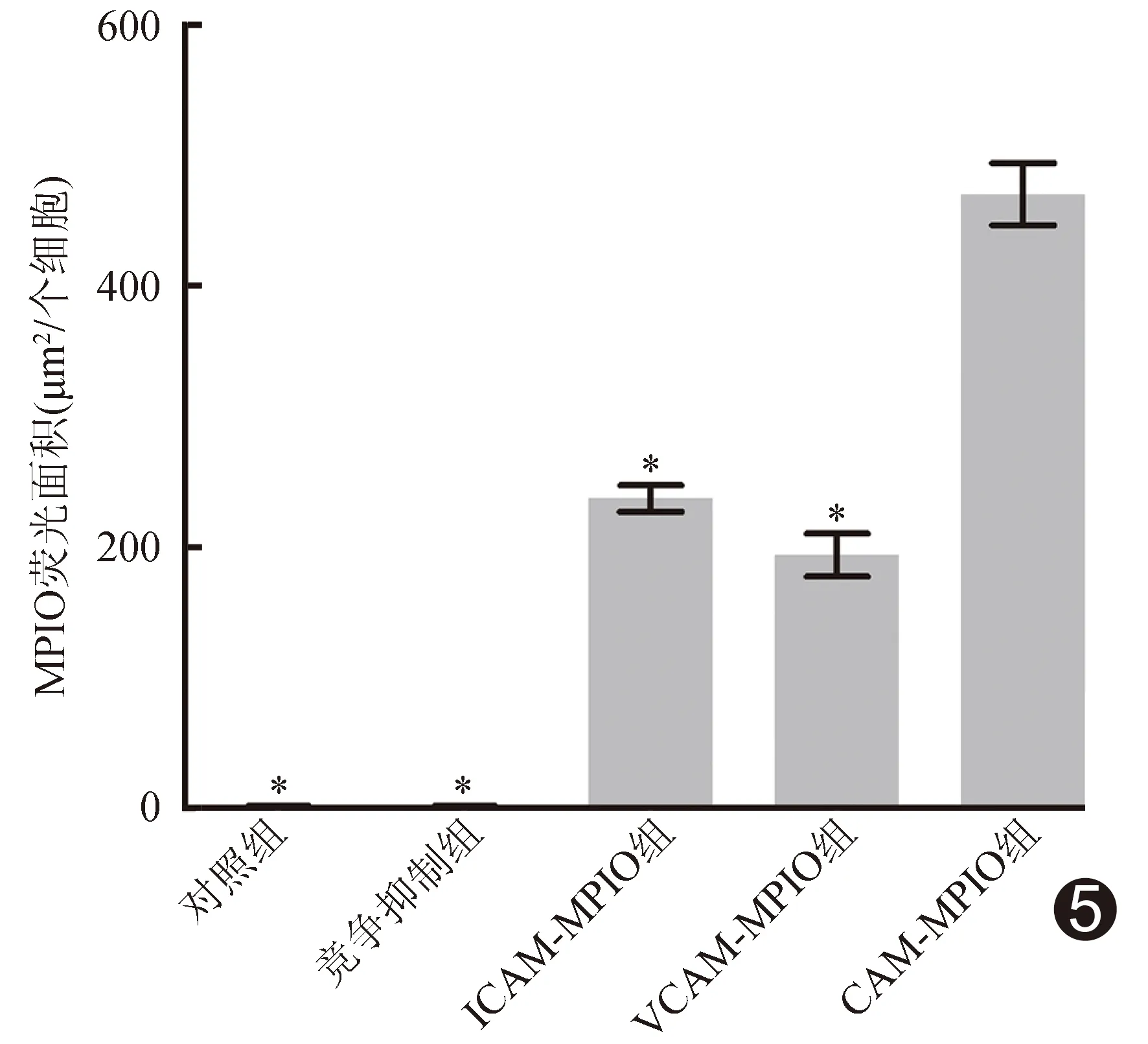
图5 免疫荧光实验显示靶向分子示踪剂与体外细胞特异性结合黄色荧光面积柱图 (*:与CAM-MPIO组比较,P<0.01)
本研究的主要不足在于MPIO表面由惰性材料包被,在人体内不能被生物降解,至今尚未被食品药品监督管理局(food and drug administration, FDA)批准用于人体研究,仅可用于动物实验或离体实验。目前已可利用FDA批准的可作为药物载体的乳酸羟基乙酸共聚物(polylactide-co-glycolide, PLGA)和生物素包被MPIO成功合成靶向分子示踪剂[13-14],但尚未见应用于人体的研究。相信在不久的将来会找到可生物降解的材料包被MPIO合成靶向示踪剂或作为靶向药物载体用于人类,协助早期诊断及靶向治疗疾病。

图6 T2WI示靶向分子示踪剂与体外细胞特异性结合情况 图7 T2-mapping伪彩图示靶向分子示踪剂与体外细胞特异性结合情况
