lncRNA SNHG1对卵巢癌增殖的影响及其机制*
2019-06-10宋洋杨艳任芳
宋洋, 杨艳, 任芳
(中国医科大学附属盛京医院, 辽宁 沈阳 110000)
卵巢癌是女性癌症死亡的第5大原因,也是世界上致死率最高的妇科肿瘤[1]。因卵巢癌发病较为隐匿,就诊时有超过60%的患者已发展到晚期。尽管对卵巢癌用肿瘤切除手术配合铂类或紫杉烷类化疗药物进行积极治疗,但其5年生存率仍然只有40%[2]。人类基因组序列数据显示,只有2%的基因编码了蛋白质,因此大多数转录产物都被认为是非编码RNA(non-coding RNA,ncRNA),其中长度>200个碱基的ncRNA被称为长链非编码RNA(long non-coding RNA,lncRNA)[3]。lncRNA已被证明与多种人类疾病以及肿瘤的发生发展密切相关,这其中也包括卵巢癌[4]。研究发现lncRNASNHG1能够促进肺癌[5]、肝癌[6]以及胃癌[7]等的恶性发展,但对卵巢癌的作用还未见报道。
1 材料与方法
1.1 材料
1.1.1临床样本 收集2014年5月~2018年10月进行手术的上皮性卵巢癌以及癌旁组织22对(患者在手术前未经放化疗治疗)。组织标本取材后迅速置于-80 ℃超低温冰箱中保存。
1.1.2细胞株 人卵巢癌细胞SK-OV-3、OV-90、TOV-112D、HO-8910购自上海中乔新舟生物科技有限公司,CAOV3购自武汉普诺赛生命科技有限公司。SK-OV-3细胞和HO-8910细胞培养于含有双抗以及15%胎牛血清的PRMI-1640培养液中,其余细胞均培养于42.5% MCDB105(含1.5 g/L碳酸氢钠)及42.5% M199(含2.2 g/L碳酸氢钠)培养液中,同时加入15%胎牛血清以及1%的双抗。细胞置于含有5% CO2的37 ℃培养箱中培养,常规消化传代,选用对数生长期的细胞进行实验。
1.1.3主要试剂 细胞培养液以及胎牛血清均购自Gibco,NC siRNA、lncRNASNHG1 siRNA及NC mimic和miR-199a-3p mimic委托上海吉玛基因合成,Lipofectamine 2000转染试剂购自Invitrogen公司,TRLzol试剂以及TIANSeq M-MLV反转录酶购自百泰克生物技术有限公司,SYBR Green qPCR Mix购自TOYOBO公司,CCK-8检测试剂购自日本同仁公司,pMIR-reporter荧光素酶载体购自美国Ambion公司,双荧光素酶检测试剂盒购自Promega公司。
1.2 方法
1.2.1Real-time PCR 采用TRLzol试剂提取总RNA并通过TIANSeq M-MLV反转录成cDNA,实验过程均严格按照试剂盒说明书进行操作。采用SYBR Green qPCR Mix进行Real-time PCR反应,反应条件为95 ℃ 10 min,95 ℃ 10 s、60 ℃ 30 s、72℃ 10 s,35个循环后检测其溶解曲线并分析样本Ct值。以GAPDH为内参,采用2-ΔΔCt法计算mRNA的相对表达量。SNHG1的正向引物为5′-AGGCTGAAGTTACAGGTC-3′,反向引物为5′-TTGGCTCCCAGTGTCTTA-3′;GAPDH正向引物为5′-GTCAACGGATTTGGTCTGTATT-3′,反向引物为5′-AGTCTTCTGGGTGGCAGTGAT-3′。
1.2.2细胞转染 将对数生长期的细胞接种于6孔板中,待细胞增长到70%融合时采用Lipofectamine 2 000转染试剂进行细胞转染,按照试剂盒说明书操作。实验设置对照组、NC siRNA转染组和SNHG1 siRNA转染组。SNHG1 siRNA的序列为5′-CAGCAGTTGAGGGTTTGCTGTGTAT-3′,将此序列打乱后经分析不干扰任何基因表达的序列作为NC siRNA序列。
1.2.3CCK-8实验 按照1.0×103个细胞每孔的密度将细胞接种至96孔板。分别于细胞转染后的0、24、48、72及96 h时加入10 μL的CCK-8试剂,2 h后于酶标仪上测量OD450值。
1.2.4双荧光素酶检测 分别将含有SNHG1野生型序列(5′-TGACCACTTTCGTAAACTACTGA-3′)的质粒WT-SNHG1和突变型序列(5′-TGACCACTTTCGTAACGATGACA-3′)的质粒MUT-SNHG1与miR-199a-3p mimic或NC mimic共转染至293T细胞内,24 h后采用双荧光素酶检测试剂检测各组的荧光强度。以荧光素酶pGL-3.0为内参,分析各组的荧光素酶的活性。
1.3 统计学方法
采用GraphPad Prism 7.0 软件进行数据分析。用t检验进行两组间的差异比较、单因素方差分析进行3组间的差异比较,P<0.05被认为差异具有统计学意义。
2 结果
2.1 LncRNA SNHG1在卵巢癌、癌旁组织以及卵巢癌细胞株中的表达
Real-time PCR结果表明(图1),卵巢癌组织lncRNASNHG1表达水平高于癌旁组织[(0.038±0.057)vs (0.010±0.007)],差异具有统计学意义(P<0.05)。卵巢癌细胞株CaOV3和OV-90中lncRNASNHG1的表达水平最高(图1),因此选择这两株细胞用于后续研究。
2.2 siRNA下调癌细胞株的lncRNA SNHG1表达
如图2所示,OV-90细胞中SNHG1 siRNA组与NC siRNA组比较,lncRNASNHG1的表达水平分别为(0.37±0.06)和(0.99±0.10),两组比较差异有统计学意义(P<0.05);CaOV3细胞中SNHG1 siRNA组和NC siRNA组lncRNASNHG1的表达水平分别为(0.19±0.09)和(0.96±0.09),两组比较差异有统计学意义(P<0.05)。结果表明SNHG1 siRNA有效下调了两株细胞中lncRNASNHG1的表达,而转染NC siRNA未影响lncRNASNHG1的表达。

(1)与癌组织比较,P<0.05图1 卵巢癌组织、癌旁组织及癌细胞株中lncRNA SNHG1的表达Fig.1 Expression of lncRNA SNHG1 in ovarian cancer tissue, the adjancet tissues and cancer cell strains
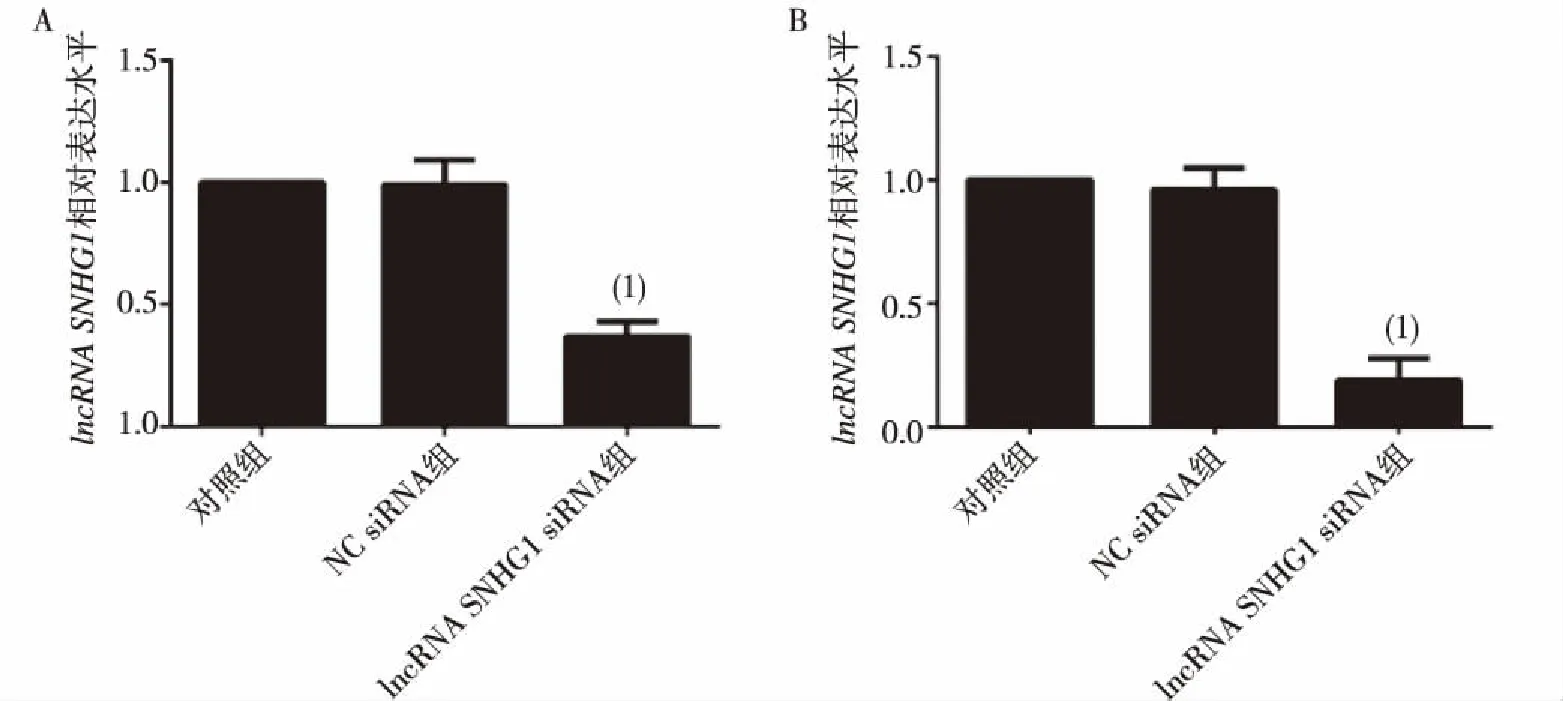
注:A为OV-90,B为CaOV3;(1)与NC siRNA组比较,P<0.05图2 转染siRNA后OV-90及CaOV3卵巢癌细胞株中lncRNA SNHG1的表达Fig.2 Expression of lncRNA SNHG1 after transfection with siRNA
2.3 下调lncRNA SNHG1对卵巢癌细胞增殖的影响
如图3所示,与NC siRNA转染组比较,转染SNHG1 siRNA 48 h时,OV-90细胞的增殖能力显著降低(P<0.05),而CaOV3细胞在SNHG1 siRNA转染24 h后细胞增殖能力显著降低(P<0.05)。此结果表明下调lncRNASNHG1能够抑制卵巢癌细胞的增殖。

(1)与NC siRNA组比较, P<0.05图3 下调lncRNA SNHG1对细胞增殖的影响Fig.3 Effects of down-regulation of lncRNA SNHG1 on cell proliferation
2.4 lncRNA SNHG1对miR-199a-3p的调控作用
双荧光素酶结果显示,野生型SNHG1与miR-199a-3p mimic共转染能够显著降低双荧光素酶的活性,差异具有统计学意义(P<0.05)。而将SNHG1与miR-199a-3p的结合序列突变的突变型SNHG1与miR-199a-3p mimic共转染则不影响双荧光素酶的活性,差异具有统计学意义(P>0.05)。见图4。此结果表明lncRNASNHG1能够通过miR-199a-3p特异性结合序列吸附miR-199a-3p、进而调控其表达。
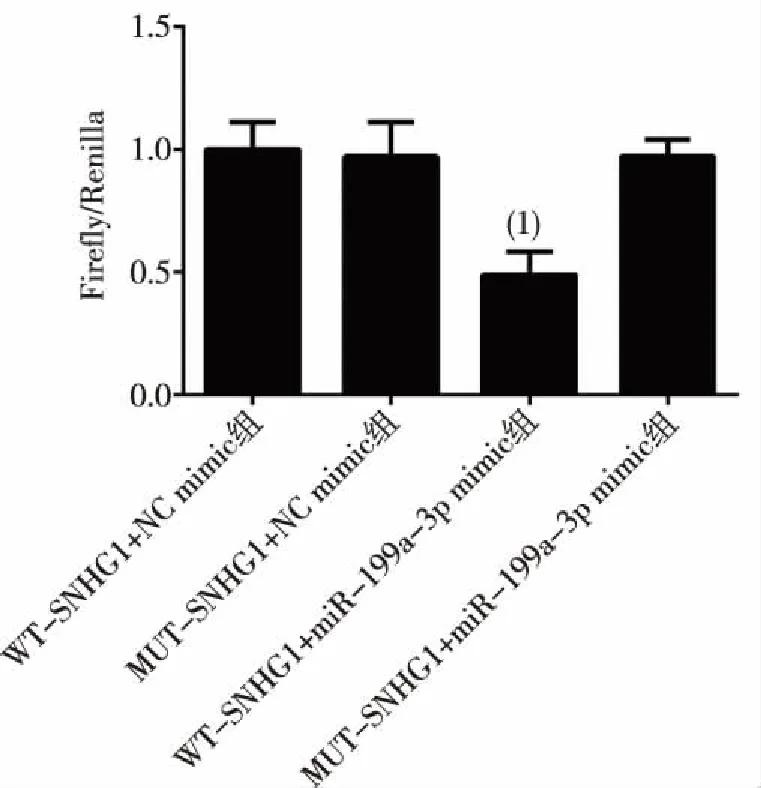
(1)与MUT-SNHG1+miR-199a-3p mimic组比较, P<0.05图4 lncRNA SNHG1对miR-199a-3p的调控作用Fig.4 Regulatory effects of lncRNA SNHG1 on miR-199a-3p
3 讨论
现已证明许多lncRNA在肿瘤的发生发展中发挥了重要作用,lncRNA表达的异常也已被作为多种肿瘤的预后标志物,如lncRNAAFAP1-AS1[8]、lncRNAUCA1[9]等。lncRNASNHG1位于11号染色体,在多种肿瘤组织中异常高表达并且能够促进肺癌[5]、肝癌[6]、胃癌[7]、食管癌[10]以及前列腺癌[11]细胞的增殖,并且与这些肿瘤的不良预后密切相关。然而lncRNASNHG1在卵巢癌中的作用还未见报道。本研究分析了22对卵巢癌及癌旁组织,结果发现lncRNASNHG1在卵巢癌中的表达水平显著高于癌旁组织,因此本研究推测lncRNASNHG1在卵巢癌的发展中也发挥了重要作用。
众所周知,异常增殖是肿瘤细胞的标志之一,抑制肿瘤细胞的增殖是抗肿瘤研究的关键所在[12-14]。前人研究发现下调lncRNASNHG1能够抑制胃癌细胞的增殖、克隆形成以及细胞周期转换[7]。在肺癌细胞中下调lncRNASNHG1不仅能够抑制肺癌细胞的增殖还能够诱导其凋亡[5]。类似的作用在其他肿瘤细胞中也多次被证明[15-17]。本研究在已明确lncRNASNHG1在卵巢癌组织中高表达的情况下,在两株lncRNASNHG1表达最高的卵巢癌细胞中下调了lncRNASNHG1的水平,Real-time PCR结果显示干扰效率均在60%以上,可以进行后续研究。本研究的CCK-8结果显示下调lncRNASNHG1后细胞的增殖能力显著受到抑制,表明lncRNASNHG1参与了卵巢癌细胞的增殖,并且lncRNASNHG1具有作为抗卵巢癌治疗靶点的潜力。越来越多的证据表明,lncRNA参与了许多重要的生物学过程,例如细胞信号调节、基因印迹、染色质修饰、转录激活、转录后调节以及蛋白功能调控等[18]。自2011年Salmena等[19]提出竞争性內源RNA(competing endogenous RNA,ceRNA)的假说后,人们对lncRNA作用机制又有了新的认识。ceRNA假说中指出lncRNA可以通过miRNA反应元件(microRNA response elements,MRE)结合miRNA,发挥类似海绵的作用吸附miRNA进而调控miRNA的表达。这种作用机制已经在多种肿瘤细胞中被反复证明[20-22]。本研究通过生物信息学分析发现lncRNASNHG1上包含有miR-199a-3p的MRE,而双荧光素酶检测发现,野生型SNHG1和miR-199a-3p mimic共转染工具细胞293T确实能够显著降低荧光素酶的活性,而突变型SNHG1载体与miR-199a-3p mimic共转染则对荧光素酶的活性没有影响,因此,lncRNASNHG1确实能够通过MRE结合miR-199a-3p。Yasuto等[23]通过miRNA芯片分析发现miR-199a-3p在卵巢癌细胞中表达显著降低。在卵巢癌细胞中过表达miR-199a-3p能够抑制卵巢癌细胞的增殖、侵袭、黏附,抑制卵巢癌细胞异种移植瘤的体内生长并且阻碍促肿瘤信号通路c-Met、ERK以及AKT的激活[23]。因此本研究推测下调lncRNASNHG1可能通过释放miR-199a-3p而发挥了抑制卵巢癌细胞增殖的作用。
综上,本研究结果表明lncRNASNHG1与卵巢癌的进展密切相关,可作为卵巢癌预后的指示分子。此外,下调lncRNASNHG1能够抑制卵巢癌细胞的增殖,因此,lncRNASNHG1有望成为治疗和预防卵巢癌的潜在靶点。
