新疆土壤中解磷菌的分离纯化与鉴定
2019-06-01刘思岑亢秀萍耿雪青
刘思岑,亢秀萍,赵 宇,耿雪青,张 雄,王 磊
(1.山西农业大学园艺学院,山西 太谷 030801;2.山西省设施园艺工程技术中心,山西 太谷 030801;3.山西省设施蔬菜提质增效协同创新中心,山西 太谷 030801;4.上海交通大学农业与生物学院,上海 200240)
磷元素是植物所需的三大营养元素之一,磷元素参与植物许多代谢过程,包括细胞分裂、糖类物质代谢、脂类代谢、光合作用以及呼吸作用等过程,磷元素对维持植物的生长发育是必不可缺的。植物从土壤中吸收磷是植物获取磷元素的主要途径之一,然而尽管土壤中磷含量为0.05%(质量比),但其中仅0.1%的可溶性磷可以被植物吸收[1],土壤中可被植物吸收利用的磷素远达不到植物所需磷含量。目前,施用磷肥成为提高土壤有效磷含量的主要手段。然而,磷肥施于土壤后可用磷会快速被Ca2+(主要为碱性土壤),Al3+,Fe3+(酸性土壤)结合形成难溶沉淀,土壤中可溶磷含量很少超过30%[2],经过径流和渗出,只有10%~20%的磷元素可以被植物吸收利用[3]。不仅如此,大量的施用磷肥会使土壤肥力退化,尤其是耕作土壤。研究表明,大量施用化学肥料的同时,土壤中的砷、镉、铅等重金属含量增加,更扰乱了微生物多样性及其活性,从而导致农作物减产[4-5]。再者磷肥的制作主要从不可再生的磷矿石中分离,全球的磷矿石资源在50~100 a 将被耗尽[6]。而解磷菌是一类可以将难溶性磷转化为能被植物吸收的有效磷的微生物,可以改善植物生长的磷素营养[7],有效地促进植物的生长,提高农作物的产量[8-9]。
新疆地处东经 73°40′~96°18′,北纬 34°25′~48°10′,远离海洋,深居内陆,四周有高山阻隔,海洋气流不易到达,形成明显的温带大陆性气候。温差较大,日照时间充足(年日照时数达2 500~3 500 h),年平均降水量为150 mm 左右,新疆多从内陆地区和国外进口菌种,但由于对本地环境的不适应,多数菌剂不能发挥效用。因此提取本地优良解磷菌种,创制以解磷微生物为主要成分的生物肥料,提高磷肥利用率,不仅可以促进农作物生长,而且可改善土壤环境。
本试验从新疆本地土壤中分离出解磷菌,旨在为之后新疆土壤中解磷菌肥的开发和应用提供理论基础,对促进新疆农业的可持续发展具有重要的意义。
1 材料和方法
1.1 试验材料
1.1.1 供试土壤 土壤样品采自于新疆昌吉市室外土壤,取地面5 cm 下土壤,多点采集混匀,于4 ℃冰箱保存备用。
1.1.2 供试培养基 PVK 培养基:葡萄糖10 g,Ca3(PO4)25 g,NaCl 0.1 g,MgSO40.1 g,KCl 0.2 g,酵母浸膏 0.5 g,(NH4)2SO40.5 g,MnSO40.002 g,FeSO40.002 g,蒸馏水 1 000 mL,pH 值 7.0~7.2。NBRIP培养基:葡萄糖 10 g,Ca3(PO4)25 g,NaCl 0.2 g,(NH4)2SO40.5 g,MgSO40.1 g,酵母粉 0.5 g,琼脂20 g,蒸馏水 1 000 mL,pH 值 6.8~7.0。
1.2 试验方法
1.2.1 解磷菌的分离与纯化 称取1 g 土壤,于研钵研碎置于含90 mL 无菌水的玻璃瓶内,摇床28 ℃,170 r/min 振荡混匀 20 min,静止 10 min,取溶液 1 μL于9 μL 无菌水的离心管内,设置浓度梯度为10-2,10-3,10-4,10-5,10-6,10-7,分别取 1 mL 涂布于 PVK固体培养基,每个浓度重复3 次,3 d 后挑取周围有透明溶磷圈的菌落,在LB 固体培养基上纯化5 次。筛选菌株置于30%的甘油中,-80 ℃冰箱中保存。
1.2.2 解磷能力定性定量的检测
1.2.2.1 解磷能力定性检测 将纯化的菌株接种于NBRIP 固体培养基内,32 ℃下倒置培养7 d 后测定溶磷圈直径(D)与菌落直径(d)及 D/d 的值,每个菌株3 次重复。选择D/d 值较大的菌株进行液体摇瓶检测。
1.2.2.2 解磷能力定量检测 从1.3.1 筛选出来的菌株在NB 液体培养基中培养24 h(使其浓度为1×108cfu/mL),取0.5 mL 菌液于含50 mL Ca(3PO)42的NBRIP 液体培养基中,对照为灭菌的不加菌体的 NBRIP 液体培养基。32 ℃,170 r/min 条件下培养7 d,每24 h 取1 mL 三角瓶中培养液,超声波震碎细胞后,10 000 r/min 条件下离心2 min,采用钼蓝比色法[10]测定有效磷含量,采用pH 计测定菌悬液pH 值。
1.2.3 菌株生理生化与16S rDNA 的鉴定
1.2.3.1 菌株生理生化的鉴定 将筛选出来的优势菌株,进行革兰氏染色、氧化酶试验、接触酶试验、吲哚试验及V-P、柠檬酸盐、明胶液化、硫化氢、甲基红等生理生化试验。
1.2.3.2 16S rDNA 序列鉴定 将优势菌株在LB 固体培养基上培养24 h 后,挑取菌落。以16S rDNA引物为细菌通用引物(27F:5′-AGAGTTTGATCCTG GCTCAG-3′和 1540R:5′-AGGAGGTGATCCAGCCG CA-3′)进行PCR 扩增,扩增产物经纯化回收,交由上海生物工程有限公司进行测序,得到的序列在NCBI 上Blast 数据库中进行比对。用MEGA 7.0 软件构建系统发育树,并对优势菌株进行遗传性质的分析。
1.2.4 不同初始pH 下解磷能力测定 配制NBRIP液体培养基,初始 pH 值分别设置为 5,6,7,8,9,在含50 mL NBRIP 液体培养基的玻璃瓶中加入0.5 mL的菌液,32 ℃,170 r/min 培养 5 d 后,取 1 mL 溶液在10 000 r/min,2 min 条件下离心,采用pH 计测定pH 值,用分光光度计测定溶液中的有效磷含量。
1.2.5 不同盐浓度下解磷菌的解磷能力测定 配制盐浓度为 0,0.5%,1.0%,2.0%,3.0%的 NBRIP 液体培养基,按照0.5%的接种量注入培养基中,在32 ℃,170 r/min 摇床条件下培养5 d,取溶液1 mL进行离心,测定有效磷含量与pH 值。
1.2.6 不同温度下解磷菌解磷能力测定 配制含磷酸钙的NBRIP 液体培养基,接种0.5%的菌液,分别于 4,8,20,27,32,37 ℃下培养 5 d,取 1 mL 溶液于10 000 r/min,2 min 条件下离心,测定溶液有效磷含量与pH 值。
1.2.7 优势菌株在不同磷源下解磷能力测定 将优势菌株在LB 固体培养基中活化,振荡培养24 h,设定菌悬液的OD600=1,配制NBRIP 液体培养基,分别用等量的磷酸铝、磷酸铁、植酸钙、卵磷脂替代NBRIP 中的磷酸钙。振荡培养5 d 后测定溶液中有效磷的含量和pH 值。
1.3 数据处理
应用SPSS 20.0 软件对数据进行方差分析,并用Duncan 新复极差法比较不同处理间各种指标之间的差异;相关数据统计分析采用Excel 2007 软件。
2 结果与分析
2.1 解磷菌定性检测结果
分离纯化出30 株有解磷能力的菌株,经平板初筛发现,6 株菌的 D/d 值在 1.6~2.0(表1),分别为 A12,A14,A16,B1,B5,C5,其中 D/d 值最大的为A14,A12,B5,C5。
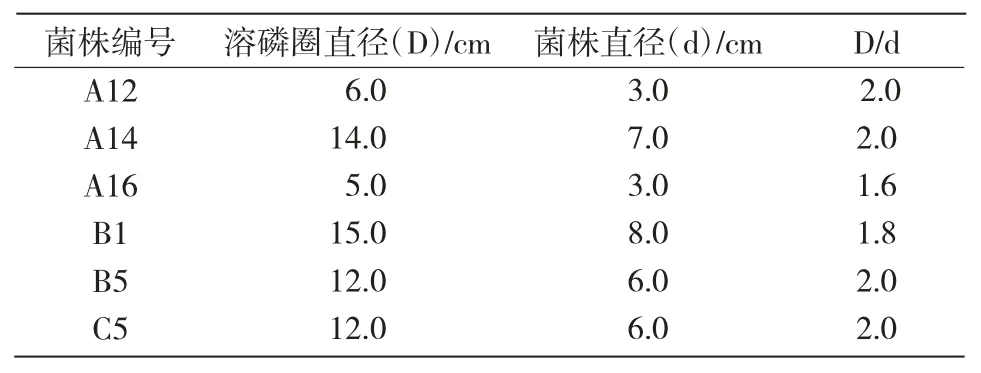
表1 解磷菌在平板培养基上溶磷圈大小
2.2 菌株定量检测结果
由表2可知,B5 的可溶性磷含量在第6 天时高达519.66 mg/L,此时pH 值为4.53,有效磷的产生伴随着pH 值的降低。大量研究表明,解磷菌在产生有效磷时伴随pH 值的降低,但有效磷的含量与pH 值呈负相关。营养液pH 值的减小可能是由于解磷菌在溶磷时会分泌有机酸,从而导致pH 值降低。
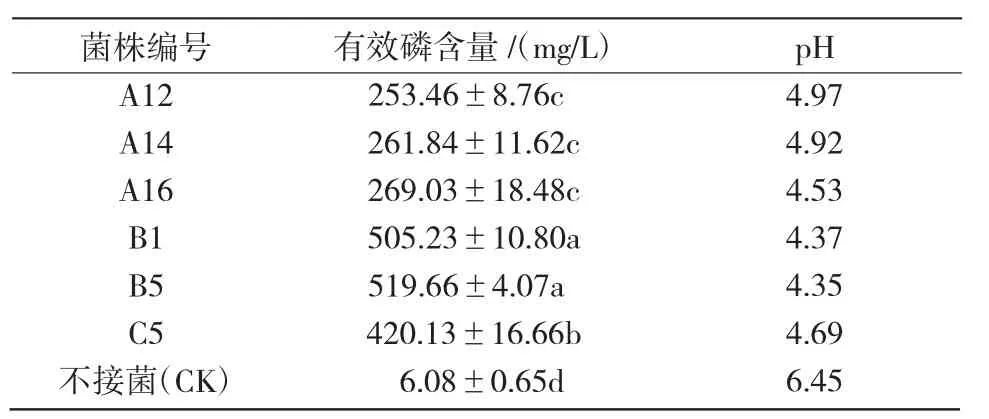
表2 解磷菌株7 d 内有效磷含量与pH 值
2.3 菌株B5的生理生化鉴定
由表3可知,该菌株为革兰氏阴性菌株,其中,柠檬酸盐试验、明胶液化试验、接触酶反应、吲哚试验、产H2S 为阳性,甲基红试验、V-P 反应及氧化酶试验为阴性。

表3 菌株B5 生理生化鉴定结果
2.4 菌株16S rDNA测序结果与分析
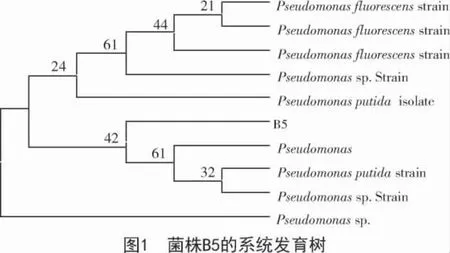
优势菌株B5 经16S rDNA 测序,获得1 495 bp的基因序列。将测序结果与在NCBI 中的Blast 核酸数据库进行同源性对比,从而鉴定菌株,并用MEGA 6.0 软件构建系统进化树(bootstrap 值为 1 000),分析菌株的遗传性质。对比结果显示,菌株B5 与假单胞菌属(Pseudomonas sp.)具有高度同源性,与荧光假单胞菌和恶臭假单胞菌相似度为99%(图1)。
2.5 解磷菌B5在不同初始pH值时溶磷量的变化
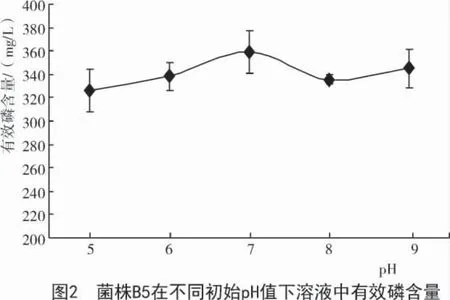
不同pH 值对菌株的解磷效果影响不同,经5 d摇瓶后测定锥形瓶中的有效磷含量如图2所示,当菌株B5 在pH 值为5.0 时解磷效果较弱,在pH 值为6~9 时均可以产生较高的溶磷量,说明该菌在碱性土壤中的解磷效果较好,其中,pH 值为7 时溶液中的有效磷含量最高。
2.6 解磷菌在不同盐浓度下溶磷量的变化
在相应条件下培养后,不同盐浓度对解磷菌B5 溶磷量的影响如图3所示。由图3可知,盐浓度为0.5%时,生长良好,有效磷含量最高;溶液的盐浓度为3%时,溶液中的有效磷含量最低。
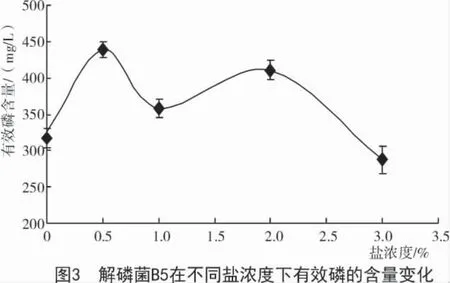
2.7 解磷菌在不同温度下解磷含量的变化
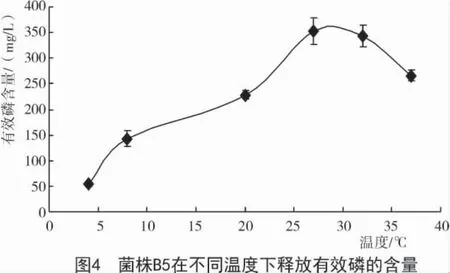
菌株B5 在不同的温度下释放的有效磷含量也不同,当菌株处于27,32 ℃时,有效磷的含量分别为 352.28,342.75 mg/L;37 ℃时有效磷含量降低,表明假单胞菌在30 ℃左右时生长较好;菌株在4 ℃时解磷效果最差,有效磷含量仅为53.57 mg/L(图4)。
2.8 解磷优势菌株B5在不同磷源下有效磷含量与pH值的变化
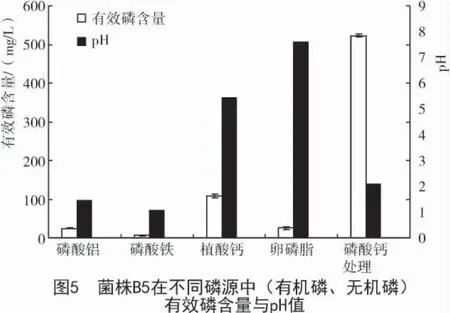
振荡培养5 d 后,有效磷的含量与pH 的变化如图5所示。从图5可以看出,以磷酸钙为磷源时,有效磷含量最高,为523.45 mg/L;其次为植酸钙,有效磷含量为108.96 mg/L;当磷源为磷酸铝、卵磷脂、磷酸铁时,有效磷含量较低,分别为26.00,24.85,6.38 mg/L。以有机磷的卵磷脂为磷源时,溶液的pH值达到8.05;而以无机磷为磷源时,溶液的pH 值不同程度减小。试验结果表明,菌株B5 可以溶解有机磷,但相比无机磷效果较差。
3 结论与讨论
新疆地处我国西北部,土地面积虽广,但可耕种土地较少,且昼夜温差较大,对于粮食、水果的种植、施肥等方式有待积极改善。本试验以Ca3(PO4)2为唯一磷源从新疆土壤中分离纯化出30 株解磷菌,筛选出1 株解磷效果最好的解磷菌B5,该菌溶磷量为519.66 mg/L,经16S rDNA 测序、生理生化试验鉴定,该菌为假单胞菌属细菌。任嘉红等[11]曾从南方红豆杉中分离出1 株荧光假单胞菌,该菌溶磷量为647.67 mg/L。
目前,研究解磷菌溶解无机磷的解磷机制主要为酸解机制,溶磷的发生往往伴随pH 值的降低[12]。很多研究表明,pH 值与溶磷量并非正相关关系[13],可能是由于解磷菌溶磷时分泌的有机酸或者产生H+使溶液 pH 值下降。ILLMER 等[14]研究发现,假单胞菌等菌溶解无机磷时不产生有机酸,但pH 值仍有降低,可能与菌株释放的质子和NH4+的同化有关。除以上溶磷机制外,解磷菌的溶磷能力被证明与外源的磷源有关,ZENG 等[15]对假单胞菌的研究发现,在不同浓度可溶性磷含量的条件下,菌株分泌有机酸的含量不同。未来对菌剂的应用可以添加适量磷肥,以增加植物对磷素更好的吸收,从而促进植物生长。微生物矿化有机磷主要产生各种酶,如植酸酶、核酸酶、磷酸酶等[16],溶解有机酸的酶主要为酸性磷酸酶与碱性磷酸酶。研究表明,解磷菌除了可以释放土壤中的难溶性磷之外,自身可以产生促进植物生长的激素等物质,如IAA、赤霉素、铁载体等[17-18]。有些解磷菌会与金属离子反应,从而降低重金属对土壤的毒性。
