HLA-G分子在结直肠癌中的表达及意义
2019-04-23叶尚勉董丹丹
何 煦,叶尚勉,董丹丹,李 科
(四川省医学科学院·四川省人民医院 a.中心实验室,b.病理科,四川 成都 610072)
结直肠癌是目前发病率较高的恶性肿瘤,发生转移的患者5年生存率不到10%,肿瘤侵袭和转移是导致食管癌患者死亡的主要因素[1]。随着诊治水平的提高,结直肠癌的发病率在全球范围内逐步下降,但如何提高结直肠癌的早期诊断率仍是全球性的科研难点和热点。人类白细胞抗原-G(HLA-G)是一种非经典的HLA-I类抗原,正常情况下HLA-G仅在胎盘的绒毛膜细胞表达,在分化成熟的正常成人组织中无表达。在病理情况下,HLA-G可以在肿瘤、器官移植和自身免疫性疾病等情况下产生[2]。本研究对HLA-G在结直肠癌患者中的表达进行了分析,并且探讨了HLA-G的表达与临床病理指标之间及生存率之间的关系,为进一步研究HLA-G在结直肠癌发生发展中的作用提供相关的理论基础。
1 资料与方法
1.1一般资料2013年1月至2018年1月在四川省人民医院确诊的201例结直肠癌患者,均为首次发现癌症,且无遗传性结肠癌综合征家族史,并且未接受术前化疗和放疗。男106例,女95例,平均年龄64岁。原发性结肠癌80例,原发性直肠癌121例。临床病理分期分级按照AJCC 和UICC制定的TNM标准。I期占21% (42/201),II期38% (77/201),III期39% (78/201),IV期2% (4/201)。术后所有Ⅰ~Ⅲ期患者接受口服5-氟尿嘧啶治疗,Ⅳ期患者接受包括5-氟尿嘧啶治疗的系统治疗。85例患者在检测HLA-G后随访,中位随访时间27个月(3~36个月),其中20例患者在随访过程中死亡。所有的组织切片取自外科术后病理组织,均为原发性直结肠腺癌,转移性癌组织未纳入,所有病例均为病理诊断结果。
1.2抗HLA-G单克隆抗体(HGY)的制备从人胎盘组织经两个连续抗体亲和层析柱(抗HLA-G抗体亲和层析柱和抗HLA-Gβ2微球蛋白抗体亲和层析柱)分离纯化获得天然HLA-G蛋白。然后用天然HLA-G蛋白按标准方法免疫BALA/C小鼠。再用免疫小鼠的脾细胞与SP2鼠骨髓瘤细胞株融合成杂交瘤细胞。经用有限稀释法,抗体捕获酶联免疫测定法和Western blot等方法筛选出一株分泌抗HLA-G单克隆抗体的杂交瘤细胞株,命名为HGY。该细胞株产生的单克隆经小鼠抗体分型试剂盒确定为IgG3。实验还进一步证明该抗体结合位点在HLA-G的α1区域。
1.3免疫组织化学检测用免疫组织化学SP法检测结直肠癌组织中HLA-G的表达,通用型SP试剂盒购自北京中杉金桥公司,抗HLA-G蛋白单克隆抗体的工作浓度为1∶400。组织用10%福尔马林固定,石蜡包埋,5 μm厚连续切片,常规脱蜡水化,抗原修复,封闭内源性过氧化物酶,加一抗HGY 4 ℃过夜。PBS缓冲液洗3次,加S-P试剂盒,镜下显色后,用苏木精对比染色。每次实验都设阳性对照和阴性对照。以癌细胞膜,细胞浆,细胞核出现棕黄色反应物判为阳性表达,由两位病理学专家在光镜下判读结果,根据显色百分比和显色信号的强度,将显色结果分为四级:(-)组织标本无染色;(+)阳性信号少于25%的癌症组织,和/或显色信号弱;(++)阳性信号在25%~50%,和/或信号强度中等;(+++)阳性信号多于50%,和/或显色为强阳性。
1.4宿主免疫反应评估采用结直肠癌患者肿瘤内淋巴细胞的浸润数量评估宿主的免疫反应。在5个高倍视野下,计数浸润的淋巴细胞数目,根据淋巴细胞的数量,将宿主免疫反应评分为强(+++)、中(++)、弱(+)。
1.5统计学方法采用SPSS 17.0统计学软件处理数据。计数资料比较采用χ2检验,生存率的分析采用Kaplan-Meier法。建立Cox回归模型进行多因素分析,确定影响生存率的独立预测因素,检验水准α=0.05。
2 结果
2.1原发性结直肠癌中HLA-G表达原发性结直肠癌组织中,65%(130/201)出现HLA-G表达,其中18%(24/130)为强表达(+++),31%(41/130)为中度表达(++),50%(65/130)为弱表达(+)。HLA-G的表达部位在细胞膜(8%)或胞浆中(2%),两个部位同时表达最多见(90%),71例结直肠癌标本(35%)未见HLA-G表达。正常结直肠组织和良性腺瘤组织中未见HLA-G表达。见图1。

图1 结直肠癌和正常结直肠组织中HLA-G的表达(×200) a:结直肠癌HLA-G表达强阳性;b:正常结直肠组织中无HLA-G表达
2.2不同临床病理学参数间HLA-G的表达HLA-G的表达在肿瘤部位、肠壁浸润深度、淋巴结转移和疾病分期方面的差异有统计学意义(P< 0.05),在年龄、性别、组织分化程度上差异无统计学意义(P> 0.05)。见表1。

表1 不同临床病理学参数间HLA-G的表达
2.3HLA-G在结直肠癌的表达与宿主免疫反应的关系从图2可以看出,HLA-G表达强阳性的区域淋巴细胞少,而HLA-G表达阴性的区域有大量淋巴细胞浸润。HLA-G表达阳性与HLA-G表达阴性的肿瘤组织相比,淋巴细胞的浸润被明显抑制,差异有统计学意义(χ2=42.677,P< 0.001),见表3。

图2 HLA-G的表达与宿主免疫反应的关系(×200) a:HLA-G表达强阳性的区域淋巴细胞少;b:HLA-G表达弱阳性的区域大量淋巴细胞浸润;c:HLA-G阴性区域大量淋巴细胞浸润

宿主免疫反应病例数HLA-G 表达(-)(+)(++)(+++)P弱9717302822中等 54261882强502817500.001
2.4HLA-G在结直肠癌的表达与患者生存率之间的关系85例患者在36个月随访期间,20例患者因肿瘤发生死亡,其中48例HLA-G阴性患者中2例死亡,37例HLA-G阳性患者中18例死亡,HLA-G阴性患者的生存率(96%)明显高于HLA-G阳性患者(51%)(χ2=22.98,P= 0.001)。分析其它临床病理学因素,如年龄、性别、浸润深度、组织分化程度、淋巴结有无转移、疾病分期与患者生存率之间的关系,其中淋巴结有无转移和疾病分期与生存率有关(表4)。Cox多因素分析确定HLA-G的表达与TNM分期、淋巴结有无转移一样,也是结直肠癌一个独立的预后指标(P= 0.021),见表5。
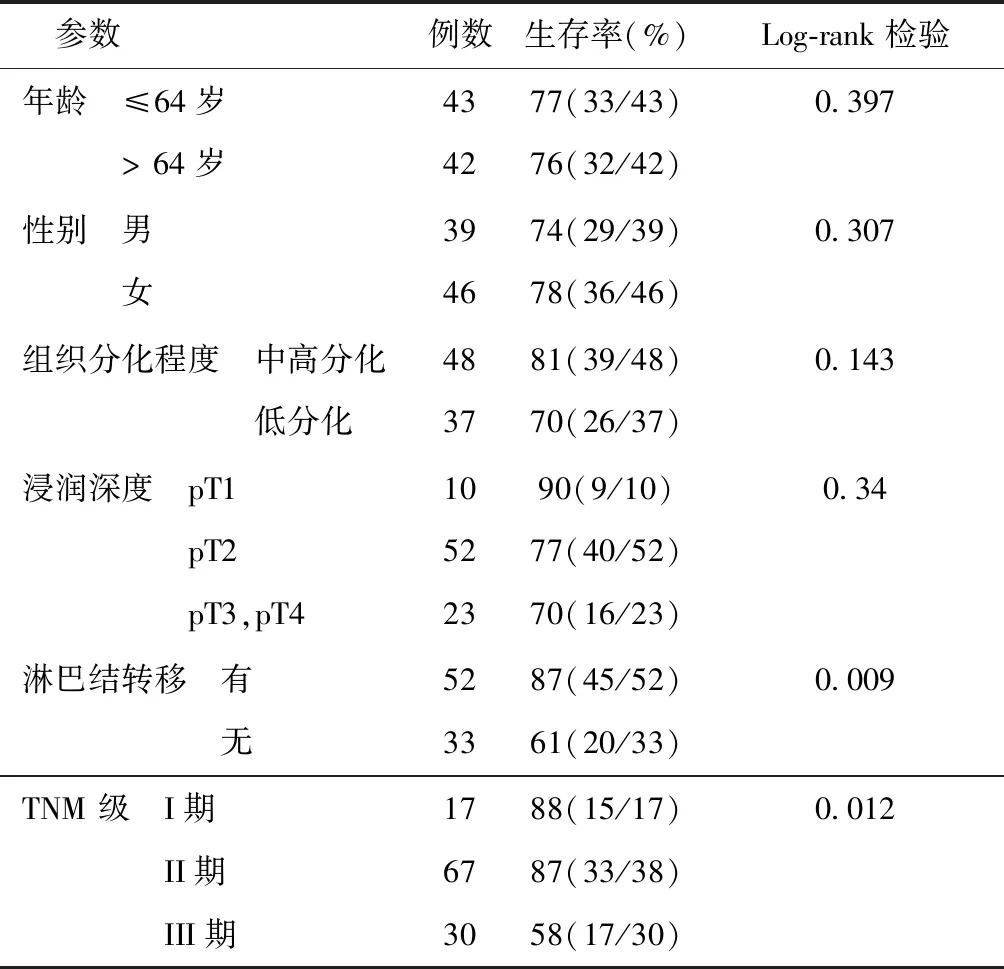
表4 生存率与各种临床病理学参数的关系

表5 结直肠癌患者生存率的影响因素分析
3 讨论
HLA-G是一种非经典的HLA-I类抗原,该白细胞抗原的基因同经典I类白细胞抗原的基因都位于第6对染色体的短臂上,基因和表达的产物与经典I类白细胞抗原有86%雷同[3]。在正常生理情况下,HLA-G仅在胎盘的绒毛膜细胞和其他少量的组织,如胸腺,角膜和骨髓造血祖细胞等表达(HLA-A,-B 和-C在几乎所有的有核体细胞均有表达),在母体对胎儿的免疫耐受起重要作用,在妊娠时可以保护胎儿免受母亲免疫系统的排斥[4]。HLA-G具有抑制自然杀伤细胞 (NK)、细胞毒性T淋巴细胞(CTL)和抗原递呈细胞(APC)的功能,是机体免疫耐受机制中重要的调节因子[5,6]。
近年来的研究发现,HLA-G在大多数常见恶性肿瘤组织又重新出现表达,HLA-G在肿瘤细胞的表达具有较高的肿瘤特异性[7~9]。本实验201例结直肠癌的研究数据表明,有较高比例的患者(65%)出现HLA-G蛋白的表达,而在正常结直肠组织则无表达。在分析了结直肠癌患者HLA-G的表达与各项临床病理学参数的关系后发现,HLA-G的表达与组织分化程度、肠壁浸润深度、疾病分期有关,这些结果提示HLA-G的免疫组织化学检测可作为判断结直肠癌的一个辅助诊断指标。
肿瘤在发生和发展变化过程中,要表达一些不同于正常组织的肿瘤抗原,免疫系统对这些发生癌变的细胞有排斥消除的功能,称之宿主的免疫监视。但在已经患上癌症患者的体内,癌细胞明显地逃过了宿主的免疫监视,这种现象称之为肿瘤的免疫逃逸[10,11]。由于HLA-G是一种免疫抑制分子,能够抑制免疫应答,可引起肿瘤细胞的入侵和转移,因此如果肿瘤细胞出现HLA-G的异常表达,便能更好地解释肿瘤免疫逃逸机制。在研究HLA-G的表达与宿主免疫反应的关系中我们发现,HLA-G的表达与宿主免疫反应成负相关关系,HLA-G表达阳性的区域宿主免疫反应弱于HLA-G阴性区域,说明HLA-G可能参与了宿主的免疫反应,是肿瘤细胞逃避宿主免疫反应的策略之一。此外,HLA-G的表达与结直肠癌的预后密切相关,HLA-G阴性患者的生存率明显高于HLA-G阳性患者,也表明HLA-G可通过抑制宿主免疫反应,帮助肿瘤细胞逃避宿主的免疫应答,使肿瘤易于发生转移,从而使患者生存率降低。
综上,本研究比较了HLA-G在结直肠癌和正常结直肠组织中表达的差别,以及与各项临床病理指标的关系,并且同时分析了与生存率之间的关系,通过以上结果表明,HLA-G分子在结直肠癌的发生、发展、转移、预后中都有重要作用,它参与了肿瘤免疫逃逸机制。HLA-G在恶性肿瘤的表达可能具有较高的临床应用价值,能够用于肿瘤的诊断和预后的指导和监测,是一个较为理想的肿瘤标志物。
