具有抗氧化活性的人源乳杆菌菌株筛选
2019-04-12李颖刘玉珍张雨晴李新玲牟光庆妥彦峰
李颖,刘玉珍,张雨晴,李新玲,牟光庆,妥彦峰,*
(1.大连工业大学食品学院,辽宁大连116034;2.新疆天润乳业股份有限公司,新疆乌鲁木齐830000)
1956年Harman 提出了自由基致衰理论,此后的大量研究证明自由基损伤可促使生命系统发生衰退性变化。自由基作用于机体内的蛋白质、核酸等生物大分子,造成氧化损伤,使细胞中毒凋亡,与衰老疾病密切相关。大部分的抗氧化剂来自于化学合成或天然物质的提取物。随着科学的进步,越来越多的人认识到化学合成抗氧化剂的危害,而天然物质的提取又因为分离鉴定、复配、改性等问题的限制,阻碍了其发展。微生物资源丰富,生产周期短,原料低廉。微生物发酵法在将来很可能成为大规模获得食用抗氧化剂的一条有效途径[1]。
乳酸菌的抗氧化活性已得到了体内及体外实验的证实[2-3],早在1900年人们就已发现常食含有乳酸菌的乳制品有利于人的健康长寿[4],乳酸菌对机体的免疫反应、肿瘤发生、衰老过程和应激反应等发生作用[5],有专家指出氧化应激与慢性疾病和机体衰老密切相关,如何增强机体的抗氧化能力预防疾病与衰老,成为研究的热点课题之一[6]。食用必需量的天然抗氧化剂可有效预防氧化应激,乳酸菌(Lactobacillus,LAB)作为一种优质天然抗氧化剂,其抗氧化功能备受关注。结合乳酸菌具有的保健特性和天然无毒、能贯穿食品加工过程等的特点,势必成为人们首先考虑的新型抗氧化剂[7]。
本试验以大连工业大学大连益生菌功能特性研究重点实验室从健康人粪便中分离出的7 株植物乳杆菌为对象,通过对其抗氧化能力的测定,筛选具有抗氧化活性的乳杆菌并分析乳杆菌可能的的抗氧化机制。
1 材料与方法
1.1 材料与试剂
鼠李糖乳杆菌(Lactobacillus rhamnosusGG,LGG)和大肠杆菌(Escherichia coli,E.coli)为大连工业大学大连市益生菌功能研究重点实验室保存菌株;MRS 肉汤培养基(生物试剂):北京奥博星生物技术有限责任公司;过氧化氢:天津市科密欧化学试剂有限公司;氯化钠、三羟甲基氨基甲烷:国药集团化学试剂有限公司;二苯基苦基苯肼(2,2-diphenyl-1-picrylhydrazy1,DPPH)、邻二氮菲、邻苯三酚、铁氰化钾、三氯乙酸:美国SIGMA 公司;无水乙醇、硫酸亚铁、三氯化铁:天津市大茂化学试剂厂;抗坏血酸(VC):天津市津科精细化工研究所;以上试剂均为分析纯。T-AOC 试剂盒、SOD试剂盒、GSH 试剂盒:南京建成生物工程研究所。
1.2 主要仪器设备
KG-SX-500 灭菌锅:上海精密实验设备有限公司;SW-CJ-2FD 超净工作台:苏净集团苏州安泰空气技术有限公司;FQC 生化培养箱:上海一恒科学仪器有限公司;S210-k 精密pH 计:梅特勒-托利多仪器有限公司;1510 酶标仪:美国Thermo Fisher Scientific 公司;CKX41 倒置电子显微镜:日本OLYMPUS 公司;Z326K型冷冻离心机:德国HERMLE Labortechnlk GmbH;AW200SG 型厌氧工作站:英国Electrotek 公司;超声波细胞破碎机(Scientz-IID):宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 健康人类粪便中乳杆菌的筛选
取近期未食用含乳酸菌食物或药物的健康人(年龄18~25 岁)的粪便0.5 g~1 g,置于灭菌后的4.5 mL浓度为0.9%的生理盐水中,用无菌生理盐水进行10 倍梯度稀释,采用涂布平板法,分别取10-4、10-5、10-6系列稀释液各100 μL 涂布在无菌MRS 琼脂培养基平板上,于37 ℃的厌氧工作站(气体组成:10%氢气,10%二氧化碳和80%氮气)培养48 h。待长出菌落,在MRS平板上划线纯化,于37 ℃的厌氧培养箱培养。选取接触酶阴性和革兰氏阳性菌作为备选菌株,进行16S rDNA 测序鉴定。并对菌种冻存保藏。
1.3.2 乳酸菌的培养及菌体、无细胞提取物的制备
根据黄玉军等[8]报道的方法制备菌体及无细胞提取物。备选菌株按2%(体积分数)比例接种于MRS 培养液,于37 ℃培养18 h;菌株连续活化两代后,按2%(体积分数)接种量接种于5 mL MRS 液体培养基中,置于37 ℃恒温培养箱中孵育24 h。在4 ℃、8 000 r/min条件下离心10 min,收集菌体。将离心后的菌体用pH7.40 的磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤3 次后,重悬于PBS 中,调整菌数至109CFU/mL(OD600nm≈0.7),得到待测菌体,然后将菌数为109CFU/mL的菌体,超声波冰浴破碎细胞(工作时间6 s,间隔时间9 s,10 min,输出功率200 W),在10 000 r/min,4 ℃离心10 min,上清液即为无细胞提取物并放于-20 ℃保存。
1.3.3 清除DPPH 自由基能力的测定
采用Mu 等[9]报道的方法测定备选菌株菌体和无细胞提取物的清除DPPH 自由基能力。DPPH 溶于无水乙醇,浓度为0.2 mmol/L;将1 mL 备选菌株菌悬液(或无细胞提取物)加入1 mL 0.2 mmol/L DPPH,室温20 ℃下避光反应30 min,4 000 r/min 离心10 min,于517 nm 处测定上清液的吸光度。
样品对DPPH 的清除率/%=[1-(Ai-A)j/A)c]×100
式中:Ai为1 mL 的DPPH+1 mL 样品的吸光度;Aj为1 mL 无水乙醇+1 mL 样品的吸光度;Ac为1 mL DPPH+1 mL 无水乙醇的吸光度。
1.3.4 对不同浓度H2O2溶液耐受能力的测定
参照Mu 等[9]报道的方法测定试验菌株对不同浓度H2O2溶液的耐受能力。在无菌的MRS 培养液中加入不同体积的20 mmol/L H2O2溶液,总体积为5 mL,使过氧化氢的终浓度为0、0.4、0.8、1.0 mmol/L。按2%的接种量加入MRS 培养液,37 ℃厌氧培养8 h,在600 nm 波长下测定培养液吸光度值。吸光度值越大说明菌液浓度越大,从而判定试验菌株对H2O2溶液耐受能力。
1.3.5 清除羟自由基(·OH-)能力的测定
参照Mu 等[9]报道的方法测定备选菌株对·OH-的清除作用,略有修改。反应混合物含有1.0 mL PBS(0.02 mol/L,pH 7.4),0.5 mL 邻二氮菲(2.5 mmol/L),0.5 mLFeSO(42.5 mmol/L),0.5 mL H2O(220 mmol/L)和0.5 mL 菌体或无细胞提取物,在37 ℃水浴反应1.0 h,将混合液4 000 r/min 离心10 min,于536 nm 处测定吸光度。空白管用蒸馏水代替。样品为按1.3.2 方法制备的7 株试验菌株及阴阳性对照菌大肠杆菌、LGG 的菌体及无细胞提取物。
自由基的清除率/%=(A样品-A对照)(/A空白-A对照)×100
式中:A对照为不加样品,加入H2O2的吸光度;A空白为不加样品,不加H2O2的吸光度;A样品为加入样品和H2O2的吸光度。
1.3.6 清除超氧阴离子自由基(O2-·)能力的测定
参照张江巍等[3]报道的方法测定备选菌株菌体或无细胞提取物清除超氧阴离子自由基的能力。在离心管中依次加入2 mLTris-HCl 缓冲液(150 mmol/L,pH=8.20),0.6 mL 样品(109CFU/mL),对照组加入PBS,25 ℃恒温预热10 min,最后加入25 ℃预热后的1.2 mmol/L 邻苯三酚溶液0.4 mL(用10 mmol/L HCl 溶液配制),混匀后25 ℃恒温水浴反应20 min,3 500 r/min离心10 min,取上清液在325 nm 处测吸光度,试验做3 个平行,重复2 次,求平均值。样品为按1.3.2 方法制备的7 株试验菌株及阳性对照菌LGG 的菌体及无细胞提取物。
超氧阴离子自由基清除率/ %=[1-(OD1-OD2)/(OD2-OD4)]×100
式中:OD1为含样品和邻苯三酚的吸光度;OD2为含样品不含邻苯三酚的吸光度;OD3为不含样品含邻苯三酚的吸光度;A4为不含样品和邻苯三酚的吸光度;
1.3.7 总还原力的测定
参照Wu 等[10]报道的方法测定备选菌株菌体或无细胞提取物的总还原能力。反应体系中加入待测样品0.5 mL、1%铁氰化钾0.5 mL、0.2 mol/L(pH=6.60)PBS 0.5 mL 于10 mL 离心管中50 ℃水浴20 min,急速冷却后,加入10%三氯乙酸(trichloroacetic acid,TCA)0.5 mL,3 500 r/min 离心10 min。吸取上清液1 mL,加入0.1%的FeCl3溶液1 mL 于700 nm 处测定吸光度值。以PBS代替菌液作空白对照。样品为按1.3.2 方法制备的7株试验菌株及阳性对照菌LGG 的菌体及无细胞提取物。
还原能力/%=(As-Ap)/Ap×100
式中:As为样品的吸光度;Ap为空白的吸光度。
1.3.8 总抗氧化能力(total antioxidant capacity,T-AOC)的测定
根据备选菌株DPPH 自由基清除率、超氧阴离子自由基清除率、羟自由基清除能力、耐受过氧化氢及还原能力,筛选获得抗氧化指标较高的菌株,进行后续试验。
选用南京建成总抗氧化能力试剂盒[11]对菌株2号、3 号及阳性对照菌LGG 的菌体和无细胞提取物进行检测。
总抗氧化能力/mL=(测定OD值-对照OD值)×反应量总量×样本测试前稀释倍数(/0.01×30×取样量)
1.3.9 超氧化物歧化酶(superoxide dismutase,SOD)活力的测定
采用试剂盒检测菌株2 号、3 号及阳性对照菌LGG 的无细胞提取物的超氧化物歧化酶(SOD)活力,方法及试剂的配制参照产品说明进行。
SOD 抑制率/%=([A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)×100%
OD活力(/U/mL)=SOD 抑制率/50%×反应体系稀释倍数×0.24 mL×样品测试前稀释倍数(5 倍)1.3.10 微量还原型谷胱甘肽(micro reduced glutathione,GSH)含量的检测
本试验选用GSH 试剂盒检测菌株2 号、3 号及阳性对照菌LGG 的无细胞提取物的含量,方法及试剂的配制参照产品说明进行。
GSH 含量/(μmol/L)=[(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准管浓度(20 μmol/L)×样品前处理稀释倍数(5 倍)]
1.4 数据处理
试验所得数据用SPSS 20.0 软件进行方差分析,差异显著性检验采用独立样本t 检验和单因素方差分析(ANOVE,LSD)。所有数据均用平均值±标准误差表示,p<0.05 表示差异显著。
2 结果与分析
2.1 乳酸菌菌株的菌落形态及鉴定结果
本研究从2 份健康人粪便中分离出7 株符合乳酸菌特性的杆菌,编号分别为1、2、3、4、5、7、8。7 株乳酸菌的外观形态均为表面光滑、湿润,边缘整齐或略微凸起的乳白色不透明菌落,经革兰氏染色呈阳性、过氧化氢酶实验呈阴性,可初步认定为乳杆菌。经过16S rDNA 测序鉴定,确定7 株为植物乳杆菌。鉴定结果如表1。

表1 菌种鉴定结果Table 1 Strains of appraisal results
2.2 DPPH 自由基清除能力的测定
分别测定7 株备选菌株的菌体和无细胞提取物对DPPH 自由基的清除率,以VC为对照,结果见表2。
由表2可知,7 株植物乳杆菌的菌体及无细胞提取物对DPPH 自由基均有一定的清除能力,但菌体的DPPH 自由基清除能力均明显大于无细胞提取物的清除能力,菌体的清除率达18.12%~30.35%,无细胞提取物的清除率达7.55%~12.07%。VC的清除能力最强。大肠杆菌对DPPH 自由基清除率高的主要原因是大肠杆菌是一种过氧化氢酶阳性菌,在其细胞中含有内源过氧化氢酶。以上结果与杨静秋[12]的研究结果相似,完整菌体清除DPPH 自由基的活性较高,因此可以初步推测乳酸菌清除DPPH 的活性物质主要存在于菌体表面和代谢产物中,而不是细胞内[13]。有报道显示,乳酸菌具有DPPH 自由基清除活性可能和菌体产生的胞外多糖有关,Xu 等[14]的研究显示DPPH 自由基的清除活性与由双歧杆菌分离出的胞外多糖的浓度呈正相关。
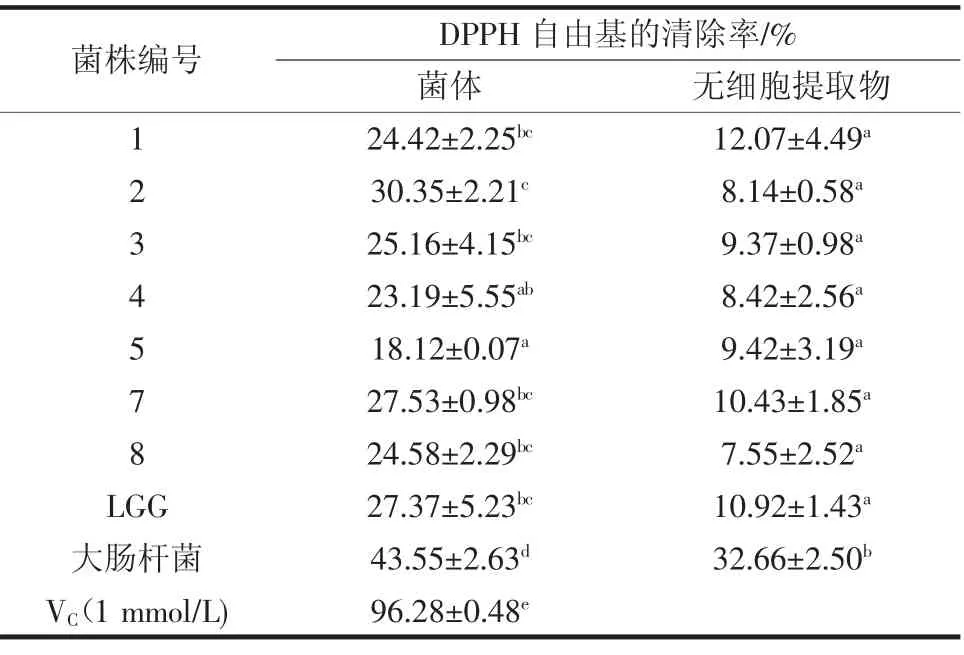
表2 不同菌株对DPPH 自由基的清除能力Table 2 DPPH free radical scavenging ability of different strains
2.3 乳杆菌对不同浓度过氧化氢溶液的耐受能力
备选菌株分别接种于含有不同浓度的过氧化氢MRS 培养基中,检测培养8 h 后培养液在600 nm 处的吸光度值,评价菌株对过氧化氢的耐受能力,结果见表3。
由表3可知,随着过氧化氢浓度的增加,接种不同菌株MRS 培养液的吸光度值均有不同程度下降,说明过氧化氢对菌株产生了氧化损伤。当培养液中过氧化氢浓度为1.0 mmol/L 时,接种菌株2、4 及对照菌株培养液的吸光度值无显著差异,而接种菌株1、3、7 的培养液吸光度值显著高于接种LGG 吸光度值,说明菌株1、3、7 对浓度为1.0 mmol/L 过氧化氢具有较强耐受性。该结果与车驰等[15]的研究结果一致,结果表明,8 株乳杆菌对不同浓度的过氧化氢都有一定的耐受能力,但不同菌株的耐受能力不同。
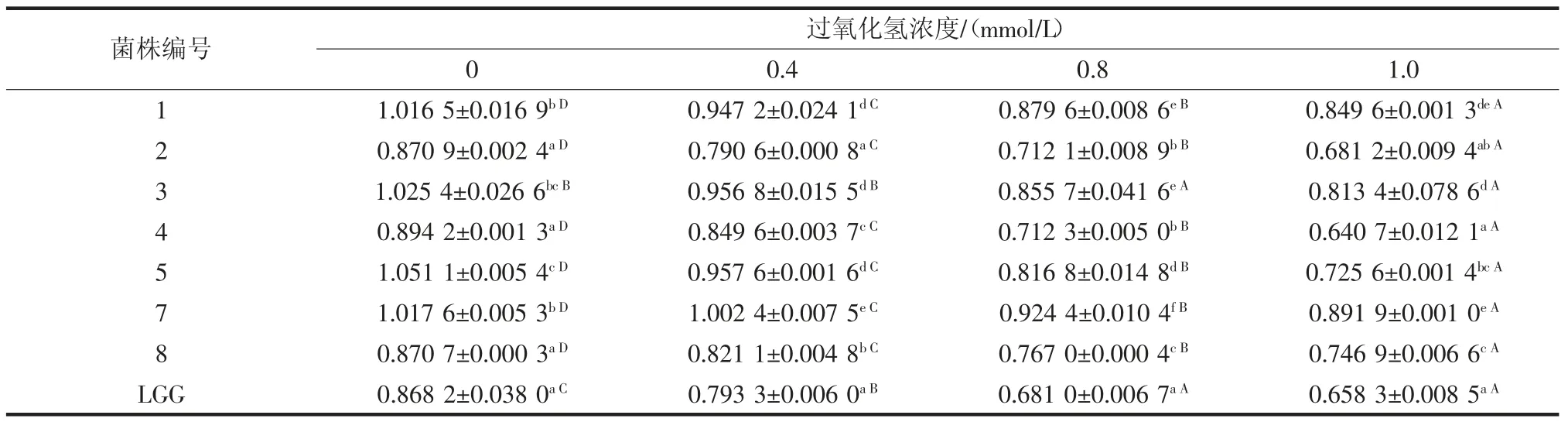
表3 含有H2O2 培养基中乳杆菌的菌体浓度(OD600)Table 3 Cell concentration of Lactobacillus containing H2O2 medium
2.4 羟自由基(OH·)清除能力的测定
备选菌株的菌体及无细胞提取物对羟自由基的清除能力结果见表4。
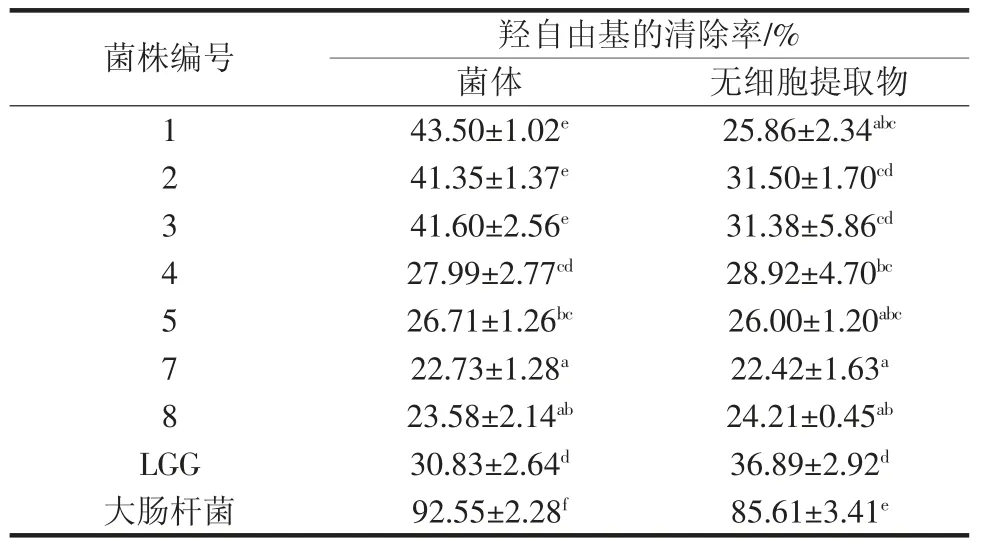
表4 不同菌株对羟自由基的清除能力测定Table 4 Determination of scavenging ability of hydroxyl free radicals by different strains
由表4可知,7 株菌株对羟自由基均有一定的清除作用。其中1、2、3 号菌株的菌体清除率较高,与两株对照菌株之间存在显著差异(p<0.05)。2、3 号菌株的无细胞提取物的清除率与阳性对照菌株LGG 无显著差异,与阴性对照(大肠杆菌)之间差异显著(p<0.05)。此外,在此试验条件下发现1、2、3、5、7 号菌株及阴性对照大肠杆菌的菌体羟自由基清除率均高于其无细胞提取物,然而4、8 号菌及LGG 3 株菌的菌体羟自由基清除率均低于其无细胞提取物。刘少敏[16]研究了嗜酸乳杆菌(Lactobacillius acidophilus)NCFM,植物乳杆(Lb.plantarum)ATCC 14917,鼠李糖乳杆菌(Lb.rhamnosusGG,LGG)和植物乳杆菌(Lb.plantarum)NDC 75017 对羟自由基清除能力的影响,发现LGG 的羟自由基清除能力最强。羟自由基能够降解DNA,损伤细胞膜和多糖化合物,是最主要的能够导致脂质过氧化和多种人体细胞损伤的自由基[17]。乳酸菌菌体具有较强的羟自由基清除能力可归结为在乳酸菌细胞内存在着针对Cu2+和Fe2+的天然螯合物质,Cu2+和Fe2+能够参与到机体多种氧化过程中,因此乳酸菌对Cu2+和Fe2+的螯合作用,能够从根本上减少羟自由基的产生[18]。本研究中备选菌株对Cu2+和Fe2+的螯合作用还有待进一步研究。
2.5 超氧阴离子自由基(O2-·)清除能力的测定
备选菌株的菌体及无细胞提取物对超氧阴离子自由基清除能力的测定结果见表5。
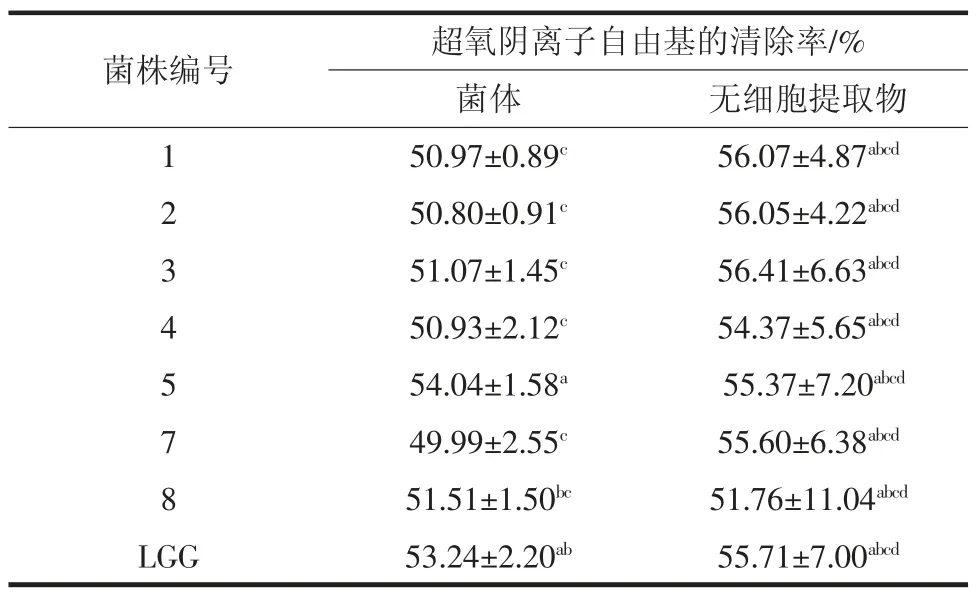
表5 同等浓度的不同菌株对O2-·的清除能力Table 5 The same concentration of different strains of O2-free radicals scavenging ability
由表5可知,在浓度为109cfu/mL 时,无细胞提取物对超氧阴离子自由基的清除率均高于菌体,其中菌株5、8 与阳性对照菌株LGG 菌体之间无显著差异。其余菌株的菌体清除率与对照之间差异显著(p<0.05)。所有菌株的无细胞提取物的清除率与阳性对照之间无差异显著。所有菌株的菌体及无细胞提取物均具有大于50%的超氧阴离子自由基清除能力。乳酸菌菌体及无细胞提取物具有超氧阴离子自由基清除能力可能是由于其菌体细胞及代谢产物中存在各种各样的氧化酶,有报道显示,乳酸菌存在不同的活性氧族(reactive oxygenspecies,ROS)解毒机制,包括过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和各种各样的氧化酶[12]。
2.6 总还原力的测定
备选菌株的菌体及无细胞提取物的总还原能力的测定结果见表6。
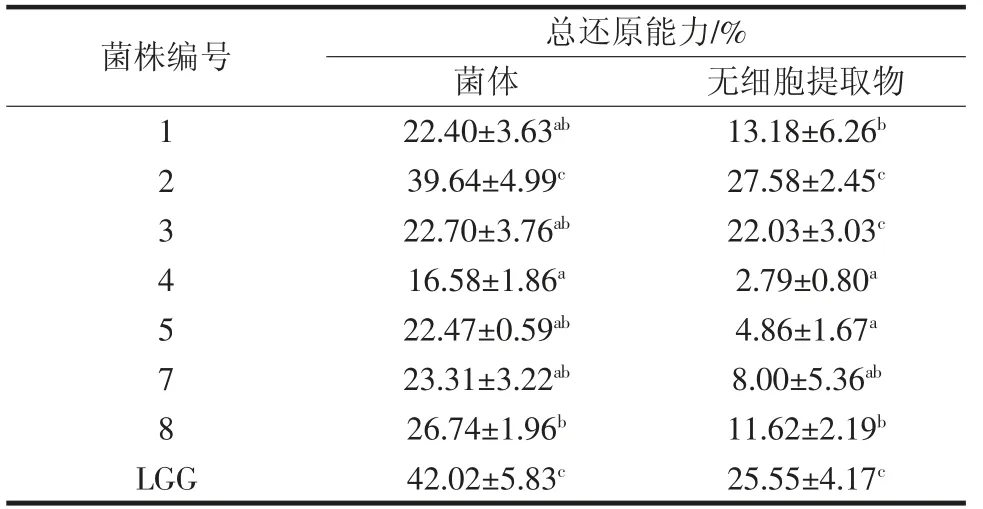
表6 乳酸菌总还原能力的测定Table 6 Total reducing capacity determination of lactic acid bacteria
由表6可知,各菌株菌体的还原能力均强于无细胞提取物,菌株2 的菌体及无细胞提取物的还原能力最强,分别为39.64%、27.58%,且与对照组无显著差异,其余除3 号菌的无细胞提取物外,菌体和无细胞提取物的还原能力均与对照组差异显著(p<0.05)。说明乳酸菌具有还原能力的活性物质的含量不仅在不同菌株间具有差异,在乳酸菌不同部位也存在较大差异。菌株无细胞提取物各抗氧化指标均低于完整菌体,也可能是由于超声破碎使部分发挥抗氧化活性的细胞物质失活。Lin 等[19]在对19 株乳酸菌无细胞提取物进行抗氧化试验时发现,受试的19 株菌均具有还原能力。
2.7 总抗氧化能力(T-AOC)的测定
经过测定7 株备选菌株对3 种自由基清除能力、过氧化氢耐受能力以及总还原力,结果表明菌株2 的菌体对DPPH 自由基的清除率高达到30.35%,对羟自由基的清除率达41.35%,还原能力高达39.64%,高于试验所用其他菌株,无细胞提取物对羟自由基的清除率高达到31.50%,与阳性对照菌株LGG 无显著差异。菌株3 对3 种自由基的清除率较高,处于较稳定的状态。从而挑选出2、3 号菌株进行总抗氧化能力、SOD 和GSH 酶活性的研究。
2、3 号及LGG 菌株的菌体及无细胞提取物的总抗氧化能力的测定结果见表7。

表7 总抗氧化能力测定Table 7 Total antioxidant capacity determination
由表7可知,菌株2 的菌体的总抗氧化能力与菌株LGG 无显著差异,但无细胞提取物的总抗氧化能力显著(p<0.05)高于LGG 无细胞提取物总抗氧化能力。陈明[20]研究了不同植物乳杆菌的总抗氧化能力,发现无论是在发酵上清液还是在无细胞提取物中菌株BX62、24-7 和XM5 都具有较高的T-AOC 活性。
2.8 超氧化物歧化酶(SOD)活力的测定
对筛选出来的2、3 号菌及LGG 菌株的无细胞提取物进行SOD 活性测定,结果见表8。
本反应体系中SOD 抑制率为50%时所对应的酶量为一个SOD 活力单位(U)。菌株3 的SOD 抑制率和SOD 活力最强。但3 种菌株SOD 抑制率和SOD 活力无显著差异(p<0.05)。张江巍等[2]筛得的抗氧化乳酸菌L4 具有SOD 活性;大多数乳酸菌是通过产生超氧化物歧化酶和谷胱甘肽过氧化物酶清除羟自由基和过氧化氢[21-24]。Lee 等[25]为探索乳酸菌抗氧化机制,测定了菌株L.plantarumKCTC 3099 螯合金属离子及SOD 活性,结果表明受试菌SOD 活性极低,但螫合Fe2+、Cu2+的能力分别为13.6 mg/kg 和23.9 mg/kg,因此推断乳酸菌抗氧化能力来自于菌体螯合金属离子的能力。
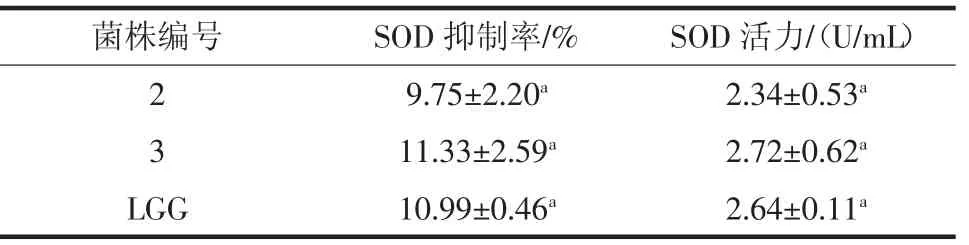
表8 SOD 活力的测定Table 8 Determination of SOD activity
2.9 微量还原型谷胱甘肽(GSH)含量的检测
对筛选出来的2、3 号及LGG 菌株的无细胞提取物进行GSH 含量测定,结果见表9。
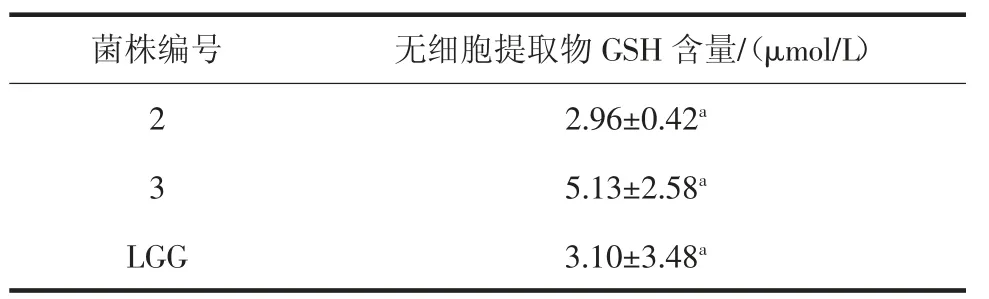
表9 还原型谷胱甘肽(GSH)的测定Table 9 Determination of reduced glutathione(GSH)
由表9可知,所有菌株均存在GSH,3 株菌GSH含量差异不显著。谷胱甘肽过氧化物酶是一种重要的催化过氧化氢分解的酶,它的作用是保护细胞膜结构和功能的完整延迟细胞的衰老,也具有一定的清除O2-·的能力[26]。GSH 具有清除自由基和抗氧化作用,如体内产生的过氧化氢、氢过氧化物(ROOH)、过氧化物自由基(R·)等均能被清除[27]。很多研究认为,乳酸菌的抗氧化作用是由胞内抗氧化成分和氧化还原调控系统共同调节完成的,乳酸菌自身能产生GSH 和SOD等抗氧化酶和非酶类抗氧化剂,也可通过菌体产生的代谢产物调节氧化还原电位而清除自由基,降低氧化应激[28]。
3 结论
本研究结果表明筛选出的2 号及3 号植物乳杆菌具有抗氧化活性。乳酸菌完整菌体与无细胞提取物抗氧化活性的不同,可能与超声处理对菌体活性成分的影响有关,完整活菌体状态下,菌体表面成分、细胞内容物均参与清除自由基等抗氧化的过程。本研究中抗氧化活性随菌体及试验方法的不同而不同,因此有必要进行细胞试验及动物试验,验证菌株的抗氧化性能。
