超声细胞破碎辅助提取江永香菇多糖工艺及其抗氧化活性研究
2019-04-12王希朱攀宇蒋荣娜刘燚琳王宗成
王希,朱攀宇,蒋荣娜,刘燚琳,王宗成,*
(1.株洲市食品药品检验所,湖南株洲412000;2.湖南科技学院化学与生物工程学院,湖南永州425199)
香菇(Lentinus edodes(Berk.)sing)为真菌科担子菌纲伞菌目伞菌科香蕈,又名香蕈、冬菇,是一种木腐菌,子实体单生、丛生或群生[1-2]。香菇为药食同源的中药材,用于益气不饥,治风破血、化痰理气、益味助食、预防佝偻病、预防身体衰弱、毛细血管破裂、牙床以及腹腔出血[3]。香菇多糖是香菇中主要的活性成分,香菇多糖通过刺激机体增加免疫因子的释放量增加,增强机体的免疫功能,且不会损伤正常细胞的作用,临床上主要用于癌症的辅助治疗[4]。香菇多糖同时能够提高巨噬细胞的吞噬作用,增加体内淋巴细胞转化率,近代研究表明香菇多糖在提高免疫力、抗肿瘤、抗病毒、抗肝炎、抗氧化方面均具有很好的药理作用[5-7]。据文献记载,香菇多糖的提取方法主要为热水提取法、碱水浸提法、微波辅助提取、超声辅助提取等[8-9]。超声波所特有的空化效应、机械效应、热效应,对提取的香菇多糖有助溶作用[10]。赵谋明等[11]研究发现,超声处理能有效降低香菇多糖溶液的黏度,提高香菇多糖的溶解性。邹林武等[12]发现,超声波不但不会破坏香菇多糖的结构,而且会增加香菇多糖的支链,在一定程度上提高了香菇多糖的抗氧化性能。江永香菇盖头硕大、色泽自然、香气独特,与江永香柚、香芋、香姜、香米统称为“江永五香”[13]。从香菇中提取香菇多糖的报道较多,但未发现有从江永香菇中提取香菇多糖的报道,此外通过超声波细胞破碎法辅以热水浸提香菇多糖的研究也未见系统报道。因此,本项目采用超声波辅助热水法提取江永香菇多糖,研究江永香菇多糖提取工艺并测定其抗氧化活性,以期为江永香菇综合利用开发提供科学依据。
1 材料与方法
1.1 材料与试剂
江永香菇:购于永州市零陵区河西市场,将干香菇放入烘箱中干燥4 h 至恒重,粉碎过40 目筛得细粉,放入烘箱中备用。
葡萄糖标准品:中国药品生物制品检定所;95%乙醇、ABTS、DPPH:分析纯,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
TE124S 型电子天平:赛多利斯科学仪器(北京)有限公司;JYD-1200L 型超声波细胞破碎仪:上海之信仪器有限公司;TG16G 型离心机:湖南凯达仪器有限公司;UV2800S 型分光光度计:上海舜宇恒平仪器有限公司。
1.3 试验方法
1.3.1 标准曲线的绘制
参照文献[13],配置0.1(mg/mL)葡萄糖标准溶液,然后稀释为不同浓度的葡萄糖溶液,采取苯酚-硫酸法显色,于490 nm 处测定溶液的吸光值,绘制吸光值为纵坐标、葡萄糖浓度为横坐标的标准曲线回归方程。得出的回归方程为:y=0.905 7x+0.224 9(R2=0.995 5)。
1.3.2 香菇多糖的提取
精确称取干燥至恒重的香菇粉末10 g,用去离子水调节料液比,超声波细胞破碎一定时间,再进行热水浸提,在4 000 r/min 的条件下离心10 min,取其上清液,旋转蒸发至约50 mL,用3 倍体积的无水乙醇进行醇析过夜,抽滤,取得沉淀,烘干至恒重,即为香菇多糖[14]。
1.3.3 香菇多糖含量测定及得率
精确称取0.1 g 香菇多糖,溶于蒸馏水并定容至50 mL,然后吸取此溶液2 mL 并用蒸馏水定容至50 mL,再取1.0 mL 稀释后的溶液,参照1.2.1 标准曲线绘制方法测定香菇多糖的含量[15]。
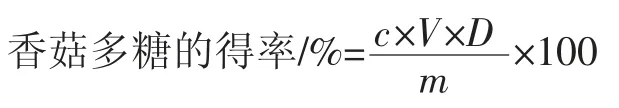
式中:c代表稀释后的浓度,g/mL,V表示初次定容的体积,mL;D表示稀释倍数;m 表示香菇质量,g。
1.3.4 单因素试验
考察料液比、超声功率、超声时间、浸提时间、浸提温度5 个影响因素对江永香菇多糖得率的影响。
1)超声时间:在料液比1 ∶30(g/mL)、超声功率400 W 下超声细胞破碎一定时间,再于80 ℃下浸提60 min,考查超声时间(1、2、3、4、5、6 min)对香菇多糖得率的影响。
2)超声功率:在料液比1 ∶30(g/mL)、一定超声功率下超声细胞破碎5 min,再于80 ℃下浸提60 min,考查超声功率(200、300、400、500、600、700 W)对香菇多糖得率的影响。
3)料液比:在一定料液比、超声功率400 W 下超声细胞破碎5 min,再于80 ℃下浸提60 min,考查料液比[1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35(g/mL)]对香菇多糖得率的影响。
4)浸提时间:在料液比1 ∶30(g/mL)、超声功率400 W 下超声细胞破碎5 min,再于80 ℃下浸提,考查浸提时间(20、30、40、50、60、70 min)对香菇多糖得率的影响。
5)浸提温度:在料液比1:30(g/mL)、超声功率400 W 下超声细胞破碎5 min,再于一定温度下浸提60 min,考查浸提温度(50、60、70、80、90、100 ℃)对香菇多糖得率的影响。
1.3.5 响应面设计试验
对单因素试验数据分析,以浸提温度、浸提时间、超声时间3 个因素为自变量,以香菇多糖得率为响应值,采用Box-Behnken 试验设计,进行响应面试验。
1.3.6 抗氧化性试验
将超声波细胞破碎法辅以热水浸提得到的江永香菇多糖(CD-lentinus)和热水回流提取得到的江永香菇多糖(HW-lentinus)溶解稀释成不同浓度,进行抗氧化活性测定。
1.3.6.1 香菇多糖DPPH 自由基清除能力的测定
在试管中分别加入4.0 mL 不同浓度香菇多糖溶液,加入4.0 mL 0.3 mmol/L 的DPPH 乙醇溶液,振荡摇匀,静置30 min,在517 nm 波长下,用蒸馏水调零,测定吸光度(Ai),空白对照组以4.0 mL 蒸馏水代替样品,加入4.0 mL DPPH 乙醇溶液,测定517 nm 波长下的吸光度(Ao),同时在4.0 mL 样品溶液中加入4.0 mL 乙醇,测定在517 nm 下的吸光度(Aj),以相应浓度的VC作为对照[16],操作同上,DPPH 自由基的清除率按下列公式计算。
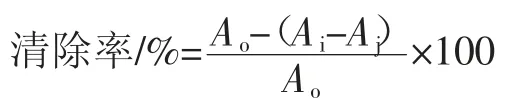
式中:Ao代表不加香菇多糖的吸光度;Ai为测定液的吸光度;Aj为香菇多糖的本体的吸光度。
1.3.6.2 香菇多糖ABTS+自由基清除率的测定
依次在试管中加入2.0 mL 不同浓度香菇多糖溶液,再加入2.0 mL ABTS 溶液,静置6 min,在734 nm可见光波长下测定吸光值(Ai),以2.0 mL 的蒸馏水代替样品作为空白对照,在734 nm 波长下测吸光度Ao,以相应的质量浓度的VC作对照[16]。
式中:Ao为不加香菇多糖的吸光度;Aj为样品的吸光度。
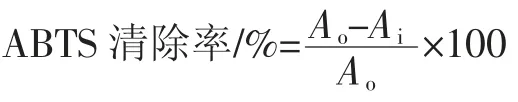
2 结果与讨论
2.1 单因素试验结果与分析
2.1.1 超声时间对得率的影响
超声时间对得率的影响见图1。
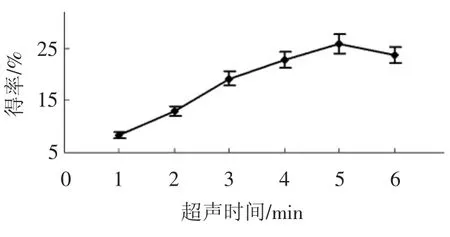
图1 超声时间对得率的影响Fig.1 Effect of ultrasonic time on the yield
如图1所示,随超声细胞破碎时间的延长,香菇多糖的得率呈现递增趋势,当超声时间为5 min 时,香菇多糖的得率最大,少于5 min 时,增加非常明显,但是大于5 min 反而减少。可能由于超声波具有的空化效应和机械效应,可在极短的时间内,击碎细胞壁,促使细胞内物质外流,提高香菇多糖的溶出度,但是时间太长,可能会使其他成分浸出较多竞争溶剂,影响产品的质量和得率[18],因此选择4min~6 min 进行进一步优化。
2.1.2 超声功率对得率的影响
超声功率对得率的影响见图2。
如图2所示,随着超声功率的增大,香菇多糖的得率呈现先递增后减小趋势,当超声功率为500 W 时,香菇多糖的得率最大,但是400 W~600 W,香菇多糖的得率变化不明显。可能由于超声波功率较小时,超声波细胞破碎效果随功率增加而增加,但是超声功率过大时,会使其他成分浸出较多竞争溶剂,影响产品的质量和得率[18],因此宜选择超声功率为500 W。
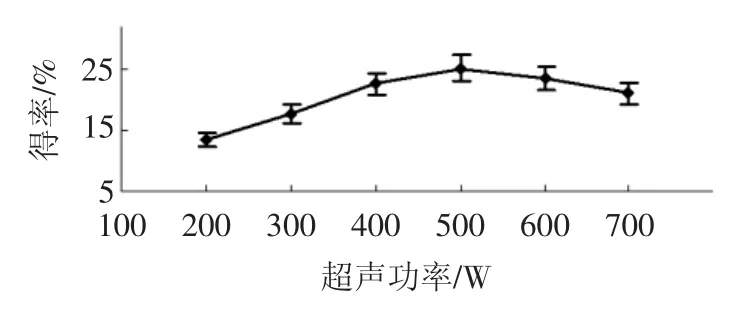
图2 超声功率对得率的影响Fig.2 Effect of ultrasonic power on the yield
2.1.3 料液比对得率的影响
料液比对得率的影响见图3。

图3 料液比对得率的影响Fig.3 Effect of solid-liquid ratio on the yield
如图3 香菇多糖的得率随着料液比的减小呈现递增趋势,料液比为1 ∶25(g/mL)时,接近于稳定,溶剂过大,加热成本增加,提取设备容积也需要更大,为了节省成本,料液比1 ∶25(g/mL)较佳。
2.1.4 浸提时间对提取率的影响
浸提时间对得率的影响见图4。
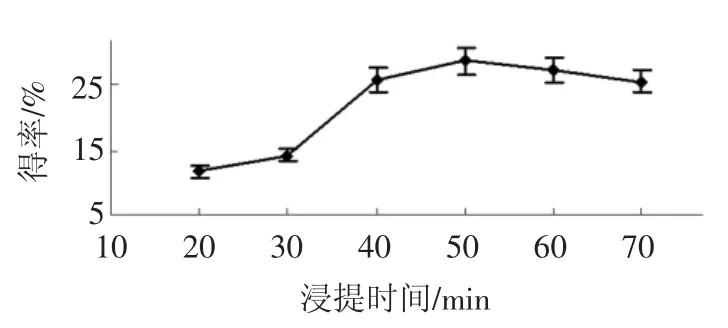
图4 浸提时间对得率的影响Fig.4 Effect of extraction time on the yield
如图4所示,在浸提时间为50 min 时,香菇多糖得率最高,当低于50 min 时,得率增加明显,超过50 min 后反而稍减少,可能由于浸提时间过长,香菇多糖结构破坏导致得率稍减少,为了节约生产时间,宜选取浸提时间为40 min~60 min。
2.1.5 浸提温度对提取率的影响
浸提温度对得率的影响见图5。
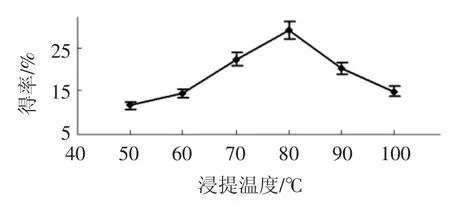
图5 浸提温度对得率的影响Fig.5 Effect of extraction temperature on yield
如图5所示,随着浸提温度的升高,香菇多糖的得率在80 ℃达到最大值,后逐渐降低。温度过高,可能会破坏香菇多糖,使多糖降解,此外要在高温下进行工业化生产,将消耗更多的能量,在一定程度上,增大了生产成本,选取浸提温度为80 ℃为宜。
2.2 响应面设计试验结果及其分析
2.2.1 设计方案及试验结果
由于超声功率在500 W 时香菇多糖得率最高,且超声功率在400 W~600 W 范围内得率变化不明显;此外料液比不宜过大,1 ∶25(g/mL)时提取香菇多糖较充分,因此固定超声功率500 W 和料液比1 ∶25(g/mL),选择浸提时间、浸提温度、超声时间3 个因素进行响应面优化香菇多糖提取工艺,具体因素及水平见表1,试验设计及结果见表2。
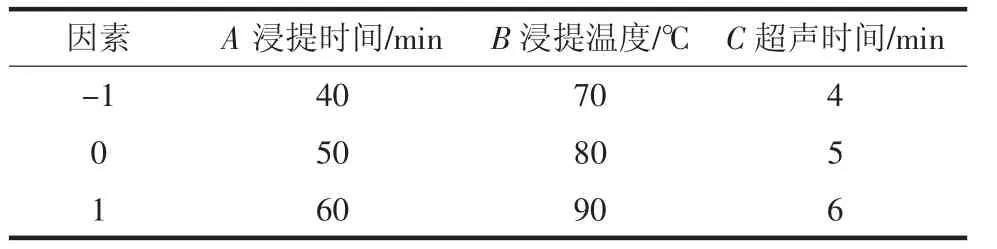
表1 响应面试验因素水平表Table 1 Factors and levels of the response surface design
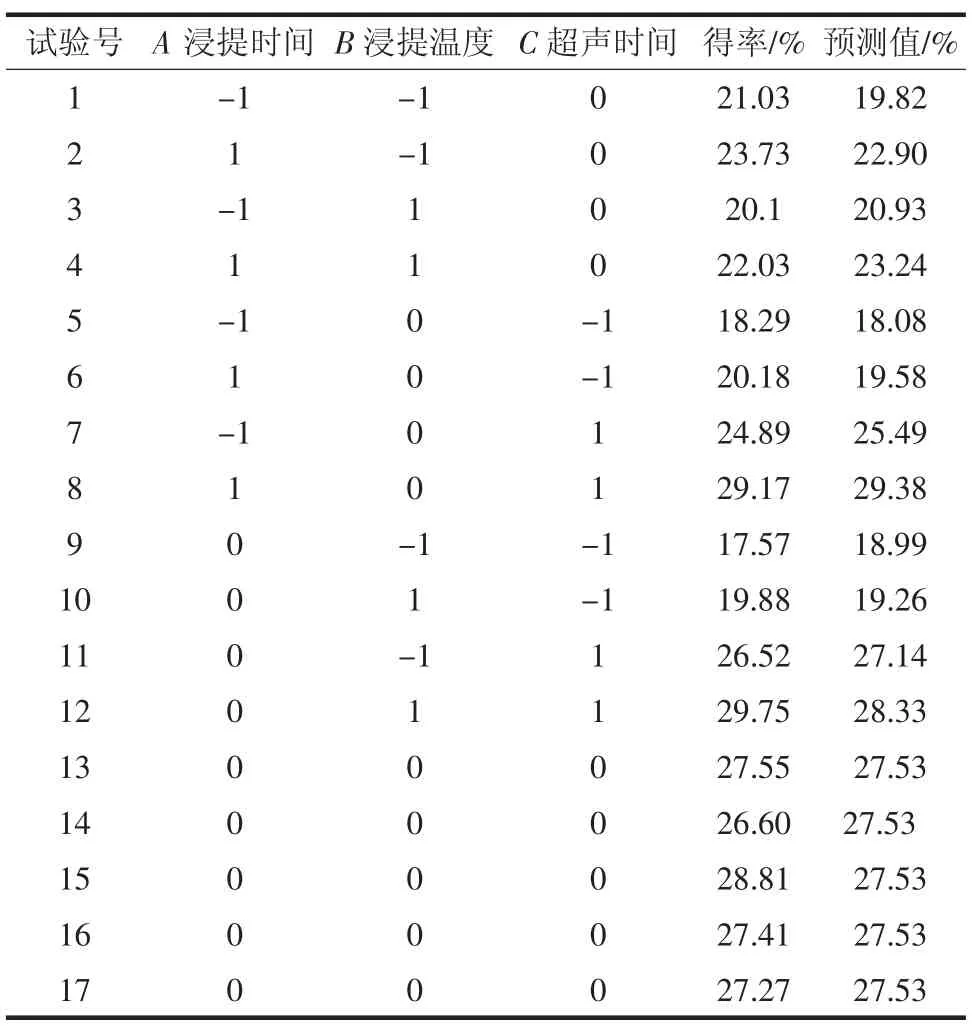
表2 响应面法试验设计及结果Table 2 The experimental design and results of response surface method
2.2.2 数据模型的建立和分析
根据试验数据,采用Design-Expert 8.0.6 软件进行回归拟合,得到多糖得率(Y)对试验因素的回归方程为:
Y=27.53+1.35A+0.36B+4.30C-0.19AB+0.60AC+0.23BC-3.05A2-2.75B2-1.34C2。
公式为二次多元方程,方程中的二次项系数为负值,可知抛物面的开口向下,成倒V 字形,每个面上,存在一个最大值,因此可推测出最优提取条件。系数绝对值的大小可以反映因素对响应值的影响程度,由一次项系数可得出,提取香菇多糖的主次影响因素顺序为:超声时间>浸提时间>浸提温度。
2.2.3 回归模型的方差分析
为进一步确定各因素对香菇多糖得率的影响程度和可靠性,对回归模型进行了方差分析,结果见表3。
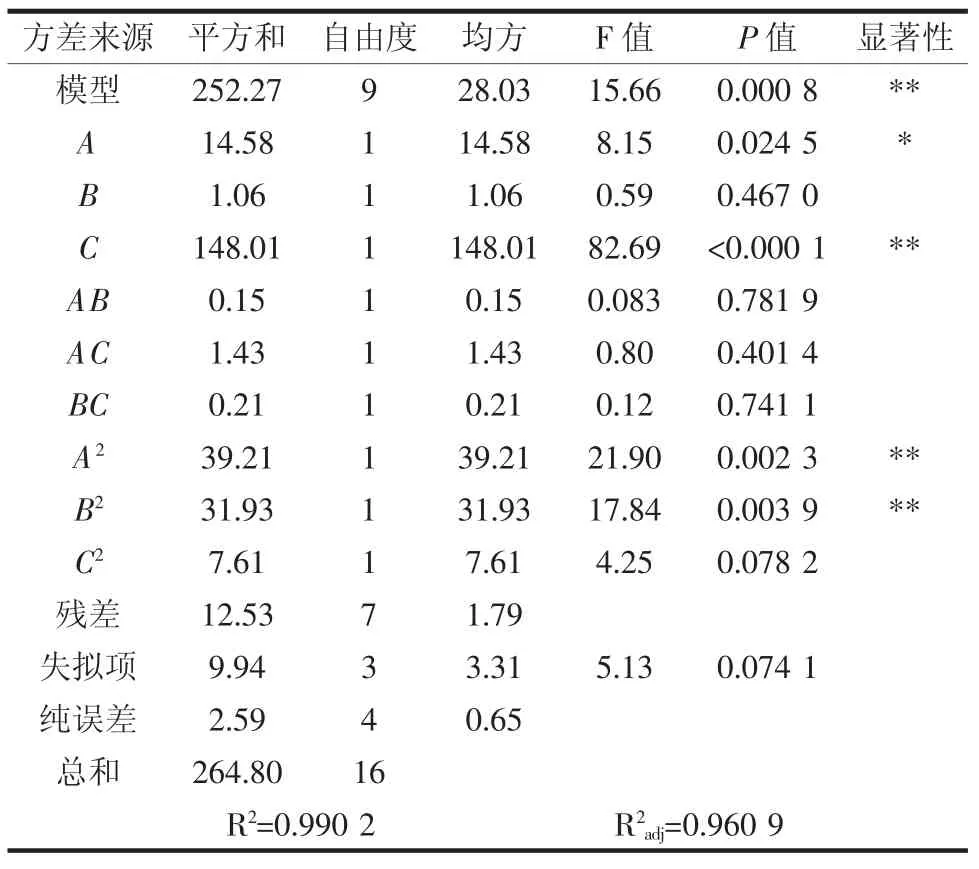
表3 响应面设计试验的方差分析Table 3 Analysis of variance of response surface design experiment
模型的P=0.000 8 <0.01,是显著的,说明模型是可行的,失拟项>0.05,不显著,说明不需要引入更高次数的项,当前模型与实际拟合度较好,R2adj=0.960 9 和相关系数R2=0.990 2,也说明该模型拟合程度良好。A、C、A2和B2均小于0.05,说明超声时间和浸提时间的一次项、超声时间和浸提温度的二次项均存在显著性,由表中的P值也可以印证上述的影响因素顺序为:超声时间对香菇多糖的得率影响最大,其次是浸提时间,浸提温度影响最小。
2.2.4 响应面分析
通过Design-Expert 8.0.6 软件模拟三因素之间的交互作用响应曲面图,如图6~图8。从3D 响应面图可以看出,各个因素对多糖得率的影响程度。响应曲面的坡度陡峭程度说明影响因素对响应值的影响大小[19],图7 的响应面较为陡峭,说明超声时间和浸提时间的交互作用较大,但是由表3可知,3 个交互作用均未达到显著性水平。
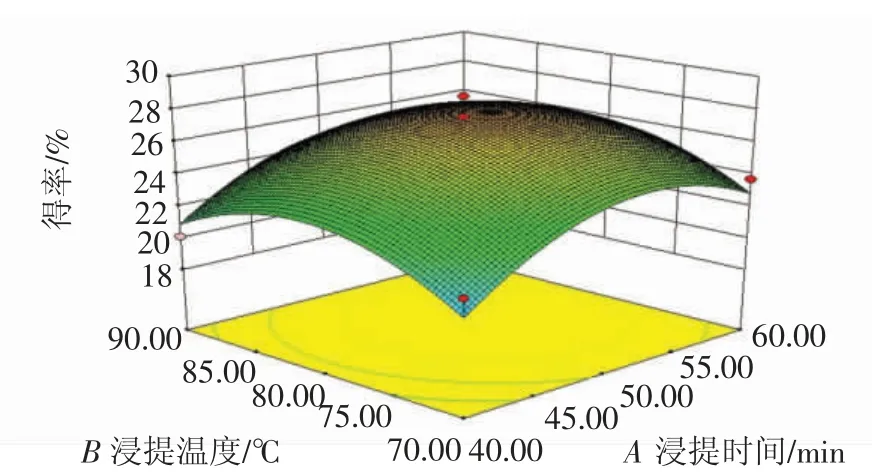
图6 浸提温度和浸提时间的交互作用Fig.6 Extraction temperature and extraction time on the yield of interaction
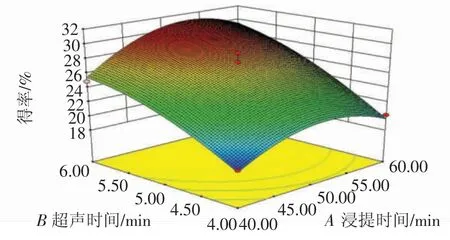
图7 超声时间和浸提时间的交互作用Fig.7 Ultrasonic time and extraction time on the yield of interaction

图8 超声时间和浸提温度的交互作用Fig.8 Ultrasonic time and extraction temperture on the yield of interaction
2.2.5 提取条件的优化及验证试验
通过软件对回归方程的进一步优化,由以上试验的结果分析,香菇多糖的最佳的提取工艺是浸提时间51.25 min、浸提温度为77.89 ℃、超声时间为5.95 min,结合实际情况最佳工艺条件调整为:超声时间6 min、浸提温度78 ℃、浸提时间51 min。在此条件下,经过3次平行试验验证,江永香菇多糖的得率可达到29.71%。
2.3 抗氧化活性研究
2.3.1 香菇多糖的DPPH 自由基的清除能力
香菇多糖的DPPH 自由基清除能力见图9。
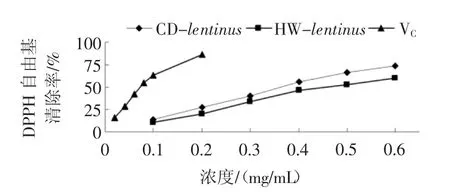
图9 不同浓度的江永香菇多糖和VC 的DPPH 自由基清除能力Fig.9 DPPH free radical clearance rate of different concentrations of polysaccharide from Lentinus edodes from Jiangyong and VC
超声波细胞破碎法辅以热水浸提得到的江永香菇多糖(CD-lentinus)和热水回流提取得到的江永香菇多糖(HW-lentinus)均具有一定的DPPH 自由基清除能力,虽然弱于VC,但是与浓度呈正相关,且CDlentinus对DPPH 自由基清除能力较HW-lentinus强。CD-lentinus、HW-lentinus和VC清除DPPH 自由基的IC50分别为0.35、0.46 mg/mL 和0.07 mg/mL,说明江永香菇多糖对DPPH 自由基具有较高清除作用。
2.3.2 香菇多糖的ABTS+自由基的清除能力
香菇多糖的ABTS+自由基清除能力见图10。
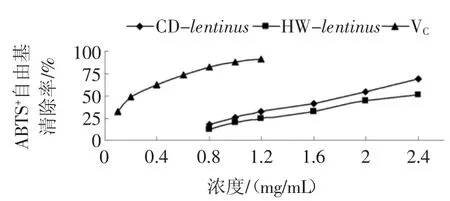
图10 不同浓度的江永香菇多糖和VC 的ABTS+自由基清除能力Fig.10 ABTS+free radical clearance rate of different concentrations of polysaccharide from Lentinus edodes from Jiangyong and VC
ABTS+自由基清除能力通常用于反应物质的总的抗氧化能力,在波长为734 nm 下测定的吸光度可用来评价物质的抗氧化能力。如图10,CD-lentinus和HWlentinus均具有一定的ABTS+自由基清除能力,虽然弱于VC,但是与浓度呈正相关,且CD-lentinus对ABTS+自由基清除能力较HW-lentinus强。CD-lentinus、HWlentinus和VC清除ABTS+自由基的IC50分别为1.76、2.32 mg/mL 和0.22 mg/mL,说明江永香菇多糖对ABTS+自由基具有较高清除作用。
3 结论
本文通过单因素试验和响应面法优化了江永香菇多糖提取工艺条件,得出超声波细胞破碎法辅以热水浸提香菇多糖的最佳提取工艺为超声时间6 min、浸提温度78 ℃、浸提时间51 min。在此条件下,江永香菇多糖的得率可达到29.71%。
本试验测定了江永香菇多糖的抗氧化活性,超声波细胞破碎法辅以热水浸提江永香菇多糖体外清除DPPH 自由基能力的IC50值为0.35 mg/mL,清除ABTS+自由基能力的IC50值为1.76 mg/mL,其DPPH 自由基清除能力和ABTS+自由基清除能力均高于热水回流提取得到的江永香菇多糖,但低于VC。从抗氧化性结果看出,江永香菇多糖活性较高,应用于抗氧化保健产品具有开发前景。
