红肉中N-羟乙酰神经氨酸在人体中的代谢途径及危害
2019-04-12文琦沈清武
文琦,沈清武
(湖南农业大学食品科学技术学院,湖南长沙410128)
70年前,贡纳·布利克斯等发现脑糖脂与唾液黏蛋白经酸水解的主要产物为唾液酸[1]。这是一种具有9个碳骨架的酸性糖类,为神经氨酸的N-或O-取代衍生物的总称。唾液酸常存在于N-聚糖、O-聚糖和神经节苷脂中糖鞘脂分支的末端,也存在于糖基磷脂酰肌醇锚着点(GPI anchors)的侧链末端,构成单糖或多糖残基[1-4]。
这一类单糖在生物多样性方面有着巨大潜力。(1)碳链连接方式多样。高能供体形式的唾液酸(cytidine monophospho-sialic acid,CMP-Sia)经过唾液酸转移酶能与寡糖通过α2-3 方式连接。唾液酸也可在聚糖内自身聚合,一般为α2-8 唾液酸残基连接方式形成唾液酸多聚体。在棘皮动物中,其他单糖(如海藻糖、半乳糖)可与唾液酸残基的C-4 连接。(2)自然修饰多种多样。例如,神经氨酸(Neuraminic acid,Neu)的C-5 连接氨基;2-酮基-3-脱氧-D-甘油-D-半乳糖酸(deaminoneuraminic acid,KDN)的C-5 连接羟基;N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac)的C-5 连接N-乙酰基;当Neu5Ac 的N-乙酰基羟基化时,则形成Neu5Gc[5-6]。这4 个核心唾液酸分子(Neu5Ac、Neu5Gc、KDN 和Neu)可在C-4、C-7、C-8 和C-9 上携带一个或多个基团(O-乙酰、O-甲基、O-硫酸盐、O-乳酸基或磷酸基)。此外,C-1 上的羧基通常与羟基相邻的糖基凝聚成一个内酯,或者与C-5 中游离的氨基形成内酰胺。现今已发现50 多种唾液酸,糖基末端的唾液酸残基数量根据单糖、三糖、寡糖及多糖等聚合的不同程度而拓展到了400 个以上[7]。唾液酸的数目、自身聚合方式以及空间结构排列顺序的多样化,致使糖脂和糖蛋白的结构多种多样,为发挥各自不同的生理功能奠定了基础[8]。唾液酸在细胞外膜、溶酶体膜以及糖蛋白(如血蛋白和黏蛋白)中具有较高的表达量[1],说明唾液酸能维持分子与细胞膜的稳定以及细胞与环境的平衡。此外,婴儿饮食中需要补充唾液酸以达到最佳的大脑发育[9];唾液酸能够改善仔猪和大鼠的记忆、学习能力及脑唾液酸含量[10]。
Neu5Gc 于常态下为白色结晶粉末,带有负电荷,与碱反应,易溶于水且微溶于甲醇,不溶于乙醚和石油。Neu5Gc 大多存在于碳水化合物中,具有广泛的生物学作用:(1)Neu5Gc 是许多糖蛋白及糖脂的基本组成部分;(2)Neu5Gc 能调节血蛋白半衰期、中和毒素以及粘附细胞;(3)Neu5Gc 位于糖侧链的非还原性末端,具有阴离子电荷,能发挥各种生理特异性作用[11-13]。Neu5Gc 既能掩盖抗原位点、受体,又能作为各种微生物和动物凝集素的配体,并且Neu5Gc 上的化学修饰能影响这些功能(特别是配体功能)[1]。Neu5Gc 存在于大多数后口动物的非神经组织和体液中,例如脊椎动物、棘皮动物[14],但不存在于正常人体组织中[15]。动物体内主要表达Neu5Ac 和Neu5Gc,Neu5Gc 大多数以双唾液酸或寡唾液酸链形式连接在神经节苷脂或糖蛋白末端,一般为α2-8 或α2-5 寡糖连接的有利于胚胎的早期发育和抗微生物感染的多聚体Neu5Gc[8,16]。其中,α2-8 连接的Neu5Gc 含有2 个~3 个唾液酸残基,在细胞黏附、分化、信号传导等过程中充当信使,并在特异性抗原表面表达[17]。例如,缺乏Neu5Gc 将会导致胰岛B 细胞功能障碍[18]。
1 Neu5Gc在人体内的代谢命运
1.1 人体无法自主合成Neu5Gc
除了膳食摄入的唾液酸,人类和其他哺乳动物都能利用糖酵解过程产物合成内源性唾液酸[15]。Neu5Ac是由胞质腔内的中性前体 N-乙酰甘露糖胺(Nacetylmannosamine,ManNAc)合成的[19]。ManNAc 的来源有两种途径,一种是由N-乙酰氨基葡萄糖(Nacetylglucosamine,GlcNAc)经过N-乙酰氨基葡萄糖-2-差向异构酶(N-acetylglucosamine 2-epimerase,GNE)直接催化形成[20];另一种是在N-乙酰葡萄糖胺激酶(N-acetylglucosamine kinase,GNK)、GNE 等一系列酶作用下实现了GlcNAc、二磷酸尿苷-N-乙酰氨基葡萄糖(uridine diphosphate-N-acetylglucosamine,UDP-GlcNAc)和ManNAc 之间的转化。GNE 同时具备二磷酸尿苷-N-乙酰氨基葡萄糖-2-差向异构酶和N-乙酰甘露糖胺激酶活性。GNE 的异构酶功能将UDP-GlcNAc 转化成ManNAc,其激酶活性使ManNAc磷酸化形成6-磷酸乙酰甘露糖胺,而后在N-乙酰神经氨酰酸合酶(N-acetylneuraminic acid phosphate synthase,NANS)的聚合作用下形成9-磷酸乙酰神经氨酸,再经 N-乙酰神经氨酰酸磷酸酶(Nacetylneuraminic acid phosphatase,NANP) 作 用 形 成Neu5Ac,以上都在胞浆中进行。随后Neu5Ac 在细胞核中活化成单磷酸胞苷-N-乙酰神经氨酸(cytidine monophospho-N-acetylneuraminic acid,CMP-Neu5Ac),最终由特定的转运蛋白泵入高尔基体。在高尔基体中,CMP-Neu5Ac 向内质网中新合成的糖脂和糖蛋白提供唾液酸供体,在唾液酸转移酶的作用下形成糖复合物,随后进入细胞表面或从细胞中分泌出来。溶酶体室也可以释放糖脂和糖蛋白中的唾液酸,然后被泵回细胞质,以重新利用产生细胞所需的糖复合物[1]。在非人类细胞中由于具有单磷酸胞苷-N-乙酰神经氨酸羟化酶(cytidine monophospho-N-acetylneuraminic acid hydroxylase,CMAH),从而在线粒体外膜上进行CMPNeu5Ac 向CMP-Neu5Gc 转化,而Neu5Gc 的后续命运与Neu5Ac 的循环和不同程度的重复利用相似[8]。
人类CMAH 基因缺失了一个外显子,这导致了开放阅读框被过早截断,CMP-Neu5Gc 羟化酶由此失活,所以人体不具有从Neu5Ac 合成Neu5Gc 的能力[15]。这种变异发生在我们与类人猿的最后一个共同祖先之后,并且是目前已知的最早的人类与类人猿基因差异之一。这就是大多数哺乳动物体内都含有Neu5Gc 而人类没有的原因。人类进化过程中,这类差别带来了人类有别于其他物种的转变。(1)与我们最近的进化亲属黑猩猩和大猩猩相比,人血细胞与血清蛋白缺乏Neu5Gc,并且积累了过量的Neu5Ac 前体[9]。(2)有研究指出在所有被研究动物的大脑中CMAH/Neu5Gc 的表达都被抑制了,包括那些在其他组织中CMAH/Neu5Gc 高表达的动物。由于人类谱系中Neu5Gc 的丢失可能早于人属的出现,因此Neu5Gc 的缺失在某种程度上促进了人类大脑的进化[1]。(3)与CD33 相关的免疫球蛋白样凝集素(siglecs)能与唾液酸选择性结合,Neu5Gc 的缺失导致这些抑制分子能更好地与Neu5Ac 结合[1]。再者,恶性疟原虫(Pf)与赖氏疟原虫(Pr)是很难区别的,但是黑猩猩对Pr 易感,对Pf 不易感,人类则相反[21]。这是因为疟原虫侵入机体与EBA-175 蛋白有关,而Pf EBA-175 选择识别Neu5Ac,Pr EBA-175 和红细胞的结合与其对Neu5Gc 的识别有关,这说明人类和黑猩猩的差异进化及疟疾易感性也与Neu5Gc 遗传的丢失有关[21]。
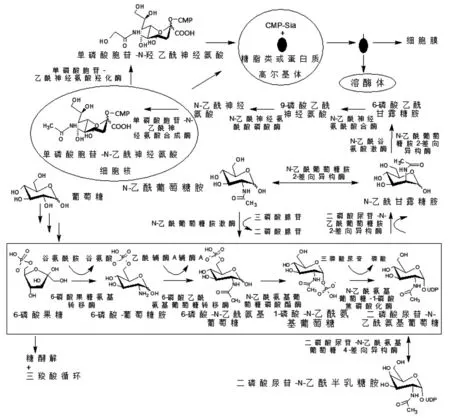
图1 N-乙酰甘露糖胺(ManNAc)合成途径Fig.1 The synthesis of N-acetylmannosamine(ManNAc)
研究人员使用CMAH 基因敲除小鼠做实验观察,此种基因工程小鼠体内的CMAH 基因被敲除,不表达Neu5Gc,这种状态下的小鼠与人体是相似的。饲喂CMAH 基因敲除小鼠不含Neu5Gc 的食物一段时间后,CMAH 基因敲除小鼠体内依然没有Neu5Gc 的表达。接着按时饲喂CMAH 基因敲除小鼠含Neu5Gc 的食物一段时间后,小鼠体内检测出Neu5Gc 及相应的anti-Neu5Gc 抗体,表明在哺乳动物体内不存在其他Neu5Gc 生物合成途径[22]。因此,人体不能自主合成Neu5Gc,只能合成Neu5Ac,人体中的Neu5Gc 只有可能是外源性的。
1.3 人体对外源性Neu5Gc 的吸收
虽然人体不能自主合成Neu5Gc,但通过Neu5Gc与单特异性抗体(αNeu5Gc IgY)的免疫反应试验发现它存在于人体脉管系统的内皮细胞、癌细胞、胎盘组织以及中空器官的上皮细胞中[23]。例如,在人类肿瘤中,聚糖形式的Neu5Gc 占有1%~3%[24]。与此同时,吃红肉和其他哺乳动物食品的人每天将会摄入Neu5Gc,所以Neu5Gc 是通过人体代谢而被吸收利用的。
外源性Neu5Gc能通过2 种潜在途经合并到人体细胞中。(1)细胞摄取的糖脂或糖蛋白进入溶酶体室后,释放Neu5Gc,在细胞质实现Neu5Gc 的再利用。Muriel Bardor 等用含Neu5Gc 的培养基培养人类上皮细胞,3 d 后检测,发现细胞中含有Neu5Gc。Neu5Gc 通过胞饮作用进入溶酶体内后,溶解糖蛋白和糖脂释放出Neu5Gc,并与相应受体结合进入到细胞液中[25]。(2)食物在肠道中分解产生的中性前体N-羟乙酰甘露糖胺(ManNGc)能通过被动扩散进入细胞,接着ManNGc转化为Neu5Gc[26]。这2 种途径都能有效地绕过人类的酶缺陷。
1.4 Neu5Gc的蓄积
Neu5Gc 能在人体中蓄积。细胞内唾液酸生物合成酶不能区分Neu5Gc 和Neu5Ac,外源性Neu5Gc 正是利用这种代谢“漏洞”对人体细胞的进行唾液酸化[27]。Nohle 等发现,给小鼠和大鼠喂食含放射性的游离态唾液酸基本上全部在尿液中检出,而放射性唾液酸糖蛋白则没有[28],但在它们释放的二氧化碳中出现了放射性信号,表明唾液酸糖蛋白被代谢了。Kalyan Banda 等通过CMAH 基因敲除小鼠模型探讨了Neu5Gc 糖蛋白以及游离Neu5Gc 胃肠道代谢机制[10]。游离Neu5Gc 被CMAH 基因敲除小鼠吸收后迅速进入血液循环,1 h~2 h 后随尿液排出。与此相反,Neu5Gc 糖蛋白可以进入小肠壁,在血液循环中稳定循环数小时,代谢合并到多个外周组织的糖蛋白和糖脂中,在肝脏、肾脏和小肠壁上均检测出了结合态的Neu5Gc,从而最终证明Neu5Gc 可以从食物中被吸收代谢并进入到人体内。因此,含有糖基连接的Neu5Gc 糖蛋白是人体组织积累的饮食来源,而不是游离的Neu5Gc。健康人群研究表明,在人类食用Neu5Gc 之后,游离的Neu5Gc 在进入人体4 h~6 h 之后就被吸收或排泄出体外,并且仅在人的唾液和面部毛发中被检测到少量的Neu5Gc。但是如果Neu5Gc 与糖蛋白或糖脂结合,就不容易被排泄出去,会在人体中不断地积累[22]。此外,相较于正常无明显疾病的人群来说,营养不良人群体内更容易蓄积Neu5Gc[29]。
2 Neu5Gc与红肉的安全性
2.1 红肉及其制品特异性致病观点
Neu5Gc 曾被认为是人类的一种癌胚抗原(carcino-embryonic antigen,CEA),仅在胎儿和某些人类肿瘤以及肿瘤细胞系中表达。其实,Neu5Gc 也存在于人体正常组织中的血管或靠近血管部位,但肿瘤中Neu5Gc 的表达量明显高于正常组织[30]。生长中的肿瘤具有高代谢,高度血管化、巨噬细胞增多等特点,这些恶性细胞与周围正常细胞相比,可能会占用更多的Neu5Gc。此外,缺氧能上调溶酶体中唾液酸转运体的基因表达,释放游离唾液酸进入细胞质[31]。
红肉及其制品对人体特异性致病[32]。2015年世界卫生组织下属的国际癌症研究机构将红肉列为较可能的致癌物,将加工肉制品列为致癌物。Youngyo Kim 等对16 份队列研究进行荟萃分析,得出结论:总肉(所有类型的肉)、红色和加工肉类的摄入与代谢综合征得病率呈正相关,而白肉的摄入与代谢综合征得病率呈负相关[33]。Zhanwei Zhao 等对Pub Med 和EMBASE 上2016年9月以来发表的论文进行了系统回顾与荟萃分析,发现食用红肉和加工肉类与直肠癌的患病风险无关,但与整体结直肠癌患病风险呈正相关[34]。短暂几个星期的摄入Neu5Gc,Neu5Gc 所引发的人体炎症反应能持续数年[35]。相对于白肉和植物食品,红肉中特异性含有Neu5Gc,这也是与红肉特异性相关的多种疾病的共同发病原因[36]。Neu5Gc 在红肉中的含量大小依次为:牛肉>猪肉>羊肉>兔肉[37],并在猪的肝脏、肾脏、脾脏等多个器官中高水平表达[38]。而在所有组织器官中,骨骼肌和脂肪组织中的Neu5Gc 浓度最低[39]。
2.2 Neu5Gc 能激发人体免疫应答反应
Neu5Gc 是一种独特的新型抗原,可以通过多种方式改变人体细胞表面。虽然它被细胞生化机制识别为“自我”,但它被免疫系统识别为“非自我”,因此成为了“外来自身抗原”[40]。在人静脉注射抗血清或者被蛇咬等情况发生后,会产生针对Neu5Gc 这一特异抗原的“血清病”(Hangananutziu-Deicher,HD) 抗体。含Neu5Gc 的生物大分子,如Neu5Gc 糖蛋白、糖脂和多糖都是HD 抗体的特异抗原。癌症和某些传染病患者以及感染了一种恶性疱疹病毒名为马雷克氏病(marek’s disease)的鸡体内也自发存在HD 抗体。随着Neu5Gc 在体内参与生物合成而不断积累,并在癌变的组织中高水平表达,Neu5Gc 被认为是癌细胞的分子标记之一[23]。虽然人体中的唾液酸生物合成酶不能清楚地区分Neu5Ac 和Neu5Gc,但是人体内的体液免疫系统却能区分[40],并且所有被测试的人体内都存在Neu5Gc特异性免疫球蛋白(Ig),其水平是变化波动的[25,40]。以唾液酸糖蛋白或神经节苷脂形式整合到细胞表面的Neu5Gc 可被人体产生的Neu5Gc 特异性抗体识别而发生免疫反应和慢性炎症,称为异种唾液酸炎(xenosialitis)[40],从而造成了与Neu5Gc 相关的疾病的发生。鸡同人类一样无法自主合成Neu5Gc,对于外源Neu5Gc 会产生免疫反应[41]。anti-Neu5Gc 抗体还能刺激K 细胞,诱导细胞毒性T 淋巴细胞的细胞杀伤性作用[25]。从这个角度分析,Neu5Gc 的抗体可以诱导肿瘤细胞凋亡,因此Neu5Gc 疫苗能成为肿瘤免疫的新途径[42]。
2.3 anti-Neu5Gc 抗体促进慢性炎症及癌症进程
人体内的anti-Neu5Gc 抗体是多克隆的,复杂的,在个体中可变且具有潜在表位,并且存在于所有健康人体内[43]。由于人体无法合成Neu5Gc,因此,人体获得Neu5Gc 的唯一途径是饮食[15]。婴儿体内从半岁开始出现anti-Neu5Gc 抗体,并在一岁时达到成人水平。这是由于牛奶配方奶粉和含有较多Neu5Gc 的牛肉、猪肉、羊肉等红色肉类的婴儿食品中引入了Neu5Gc,从而导致婴儿体内anti-Neu5Gc 抗体(IgG 与IgG)增加[44]。还有研究显示,Neu5Gc 摄入量小于8 mg/d 时,Neu5Gc 摄入量越高,anti-Neu5Gc 抗体浓度越大,红肉及奶制品的过多摄入会致使机体内的anti-Neu5Gc 抗体浓度提高[45]。
整合到人体细胞表面的Neu5Gc 将会引发人体特异性免疫反应(其他食肉哺乳动物无此免疫反应)和慢性炎症[36]。特异性免疫反应若发生在恶性组织中,不仅能引起慢性炎症,甚至能进一步促进抗体抗原反应[46]。在人体,红肉来源的Neu5Gc 被检测到在动脉粥样硬化斑覆盖的内皮细胞层表达[47]。anti-Neu5Gc 抗体结合后可导致内皮细胞的活化,选择素(selectin)的表达和细胞因子分泌的增加,从而说明红肉来源的Neu5Gc可以在血管内皮层引发唾液酸炎,加重动脉粥样硬化和心血管疾病,另外,Neu5Gc 引发的周身性炎症还能加重二型糖尿病、肌肉萎缩等疾病[36]。除此之外,Neu5Gc 在人类癌症[31]、动脉粥样硬化和大肠杆菌志贺氏毒素中的潜在病理作用也受到了重视[45]。这些研究表明,Neu5Gc 在大多数情况下通过与Neu5Gc 特异性Ig 相互作用而积极加剧这些疾病。因此,Neu5Gc 可能是红肉特异性相关的多种疾病的共同致病机理。
anti-Neu5Gc 抗体可以促进癌症进程[43]。现已证明了从正常人血清中纯化的anti-Neu5Gc 抗体可以特异性结合到人癌切片上。另外,正常人血清中的anti-Neu5Gc 抗体可以在体外培养的表达Neu5Gc 的人细胞上沉积补体[25]。尽管这种抗体的高水平表达可能造成细胞毒性,但Neu5Gc 和anti-Neu5Gc 抗体联合产生的弱炎症反应可能会有助于促进癌变或肿瘤进展[43]。慢性炎症可以刺激癌症的发生,约20%的恶性肿瘤来自于炎症[48]。Varki 实验室用CMAH 基因敲除小鼠模拟人体试验证实,饲料中添加的Neu5Gc 可以整合到小鼠体内[49],当注射或诱导产生Neu5Gc 抗体后,抗体抗原反应引发的炎症促进肝癌的发生[32]和B16 黑色素瘤细胞的生长[40]。因此,人们通过食用红肉,积累了外源性Neu5Gc 于体内,从而引发了抗原抗体反应,抗原抗体反应又通过促进慢性炎症来刺激癌症的发展,这就是Neu5Gc 特异性致癌的原因。值得注意的是,单独使用anti-Neu5Gc 抗体或anti-Neu5Gc 的表位抗体与红肉摄入量、冠心病或结直肠癌(colorectal cancer,CRC)风险无关。然而,当将所有Neu5Gc 糖蛋白的抗体反应合并时,与CRC 风险呈正相关。总IgG 抗体浓度较高的前四分之一个体的风险几乎是较低的后四分之一个体的3 倍[50]。
3 展望
大量的流行病学调查报告显示,红肉和加工肉制品的食用与直盲肠癌、食道癌、胃癌、肝癌、膀胱癌、动脉粥样硬化、二型糖尿病、年龄依赖性黄斑病变、类风湿性关节炎等疾病,甚至与人的寿命相关。这是因为红肉中的Neu5Gc 能引发人体免疫应答产生 anti-Neu5Gc 抗体,从而引起各种疾病及癌症。在肿瘤细胞中Neu5Gc 的含量明显比健康细胞中多,降低Neu5Gc的摄取量,不仅可以降低心血管等疾病的风险,而且可以降低肿瘤疾病的恶化。近年来,Neu5Gc 及其抗体在肿瘤检测和治疗方面应用越来越多,一是因为它是大多数内脏肿瘤的特异性标志物,二是因为Neu5Gc 及其产生的相应抗体有成为肿瘤生物治疗的潜质,抗Neu5Gc 的抗体能刺激CTL 的细胞杀伤性作用。更深入的研究则需要了解Neu5Gc 分别进入肿瘤细胞和健康细胞中途径的区别,从而为降低人体对Neu5Gc 的吸收途径提供参考。
