生、熟大黄对小鼠应激性胃溃疡药效比较
2019-04-10毛跟年赵倩倩
李 菡, 雷 婷, 毛跟年, 孔 阳, 赵倩倩, 夏 娟
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.广东医科大学附属医院 血液疾病研究室, 广东 湛江 524001)
0 引言
药材经炮制后使用是临床上中药使用的特色体现,通过炮制改变了药物的药性及活性成分的含量,产生新的临床疗效和生物活性[1].大黄,临床使用历史久远,始载于《神农本草经》,能攻下积滞、通腑泄热、清热解毒、通经止血等.现代研究证实,大黄及其活性成分可广泛用于保肝利胆、抑菌消炎、降血脂,抗氧化抗肿瘤等[2].大黄也是著名的“生熟异治”临床使用中药,最早在东汉张仲景所著的《金匮玉函经》就提出“……皆去黑皮、或炮或生……”的生熟大黄概念.临床使用中,生大黄常用于攻积导滞、通泻热毒,酒蒸后的熟大黄毒性作用降低,常用于活血化瘀[3].
在现代资料研究中,多比较生大黄与熟大黄的化学成分或泻下、解热、抗炎等作用,如隋峰等[4]提出生大黄比熟大黄的解热作用更显著,Wang等[5]通过超高效液相色谱联合离子阱—飞行时间质谱分析方法(UFLC/MS-IT-TOF)比较不同炮制品大黄中化学成分变化,证实与生大黄相比,熟大黄通过水蒸减少了蒽醌苷含量而消弱了泻下作用.在大鼠热结血瘀模型中,熟大黄相较于生大黄显示出更显著的药效作用[6].临床上已有将大黄运用于治疗应激性胃黏膜病变,但对于两种炮制品大黄对应激性胃溃疡的作用比较未见相关研究.
严重性应激易诱发胃肠粘膜损伤,出现出血、溃疡、穿孔等症状,其主要原因与胃酸分泌过多、黏膜内血流量减少和防御机能减弱有关[7].有研究发现,大黄作用于重症患者并发消化道出血时,具有保护胃肠黏膜的作用[8],对脑损伤病人诱发的应激性胃肠道出血、消化道粘膜病变有明显治疗作用,但具体机制未知.中华古方大柴胡汤是中医药领域防止应激性胃溃疡的经典方剂之一,其中大黄药效明显[9].大黄提取液能降低运动应激性胃溃疡大鼠的溃疡指数,作用机制可能与促进前列环素(PGI2)的合成和释放,减轻缩血管作用有关[10].
为比较生熟大黄对胃溃疡的作用情况及初步解析其作用机制,本实验通过观察不同剂量生大黄与熟大黄对水浸束缚应激法导致的应激性胃溃疡小鼠胃黏膜溃疡指数、胃酸pH及血浆中丙二醛( malondialdehyde,MDA)、超氧化物歧化酶( superoxide dismutase,SOD)、一氧化氮(nitrogen,NO)和内皮素-1(endothelin-1 ,ET-1)的影响,初步考察不同炮制品大黄对应激引起的胃溃疡的治疗作用及治疗机制,为更优的发挥不同炮制品疗效,规范临床使用提供理论数据.
1 材料与方法
1.1 材料
1.1.1 实验动物
健康雄性昆明小鼠,体重18~20 g,由西安交通大学医学院实验动物中心提供,动物许可证号 SCXK( 陕)2013-0004.实验动物置于室温(20±2)℃ ,相对湿度50%~60%的环境中,每笼6只,自由饮水摄食,适应实验环境5天后开始实验.
1.1.2 实验药品及试剂
(1) 药品:大黄购于西安市中医医院,经陕西科技大学药学系毛跟年教授鉴定为蓼科植物掌叶大黄Rheum palmatum L.的干燥根及根茎,符合2015年版《中国药典》规定.所用生大黄炮制工艺: 刮去外皮,切厚片或块,60℃烘干. 熟大黄的炮制工艺[3]:生大黄切片,黄酒拌匀后闷3 h至润透,等黄酒被完全吸收,放入高压蒸锅内120 ℃蒸5 h至内外均为焦黑色,晾干待用.奥美拉唑肠溶胶囊(北京悦康药业集团有限公司,批号14351155).
(2) 试剂:黄酒(浙江绍兴鉴湖酿酒有限公司,批号20161225,酒精度≥14%),BCA蛋白定量试剂盒,超氧化物歧化酶 ( SOD)测试盒,一氧化氮(NO)测试盒,丙二醛(MDA)测试盒(南京建成生物工程研究所,批号分别为20160928,20170502,20170429,20170424).小鼠内皮素-1( ET-1)Elisa试剂盒(尚柏生物医学技术有限公司,批号20170513),水为娃哈哈纯净水,其余试剂均为市售分析纯.
1.1.3 仪器
YP802N型电子分析天平(上海精密科学仪器有限公司) ,YF-111B型高速中药粉碎机(瑞安市永历制药机械有限公司),LMQ.C-50E型新华医疗全自动高压灭菌锅(山东新华医疗器械股份有限公司),varioskan flash型全波长扫描式多功能读数仪(芬兰Thermo Scientific科技有限公司),PHS-3C型精密pH计(深圳市同奥科技有限公司) ,TG16-WS型台式高速离心机(湖南湘仪实验室仪器开发有限公司) ,DM2500M型正置显微镜(德国徕卡Leica仪器有限公司),IKARV 10型旋转蒸发仪(广州艾卡仪器设备有限公司).
1.2 方法
1.2.1 生大黄与熟大黄水提物制备
分别将生大黄与熟大黄粉碎为粗粉,用10倍水浸泡2 h,煎煮2次,每次10 min,过滤,合并滤液.用旋转蒸发仪60 ℃,0.083 MPa 减压浓缩成浸膏,灭菌,制成含生药1 g·mL-1,即得生大黄与熟大黄水提药液(生大黄浸膏含大黄素0.102 mg·g-1,熟大黄水提物含大黄素0.116 mg·g-1),4 ℃冰箱保存备用.
临床用大黄以3~15 g·d-1的使用剂量,按人与小鼠体表面积体重比换算选取用药剂量0.78 g·kg-1和3.12 g·kg-1.
1.2.2 小鼠急性胃溃疡模型建立
治疗组灌胃给药,每天1次,连续7天,正常及模型对照组均灌服水溶液.第7天灌胃后,将小鼠给水不给食24 h. 第8天,将模型组及治疗组小鼠捆绑束缚浸入恒温水浴箱中,液面到小鼠剑突下,水温调节在(20±2) ℃,浸泡15 h后,取材检测.
1.2.3 动物分组与给药
(20±2) g小鼠经适应性喂养5天,随机分成7组,每组8只,分别为正常对照组(NC)、模型组(MO)、阳性药奥美拉唑组(20.0 mg·kg-1,AO)、生大黄低剂量组(7.8 g·kg-1,RL),生大黄高剂量组(15.6 g·kg-1,RH),熟大黄低剂量组(7.8 g·kg-1,SL), 熟大黄高剂量组(15.6 g·kg-1,SH),给药剂量为10 mL·kg-1.
1.2.4 胃溃疡相关指数检测
剖取全胃组织,沿胃大弯处剪一小口,小心挤出胃内容物于离心管中,收集胃液,称量体积,用上清液测定 pH值.
取胃组织,沿胃大弯剪开,去除食糜,冰生理盐水缓慢冲洗胃内容物,溃疡指数( Ulcer index,UI)用游标卡尺测定,首先观察溃疡灶个数,然后分别测出溃疡的长径和宽径,将两者相乘求其总和作为UI.
溃疡抑制百分率计算公式为:
溃疡抑制百分率(%)=(模型组胃溃疡指数-给药组胃溃疡指数) /模型组胃溃疡指数×100%.
取各组动物胃组织相同位置,中性福尔马林固定48 h,石蜡包埋切片,厚度统一为4μm ,经脱蜡,苏木精-伊红(HE) 染色,光学显微镜观察组织学变化.
1.2.5 血清指标检测
摘眼球取血,血液4 ℃冰箱静置1 h,4℃ 3 500 r·min-1离心10 min,收集上清液保存于-20 ℃冰箱备用.按试剂盒介绍的方法测定血液中ET-1、 MDA 、NO含量和SOD活性.
1.2.6 统计学处理
所有数据以均数±标准差(x±s)表示.组间差异比较用ANOVA比较t检验分析,由 SPSS 21.0 统计软件完成.P< 0.05 表示差异有统计学意义.
2 结果与讨论
2.1 生大黄与熟大黄对小鼠胃黏膜溃疡指数(UI)及溃疡抑制率影响
对束缚-水浸法所致应激性胃溃疡小鼠的胃组织肉眼观察,与正常对照组相比,模型组小鼠多处有大小不等的出血点,集中于腺胃部,边界清晰,无穿孔发生,溃疡指数显著增高(P<0.01);与模型组相比,生大黄高剂量组溃疡指数降低(P<0.05),熟大黄高剂量组和阳性药组溃疡指数明显降低(P<0.01).如表1所示,生大黄与熟大黄均对应急性胃溃疡小鼠的溃疡有抑制作用,相同剂量下,熟大黄的作用更显著.
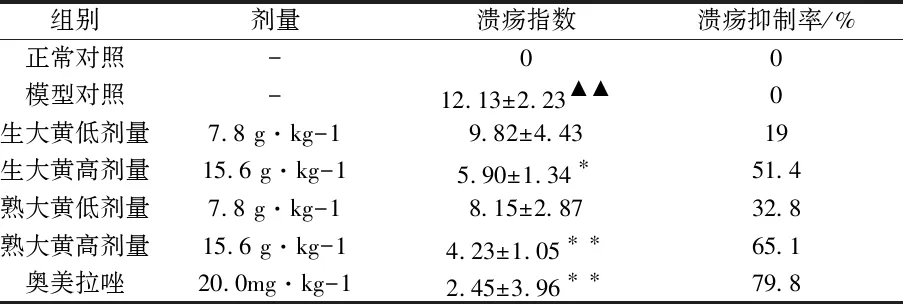
表1 生大黄与熟大黄对小鼠急性胃溃疡溃疡 指数的影响(x±s,n=6)
注:与正常组比较,▲▲P<0.01;与模型组相比,*P<0.05,**P<0.01
2.2 生大黄与熟大黄对小鼠胃黏膜组织形态学的影响
组织病理学结果表明,正常对照组:胃黏膜层光滑完整,上皮细胞排列整齐,未见毛血管扩张充血和炎性细胞浸润. 模型对照组: 胃黏膜上皮明显破损,局部腺体结构紊乱,腺腔内有较多脱落的上皮细胞碎片和炎症细胞浸润,部分壁细胞肿大. 生大黄低剂量组:胃黏膜上皮破损较严重,腺腔内偶见脱落细胞,溃疡破坏黏膜下层,并有炎症细胞浸润. 生大黄高剂量组: 胃黏膜轻度缺损,腺体排布整齐,有少部分炎症浸润.损伤较模型组明显减轻,腺体排列较整齐.熟大黄低剂量组: 胃粘膜轻度缺损,腺体排列较整齐,有少部分炎症细胞浸润. 熟大黄高剂量组:胃黏膜保持完整性,腺体排列较整齐,受损部位表浅且范围较小,偶见表层小片状脱落上皮,浸润炎细胞较少(见图1). 从病理结果看生大黄与熟大黄对小鼠胃黏膜损伤和炎症细胞浸润均有不同程度的缓解.

(a)正常对照组 (b)模型对照组 (c)生大黄低剂量组

(d)生大黄高剂量组 (e)熟大黄低剂量组 (f)熟大黄高剂量组
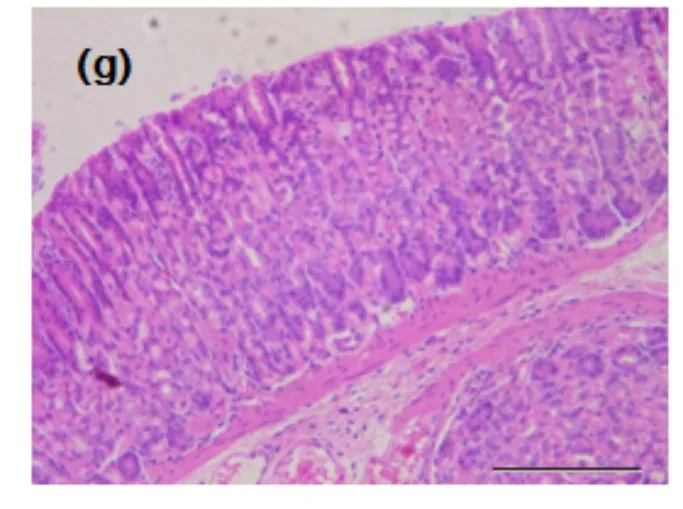
(g)阳性药组图1 生大黄与熟大黄对小鼠胃黏膜组织 病理变化的影响(HE,×200)
2.3 生大黄与熟大黄对小鼠胃液量及胃液pH的影响
胃酸是导致胃黏膜损伤的主要因素之一[11],研究证实,阻断胃酸分泌的实验性胃溃疡大鼠和临床胃溃疡病人,溃疡愈合率均较高[9].因此本研究测定了生大黄与熟大黄高、低剂量组对急性胃溃疡小鼠胃酸量、胃酸pH的影响,如图2所示.与正常对照组相比,模型组胃液量相对增加,胃液pH明显降低(P<0.05).与模型组相比,生大黄高剂量组、熟大黄低剂量组和熟大黄高剂量组能显著增加胃液pH(P<0.05),证实给予生大黄与熟大黄均能显著改善急性胃溃疡小鼠胃液过酸的症状,起到保护作用,与临床观察到的大黄显著提高胃肠功能衰竭患者胃肠粘膜组织的pH值,保护胃肠黏膜相一致[5].相同剂量下,熟大黄的保护作用更明显.
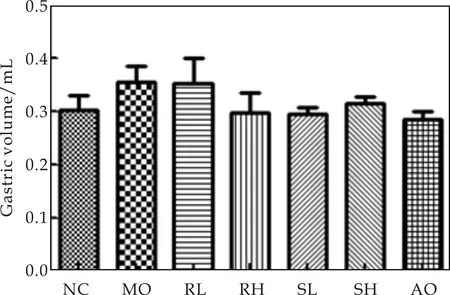
(a)胃液体积
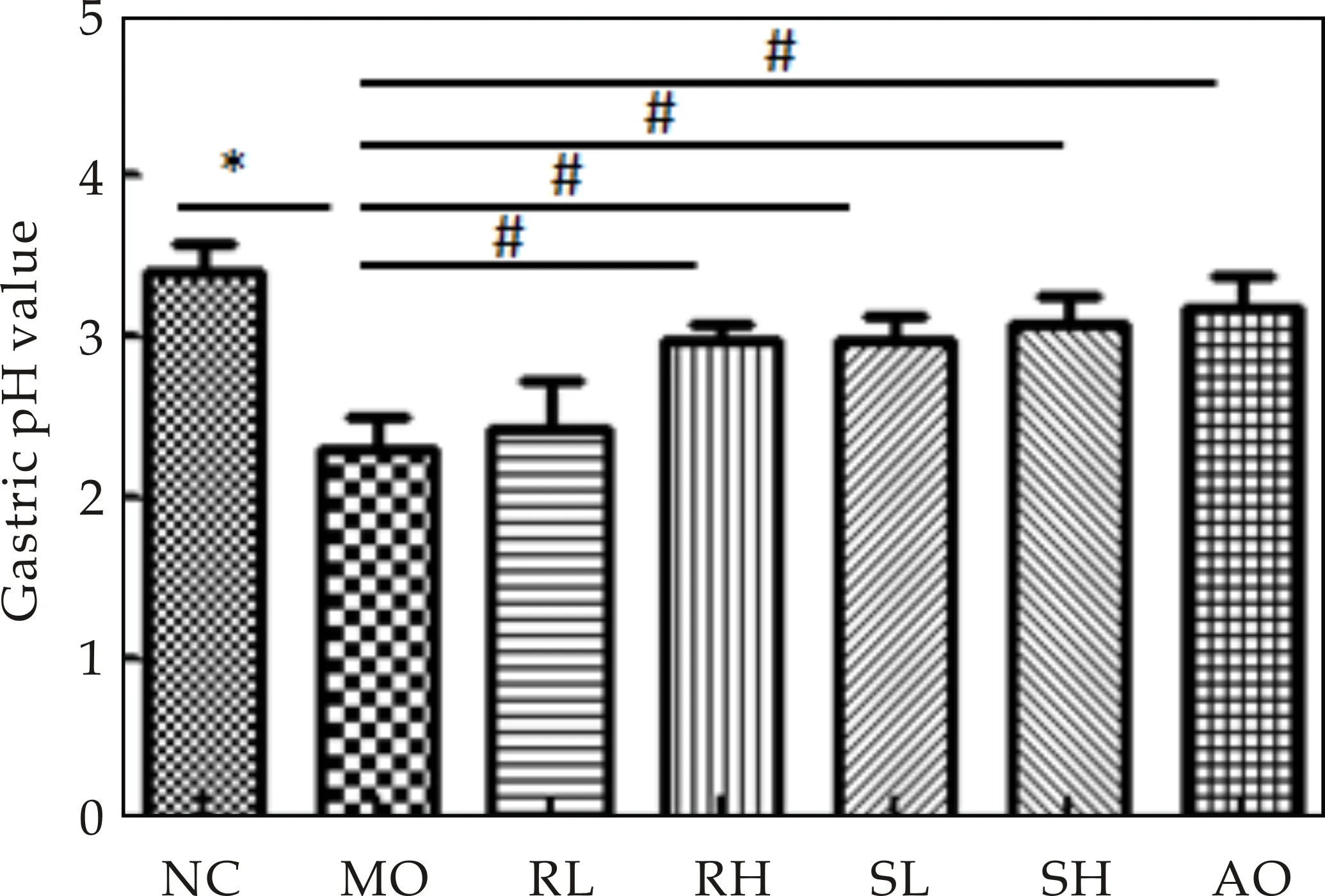
(b)胃液pH图2 生大黄与熟大黄对小鼠胃液量和胃酸pH 的影响((x±s,n=6);*P<0.05;#P<0.05)
2.4 生大黄与熟大黄对急性胃溃疡药效作用机制分析
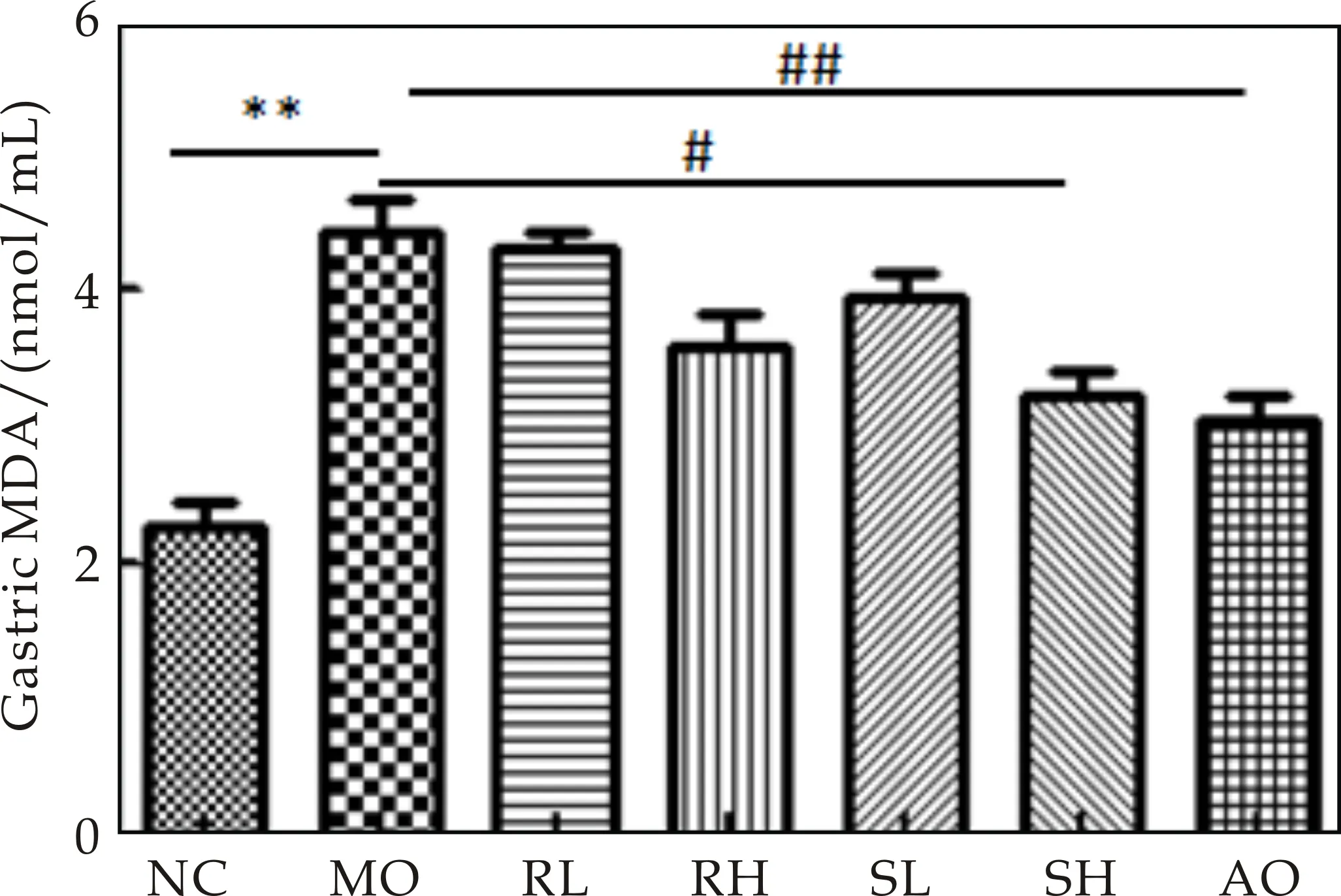
氧自由基介入了绝大部分致溃疡因子的损伤过程,可能与脂质过氧化损害及共价键结合性损伤有关[12].胃粘膜攻击因子之一的MDA和胃粘膜保护因子之一的SOD的表达情况指示了组织中清除氧自由基的能力或受自由基损伤程度的平衡偏移情况.本实验中检测了生大黄和熟大黄不同剂量组对应激性胃溃疡小鼠血清中氧化应激相关指标SOD及MDA表达的影响,结果如图3所示.对比正常对照组,应激性胃溃疡小鼠血清中SOD水平明显升高,MDA水平明显降低.给予作用药物后,对比模型对照组,熟大黄高剂量组血清中SOD水平明显升高(均P<0.05),熟大黄高剂量组血清中MDA水平明显降低(P<0.05),表明生大黄与熟大黄治疗急性胃溃疡的机制可能是通过降低氧自由基的反应而抑制胃溃疡的产生和促进溃疡愈合.
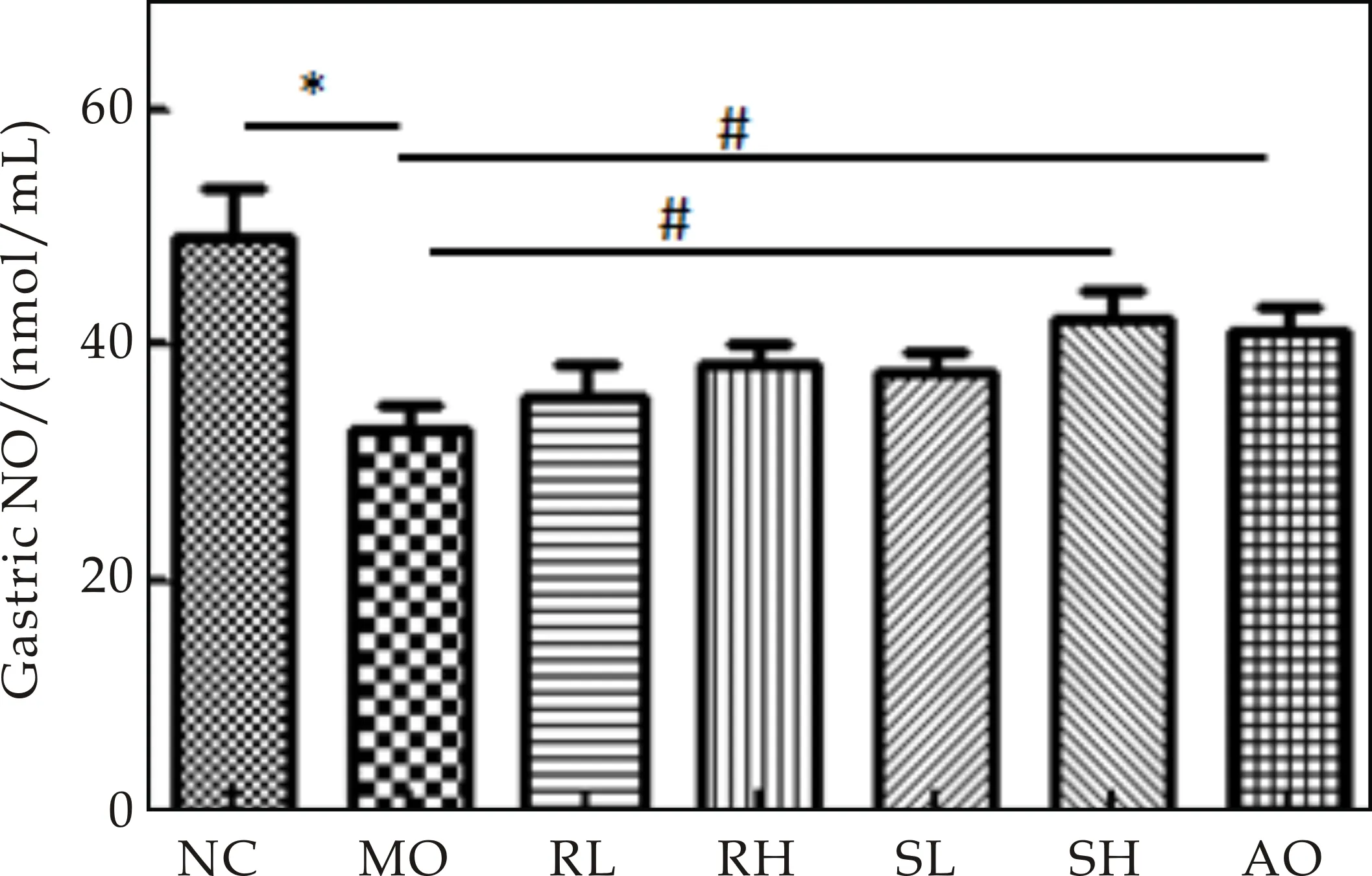
NO是一种内源性血管舒张因子,可促进胃、小肠黏膜的血管扩张,改变血管通透性,对维持上皮完整性和微血管屏障功能有重要作用[13].ET-1是一种已知的、最强的内源性血管收缩因子,可以通过作用于靶细胞上特异性受体,升高细胞内 Ca2+浓度,起到强烈收缩血管的作用[14].作为主要的血管收缩因子和舒张因子,两者表达的动态平衡对调节血管张力、维持黏膜局部血流量具有关键性作用.如图3所知,应激性胃溃疡小鼠血清中ET-1水平明显升高,NO水平明显降低.而熟大黄高剂量组NO水平明显升高(均P<0.05),生大黄高剂量组和熟大黄低剂量及高剂量组血清中ET-1水平明显降低(均P<0.05).表明大黄可通过增加胃粘膜血流改善胃黏膜受损状态,而发挥抗溃疡作用,结果与临床报道的给予危重病患者大黄预防性治疗后,应激性胃肠粘膜病变拌出血发生率明显降低相一致[11].对比同等剂量的生大黄组,熟大黄组变化趋势更明显,表明熟大黄治疗的小鼠胃黏膜受损改善状态要好于生大黄组.

(a)SOD
(b)MDA
(c)NO
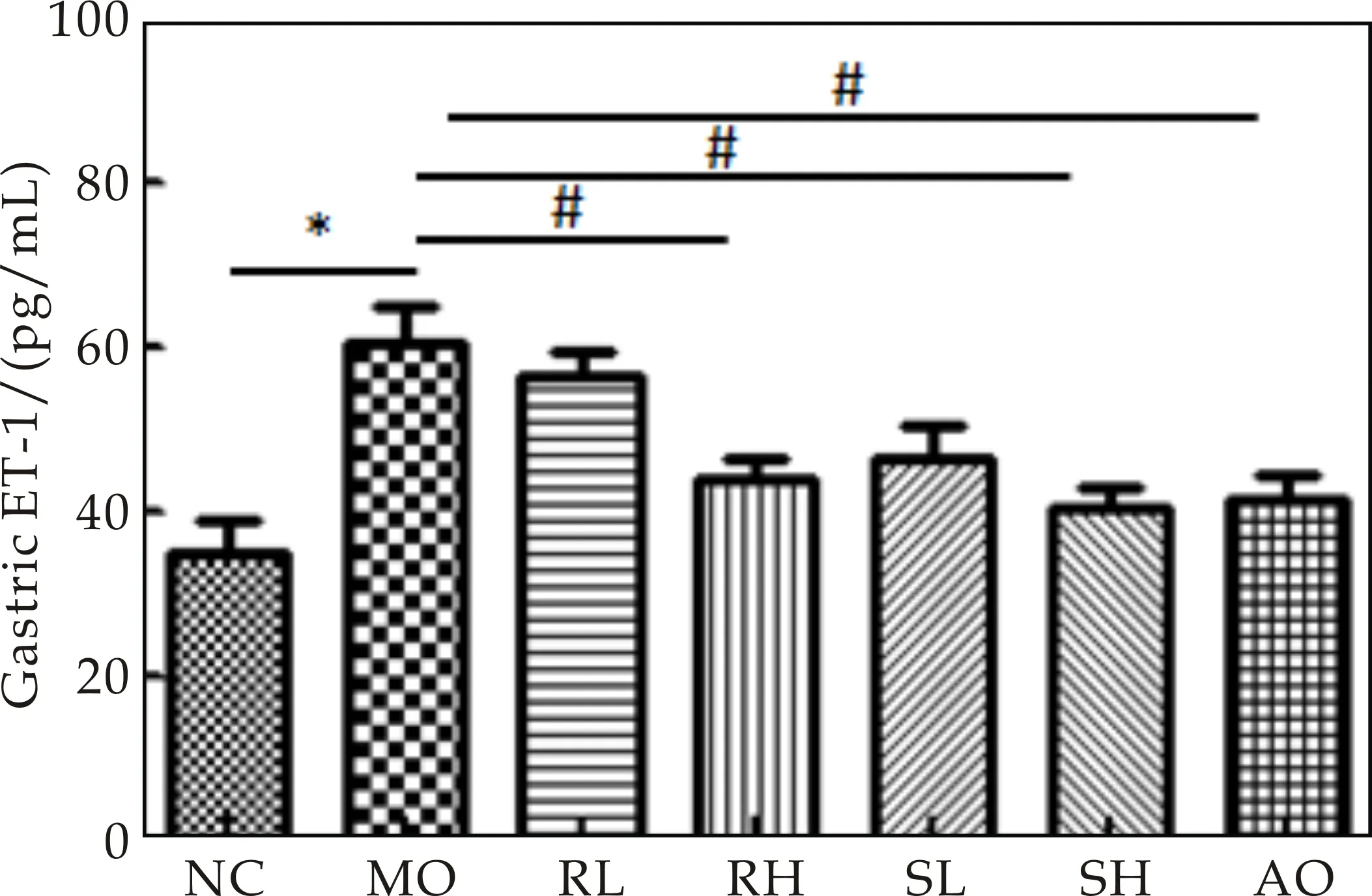
(d)ET-1图3 生大黄与熟大黄对急性胃溃疡模型小鼠 血液中SOD、MDA、NO和ET-1的影响 ((x±s,n=6);*P<0.05,**P<0.01; #P<0.05,##P<0.05)
3 结论
综上所述,生大黄与熟大黄能通过升高抗氧化因子SOD活性和NO水平,降低脂质过氧化物MDA及损伤因子ET-1表达,促进氧自由基清除,抑制胃酸分泌,加速溃疡愈合,从而保护受损的胃黏膜组织.相同剂量下,熟大黄对应急性胃溃疡小鼠血浆中SOD、MDA、NO和ET-1的影响更显著,加之有研究证实炮制得到的熟大黄减弱了大黄的毒性[15],因此熟大黄在胃溃疡疾病中具有更高的治疗价值.本研究着眼于临床常见病症应激性胃溃疡,对生熟大黄的药效作用及作用机制进行研究,明确熟大黄在治疗应激性胃溃疡中的更优疗效,为进一步规范临床中大黄使用和加深对“生熟异用” “生熟有别”理论的认识提供理论数据.对于何种化学成分变化引起生熟大黄在治疗急性胃溃疡的药效差异,以及大黄临床治疗胃溃疡的质量指标还有待研究.
