陕西茯砖茶中优势Eurotium属孢子形态学分析及其分子鉴定
2019-04-10吕嘉枥孟雁南
吕嘉枥, 雷 晟, 孟雁南
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
茯砖茶属于中国的传统发酵黑茶,是以黑毛茶为原料,经过汽蒸、渥堆、发花、干燥、包装等一系列复杂工艺精制而成,其中发花是最为关键的工艺[1].其关键技术是微生物以茶叶为培养基的固态发酵过程,通过提供一定的温度和湿度环境,促进有益微生物——“金花菌”的生长繁殖,以在茯砖茶中产生大量的肉眼可见的金黄色颗粒,俗称“金花菌”.该菌群是茯砖茶发酵的优势菌群,对促进茯砖茶品质的形成和功能性具有极其重要的作用[2].近年来对于茯砖茶中微生物的研究,一方面主要集中在成品茯砖茶优势微生物的分离鉴定方面;另一方面则是茯砖茶在发花过程中微生物的研究.研究发现茯砖茶“发花”工艺及其品质形成是由多种微生物共同参与发酵的[3],有茶叶表面存在的微生物,也有后期在加工过程中自然生长的,而“金花菌”是茯砖茶中的优势菌群.资料已记载的种群有Eurotiumamstelodami、Eurotiumchevalieri、Eurotiumrepens、Eurotiumcostiforme、Eurotiumrubrum、Eurotiumherbariorum、Eurotiumcristatum、Eurotiuminetrmeidum等[4-15].随着分子生物学的发展,新的鉴定技术在食品微生物菌群组成方面的研究发挥着重要的作用[16-20].为了阐明起源于陕西泾阳的茯砖茶中优势菌群Eurotium属的种群关系,本文选取从陕西茯茶产区采集的10种不同品牌茶样品中分离纯化的7株优势Eurotium属的金花菌群,通过光学显微镜和扫描电子显微镜对其孢子进行形态学分析,并与18S rDNA序列分析结合,确定其种属关系,为Eurotium属的菌群鉴定提供参考,同时为陕西茯砖茶中不同地域标志性优势菌群的鉴定提供依据.
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
试验菌株由陕西科技大学食品与生物工程学院微生物室提供,该菌株是从陕西茯茶产区采集的10种不同品牌茶样品中分离纯化的7株优势金花菌群,经ITS序列鉴定均为Eurotium属,编号分别为E1、E2、E3、E4、E5、E6、E7.
1.1.2 主要培养基成分
(1)察氏培养基(CZ):蔗糖40 g,NaNO33 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO40.01g,琼脂20 g,水1 000 mL.
(2)40%蔗糖察氏培养基(CZ40):蔗糖400 g,NaNO33 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO40.01g,琼脂20 g,水1 000 mL.
(3)改良察氏培养基(CZG):蔗糖40 g,硝酸铵3 g,K2HPO41 g,MgSO4·7H2O 0.5 g,NaCl 50 g,蒸馏水1 000 mL,pH 6.8±0.2,121 ℃灭菌15 min.
(4)20%蔗糖改良察氏培养基(CZG20):蔗糖200 g,硝酸铵3 g,K2HPO41 g,MgSO4·7H2O 0.5 g,NaCl 50 g,蒸馏水1 000 mL.
(5)40%蔗糖改良察氏培养基(CZG40):蔗糖400 g,硝酸铵3 g,K2HPO41 g,MgSO4·7H2O 0.5 g,NaCl 50 g,蒸馏水1 000 mL.
(6)马铃薯葡萄糖琼脂培养基(PDA):马铃薯葡萄糖琼脂培养基(PDA):马铃薯 200 g,葡萄糖 20 g,琼脂 15~20 g,蒸馏水1 000 mL.其做法是先将马铃薯洗净去皮后称取200 g,切成小块,加水煮烂(煮沸约20~30 min),用八层纱布过滤,加热,再添加15~20 g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入20 g葡萄糖,搅拌均匀,稍冷却后再补足水分至1 000 mL,pH自然,分装、加塞、包扎、灭菌,备用.
以上培养基灭菌条件均为 121 ℃、15 min.
1.1.3 试剂药品
DNA提取试剂盒和琼脂糖凝胶回收试剂盒:北京擎科新业生物技术有限公司;
18SrDNA通用引物:北京奥维森基因科技有限公司;
NS1:5′-GTAGTCATATGCTTGTCTC-3′;
NS4:5′-CTTCCGTCAATTCCTTTAAG-3′;
AxyPrepDNA凝胶回收试剂盒:AXYGEN公司;
2×Taq PCR MasterMix(含绿染料):Biomed.
其他生化试剂均为国产分析纯.
1.1.4 仪器与设备
扫描电镜(PHENOM-PRO,上海飞纳科学仪器有限公司);离子溅射仪(SBC-12型,北京中科科仪股份有限公司);测序仪(3730XL, Applied Biosystems);PCR仪(2720 thermal cycler型,Applied Biosystems);板式离心机(5810R型,Eppendorf);凝胶成像装置(JY04S-3C,北京君意东方电泳设备有限公司);电泳仪(JY300C Power Supply,北京君意东方电泳设备有限公司).
1.2 试验方法
1.2.1 7株菌产孢构造的显微观察
(1)光学显微镜观察:将7株菌分别以插片法接种于CZ、CZ40、CZG、CZG20、CZG40、PDA培养基中,28℃培养7天后,将盖玻片的一面用无菌棉球擦拭干净,另一面滴入石碳酸棉兰染色液,观察菌株的有性和无性产孢构造特征.
(2)扫描电镜观察:分别取少许7株的菌体,置于2.5%戊二醛溶液中固定2 h以上;磷酸缓冲液清洗3次(20 min/次);置于饿酸中固定2 h;磷酸缓冲液清洗3次(20 min/次);用乙醇(浓度依次为30%、50%、70%、80%、90%、100%)洗脱三次(20 min/次);置于真空冷冻干燥机中干燥、喷金,扫描电子显微镜观察菌体的闭囊壳、子囊、子囊孢子、分生孢子、分生孢子头、分生孢子梗等有性和无性产孢构造特征.
1.2.2 7株菌的18S rDNA序列测定
(1)基因扩增及测序:采用通用引物NS1和NS4扩增E1、E2、E3、E4、E5、E6、E7的18s rDNA区基因序列,同时以dH2O做负对照.扩增条件为94 ℃预变性10 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,循环30次,最后72 ℃延伸10 min后得PCR产物,扩增成功的PCR产物,用琼脂糖凝胶回收试剂盒回收,并进行测序.
(2)序列比对及系统发育树构建:测序结果提交GenBank数据库并通过Blast检索,获得与目的基因片段同源性最高的18S rDNA基因序列,用MEGA 5.0构建系统发育树,以自展法(Bootstrap)进行检验,重复1 000次.
2 结果与讨论
2.1 7株菌的有性孢子形态学分析
通过7株菌的有性孢子形态学的扫描电镜观察结果表明,7株菌的有性孢子均为子囊孢子,子囊果为闭囊壳,闭囊壳内有大量子囊,每个子囊内有8个子囊孢子,但7株菌的产孢构造有所不同,如下述和图1所示.
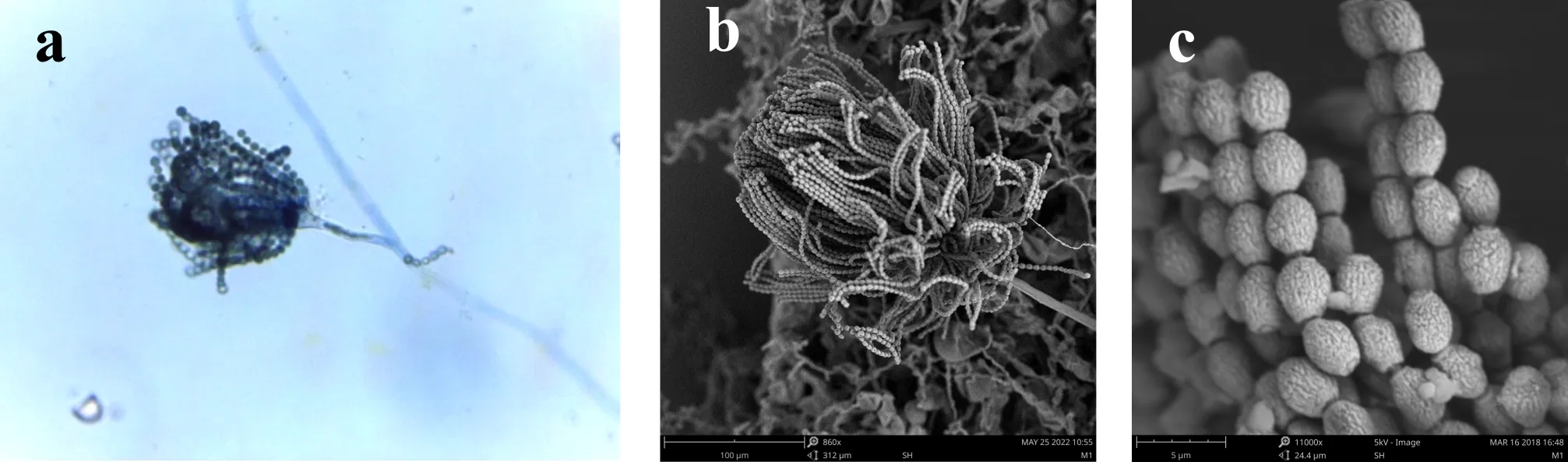
E1闭囊壳结构由絮状菌丝所包围,球形,100~170μm,子囊近球形,7~12μm,子囊内含8个子囊孢子,子囊孢子呈双凸镜形,2.8~4.4μm×4~5μm,凸面较为平整,具少量小疣,赤道沟宽浅且明显,宽约为1.2μm,边缘整齐卷曲,子囊孢子外周和赤道脊部位有排列整齐的小孔.
E2子囊果球形或近球形,黄色,处于具饰菌丝网中,70~200μm,内部包裹着具拟薄壁组织的子囊,球形至近球形,6~10μm,子囊内含8个子囊孢子,子囊孢子双凸镜形,凸面粗糙具小疣,孢子大小4~5μm×5~6μm,具两个明显的纵向鸡冠状突起,宽约0.8~1μm,边缘不整,较为卷曲.
E3闭囊壳为球形或近球形,100~180μm(240μm),子囊球形,9~11μm,子囊孢子双凸镜形,有明显的纵向鸡冠状突起,孢子大小4~5μm×5~6μm,凸面粗糙,具尖疣,赤道沟明显,较浅,边缘稍卷曲,宽约0.6μm.
E4闭囊壳球形,85~160μm,子囊近球形,9~11μm,子囊孢子呈两瓣状,4~5.2μm×4.5~5.6μm,赤道部分具两个明显的、有时稍弯曲的鸡冠状突起,孢子呈凸透镜状,凸面粗糙具小疣,赤道沟约0.6μm,附近有排列整齐的小孔.
E5闭囊壳球形或近球形,直径80~201μm,裸露,黄色,子囊近球形,7~9μm,子囊孢子呈双凸镜形,3.5~4.5μm×4~5μm,孢子两瓣中间具沟,宽约1.2μm,边缘较为整齐卷曲,凸面较为粗糙,边缘和赤道沟内部具有排列整齐的小孔.
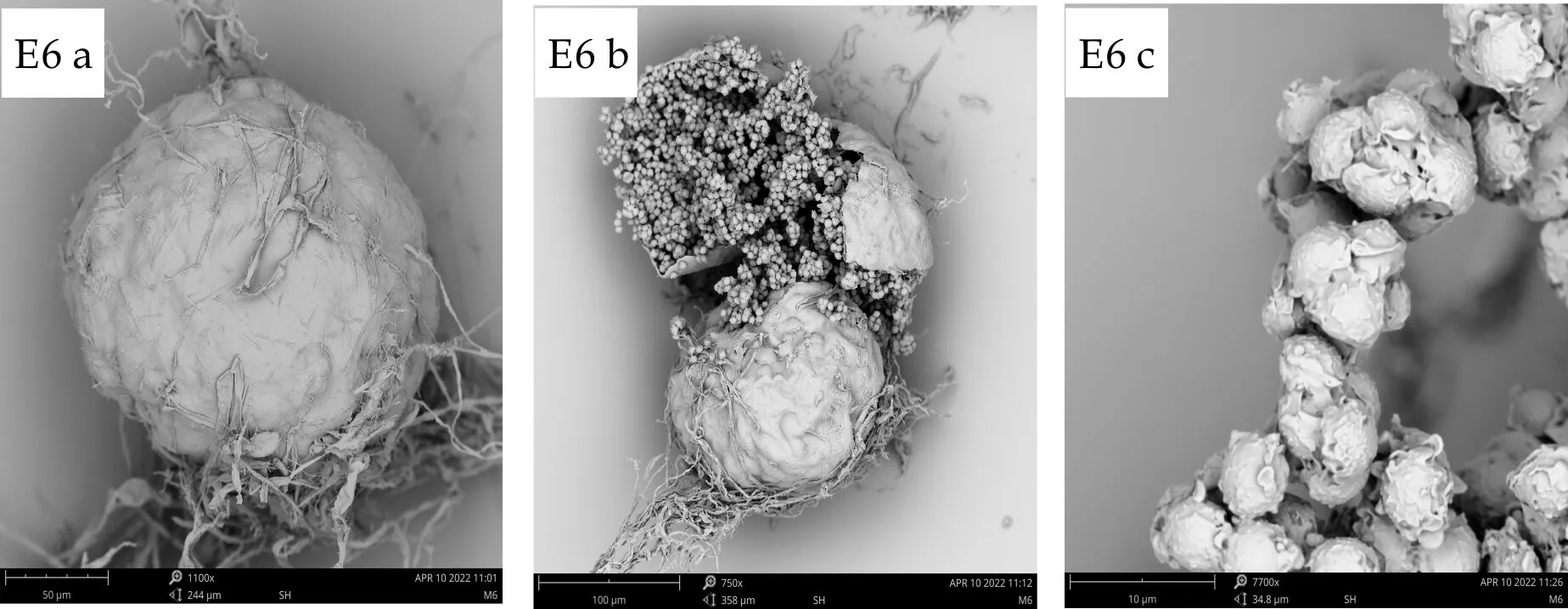
E6闭囊壳球形或近球形,100~150μm,闭囊壳裸露,子囊球形或近球形,7~10μm,内部包裹着8个子囊孢子,子囊孢子双凸镜形,4.5~5μm×5~6μm,有两个明显的“赤道”冠,宽约0.6μm,边缘不整,凸面有不规则网结状的肋状突起.
E7闭囊壳由菌丝缠绕形成,为球形或近球形,100~180μm,黄色,子囊球形,或近球形,8~11μm,子囊孢子双凸镜形,5~5.8μm×5.3~6.4μm,具两个明显的赤道冠,宽约0.6μm,凸面粗糙具小疣.

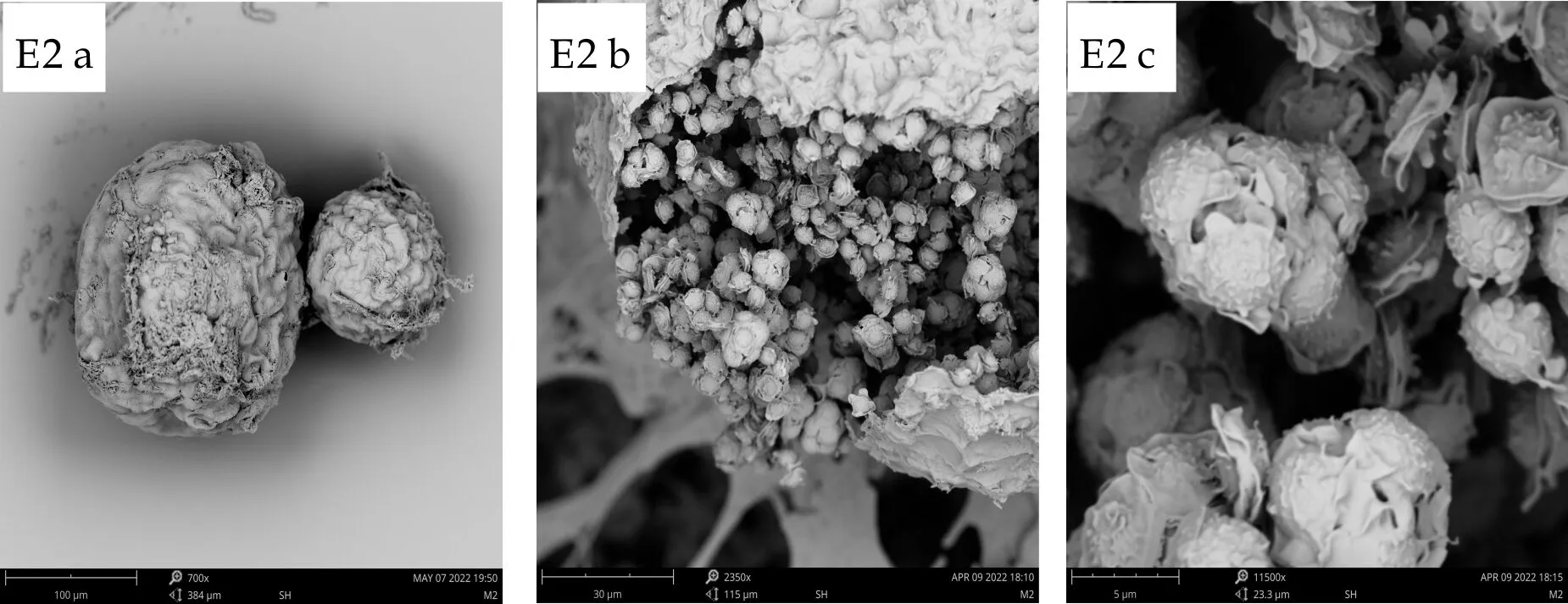
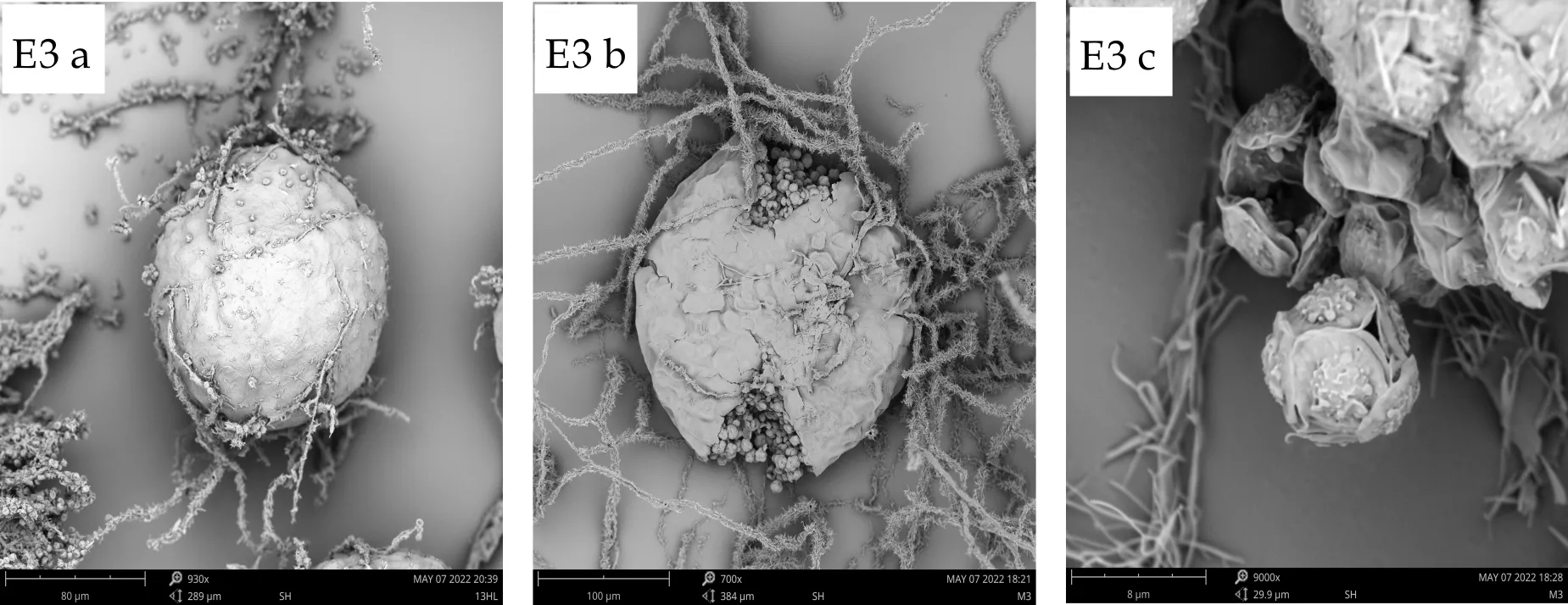
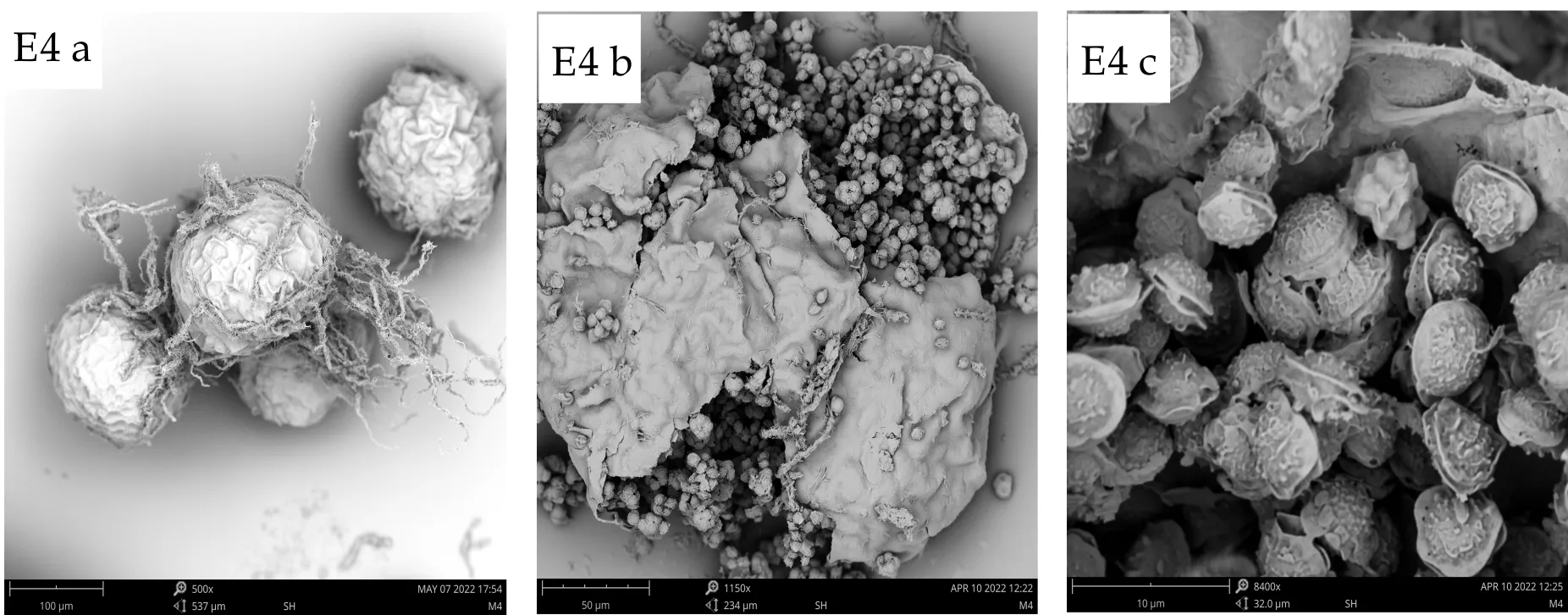
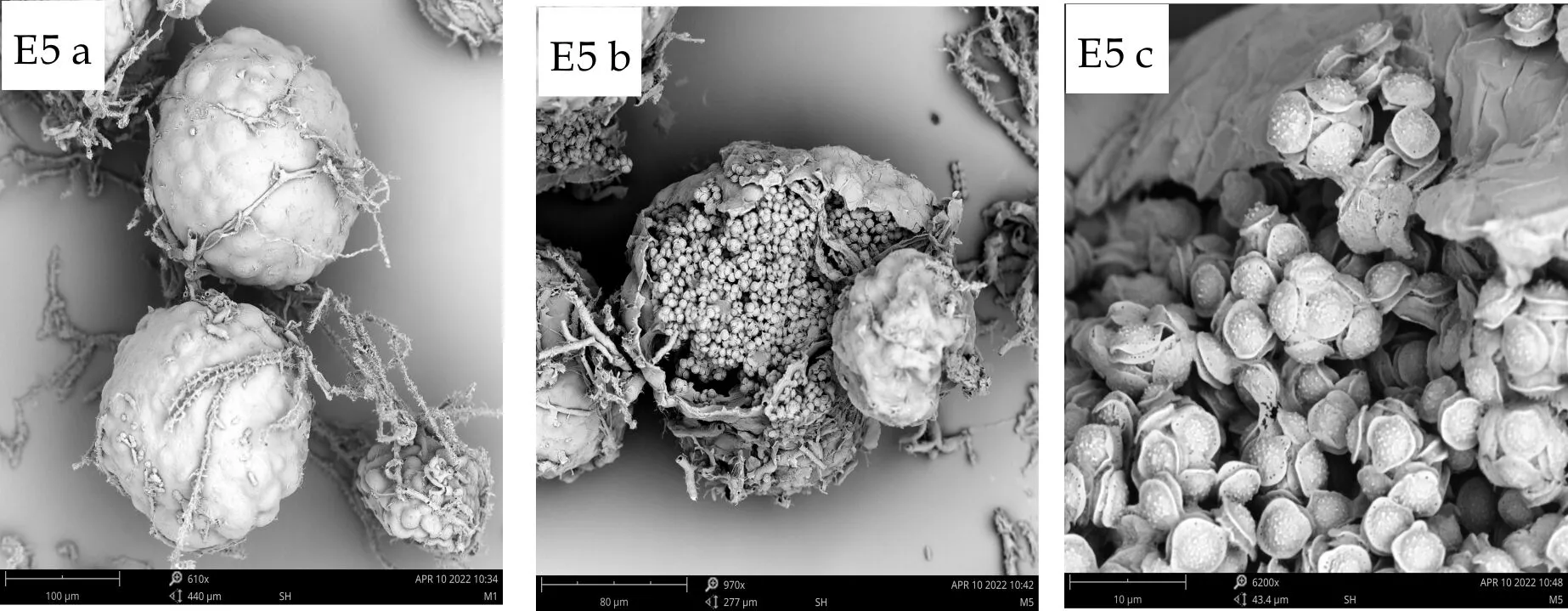

(a)、(b)、(c) 分别为扫描电子显微镜下的子囊果、子囊果释放子囊孢子、子囊孢子图1 E1~E7菌株的有性产孢构造
2.2 7株菌的无性孢子形态学分析
通过7株菌的无性产孢构造的光学显微镜和扫描电镜观察结果表明,无性孢子为分生孢子,分生孢子头为层状放射状结构,7株菌的产孢构造不尽相同,分述如下.
E1分生孢子梗壁光滑,梗直径约7.2~11×80~150μm,分生孢子头拖把型,顶囊为烧瓶形或球形,20~40μm,顶囊次生梗单层,瓶状梗,2.2~3.6×2.5~7μm,从瓶梗处串生出分生孢子,分生孢子椭圆形或腰鼓型,2.4~3.5×2.9~4μm,壁粗糙,如图2所示.
(a)光镜下的分生孢子头 (b)电镜下的分生孢子头 (c)电镜下的分生孢子图2 E1菌株的无性产孢构造
E2分生孢子梗壁光滑,5~9×125~225μm,分生孢子头灰绿色,幼时球形,老熟后疏松放射型,顶囊烧瓶形或球形,12~25μm,顶囊次生梗单层,瓶梗2.2~3.2×5~6.4μm,分生孢子由瓶梗处串生,分生孢子椭圆形或腰鼓型,4~4.8×3.2~4μm,壁粗糙,如图3所示.
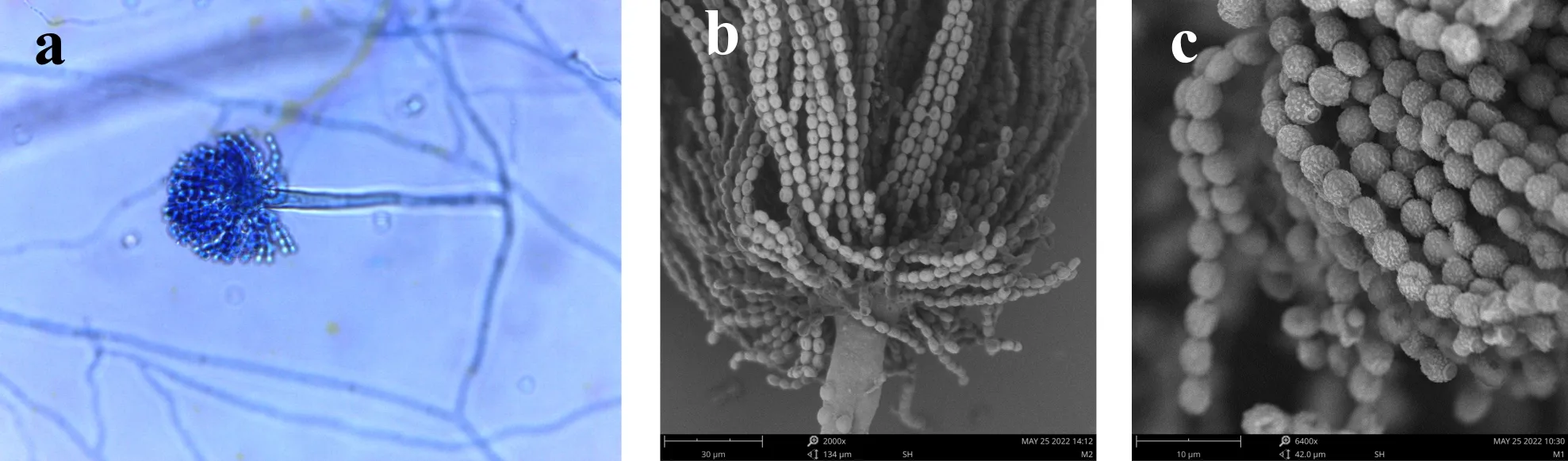
(a)光镜下的分生孢子头 (b)电镜下的分生孢子头 (c)电镜下的分生孢子图3 E2菌株的无性产孢构造
E3分生孢子梗壁光滑,7.2~11×80~150μm,分生孢子头初为球形,后呈疏松放射型,顶囊烧瓶形或球形,20~40μm,顶囊次生梗单层,瓶梗2.2~3.6×2.5~7μm,分生孢子由瓶梗处分生出,分生孢子椭圆形或腰鼓型,2.4~3.5×2.9~4μm,壁粗糙,如图4所示.
(a)光镜下的分生孢子头 (b)电镜下的分生孢子头 (c)电镜下的分生孢子图4 E3菌株的无性产孢构造
E4分生孢子梗壁光滑,7.2~11×80~150μm,分生孢子头初为球形,后为疏松放射形,顶囊烧瓶形或球形,20~40μm,顶囊次生梗单层,瓶梗2.2~3.6×2.5~7μm,分生孢子由瓶梗处分生出,分生孢子椭圆形或腰鼓型,2.4~3.5×2.9~4μm,壁粗糙,如图5所示.
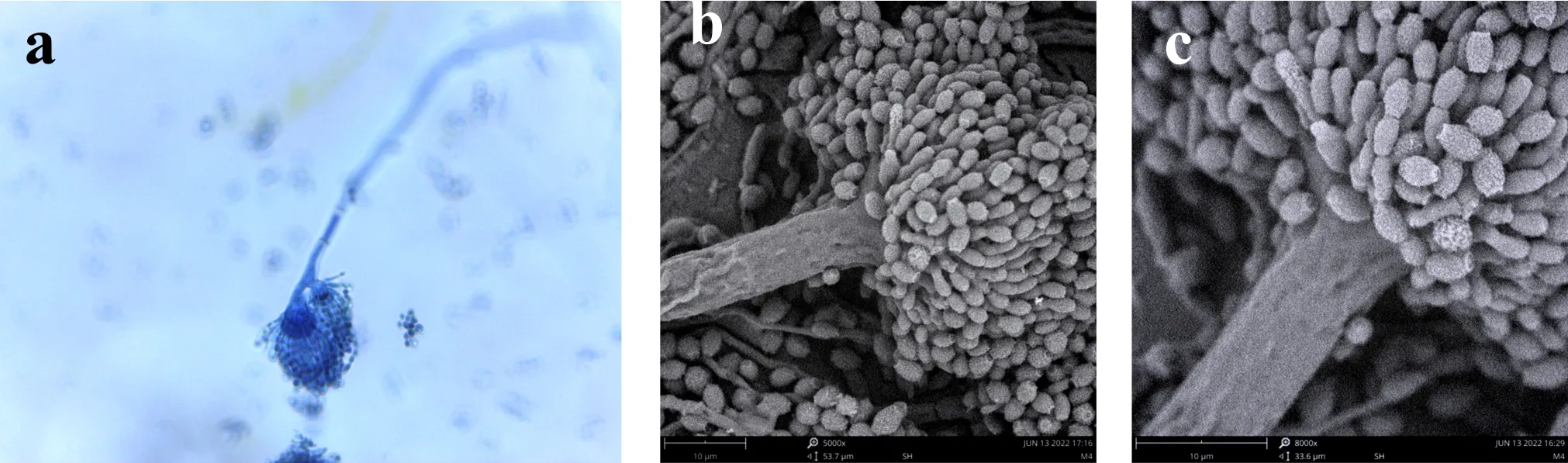
(a)光镜下的分生孢子头 (b)电镜下的分生孢子头 (c)电镜下的分生孢子.图5 E4菌株的无性产孢构造
E5无性产孢形态与E1基本相同,分生孢子梗壁光滑,2.5~11μm;分生孢子头初为球形,后呈辐射型或疏松短柱型,顶囊烧瓶形,13~35μm,分生孢子为圆球形,壁具小刺,30~90μm,顶囊次生梗单层,瓶梗1.5~2.5×2.5~4μm,分生孢子为圆球形,近球形,2.5~4μm,壁粗糙具小刺,如图6所示.
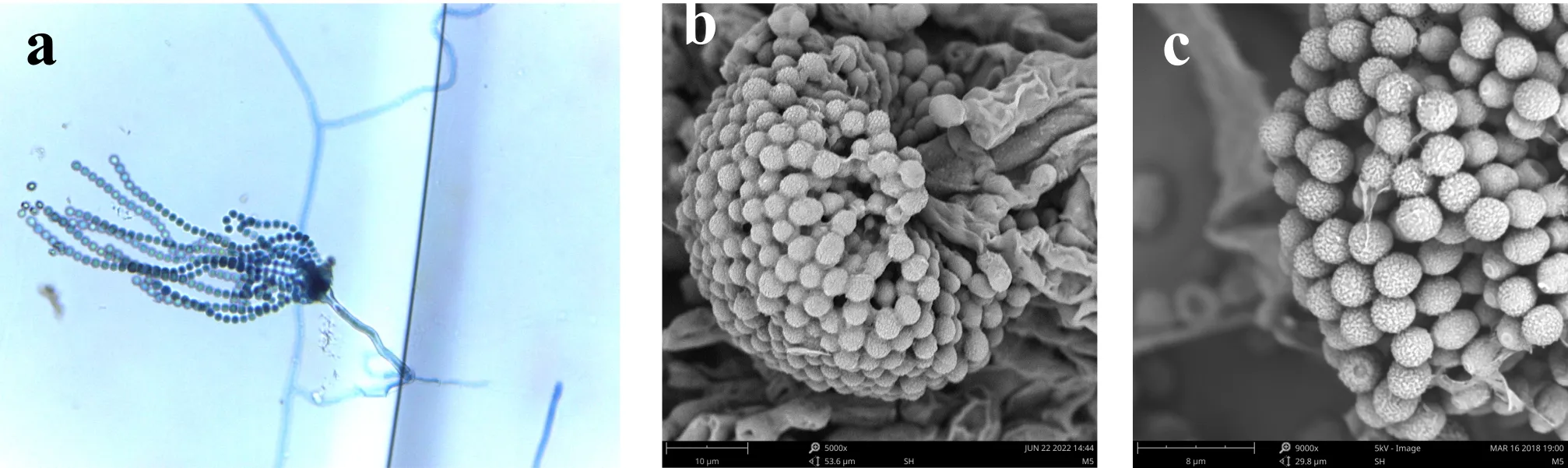
(a)光镜下的分生孢子头 (b)电镜下的分生孢子头 (c)电镜下的分生孢子图6 E5菌株的无性产孢构造
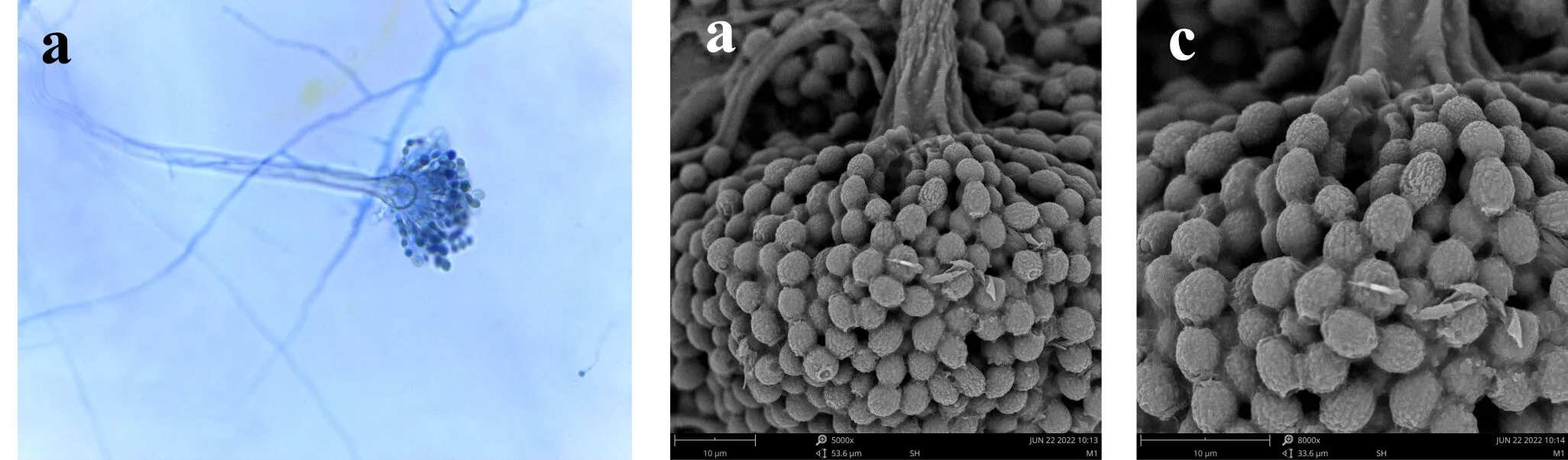
E6分生孢子梗壁光滑,7.2~11×80~150μm,分生孢子头辐射型,顶囊烧瓶形或球形,20~30μm,顶囊次生梗单层,瓶梗6.5~8.0×3.0~4.0μm,分生孢子由瓶梗处分生出,分生孢子椭圆形或腰鼓型,3.5~6.0×2.9~4μm,壁粗糙具瘤状突起,如图7所示.
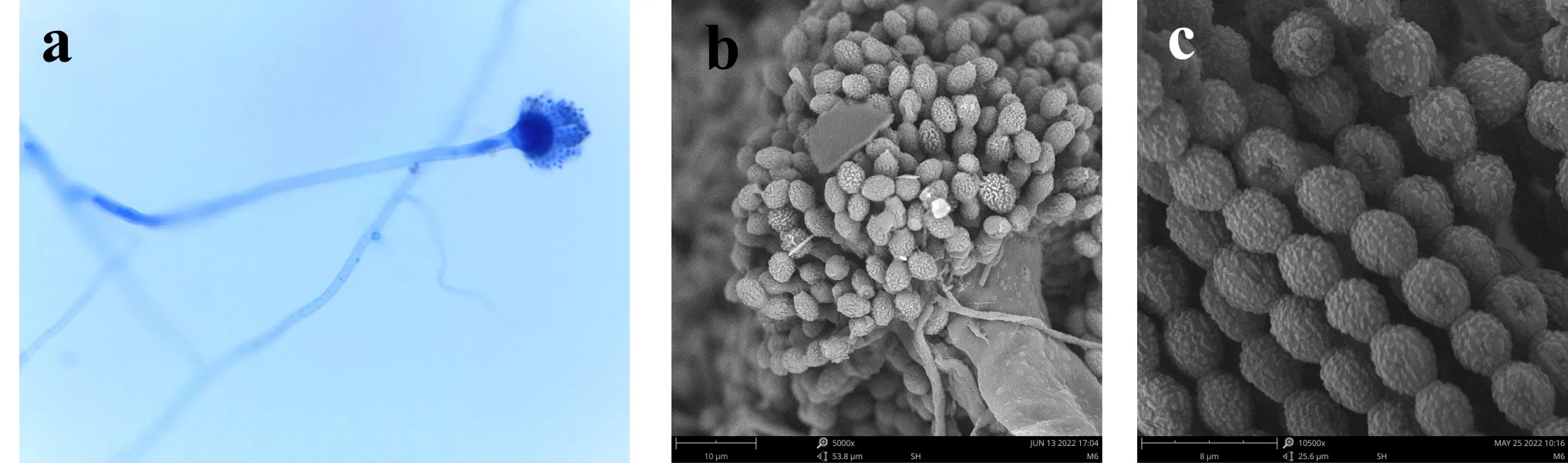
(a)光镜下的分生孢子头 (b)电镜下的分生孢子头 (c)电镜下的分生孢子图7 E6菌株的无性产孢构造
E7分生孢子梗壁光滑,7.2~11×80~150μm,分生孢子头疏松放射型,顶囊稍膨大或烧瓶形,20~40μm,顶囊次生梗单层,2.2~3.6×2.5~7μm,分生孢子由瓶梗处分生出,分生孢子椭圆形或腰鼓型,2.0~2.5×2.5~3μm,壁粗糙,如图8所示.

(a)光镜下的分生孢子头 (b)电镜下的分生孢子头 (c)电镜下的分生孢子图8 E7菌株的无性产孢构造
通过光学显微镜和扫描电子显微镜对7株菌的有性和无性孢子形态学观察与分析,并与相关鉴定手册和文献[21-23]中的描述进行对比,结果表明7株菌的种群关系分别为Eurotium属的Eurotiumchevalieri(谢瓦散囊菌,E1)、Eurotiumcristatum(冠突散囊菌,E2、E3、E4、E7)、Eurotiumamstelodami(阿姆斯特丹散囊菌,E5)、Eurotiumcostiforme(肋散囊菌,E6).
2.3 7株菌的18S rDNA序列分析
在7株菌孢子形态学观察与分析的基础上,从分子核酸水平对其差异进行进一步分析研究.选取18S rDNA区域进行试验,对目的条带进行扩增,扩增结果如图9所示.结果显示7株菌中E1的18 s大小约为1 000 bp,E2 到E7 约为1 500 bp.
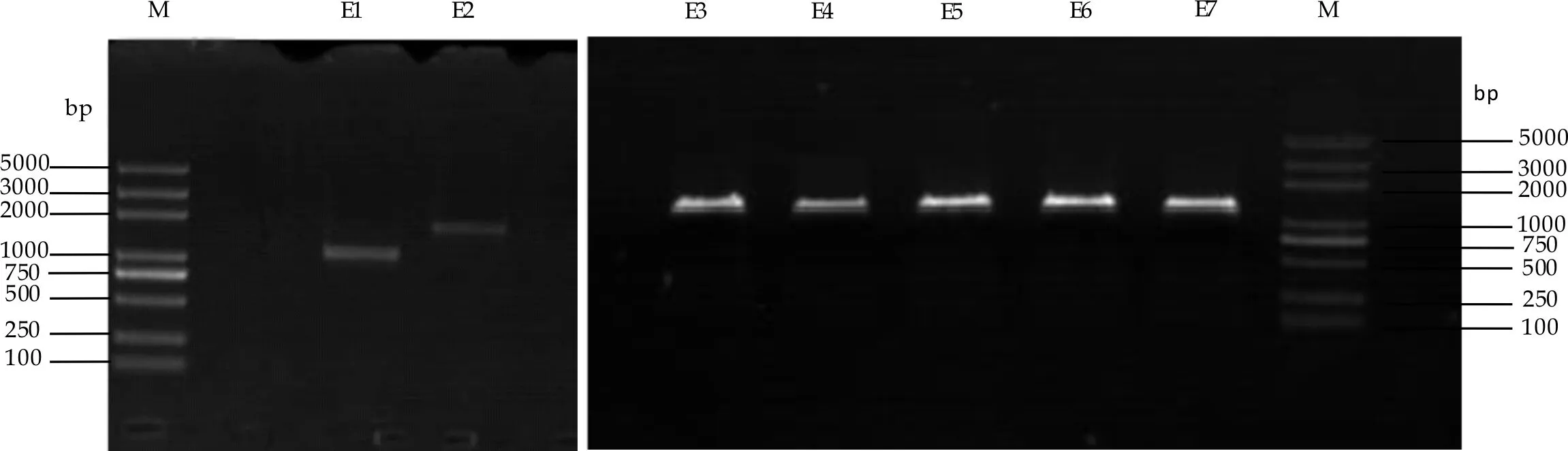
图9 E1~E 7菌株的18S rDNA PCR 产物电泳图
对PCR扩增产物进行测序,测序结果如下所示.通过MEGA系统Align selected block by clustalW分析发现,E1、E3、E4、E5、E6、E7序列除了首尾序列存在差异之外,其余序列与E4序列一致.其中E2序列与其他6株菌的序列差别较大,E5、E6、E7序列一致.将其基因序列输入NCBI数据库中进行Nucleotide blast比对及同源性搜索,结果见表1.E1序列长度(Query Length)972 bp,E2序列长度为1629 bp,E3序列长度961 bp,E4序列长度944 bp,E5、E6、E7序列长度均为969 bp.虽然7株菌的序列不完全相同,但均与表1中所列的多种菌有超过99%的相似性.因此,7株菌鉴定结果应为Aspergillusglaucus、Eurotiumherbariorum、Aspergilluspseudoglaucus、Aspergilluscristatus、Eurotiumchevalieri、Eurotiumamstelodami、Eurotiumrubrum、Aspergillusamstelodami其中之一.依据最新国际命名法规[24],散囊菌属和曲霉属曲霉组是1个单系的类群,7株菌也可为Eurotium或Aspergillus,在这种情况下,应依据形态学鉴定结果.应用MEGA5软件中Phylogeny程序,绘制系统发育树,结果如图10所示.

表1 7株菌的18S rDNA序列比对结果
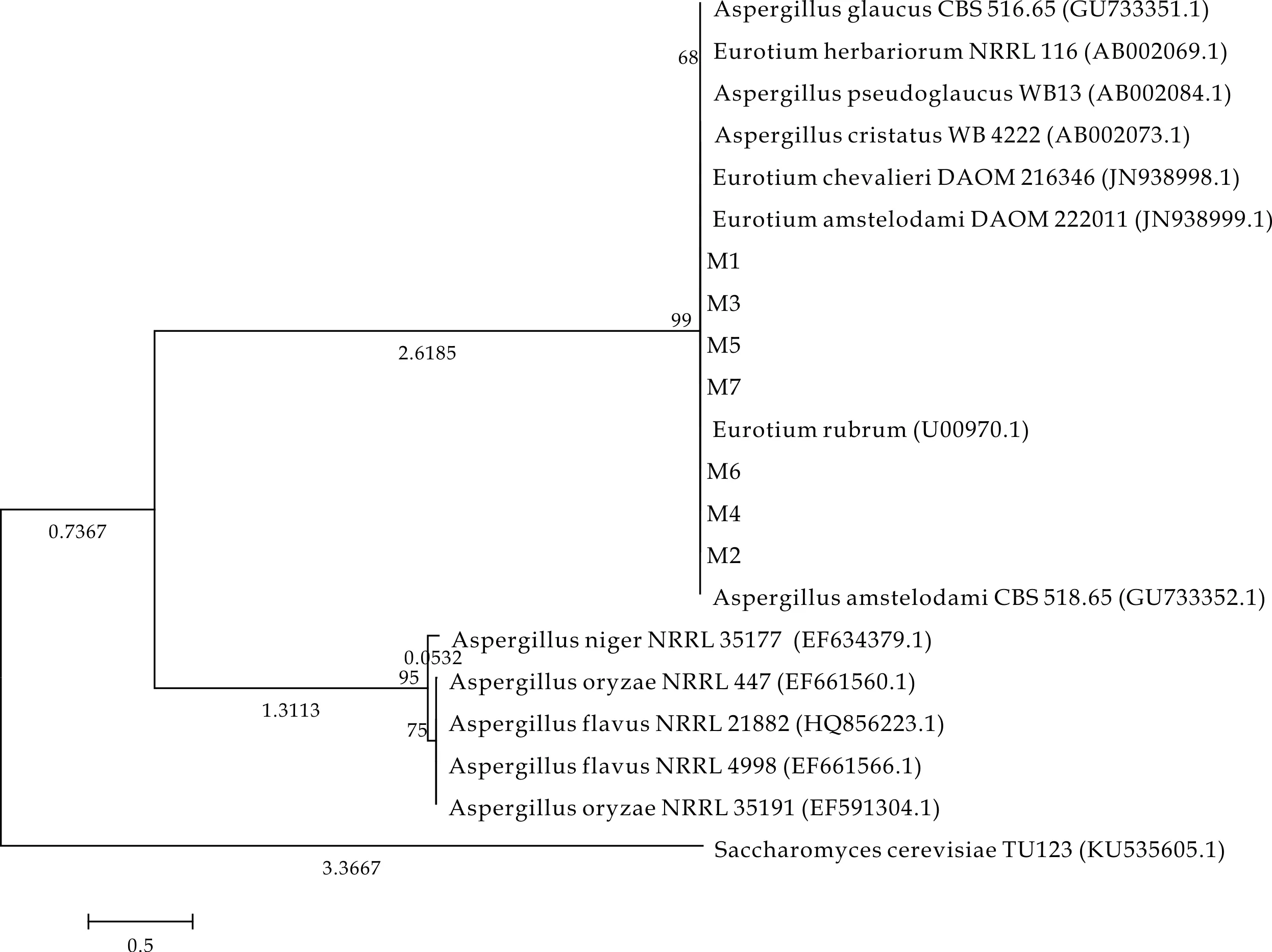
图10 基于18S rDNA序列构建 的NJ系统发育树
3 结论
茯砖茶中的优势“金花菌”是评价其产品质量优劣的重要指标,也是茯茶地理品牌标志的重要特征.因此,对其中种群及其特性的分析与研究具有重要的理论意义及实用价值.茯砖茶中的优势“金花菌”为Eurotium属的不同菌群,这些菌群在不同茯砖茶品质形成中起着重要作用.
本文通过对来自陕西茯茶产区的10种不同品牌茶样品中分离纯化的7株Eurotium属的优势金花菌的有性和无性孢子的形态学分析,结合分子生物学的18S rRNA序列分析,并与手册和文献[21-23]中的描述与检索表对照分析,以及最新国际命名法规[24],7株菌的种群关系分别为Eurotium属的Eurotiumchevalieri(E1)、Eurotiumcristatum(E2、E3、E4、E7)、Eurotiumamstelodami(E5)、Eurotiumcostiforme(E6).7株菌同属于散囊菌属或曲霉属.
目前,相关霉菌种属关系鉴定方面的研究除了形态学、分子生物学中的ITS、18SrRNA等以外,还有对NRPS、MLST等[25,26]的差异分析,也有研究者[9,27,28]利用转录组水平的多基因系统发育,分析菌株的种属关系,但这些研究目前均有一定偏差.因此,Eurotium属种群关系的鉴定尚需进一步研究.
