两相厌氧工艺快速启动运行及其群落结构特征研究
2019-04-10郭昌梓强雅洁马宏瑞
马 蕊, 郭昌梓, 强雅洁, 马宏瑞
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
厌氧生物处理技术即在厌氧环境中,一系列协同合作的微生物将废水中复杂有机物最终转化为甲烷、CO2、氢气以及合成为微生物细胞的过程[1].因其运行能耗低,处理负荷高,剩余污泥少以及可回收沼气、氢气等特点,已被广泛应用于高浓度有机工业废水处理中,并取得很好的处理效果[2].但在实际工业废水中,存在大量的硫酸盐和硫化物,难降解有机物等毒性物质对产甲烷菌的抑制明显甚至灭活,使厌氧消化系统崩溃.通过两相分离技术,分别创造有利于产酸菌与产甲烷菌的生态环境,将有毒或抑制性物质在第一相中得到大量去除或转化,可有效提高系统的处理效果,保证系统的稳定运行,使厌氧技术得到更高效的应用[3].
对于两相厌氧生物反应而言,产酸相的运行效果直接影响着整个工艺系统的处理能力.如何快速启动产酸相,并使其稳定运行,对于提高厌氧反应效率和水解酸化的正确实施及广泛应用有着重要意义.
本实验采用连续搅拌反应器(CSTR)考察两相厌氧系统的物质变化和微生物群落结构特征,研究内容主要包括反应器内挥发性脂肪酸(VFA)组分变化、pH、ORP及酸化度.同时采用扫描电镜及16S rDNA考察污泥形态和群落结构特征,为两相厌氧反应的快速启动及提高厌氧消化效率提供理论依据和运行方法,使其更好地在工程实际中应用和推广.
1 实验部分
1.1 实验装置
图1为实验装置图,采用连续搅拌反应器(CSTR),使反应器内部流态趋于完全均匀混合,由有机玻璃制成,采用pH计及ORP仪实时监测,配制有进水管、出水管和排气管,总容积为6 L,有效容积为5 L.装置采用套管及水封,保证电机搅拌桨与反应器连接处完全密封,反应进、出水采用N2作为交换气体的缓冲袋,保证反应器内厌氧环境以及压强平衡.采用水浴槽自动控温系统加热,保持反应器内部温度为35±1 ℃.
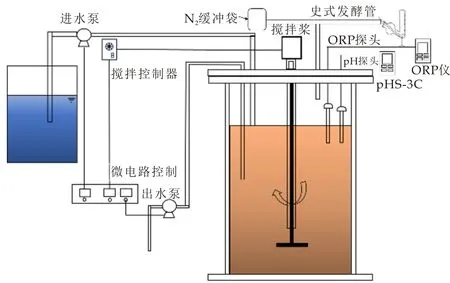
图1 实验装置示意图
1.2 实验用水及污泥
本实验采用模拟废水,产酸相投加葡萄糖、N及P营养物,COD∶N∶P=200∶5∶1,按配比添加Ni、Mn、Co等微生物生长所需微量元素.进水基质中,添加NaHCO3及NaOH以保证适宜的碱度及pH[4].在运行初始前四天,加入2 mmol/L钼酸钠,以加快实现产酸相中产甲烷菌的抑制,其出水直接排放,之后停止投加钼酸钠,再运行三天,出水仍直接排放,以此避免产酸相出水中残余的抑制剂对产甲烷菌产生毒害作用[3].在此期间,产甲烷相碳源为乙酸钠,进水COD为3 000 mg/L,以使接种污泥适应环境.一周后,将产酸相出水通过调节池添加NaHCO3及NaOH,以调节进水pH为7.2±0.2,为产甲烷相进水.
接种污泥取自陕西省西安市汉斯啤酒厂厌氧罐,呈灰黑色,污泥较浓稠,大颗粒杂质,沉渣较多,沉降比在90%左右,MLVSS/MLSS=51.07 g/L/64.35 g/L=0.79.接种污泥过0.25 mm网筛,以去除大颗粒有机物、残渣、纤维及杂质.确保反应器气密性良好后进行厌氧污泥接种,接种量为2.5 L, MLVSS/MLSS=5.424 g/L/10.8 g/L=0.5.
1.3 分析方法
分析项目包括水质指标,如COD、MLSS、pH、ORP、酸化度、VFA总量及组分分析等;气体指标,如产气量及气体组分分析;污泥指标,如污泥形态及微生物群落结构分析.以3 000 rpm离心10 min,取上清液测定各指标.所有测定指标均采用平行样测定3次,取平均值.pH值采用pHS-3C型测定;ORP采用ORP检测仪测定;挥发性脂肪酸(VFA)经预处理后采用滴定分析法及气相色谱法(福立 FL9790Plus)(FID检测器,进样口195 ℃,柱箱程序升温,90 ℃ 2 min,10 ℃/min升温到140 ℃,40 ℃/min升温到200 ℃保持2 min ,柱流量2,分流比5∶1,载气N2);酸化率(AR,%)=VFAeff/CODinf×100;酸化度(AD,%)=(r·(VFAeff-VFAinf))/CODinf×100,r为VFA的COD当量系数,r乙酸=1.066.
产气量用50 mL史式发酵管计量;气体组分采用安捷伦气相色谱仪(Agilent 6890N)测定,(TCD检测器,恒温160 ℃,TDX-01填充柱2 mX0.3 mm,100 ℃,载气Ar,尾吹N2).
污泥形态及微生物群落结构分析:将泥样进行脱水干燥预处理后喷金,进行SEM(FEI Q45)观察;16S rDNA测定前将污泥储存在-80 ℃,由浙江杭州LC-Bio技术有限公司测序.
1.4 运行参数控制
实验采取低负荷进水方式启动,采取先增加进水COD浓度,后缩短水力停留时间的方式,从而不断提高进水负荷.依据污泥生长状况及废水处理效果.本研究中启动阶段COD进水浓度控制在3 000 mg/L,每天排水2. 5 L,运行10 d后,进水浓度提高到5 000 mg/L,运行15 d,进水COD浓度进一步提高到8 000 mg/L,之后改变水力停留时间(HRT)为6 h,每天运行12 h,负荷提高到10 kg/(m3·d).反应过程中,为避免反应器处于“过酸状态”,超过菌体耐受极限,抑制产酸过程,维持反应阶段pH在4.3~4.5范围内.
2 结果与讨论
2.1 相系统中挥发性脂肪酸组分变化
挥发性脂肪酸(VFA)是评价产酸相反应器运行状况的重要指标[4].产酸相及产甲烷VFA总量随时间变化如图2~3所示,在启动初期,VFA总量较低,在此阶段,仍存在少量产甲烷菌属,接种污泥中产氢产乙酸菌及产甲烷菌活性较高,将水解发酵产物降解,转化为CH4及CO2,随着钼酸钠抑制剂的添加,VFA总量呈增长趋势.在进水COD浓度增长到5 000 mg/L时,其水解产物VFA也随之增长,从第一阶段结束时的1 982 mg/L,迅速提高到2 522 mg/L,在运行22天后,第二阶段结束VFA总量达到2 882 mg/L,进水浓度达到8 000 mg/L,产酸相酸化程度达到稳定,出水VFA最高达到3 963 mg/L.之后负荷增加,进水基质降低为5 000 mg/L,VFA总量基本维持在3 000 mg/L左右.
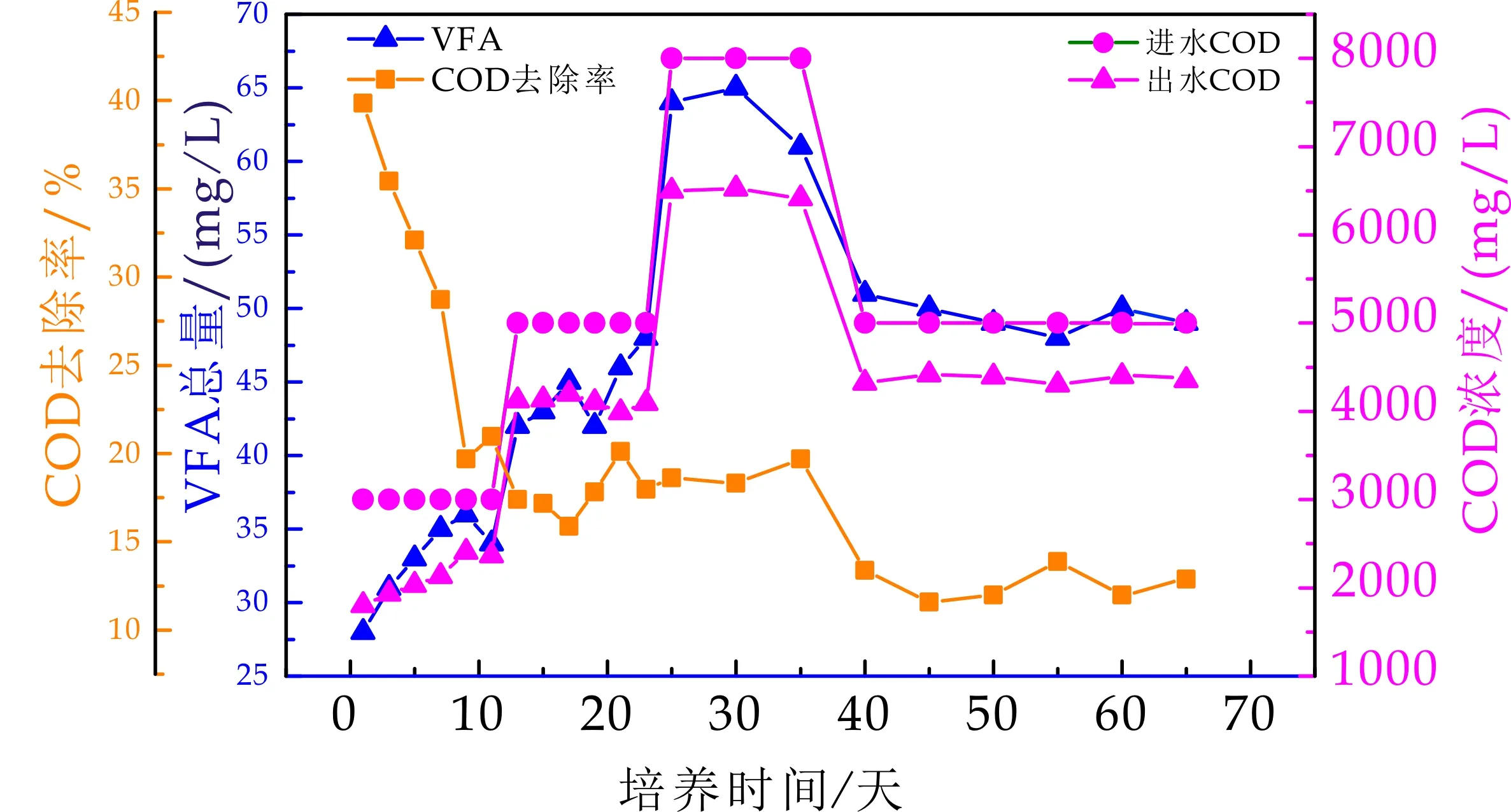
图2 产酸相VFA及COD变化

图3 产甲烷相VFA及COD变化
在图3中,初始出水VFA含量低,主要因为进水基质是产甲烷菌可直接利用的乙酸,其出水VFA值维持在300 mg/L左右,VFA随负荷增加,具有同样变化趋势,产酸相进水为8 000 mg/L,出水进入产甲烷相,其出水VFA最高达843 mg/L.负荷提高到10 kg/m3·d,70 d时,其出水VFA稳定在600 mg/L,产酸相与产甲烷相VFA总量差别较大,分相明显.在初始运行阶段,乙醇型发酵菌群的繁殖速度较丙酸型发酵和丁酸型发酵菌群而言,繁殖速度慢,最终导致了发酵类型向丙酸型和丁酸型发酵方向发展.
产酸相及产甲烷VFA变化如图4~5所示.产酸相内,在第5天,丙酸的含量占比最大,其次为丁酸,其ORP值为-348 mV,pH值为6.6,其变化的原因可能是由于在不同的pH和ORP条件下,水解酸化菌群耐受的环境不同.在此环境下可能更有利于丙酸型丁酸型发酵菌群的繁殖,丙酸及丁酸得到积累,乙醇乙酸的含量较低.随着负荷的提高,底物质量浓度较大,食物充足,各类产酸菌适应了水质环境,活性提高,有机酸得到迅速积累,pH及ORP都呈下降趋势,此时的环境适宜于多种混合发酵菌的生长,乙醇及乙酸占比不断增加,乙醇+乙酸的质量分数从一开始的17%增长到反应结束时的62%,有较明显的提高.虽在整个发酵过程,丙酸占比最大,但在培养60 d时,液相末端产物中乙酸占比最大.马文成等[4]研究得出,乙醇型发酵易在较高的启动负荷下形成,最佳的负荷范围为8~12 kg/(m3·d),且启动负荷过低(5 kg/(m3·d)以下),并辅以较慢的容积负荷提升幅度,往往易导致丁酸型发酵.在本实验中,可能由于启动负荷低,更有利于丙酸形成.随着负荷的提高,进水COD浓度增大,产酸反应器中pH下降明显,比较耐酸的乙醇型发酵菌群开始迅速繁殖,并与丁酸型、丙酸型发酵的菌群产生竞争关系.
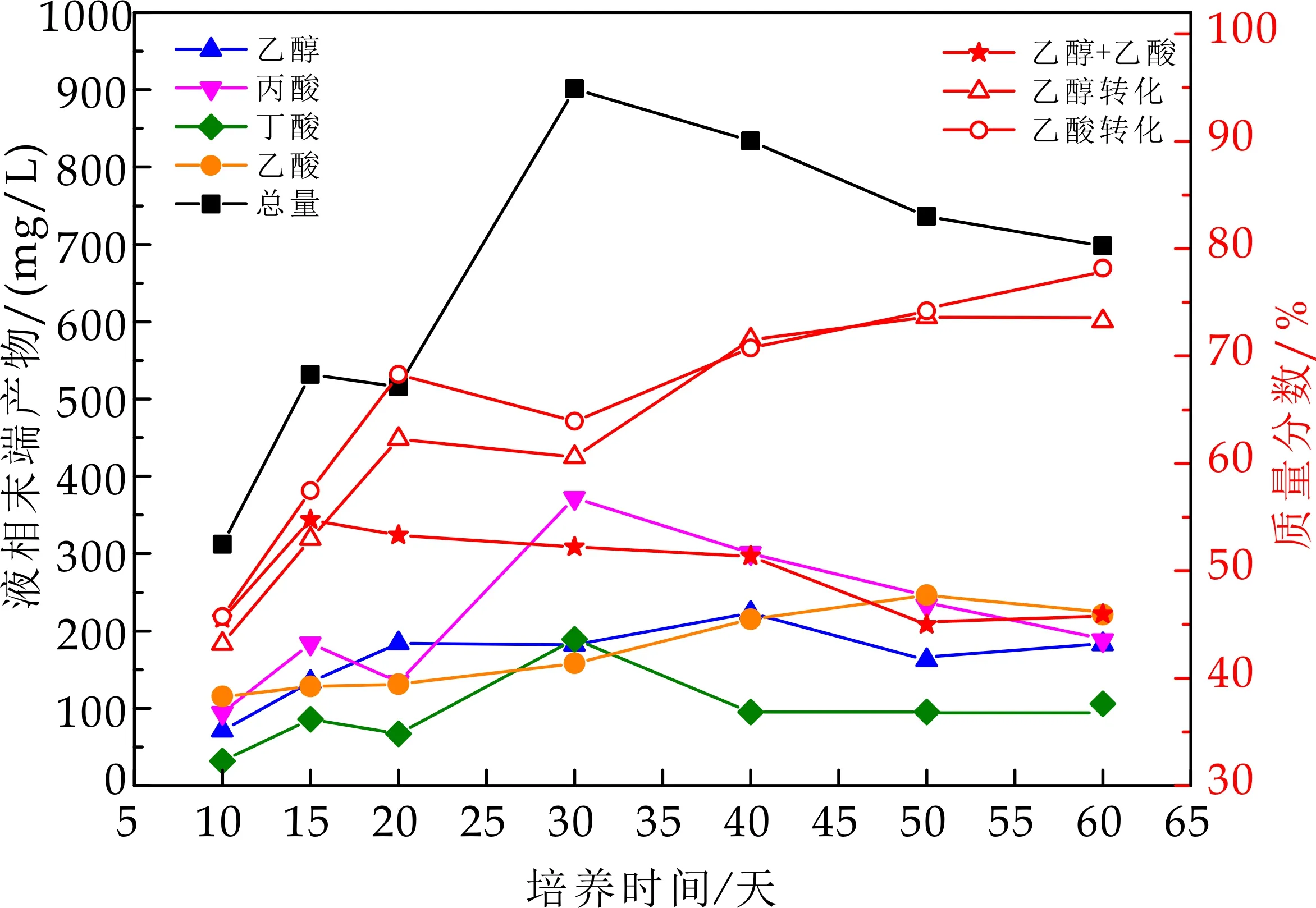
图4 产酸相内VFA组分变化
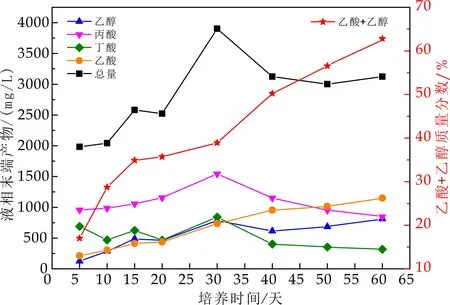
图5 产甲烷相内VFA组分变化
产酸相出水进入产甲烷相,在运行第10 d测定时,各组分含量都较低,并无明显差别,分析其原因可能为,部分以水解发酵产物为底物的菌种,处于“饥饿期”,当产酸相较丰富多种的VFA进入到产甲烷相,很快被各种菌降解利用.随着系统反应的运行,进水基质充足,环境适宜,利用乙醇型发酵产物的菌群迅速生长繁殖,相比于产酸相出水,乙酸及乙醇在产甲烷相中,均有较高转化率,随着负荷提高及产甲烷活性的增强,乙酸的转化率皆高于乙醇,分析原因为,底物转化的速率快慢决定了底物所具有的固有属性,乙酸相较于乙醇,更易被产甲烷菌属所利用[3],也可能是前期污泥驯化的结果,可利用乙酸的菌种得到富集.由于产甲烷相进水基质中丙酸含量高,而与其他有机酸对比,是最不利于被产甲烷菌利用的基质,因此在体系中更易得到积累[5].
2.2 两相系统中COD的去除率
如图2~3所示,产酸相在初期启动阶段,进水浓度为3 000 mg/L时,其COD去除率达到68%,并随着反应器运行周期的进行,去除率下降,之后稳定在20%以下,而在启动后期,负荷提高,COD去除率减少为12%左右.在反应启动初期,产酸相仍存在产甲烷菌属,随着钼酸钠的加入,对产甲烷菌属有致死作用,且不断酸化的系统,不利于产甲烷菌生长繁殖[6].产酸菌将葡萄糖水解成小分子物质及VFA,以便为后一相的产甲烷相利用,而产物都可以COD计,有其对应当量,因此其COD去除率不断下降.COD的去除主要满足其自身生长.反应后期为活性提高期,水解菌活性高,微生物主要将进水葡萄糖转化成VFA.产甲烷相具有较高的COD去除率,基本维持在75%~80%左右,因初始进水碳源为乙酸钠,是产甲烷菌可直接利用的基质,在将产酸相出水接入到产甲烷相,其去除率并没有发生明显变化.系统培养分相成功,并稳定运行.
2.3 产酸相中的酸化度
如图6所示,在培养初期,产酸相内酸化率为46.2%,酸化率随培养时间的延长而增强,最高可达到61.2%,而负荷的提高,对酸化率产生一定的影响,在整个反应阶段负荷最大时,其酸化率在45%到48%之间,而在反应器稳定阶段,其酸化率维持在60%左右.马宏瑞等[7]采用IC反应器对不同浓度的毛皮废水进行实验探究得到,在酸化程度达到45%左右时,COD去除率及污泥具有稳定特性,且活性较高.马文成等[4]分相研究中,得出酸化度在初期运行阶段快速上升且幅度变化较大,最高可达到47.68%,而在负荷提高后,其值下降,最终稳定在27%左右.酸化率的差异与反应器类型,水力停留时间及接种污泥特性都有较大关系.
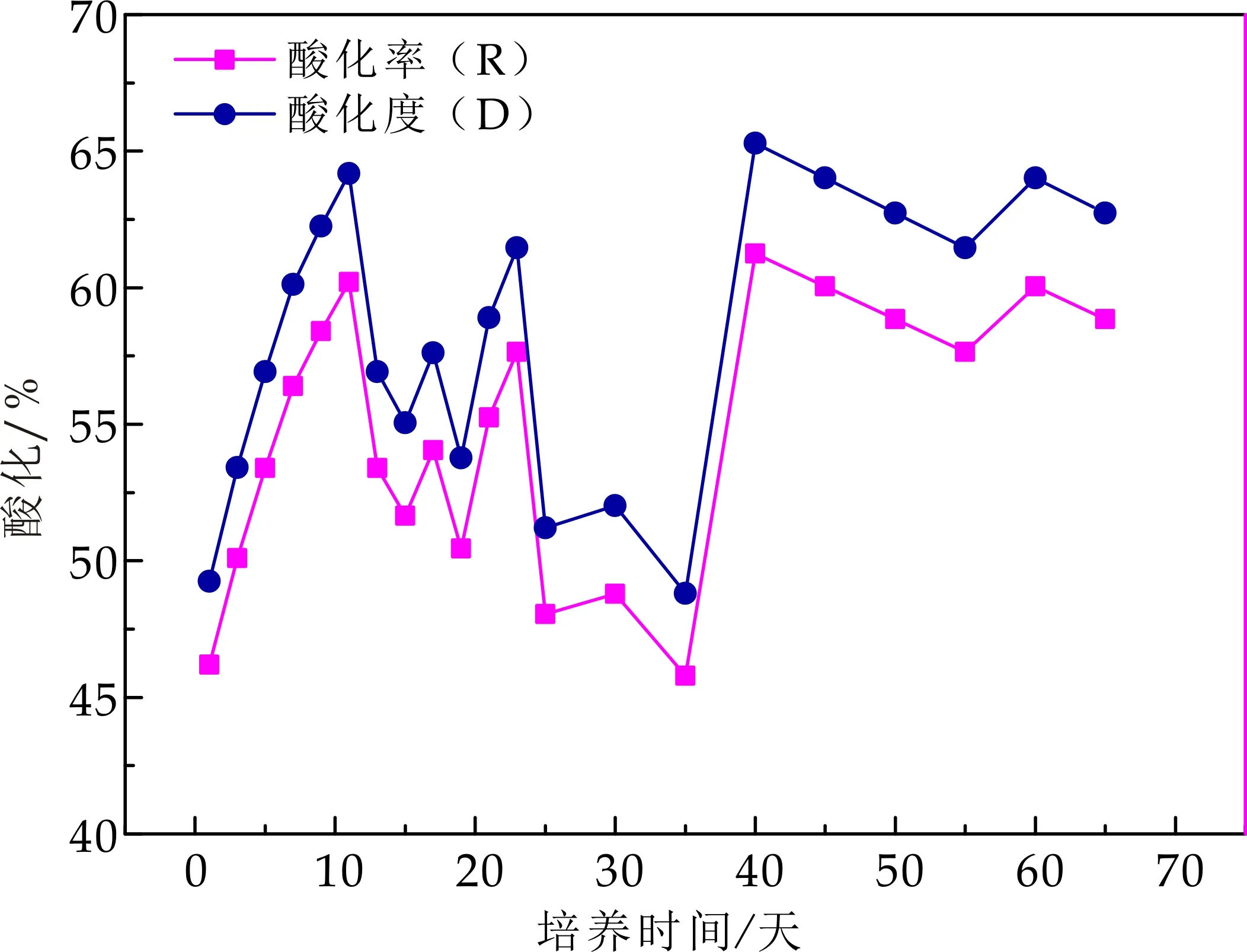
图6 产酸相酸化度变化
2.4 两相系统中气体组分变化
经史式发酵管对产气总量进行测定,HRT为6 h时,产酸反应达到稳定状态,每个周期产气量约为0.9~1 L左右.由气相色谱仪测定气体组分,如图7所示,主要为CO2及H2,随着负荷的提高及反应的稳定,H2含量在不断增加,CO2含量在不断减少,产酸反应器中,均未检测到CH4,产酸相充分水解酸化,同时抑制产甲烷菌的生长,成功实现相的分离.
分析原因,可能有三点:
(1)在产酸反应器启动阶段,投加了2 mmol/L的钼酸钠,其对产甲烷菌是起灭杀作用的,即使在反应运行3 d后,停止投加钼酸钠,产甲烷菌的活性也不能得以恢复[6].
(2)一般认为,产甲烷菌的最适pH为6.8~7.2,在pH低于6.5或高于8.2时,产甲烷菌都会受到明显抑制,而在pH低于5.5左右时,产甲烷菌完全失活.完成进水初期,反应器内pH值为4.8~5.0,整个反应过程中,产酸相的pH范围在4.3~4.5,对产甲烷菌产生完全抑制.
(3)整个产酸发酵过程中,反应器运行稳定,VFA总量随负荷升高,不断增加,并迅速积累,使得产甲烷菌和产氢产乙酸菌的活性由于“连锁效应”而受到抑制[2].综合以上三个原因,使得产酸发酵菌逐渐成为优势菌群,在产生气体组分中,未检测到CH4.如图8所示,在产甲烷相中,CH4占比持续增加,最终稳定在65%左右,表明其产甲烷菌活性增加.Wu Y等[8]在两相分离实验研究中,产酸相气体组分中,CO2浓度超过99.9%,而几乎没有H2产生.
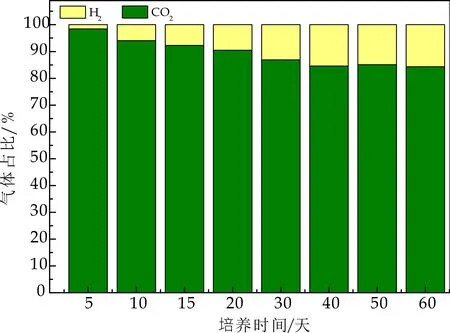
图7 水解酸化反应器内气体组分变化
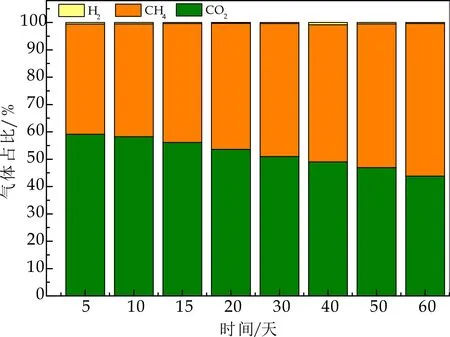
图8 产甲烷相反应器内气体组分变化
2.5 两相系统中pH变化
由图9可以看出,在启动最初阶段,由于进水基质结构较简单且易分解,初始浓度适宜,各类产酸发酵菌可迅速适应进水水质,进行产酸发酵反应,而抑制剂的添加,使得产甲烷菌灭活,产酸相产生的VFA不被消耗,有机酸得到快速积累,这一结果也进一步提供了不适宜产甲烷菌生长的环境,pH值呈迅速下降趋势.在进水配水中,加入适量NaHCO3及NaOH,以调节进水pH为7.0左右,采用pH探头实时监测,基质进入反应器后,完成进水,pH在4.8~5.0之间,随着反应器内产酸发酵微生物种群的不断演替和有机负荷的提高,pH值平稳下降,最终稳定在4.3~4.5,且整个反应阶段,未出现“过度酸化”现象,反应器运行稳定.而产甲烷相出水pH可稳定在7.2左右.
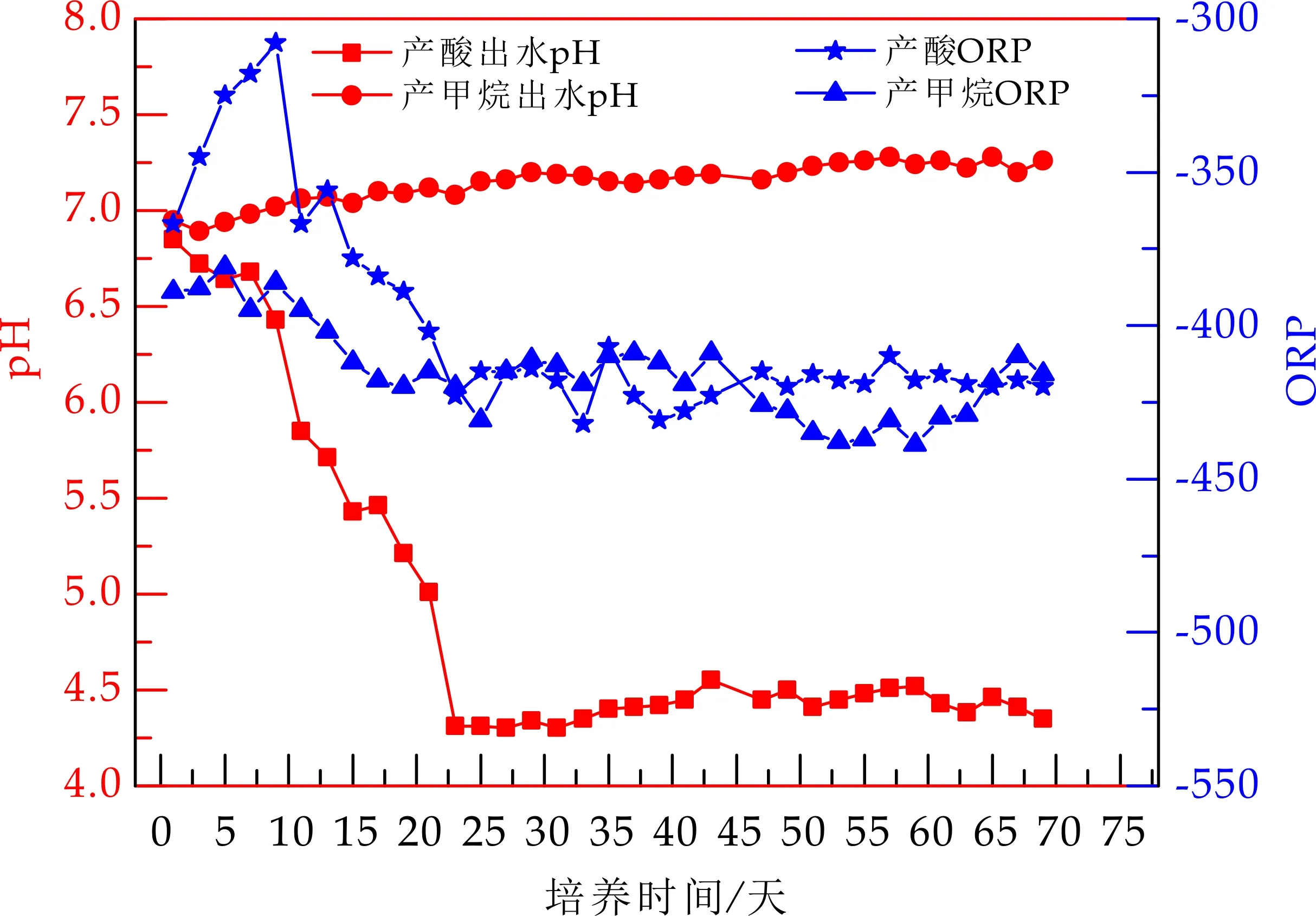
图9 两相出水pH、ORP值变化
2.6 两相系统中ORP变化
氧化还原电位,是对微生物生长代谢以及生理生化代谢极其重要的一个生态因子,其由所有能形成氧化还原电位的化学物质的存在状态决定,生物体细胞内的各种生物化学反应都是在特定的ORP范围内发生的,超出特定的范围则生物反应不能正常发生,或会改变反应发生的路径,且会对反应造成不利影响[9,10].
ORP值受温度及溶解氧的影响,在进水时,不可避免的混入氧分子,使得进水时ORP值在-150 mV左右,在进水10分钟内可迅速降至-350 mV以下,这种低氧化还原电位的造成,即是靠水浴加热以及各类群微生物反应及生长对环境氧化还原电位影响的结果,ORP值初始进水下降较快但之后呈平缓趋势,变化幅度较小,在进水完成后的1 h,ORP基本稳定在出水ORP值±10 mV.由图9可以看出,整个反应过程,出水ORP稳定在-400~-500 mV,ORP值较低.产甲烷相,ORP值从初始-400 mV降低到-420 mV,整个实验过程ORP值较稳定,变化不大.
2.7 两相系统中的污泥形态
在污泥接种1~4 d,经过足够长时间停止搅拌,沉淀,产酸反应器出水仍呈灰黑色,污泥洗出量大,主要为沉降性能较差的絮体污泥以及抑制剂钼酸钠的加入,洗脱出不具有活性的微生物.在反应器运行4 d后,污泥逐渐从接种的灰黑色转变为灰褐色,污泥质地松散,呈细小絮状.运行一周后,污泥沉降性能较好,沉降比约为40%.随着培养时间延长,污泥洗出量逐渐减少,且其活性不断提高,表观颜色发生明显变化,从刚开始接种的灰黑色到灰褐色,出现淡黄色,最后污泥以乳白色形态存在,直至反应结束.
本实验所采用反应器为CSTR,因此实验过程中并未培养成颗粒状,而成絮体形态.在整个产酸相反应过程中,由于絮凝能力较差的微生物以及处于悬浮状态的部分微生物,不适应厌氧环境而被淘汰,或因“冲洗”作用而流失,致使污泥量有较明显减少,接种阶段MLVSS/MLSS=5.424 g/L/10.8 g/L,运行15 d,MLSS为7.788 g/L,运行23 d,MLSS为7.022 g/L,之后MLSS变化量较小,维持在7.0 g/L左右,基本达到稳定.而产甲烷相反应器实验过程污泥形态较稳定,呈灰黑色,与接种污泥颜色并无明显区别,其运行15 d,MLSS为9.623 g/L,运行23 d,MLSS为9.964 g/L,至反应结束,其MLSS为10.614 g/L.
对培养成熟后的污泥进行扫描电镜观察,如图10~11所示,产酸相中,其菌群主要以短杆菌、芽孢菌及丝状菌为主,相互渗透且相互缠绕在一起,孔洞交错.而产甲烷相,主要以甲烷八叠球菌为主,其占优势.

(a)3 000倍 (b)4 000倍 (c)5 500倍图10 产酸相污泥电镜扫描结果

(d)3 000倍 (e)4 000倍 (f)6 000倍图11 产甲烷相污泥电镜扫描结果
2.8 两相系统中微生物群落结构特征
根据16S rDNA测序结果分析,如图12所示,在门分类水平,产酸相中大部分菌种都集中Actinobacteria(放线菌门)、Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门),各个菌门含量分别为42.46%、36.14%、12.69%、7.97%,表现出较高丰度,其相对丰度之和占细菌菌群总丰度的99.25%,上述菌群均被报道是厌氧发酵技术处理固废、废水及污泥中常见的细菌菌群[11].在微生物环境中,Actinobacteria是具有潜在修复功能的菌种,生长速率快.有研究证明,Actinobacteria中的一些种可以产生大量的水解酶.而Proteobacteria在厌氧水解与酸化系统中,是极其重要的微生物,大多数互营共生菌都属于该门,可降解长链脂肪酸.Firmicutes可产生蛋白酶、纤维素酶、脂肪酶和其他细胞外酶,并与有机物的降解密切相关,其具有较好的细胞壁,可抵抗外界极端环境[12-14].
而在属分类水平,如图13所示,Enterobacteriaceae(肠杆菌属),Bifidobacterium(双歧杆菌属),Corynebacterium(棒杆菌属),Bacteroidetes(拟杆菌属),Clostridiumsensustricto(梭状假胞杆菌属)分别占总量的29.68%、24.42%、11.95%、4.74%、4.75%.这些菌群在有机物的高效降解中能发挥重要作用.刘光瑞[15]在进水负荷为7.2 kg COD/m3·d时,Enterobacteriaceae的相对丰度为36.68%,负荷提高后丰度降低.陈瑛等[16]认为,在厌氧反应中产生乙醇型发酵时,其主要微生物种群是梭菌属,而形成丁酸型发酵时,主要的微生物种群是Enterobacteriaceae.Clostridiumsensustricto是厌氧环境中较为常见的菌属,具有较广泛的温度生长范围,且可利用的基质也较丰富,能明显提高发酵启动时间,其产物主要为乙酸、丁酸及少量丙酸,反应体系中一定含量的Clostridiumsensustricto可提高体系发酵类型的丰富度[17].梭菌和肠杆菌都是产酸发酵过程污泥中主要的发酵微生物,刘光瑞[15]发现,Clostridiumsensustricto具有较宽的pH生长范围,在pH为4时仍能正常生长,而Enterobacteriaceae在ph=4时其生长受到有机酸抑制,在pH为5~5.5时,Enterobacteriaceae具有活性强.而在本实验中,pH在4.5附近,Enterobacteriaceae丰度占30%左右,因此可认为,本实验中,肠杆菌属对低pH的耐受力有很大提高.Bifidobacterium为常见的碳水化合物水解酸化细菌,其主要代谢产物为乙酸和乳酸.
在产甲烷相中,如图12所示,门水平,Chloroflexi(绿弯菌门),Synergistetes(互养菌门),Bacteroidetes(拟杆菌门),Thermotogae(热袍菌门),分别占总量的36.63%、13.53%、8.74%、7.75%.Chloroflexi其主要属为Anaerolineaceae(厌氧绳菌属,36.13%)为严格厌氧的多细胞丝状微生物,可利用体系内不断积累的有机物,为产甲烷菌提供H2,从而降解有机代谢产物的抑制作用,从而保证厌氧反应的稳定进行[18].互养菌门主要功能是将水解酸化细菌产生的有机酸及醇类分解为乙酸、氢及CO2,其在厌氧污泥中与嗜乙酸型甲烷菌形成互营菌群,具有较高丰度,表明菌群互营作用的强化,使体系可以高效运行[19].吴凡[20]在对同种接种污泥进行测序,发现啤酒废水的厌氧污泥中Thermotogae含量较小.在本实验中,保持温度恒定在35 ℃,经过葡萄糖在中温条件下的驯化后,菌种丰度有明显提高.在以往的研究中,Thermotogae一般存在于高温或者极端高温条件下,而现在也有研究发现其在中温环境中也可生存且丰度较高.在属水平,Mesotoga(弥索袍菌属)所占丰度为7.75%,其与厌氧过程系统的稳定性有重要作用.Methanosarcina(甲烷八叠球菌)为乙酸裂解菌,可利用乙酸、H2及CO2产生甲烷.Aminivibrio(氨基酸降解菌)与氢营养型产甲烷菌为共生关系.Methanobacterium(甲烷杆菌属)为氢型产甲烷菌[21,22].
采用同种接种污泥进行培养,产酸相及产甲烷相中菌群作对比,如图12所示,在门水平,较多菌门发生明显变化.Chloroflexi在产酸相丰度占比为0.15%,而在产甲烷相,其值为36.63%,为主要丰度.在产酸相中,Actinobacteria丰度为42.46%,而产甲烷相中,降低到4.31%.这一结果分析为,较多菌种可在多种复杂环境中生存,因实验中,将产酸相出水进入产甲烷中,因此其出水中极可能混有部分菌种,在两相厌氧中,只是实现相对分相,各相优势菌种得到富集,而并不能实现完全分相.
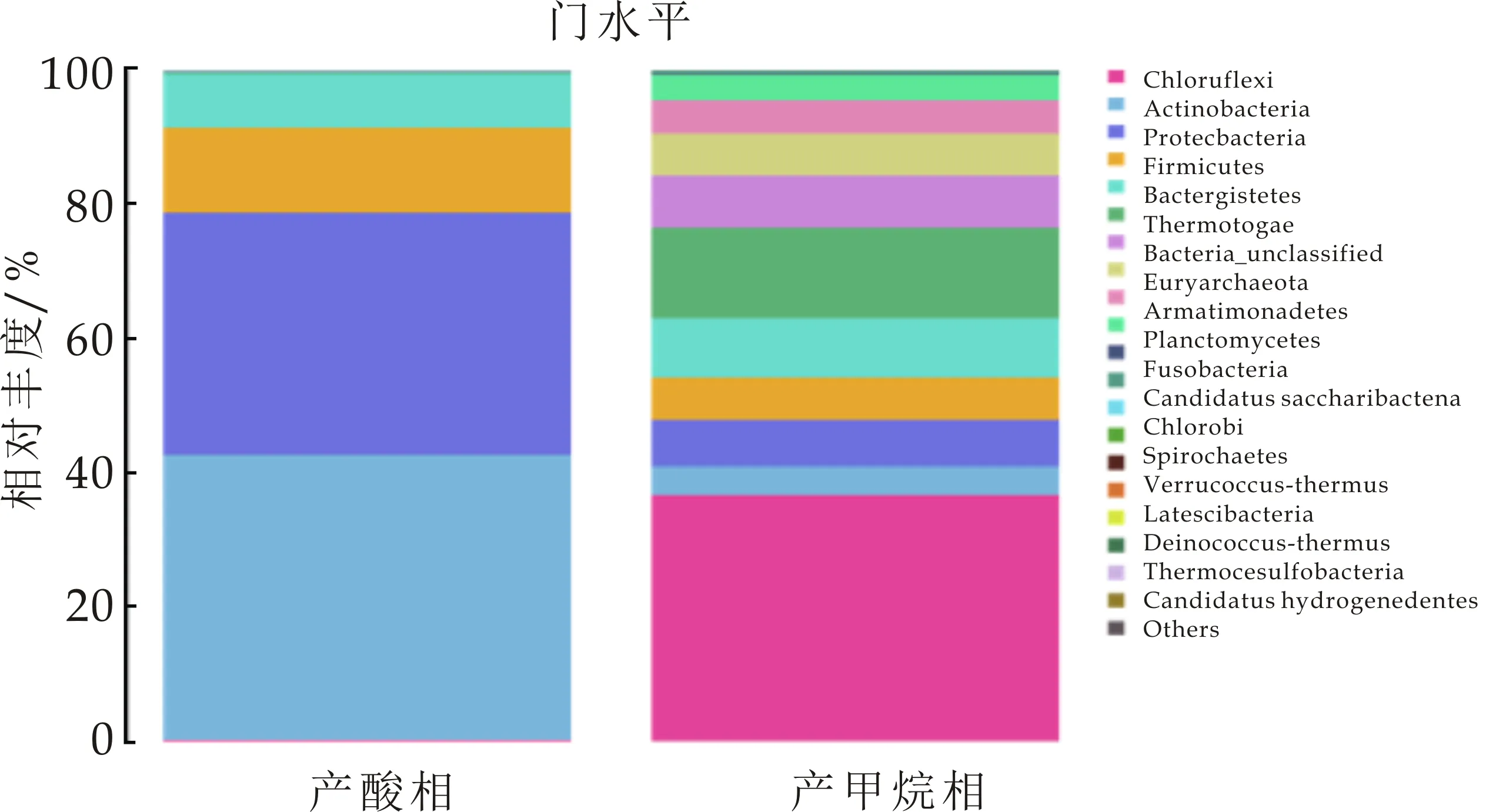
图12 门分类水平产酸相及 产甲烷相测序结果
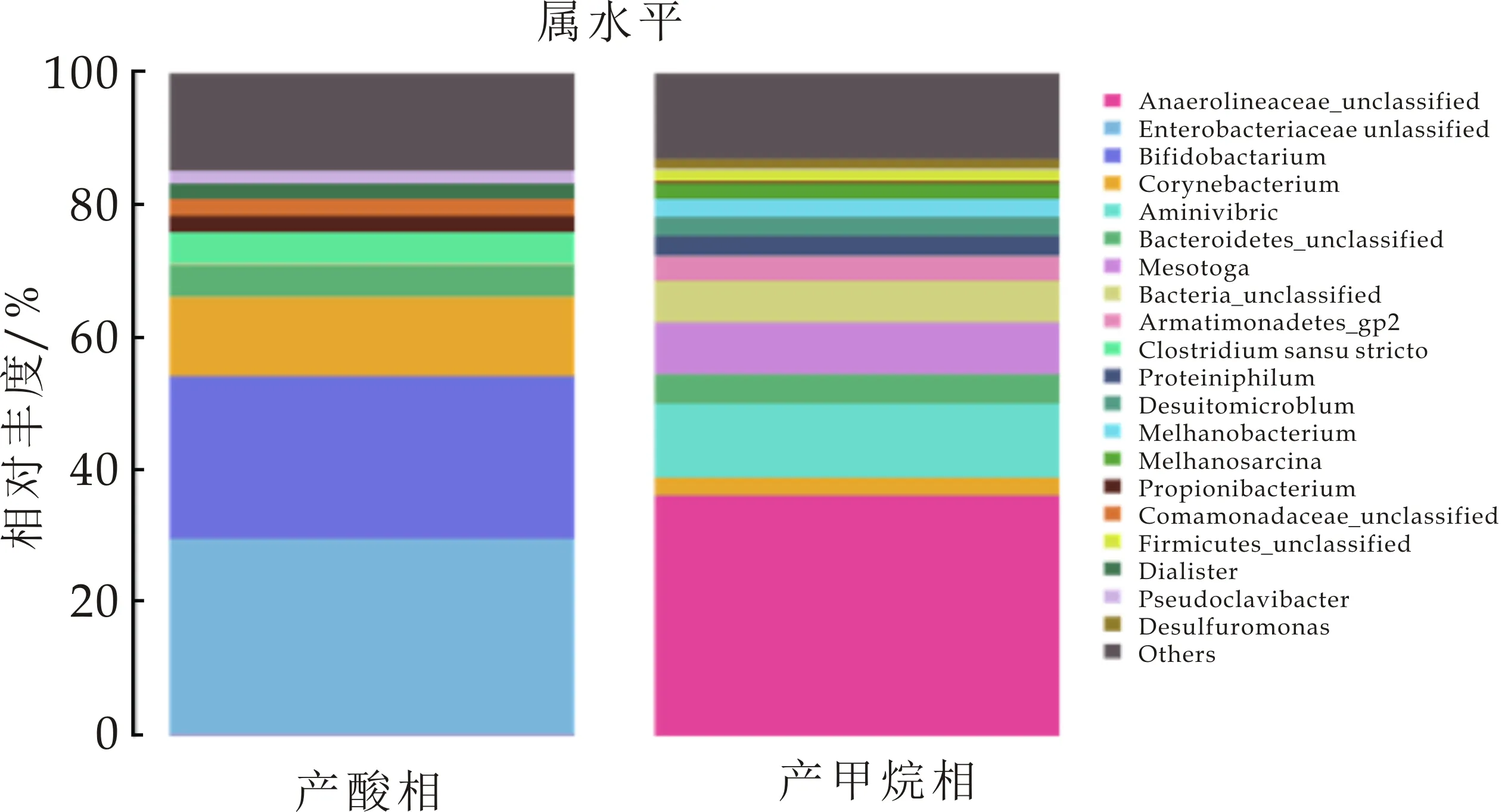
图13 属分类水平产酸相及 产甲烷相测序结果
3 结论
采用两个连续搅拌厌氧反应器进行产酸及产甲烷分相培养,产酸相pH维持在4.3~4.5,ORP为-400~-500 mV.产甲烷相pH维持在7.2左右,ORP为-400~-420 mV.得到的结论如下:
(1)在产酸与产甲烷分相培养的过程中,随着进水负荷的增大,产酸相COD去除率从初期的68%降低到12%,当进水负荷稳定在10 kg/m3·d时,酸化率稳定在45%左右.产酸相始终呈丙酸型发酵.产甲烷相COD去除率在75%~80%.两相反应特征明显.
(2)两相培养过程中,产酸相污泥颜色从开始的灰黑色逐渐变化为灰褐色、淡黄色,最后为乳白色,菌群的形态主要为短杆菌、芽孢菌及丝状菌.产甲烷相污泥始终呈灰黑色,菌群的形态主要为甲烷八叠球菌.
(3)根据16S rDNA测序结果,产酸相中优势菌属为Enterobacteriaceae(肠杆菌属),Bifidobacterium(双歧杆菌科),Corynebacterium(棒杆菌属),Bacteroidetes(拟杆菌),Clostridiumsensustricto(梭状假胞杆菌属).产甲烷相中优势菌属为Anaerolineaceae(厌氧绳菌属),Aminivibrio(氨基酸降解菌),Mesotoga(弥索袍菌属),Methanobacterium(甲烷杆菌属),Methanosarcina(甲烷八叠球菌).
