沉默PLK1基因表达对食管鳞癌细胞肿瘤生物学行为的影响
2019-03-27张少为张耀中廖海江
张少为,陈 阁,张耀中,米 源,廖海江,王 雷
(河北医科大学第四医院胸心外科,石家庄 050011)
食管癌是消化道常见恶性肿瘤之一,其在全球所有恶性肿瘤的发病率占第八位,病死率占第六位。我国是食管鳞癌高发区,每年新发病率和病死率均居世界第一位,在国内食管癌位居全部恶性肿瘤死亡第四位[1]。目前传统治疗方法主要是手术切除辅助放化疗,但食管癌在被确诊时多是中晚期,术后复发和转移的比例高,预后不佳。食管癌发病机制与原癌基因的激活和抑癌基因的失活密切相关,因此从基因分子水平阐明其发生机制是目前研究热点。PLK1(polo-like kinase)作为丝氨酸-苏氨酸激酶家族之一,是细胞有丝分裂关键的调控因子,其在启动、维持和有丝分裂的过程中发挥重要的作用。研究表明PLK1在黑色素瘤、皮肤梅克尔细胞癌、胰腺癌和肝癌等多种恶性肿瘤中高表达[2-5],下调PLK1表达可以通过减少细胞增殖、促进凋亡等机制起到明显抗肿瘤作用。目前全世界关于PLK1 与食管鳞癌发生、发展与上皮-间质转化之间相关的研究较少。本研究通过沉默PLK1基因表达,探讨其与食管鳞癌肿瘤生物学行为的分子机制,旨在为食管鳞癌的靶向治疗提供一个新思路。
1 材料与方法
1.1材料 人食管鳞癌细胞株KYSE-30购自上海通派生物科技有限公司;胎牛血清购自上海素尔生物科技有限公司;Ham和RPMI1640 培养液购自上海钰森生物技术有限公司;SilencerTMSelect PLK1和control siRNA购自美国Life Technologies公司;TaqMan®PLK1引物和探针(Hs00983227_m1)和TaqMan®GAPDH(Hs02758991_g1)购自美国Life Technologies公司;75%酒精购自北京华兴科诺公司;LipofectamineTMRNAiMAX 转染试剂盒和Opti-MEM培养基购自美国Invitrogen公司;iScriptTMcDNA合成试剂盒购自美国Bio-Rad公司;TaqMan®基因表达预混液购自美国Applied Biosystems公司;结晶紫购自美国Sigma公司;2X Laemmli Sample Buffe、Tris/甘氨酸/蛋白电泳缓冲液和Mini-PROTEAN TGX 预制胶购自美国Bio-Rad公司;总RNA提取试剂盒购自上海谱振生物科技有限公司;鼠抗人Vimentin 和GAPDH单克隆抗体购自美国Abcam公司;兔抗人PLK1和C-myc单克隆抗体购自美国Abcam公司;兔抗人MMP2单克隆抗体购自美国Cell Signaling公司;West Femto最高灵敏度化学发光底物试剂盒购自美国Thermo Scientific公司;Pierce-BCA 蛋白分析试剂盒购自上海创赛科技有限公司;PVDF 膜购自美国Millipore公司;甲醇购自天津永大化学试剂有限公司;Transwell膜嵌套、matrigel 胶购自美国BD公司。
1.2方法
1.2.1细胞培养和转染 将食管鳞癌KYSE-30细胞用RPMI 1640 和Ham细胞培养液培养液在37 ℃、CO2维持在5%左右的恒温恒湿的培养箱中培养,待细胞融合达80%左右并将生长状态良好的食管鳞癌KYSE-30细胞接种到6孔板上,按照转染说明书进行转染并设立PLK1 siRNA组及空白对照Control siRNA组,终浓度均为100 nmol/L,转染完成后再培养48 h。
1.2.2Real time荧光定量PCR法检测PLK1 mRNA的表达 首先进行总RNA的提取,用PBS洗涤转染好的食管鳞癌KYSE-30细胞,参照总RNA提取试剂盒说明书提取每组的总RNA,纯化RNA上机检测RNA浓度。然后进行逆转录合成cDNA,参照iScriptTMcDNA合成的说明书进行每组样本cDNA的反转录,在25 ℃5 min,42 ℃ 30 min,85 ℃ 5 min的条件下进行cDNA合成并保存备用。最后进行Real time荧光定量PCR扩增,将Taqman基因表达预混液、TaqMan®PLK1物和探针0.5 μL或TaqMan®GAPDH引物和探针、样本cDNA,上机在95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s的条件下进行PCR扩增,共40个循环。以GAPDH的Ct值为标准,用2-ΔCt法进行分析。
1.2.3Western blot检测PLK1蛋白的表达 PBS洗涤转染48 h后KYSE-30细胞加到6孔板上,每孔总蛋白提取试剂100 μL并含有蛋白酶抑制剂的M-PER细胞,收集样本的总蛋白提取液并离心取上清液,用BCA 法测定样本的总蛋白浓度。再转印槽中加上Tris/甘氨酸/蛋白电泳液,在Mini-PROTEAN TGX 预制胶中行每组样本蛋白上样,进行电泳。用双蒸水冲洗凝胶,在Tris/甘氨酸缓冲液中转至PVDF膜(冰浴),室温含5%脱脂奶粉的TBST液封膜1 h,加入一抗PLK1(1∶1 000)、一抗C-myc(1∶1 000)、一抗Vimentin(1∶10 000)、一抗GAPDH(1:20 000)、一抗MMP2(1∶1 000)、4 ℃摇床孵育过夜。第2天TBST洗膜3次,二抗室温孵育1 h,TBST洗膜3次,将发光底物滴于PVDF膜上,5 min后于暗室曝光显影,用 Image软件对蛋白灰度值进行分析。
1.2.4流式细胞术检测细胞周期的变化 将转染48 h的KYSE-30细胞用PBS洗涤,胰酶消化,PBS漂洗,离心,吹打均匀重悬细胞,加入4 ℃70%冰乙醇固定30 min以上。PBS去除乙醇,重悬细胞并加碘化丙啶和RNaseA的PBS,避光4 ℃染色。尼龙网过滤后用MuticycleAV分析软件进行细胞周期分析,PI 激发波长488 nm。
1.2.5Transwell侵袭实验 液化Matrigel胶于聚碳酸酯膜。将转染48 h的KYSE-30细胞加入Transwell小室上室。下室加10%PBS的细胞培养液,于恒湿恒温箱中进行孵育,24 h后将靠近内室一面的基质胶和细胞去掉,室温甲醇固定30 min,最后用0.1%结晶紫染色清水漂洗晾干膜,紧接着在显微镜下进行观察,随机选取4个高倍视野进行计数。
2 结 果
2.1Real time荧光定量PCR法检测PLK1 mRNA的表达 PLK1 siRNA组PLK1 mRNA表达0.29±0.03较Control siRNA 组1.00±0.02明显降低,差异有统计学意义(t=37.90,P=0.000),见图1。

图1 两组PLK1 mRNA的表达情况
2.2Western blot 检测PLK1蛋白的表达 PLK1 siRNA组PLK1、 C-myc、Vimentin、MMP2蛋白表达较Control siRNA组均明显降低,差异有统计学意义(t=40.72、24.57、25.15、8.85,P<0.05),见图2。
2.3流式细胞术检测细胞周期变化 PLK1 siRNA组G2/M、S期细胞与Control siRNA组比较明显降低(P<0.05),G0/G1期细胞无明显变化(P>0.05),见表1。
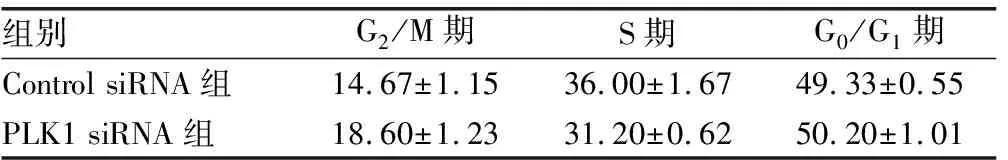
表1 流式细胞术检测细胞周期的变化
2.4Transwell侵袭实验 与Control siRNA组穿膜细胞数(94.00±4.04)个比较,PLK1 siRNA组(44.00±4.51)个明显减少,差异有统计学意义(t=14.30,P=0.000),见图3。

A:Contor siRNA组;B:PLK1 siRNA组
图3两组细胞侵袭能力的变化(×400)
3 讨 论
PLKs是丝氨酸/苏氨酸激酶,家族中包括从PLK1到PLK5,在细胞周期的各个时相的调控中发挥着核心作用。其中PLK1作为细胞周期检控点的主要调节者,在有丝分裂过程与纺锤体形成及染色体的分离具有密切关系,此外,研究表明PLK1的高表达和肿瘤的发生、发展及预后密切相关,可以作为一个潜在的有效抗肿瘤靶点[6-8]。RNA干扰技术属于转录后基因沉默机制,可以使靶基因mRNA沉默达到定向敲除与肿瘤细胞发生、发展相关基因的功效,因其具有高特异性和高效性等特点作为一种崭新的实验方法被广泛应用于基因功能的研究及肿瘤细胞信号传导通路的分析。本研究应用siRNA沉默KYSE-30细胞PLK1基因表达,结果显示KYSE-30细胞中存在PLK1高表达,RNA干扰可明显减少肿瘤细胞PLK1 mRNA和蛋白表达。
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,受细胞周期蛋白、多种激素、细胞周期蛋白激酶、 三磷酸肌醇(IP3)、Ca信使系统及细胞周期蛋白激酶抑制剂等多个蛋白共同调节,当细胞周期紊乱可导致肿瘤细胞异常增殖。PLK1 作为细胞周期依赖性激酶,在细胞有丝分裂调节过程中可以通过促进中心体成熟、细胞周期由G2期进入M期及染色体分离等功能发挥重要作用。阻止癌细胞增殖和促进凋亡是肿瘤基因治疗的基本原则,AMANI等[9]采用PLK1靶向抑制剂BI 6727处理神经胶质瘤细胞发现,可以通过显著阻滞细胞于G2/M期,导致肿瘤细胞增殖和凋亡增加。本研究应用流式细胞术分析了转染PLK1 siRNA对KYSE-30细胞的周期分布变化的影响,发现转染组较空白对照组相比可将更多细胞阻滞于G2/M期,从而调控肿瘤细胞的增殖,这与AMANI等的结果相一致。TAN等[10]研究发现PLK1是肿瘤细胞中PDK1-PLK1-Myc通路的核心成分,活化状态的PLK1进一步激活Myc促进肿瘤的生长增殖和分化。笔者同时检测了细胞周期相关蛋白C-myc的表达来进一步探讨食管鳞癌细胞PLK1表达和周期变化的可能机制,结果发现沉默PLK1基因后PLK1和C-myc蛋白表达下调,表明在食管鳞癌细胞周期调控中PLK1发挥重要作用,其可以通过上调C-myc表达促进细胞异常增殖。
上皮-间质转化是上皮来源的恶性肿瘤侵袭转移的重要机制之一,主要以E-Cadherin等上皮表型标志下调[11],Vimentin等间质表型特征分子表达上调为特征[12-13]。Vimentin可以通过调节MT1-MMP改变乳腺癌细胞的黏附及迁移能力,并且与患者的预后密切相关,下调Vimentin表达可以影响肿瘤细胞的侵袭和迁移能力[14]。此外,细胞外基质的降解也是肿瘤侵袭及转移重要的一部分,肿瘤细胞可以通过破坏细胞外基质扩散并浸润到周围正常组织,MMP2是锌结合内肽酶家族成员之一,高表达的MMP2在多种肿瘤组织中可以通过降解、破坏肿瘤附近的细胞基质,促进肿瘤细胞的侵袭及转移[15-16]。本研究表明抑制PLK1表达后可导致Vimentin和MMP2蛋白表达下调,Transwell侵袭实验进一步显示穿膜细胞数明显减少,可以说明敲掉PLK1基因后可以抑制肿瘤细胞上皮-间质转化,并减少了MMP2介导的细胞外基质的破坏,从而降低食管鳞癌细胞的侵袭能力,分析其原因可能是PLK1通过诱导食管鳞癌细胞的EMT过程促进侵袭转移。
总之,本研究发现PLK1在食管鳞癌细胞的异常增殖和促进侵袭转移过程中发挥重要作用,但是具体的调控机制尚需进一步研究,PLK1有望成为食管鳞癌分子靶向治疗的重要靶标。
