NLRC5对HepG2.2.15细胞中MHC-Ⅰ类分子的调节作用
2019-03-27王文龙盛云建
秦 娇,王文龙,盛云建,强 丽,吴 刚
(西南医科大学附属医院,四川泸州 646000)
乙型肝炎病毒(HBV)感染后引起的免疫应答是肝细胞损伤及炎症发生的主要机制,而炎症反复存在是慢性乙型肝炎进展为肝硬化甚至肝癌的重要因素。在HBV感染期间,HBV特异性T细胞的数量和功能与HBV控制情况有关[1]。因此,HBV特异性细胞毒性T淋巴细胞(CTL)不能有效清除感染HBV的细胞是造成乙型肝炎慢性化甚至肝癌的重要因素。经典的主要组织相容性复合体Ⅰ类分子(MHC-Ⅰ类分子)通过提呈抗原肽而激活T淋巴细胞,CD8+CTL识别MHC-Ⅰ类分子提呈的内源性抗原肽,参与适应性免疫应答。在肝母细胞癌实验中发现HBV感染可下调MHC-Ⅰ类分子HLA-ABC、HLA-E和MICA的表达[2]。
肽聚糖的核苷酸结合寡聚化结构域样受体家族(NLRs家族)是细胞内模式识别受体(PRR)中一个很大的蛋白家族。NLRC5蛋白作为NLRs家族成员之一,近年多项研究表明,在天然免疫及适应性免疫起重要作用。NLRC5蛋白可参与MHC-Ⅰ基因及其相关基因的调节,如β2-微球蛋白、Tap1和Lmp2基因的表达[3-4]。而NLRC5对HBV感染后所致的MHC-Ⅰ下调是否起作用,目前尚未见相关报道。Hep G2.2.15细胞是Hep G2细胞的衍生系,可持续、稳定地释放HBV。笔者将NLRC5能否诱导MHC-Ⅰ类分子表达增加的调控机制应用于Hep G2.2.15细胞,观察NLRC5在Hep G2.2.15细胞中对MHC-Ⅰ类分子表达的调控作用。
1 材料与方法
1.1细胞及材料 Hep G2细胞株由本实验室保存,Hep G2.2.15细胞由重庆医科大学肝研所赠予,复苏、培养至细胞呈对数期生长用于实验。 DMEM培养基及胎牛血清(美国Hyclone公司);liprofectamineTM2000(美国Introvigen公司)、Opti-MEM (美国Gibco公司)。pc DNA3.1质粒购自中国质粒菌株基因库;总RNA提取试剂盒、逆转录试剂盒(天根公司);PCR引物由上海Invitrogrn生物公司合成。 Anti-NLRC5(一抗)、山羊抗兔二抗(HRP,英国Abcam公司)。FITC标记鼠抗人HLA-ABC抗体(美国eBioscience公司)。
1.2方法
1.2.1实验分组 A组:Hep G2组,B组:Hep G2+IFN-γ(5 ng/mL)组,C组:Hep G2.2.15组,D组:Hep G2.2.15+IFN-γ(5 ng/mL)组,E组:Hep G2.2.15+pcDNA3.1-NLRC5-GFP;F组:Hep G2.2.15 + pcDNA3.1组。
1.2.2质粒转染 待细胞数量达80%时准备转染,将250 μL Opti-MEM与30 μL的 liprofectamineTM2000混合后静置20 min,分别将pcDNA3.1-NLRC5-GFP、pcDNA3.1加入混有转染剂的培养基中静置10 min。加入3每毫升×106细胞悬液,混匀后置于培养箱中,6 h后换液。
1.2.3RT-PCR 从细胞中提取细胞总RNA。取 0.5 μg RNA按逆转录试剂盒制备cDNA,逆转录原液稀释10倍,将试剂及样本cDNA混匀,放入定量PCR仪,并按下列条件进行cDNA扩增反应:94 ℃预变性10 min,94 ℃变性30 s,58 ℃退火30 s,68 ℃延伸25 s,共40个循环。所有样本均设置3个平行管。
1.2.4Western blot 收集细胞进行蛋白提取,配置浓度为0.5 mg/mL标准液,根据BCA法测定各样品的蛋白浓度,然后进行SDS-PAGE电泳,分别以60 V电泳浓缩胶、120 V电泳分离胶。选用PVDF膜进行转膜,室温封闭2 h,一抗4 ℃孵育过夜,TBST洗膜后加入(1∶3 500),室温下孵育2 h;用ECL化学发光法显影。
1.2.5流式细胞学检测 取对数生长的细胞,经胰蛋白酶消化后制成细胞悬液,调定浓度为每毫升1×106个,将细胞用2 μL/mL的CFSE在37 ℃染色30 min,洗涤2次,以 FITC标记的鼠抗人HLA-ABC抗体室温孵育10 min,使用流式细胞仪进行检测,每个抗体重复3次,记录激发波长488 nm处绿色荧光。
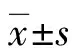
2 结 果
2.1HBV对NLRC5转录水平及蛋白的表达影响 与Hep G2组相比,Hep G2.2.15组细胞中的NLRC5转录水平及蛋白表达水平均下降(P<0.05),见图1。

图1 HBV对NLRC5转录水平及蛋白的表达影响
2.2IFN-γ对NLRC5转录水平及蛋白的表达影响 Hep G2细胞加入IFN-γ后,NLRC5的转录水平及蛋白表达水平均增加(P<0.05),Hep G2.2.15细胞在IFN-γ刺激后不能提高NLRC5的蛋白表达水平,见图2。

图2 IFN-γ对NLRC5转录水平及蛋白的表达影响
2.3HBV对MHC-Ⅰ类分子表达的影响 与Hep G2细胞相比,Hep G2.2.15细胞中的MHC-Ⅰ类分子的表达水平降低(P<0.05),见图3。

图3 HBV对MHC-Ⅰ类分子表达的影响
2.4转染NLRC5蛋白后Hep G2.2.15细胞的表达情况 转染NLRC5后的转录及蛋白表达水平均增加(P<0.05),见图4。
2.5MHC-Ⅰ类分子在稳定表达NLCR5的Hep G2.2.15细胞表面的表达情况 C组、E组、F组的MHC-Ⅰ类分子MFI分别为16.17、17.86、16.59。与未转染组相比,过表达NLRC5蛋白后的Hep G2.2.15细胞表面的MHC-Ⅰ类分子表达上调(P<0.05),见图5。
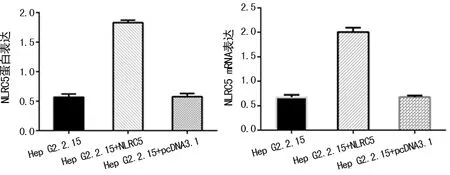
图4 转染NLRC5蛋白后Hep G2.2.15细胞的表达情况
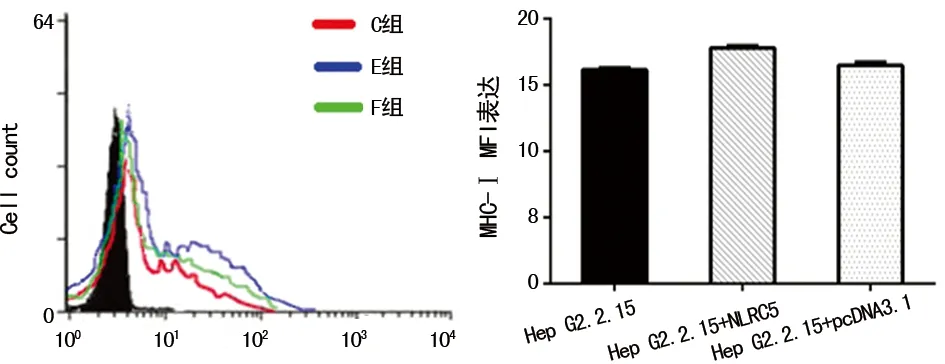
图5 MHC-Ⅰ类分子在稳定表达NLCR5的Hep G2.2.15细胞表面的表达情况
3 讨 论
病原相关分子模式(PAMP)作为先天免疫反应的第一道防御入侵微生物的防线,其识别依赖于几类PRR。NLRC5蛋白作为NLRs家族成员之一,近年来广泛在天然免疫及适应性免疫应答、抗感染、肿瘤等领域被研究。NLRC5具有非典型NLRs结构,即位于中心的腺苷酸三磷酸酶结构域、位于N端的效应器控制域(CARD 属于死亡折叠域),与NLRs其他家族成员的CARD或PYD没有同源性,为非典型的CARD结构域及位于C端最长的亮氨酸重复序列区域(LRR结构)[5-8]。研究发现,NLRC5广泛表达于人体多个组织,而免疫相关组织,如骨髓造血组织、淋巴结、脾和外周血淋巴细胞中NLRC5的表达最高[9],表明NLRC5参与免疫应答过程。NLRC5表达被TLR3配体[poly(I∶C)]、病毒感染或IFN-γ触发[7,10-11]。HBV是一种双链DNA病毒,在本实验中发现,在HBV感染后的肝细胞中可发现NLRC5表达,表明NLRC5在HBV感染机体后引起的免疫应答过程中起着一定的作用,可能参与了HBV的清除作用。IFN-γ是一种主要由Th1细胞、CD8+T淋巴细胞、NK细胞、巨噬细胞等免疫细胞分泌的细胞因子,IFN-γ可通过刺激JAK-STAT信号、途径激活NLRC5基因表达[12]。研究发现,免疫系统的IFN-γ-NLRC5-MHC-Ⅰ轴对于CD8+T细胞应答和细胞内病原体的有效杀伤至关重要[13]。本实验用等量的IFN-γ分别刺激Hep G2细胞和Hep G2.2.15细胞后得到NLRC5在转录水平及蛋白水平均呈上升趋势。
笔者发现经典MHC-Ⅰ类分子表达在Hep G2.2.15细胞中低于Hep G2细胞,Hep G2.2.15细胞不仅具有Hep G2细胞生物学活性,同时又能够持续、稳定地分泌HBV,表明HBV感染机体情况下可下调MHC-Ⅰ类分子表达,这与文献一致[2]。MHC-Ⅰ类分子分布于有核细胞表面,通过提呈抗原肽而激活CD8+T淋巴细胞,参与适应性免疫应答。HBV感染宿主细胞后,其表面MHC-Ⅰ类分子表达下调或丢失,因此在宿主细胞表面不易形成足够的抗原肽-MHC分子复合物,导致机体出现免疫耐受。目前认为,HBV感染机体后诱导机体出现免疫耐受是导致乙型肝炎慢性化的重要因素[14]。HBV特异性免疫应答在HBV清除过程中起重要作用,MHC-Ⅰ类分子限制性的CD8+CTL可诱导肝细胞凋亡,也可分泌IFN-γ,以非细胞裂解机制抑制其他肝细胞内HBV基因复制和表达。慢性HBV感染患者的CTL免疫应答能力减弱是HBV感染趋于慢性化的主要原因[15]。
尽管NLRC5在天然免疫应答中的作用仍有争议,但最近发现的MHC-Ⅰ类反式激活因子(CITA)也属于NLR蛋白家族,并构成MHC-Ⅰ类基因转录激活的关键调节因子[16]。NLRC5作为MHC-Ⅰ类分子的反式激活因子,诱导经典MHC-Ⅰ的表达(即HLA-A、HLA-B、HLA-C),非经典的Ⅰ类(即HLA-E、HLA-F,HLA-G),β亚基(B2M),免疫蛋白酶体组分(PSMB9,即LMP2)和肽转运蛋白(TAP1)[17]。有研究团队发现,流感病毒感染NLRC5缺陷型小鼠,在体内降低了MHC-Ⅰ类分子表达,CD8+T细胞功能受损及病毒滴度增加[18]。NLR家族成员NLRC5在各种类型的感染过程中调节MHC-Ⅰ的表达,但其在对HBV免疫中的作用尚未得到充分研究。为探求HBV感染机体时NLRC5能否刺激MHC-Ⅰ类分子表达,笔者将外源性NLRC5转染到Hep G2.2.15细胞,经RT-PCR及流式细胞术分别得到上调的MHC-Ⅰ类分子表达。表明在Hep G2.2.15细胞中,NLRC5可上调MHC-Ⅰ类分子表达,提出NLRC5对HBV感染的免疫应答中起重要作用。
上述研究发现,HBV感染后NLRC5蛋白和MHC-Ⅰ类分子表达均下调。HBV感染人体后可降低其抗原呈递能力,从而逃逸免疫监督,导致特异性CTL不能有效清除HBV,机体呈持续HBsAg、HBeAg阳性表现。HBV特异性CTL免疫杀伤效应的降低可能与HBV感染后导致的NLRC5表达下调有关。在HepG2.2.15细胞中过表达NLRC5,证实了NLRC5可以上调HepG2.2.15细胞MHC-Ⅰ类分子表达,而MHC-Ⅰ类分子表达增加促进HBV特异性CTL更好地发挥免疫杀伤效应,这对揭示乙型肝炎免疫耐受机制具有重要意义。因此,NLRC5是否通过MHC-Ⅰ类分子增强HBV特异性CD8+T淋巴细胞的免疫杀伤作用可进一步证实,从而为打破乙型肝炎免疫耐受提供理论依据。
