白细胞介素-1受体拮抗蛋白对大鼠创伤性骨 关节炎的治疗作用及机制研究
2019-03-27宋思琦胡毓诗
宋思琦,吴 丹,胡毓诗△
(1.成都体育学院运动医学与健康学院,成都 610041;2.北京体育大学运动人体科学学院,北京 100084)
创伤性骨关节炎(post-traumatic osteoarthritis,PTOA)是一种由于创伤引起的关节软骨退化、增生、骨化的一种OA,临床病症主要变现为关节疼痛、关节活动障碍等[1-2]。近年来,由于交通事故、外伤的增多,PTOA的发生率呈现上升的趋势[1-2]。目前学者对于PTOA的自然演变过程不甚了解,但由于创伤的作用,导致的关节软骨的降解速度远大于合成速度已成为PTOA的重要病理机制之一[2-4]。白细胞介素-1(IL-1)是一种常见的促炎因子,能够通过特异性的结合于软骨表面的IL-1受体,促进软骨降解,并分解细胞外基质,是OA发生、发展过程中的中心环节[5-7]。白细胞介素-1受体拮抗蛋白(interleukin -1 receptor antagonist protein,IL1RA)是IL-1天然拮抗剂,能阻断IL-1与其受体的结合,进而抑制IL-1α/β对软骨的破坏。研究已经显示IL1RA对OA具有治疗作用[8],但对于PTOA的治疗作用报道较少,因此本研究将对此展开研究。
1 材料与方法
1.1实验动物 50只体质量200~250 g的清洁级健康成年SD大鼠购自北京维通利华实验动物有限公司,均在(23±2)℃的室内温度内自由饮食和摄水。
1.2主要试剂与仪器 细胞裂解液购自北京普利莱基因技术有限公司;超敏发光液购自赛默飞世尔科技(中国)有限公司;PVDF膜购自美国Millipore公司;兔抗MMP-1、MMP-13、ADAMTs-4、ADAMTs-5、TIMP-1、TIMP-3及GAPDH多克隆抗体均购自美国Abcam公司;Ⅱ型胶原酶购自美国Gibco公司;IL-1β、IL-8及TNF-α ELISA试剂盒均购自武汉博士德生物技术有限公司。Chemi DocTM XRS+超高灵敏度化学发光成像系统、CFX ConnectTM实时荧光PCR仪购自伯乐生命医学产品(上海)有限公司;UV-1600PC型紫外分光光度计购自上海美谱达仪器有限公司。
1.3方法
1.3.1PTOA大鼠模型的复制、分组及给药 参考文献[1,3],采用前交叉韧带切断(ACLT)复制PTOA大鼠模型。将造模成功的大鼠分为模型组,IL1RA低、中、高剂量组(10、20、40 mg/mL),另外将只打开关节腔的大鼠设立为假手术组,每组10只。造模成功后每天按分组情况进行大鼠关节腔注射,连续14 d。将大鼠处死,取关节软骨置于-80 ℃冰箱待测。
1.3.2ELISA检测软骨组织中IL-1β、IL-8及TNF-α水平 取适量软骨组织,匀浆后加入细胞裂解液裂解,离心取上清液,按IL-1β、IL-8及TNF-α ELISA试剂盒说明书测定IL-1β、IL-8及TNF-α水平。
1.3.3Realtime PCR法检测COL-Ⅱ、Aggrecan、MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 mRNA的表达 将适量软骨组织匀浆后,加入Trizol裂解液,并采用Trizol法抽提总RNA。紫外分光光度计测定RNA纯度,当OA260nm/OA280 nm比值在1.8~2.1,根据逆转录试剂盒说明书逆转录RNA,最后根据Realtime PCR扩增试剂盒检测RNA。扩增结果利用2-ΔΔCT法进行分析。反应条件:95 ℃预变性30 s,95 ℃变形5 s,60 ℃退火25 s,45个循环。
1.3.4Western blot检测软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5、TIMP-1及TIMP-3蛋白的表达 将适量软骨组织匀浆后,加入细胞裂解液裂解组织,离心收获上清液。测定上清液蛋白浓度,并定量。制作浓缩胶及分离胶,上样,进行凝胶电泳,转PVDF膜,2%BSA室温封闭1 h,一抗(兔抗MMP-1、MMP-13、ADAMTs-4、ADAMTs-5、TIMP-1、TIMP-3及GAPDH多克隆抗体)4 ℃孵育过夜,二抗室温孵育,加入曝光液后,在凝胶成像系统中报告,并根据Image J软件分析电泳条带灰度值。
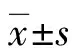
2 结 果
2.1各组大鼠软骨组织中IL-1β、IL-8及TNF-α水平 与假手术组比较,模型组软骨组织中IL-1β、IL-8及TNF-α水平明显提高(P<0.01);与模型组比较,IL1RA低、中、高剂量组软骨组织中IL-1β、IL-8及TNF-α水平明显降低(P<0.01),见表1。
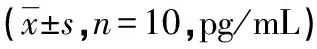
表1 各组大鼠软骨组织中IL-1β、IL-8及TNF-α水平

组别IL-1βIL-8TNF-α假手术组4.58±0.546.42±0.675.18±0.55模型组17.32±2.13∗19.44±2.08∗26.78±2.94∗低剂量组13.20±1.42#15.37±1.78#20.04±2.00#中剂量组9.28±1.05#10.76±1.34#13.15±1.54#高剂量组5.93±0.72#7.24±0.73#7.41±0.75#
*:P<0.01,与假手术组比较;#:P<0.01,与模型组比较
2.2各组大鼠软骨组织中COL-Ⅱ、Aggrecan mRNA的表达 与假手术组比较,模型组软骨组织中COL-Ⅱ、Aggrecan mRNA表达明显下调(P<0.01);与模型组比较,IL1RA低、中、高剂量组软骨组织中COL-Ⅱ、Aggrecan mRNA表达明显上调(P<0.01),见表2。
2.3各组大鼠软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 mRNA的表达 与假手术组比较,模型组软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 mRNA表达明显上调(P<0.01);与模型组比较,IL1RA低、中、高剂量组软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 mRNA表达明显下调(P<0.01),见表3。
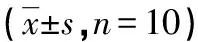
表2 各组大鼠软骨组织中COL-Ⅱ、Aggrecan mRNA表达的变化
*:P<0.01,与假手术组比较;#:P<0.01,与模型组比较
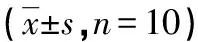
表3 各组大鼠软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 mRNA表达情况
*:P<0.01,与假手术组比较;#:P<0.01,与模型组比较
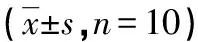
表4 各组大鼠软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 蛋白表达情况
*:P<0.01,与假手术组比较;#:P<0.01,与模型组比较
2.4各组大鼠软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 蛋白的表达 与假手术组比较,模型组软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5蛋白表达明显上调(P<0.01);与模型组比较,IL1RA低、中、高剂量组软骨组织中ADAMTs-4、ADAMTs-5蛋白表达明显下调(P<0.01),IL1RA中、高剂量组软骨组织中MMP-1、MMP-13蛋白表达明显下调(P<0.01),见图1、表4。

A:假手术组;B:模型组;C:IL1RA低剂量组;D:IL1RA中剂量组;E:IL1RA高剂量组
图1各组大鼠软骨组织中MMP-1、MMP-13、ADAMTs-4、ADAMTs-5蛋白表达的变化

A:假手术组;B:模型组;C:IL1RA低剂量组;D:IL1RA中剂量组;E:IL1RA高剂量组
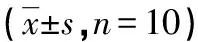
图2 各组大鼠软骨组织中TIMP-1、TIMP-3蛋白表达情况
*:P<0.01,与假手术组比较;#:P<0.01,与模型组比较
2.5各组大鼠软骨组织中TIMP-1、TIMP-3蛋白表达情况 与假手术组比较,模型组软骨组织中TIMP-1、TIMP-3蛋白表达明显下调(P<0.01);与模型组比较,IL1RA低、中、高剂量组软骨组织中TIMP-1、TIMP-3蛋白表达明显上调(P<0.05),见图2、表5。
3 讨 论
IL1RA作为IL-1的天然拮抗剂,能够特异性的结合于软骨表面的IL-1受体,进而抑制IL-1α/β对软骨的破坏作用[8]。研究显示在大鼠关节软骨急性损伤期关节腔注射IL1RA,能明显上调miR-27b、miR-140、miR-125b进而抑制软骨的分解[9]。而且IL1RA能明显降低ACLT复制的PTOA大鼠的软骨及滑膜评分,同时抑制软骨细胞凋亡[10]。进而提示IL1RA对PTOA大鼠具有一定治疗作用,但具体的作用机制不甚了解。本研究首先通过ACLT构建PTOA大鼠模型,进而检测不同剂量的IL1RA对PTOA大鼠关节软骨中炎症因子水平的影响,结果表明IL1RA能明显降低IL-1β、IL-8及TNF-α水平,IL-1β、IL-8及TNF-α主要是由活化的单核-巨噬细胞分泌产生的促炎因子,其中TNF-α不仅能够破坏软骨,还可以促进IL-1β、IL-8的分泌进而加重软骨的损伤,而且IL-1β、IL-8及TNF-α能够刺激细胞外基质降解酶的分泌加速细胞外基质的降解,进而加重软骨损伤。研究显示人PTOA或动物模型PTOA中IL-1β、IL-8及TNF-α的水平均明显提高[11-12],因此本研究结果表明IL1RA能明显的通过减少IL-1β、IL-8及TNF-α分泌,进而抑制PTOA大鼠软骨损伤。
软骨主要由软骨细胞及细胞外基质组成,后者主要由胶原蛋白及Aggrecan组成。其中COL-Ⅱ占软骨胶原蛋白90%以上,维持着软骨的三维网状结构,为细胞外基质提供支架及弹性。蛋白多糖含有大量亲水性的支链,能够维持着软骨的润滑及抗压作用。当软骨降解速度远大于合成速度后,说明软骨细胞分泌大量的降解酶,如MMPs及ADAMTs。MMPs是一种依赖于Zn2+的蛋白水解酶,其中的胶原酶MMP-1能够降解Ⅰ、Ⅱ、Ⅲ、Ⅶ、Ⅷ、Ⅹ型胶原酶,MMP-13不仅能够降解软骨特异性COL-Ⅱ及新生的COL-Ⅱ,还能够激活其他MMPs,发挥其对胶原的降解作用。ADAMTs是一种新型的金属蛋白酶,对Aggrecan具有明显的降解作用。目前研究最多的ADAMTs为ADAMTs-4及ADAMTs-5,二者在软骨、心脏、脑等多种组织器官中有表达,并有多个Aggrecan水解酶位点,同时受IL-1等炎症因子的影响。另外细胞外基质的降解速度大于合成速度,也源自于TIMPs分泌量的减少。TIMPs不仅能够与1∶1的比例与MMPs特异性结合,还是ADAMTs内源性的抑制剂。其中TIMP-1能与MMP-1及MMP-13结合抑制二者的表达,TIMP-3能与ADAMTs-4及ADAMTs-5结合抑制二者的表达。研究显示ADAMTs-4及ADAMTs-5基因敲除的小鼠OA能得到明显改善,而且体外通过IL-1β诱导软骨细胞后并敲除ADAMTs-4及ADAMTs-5表达,能明显的抑制Aggrecan的降解[13]。TIMP-1及TIMP-3在OA体外或体内模型中表达量均明显降低[14-15]。因此通过上调TIMP-1及TIMP-3表达,进而抑制MMP-1、MMP-13、ADAMTs-4及ADAMTs-5表达,能明显抑制COL-Ⅱ及Aggrecan含量的减少,进而降低软骨细胞外基质的降解速度。所以本研究进一步探讨IL1RA对PTOA大鼠软骨组织中胶原蛋白、Aggrecan、细胞外基质合成与降解蛋白表达的影响,结果表明IL1RA能明显上调COL-Ⅱ mRNA、Aggrecan mRNA、TIMP-1蛋白、TIMP-3蛋白表达,下调MMP-1、MMP-13、ADAMTs-4、ADAMTs-5 mRNA及蛋白表达,进而维持软骨基本结构。
综上所述,IL1RA能够通过促进软骨细胞外基质合成,抑制基质降解,进而抑制PTOA大鼠软骨损伤。
