乙醛氧化生成乙酸反应机理的分子模拟
2019-02-22武志强代振宇王立华
夏 垒, 龙 军, 武志强, 赵 毅, 代振宇, 王立华
(中国石化 石油化工科学研究院, 北京 100083)
醛类化合物是一类重要的有机原料及化学中间体,其可以通过还原反应制备醇类化合物[1-2],还可以通过氧化作用制备羧酸类化合物[3-5]。其中醛类化合物氧化得到相应的羧酸的反应无论是在有机合成还是在精细化工中都具有十分重要的意义和巨大的应用价值。例如,由对硝基苯甲醛氧化得到的对硝基苯甲酸被广泛应用于医药工业生产盐酸普鲁卡因、头孢菌素等或是应用于精细化工业生产滤光剂和防晒剂等[3];由巴豆醛氧化得到的巴豆酸则被应用于精细化工业制备热熔性胶黏剂[4];工业上低碳脂肪酸大部分是以化学方法合成的,其中醛氧化法就是羧酸生产的主要工艺之一[5]。
醛类化合物氧化为羧酸类化合物的反应虽然十分重要,但是并非所有情况下都是有益的。由于羧酸类化合物具有一定的酸性,可以与很多金属材料发生反应,从而对材料产生腐蚀。石油产品如燃料油、润滑油等,大部分本身很少含有羧酸类化合物,不会对材料造成腐蚀。因此出于成本的考虑,其在储存、运输和使用过程中所用的材料很少选择耐蚀材料。然而在这些过程中油品会逐渐氧化形成醇、醛、酮和羧酸等物质[6],其中的羧酸类氧化产物会对储存器皿、输运管道和机械部件等产生腐蚀,从而影响材料服役寿命[7-8]。石油产品氧化产生的羧酸类化合物主要是通过氧化产生的醛类化合物进一步氧化形成的。如果能从根源上减少羧酸类化合物的产生无疑将是更有效和更根本的措施。
醛氧化生成羧酸的反应机理一般认为是自由基链反应机理。常温下醛就可以自动地以很慢的速率吸收空气中的氧而被氧化生成过氧羧酸,过氧羧酸进一步生成羧酸的过程目前提出了2种可能的反应路径,一种方式是一分子过氧羧酸与一分子醛反应生成化学中间体,并进一步分解生成两分子羧酸[9];另一种方式是过氧羧酸离解产生自由基,并进一步发生一系列的自由基链反应生成羧酸[10]。
对于醛类化合物氧化生成羧酸类化合物的机理通过实验研究已经产生了一定的认识,然而对反应过程中基元反应的细节和各基元反应之间的内在联系尚缺乏深入的理解和分析,当前研究多偏重于采用实验方法改进生产工艺和/或开发反应活性更好的催化剂等方面[5,9],缺乏对反应机理的深入研究。随着量子化学理论和计算机技术的进步,分子模拟逐步成为帮助人们从分子甚至原子水平上认识物质性质及反应过程的重要工具[11]。笔者以乙醛氧化为乙酸的过程为基础,借助分子模拟技术对醛氧化生成羧酸反应体系中的各基元反应进行了深入研究,期待从微观层次揭示复杂化学反应体系中基元反应之间的内在联系[11],更深入地认识醛转化为羧酸的反应机理,从而对醛转化为羧酸的应用工艺开发和/或抑制醛转化为羧酸技术的发展提供理论支撑。
1 研究思路和计算方法
1.1 研究思路
乙醛氧化生成乙酸遵循自由基链反应机理,基元反应包括链引发、链增长和链终止过程。在生产过程中氧气由于绿色环保、经济效益好等优点是常用的氧化剂[12];在油品储存和使用过程中,油品氧化产生羧酸也主要是由空气中的氧气引起的[13],因此计算中采用氧气作为氧化剂。利用分子模拟技术,计算了乙醛氧化过程中各基元反应的反应能垒,深入认识反应过程的微观细节,判断乙醛氧化生成乙酸过程的速率控制步骤。
1.2 计算方法
采用分子模拟软件 Materials Studio 8.0中的 DMol3量子力学模块,利用基于密度泛函理论(DFT)的量子化学方法进行计算。
使用 DMol3模块优化模型分子的几何结构和电子结构,搜索基元反应过渡态,计算单点能和反应能垒。选用基于广义梯度近似(GGA)的PW91泛函,在大数值基组 DNP(双数值轨道基组+p轨道极化函数)水平上进行全电子计算。涉及到的能量计算均进行了零点振动能(ZPVE)校正,自洽场(SCF)迭代收敛的阈值设为 1×10-5Ha(1 Ha=2565.5 kJ/mol)。收敛精度为:能量 2×10-5Ha,受力 0.0004 Ha/nm,位移 5×10-4nm。过渡态的搜索采用完全线性同步和二次同步变换(Complete LST/QST)方法。化学键的离解能(EBonding)采用式(1)计算得出[14]。
EBonding=EA+EB-EA-B
(1)
式(1)中,EBonding为分子A-B中化学键的离解能,kJ/mol;EA为离解产生的自由基A的能量,kJ/mol;EB为离解产生的自由基B的能量,kJ/mol;EA-B为分子A-B的能量,kJ/mol。
2 结果与讨论
2.1 链引发反应
乙醛氧化反应是自由基链反应机理,自由基反应的开始是链引发产生自由基的过程。无其他物质参与的情况下,自由基是共价键发生均裂而产生的,为了研究自由基产生的过程,了解乙醛分子中共价键断裂的位置,对乙醛的结构参数进行了量子力学计算,得到了乙醛分子中各原子所带电荷和各共价键的键级、键长,分别如图1和表1所示。键级是描述分子中相邻原子之间成键强度的物理量,用以表示键的相对强度,键级越大说明共价键越稳定,其发生断裂所需的能量越高[15]。从图1和表1可以看出,C1原子和H7原子所形成的C—H键的键级最低、键长最长,并且C1和H7原子都带有正电荷,说明2个原子之间存在静电斥力,C1—H7键相对不稳定,乙醛分子中C1—H7键最容易发生断裂。

图1 乙醛分子的结构和各原子所带电荷Fig.1 Structure of acetaldehyde and Mulliken charge of each atom(a) Molecule structure; (b) Mulliken charge of atom Oxygen atom; Hydrogen atom; Carbon atomThe numbers on atoms in Fig.1(a) and Fig.1(b) are a series of numbers and Mulliken charges of atoms respectively.

BondBond orderBond length/nmC1—C30.9850.1499C1—O21.9830.1216C1—H70.9370.1119C3—H40.9570.1100C3—H50.9570.1100C3—H60.9770.1094
当无其他物质参与的情况下,乙醛产生自由基所需的最低能量即为C1—H7键断裂所需的能量,通过计算得出C1—H7键的离解能为380.78 kJ/mol,如式(2)所示。C1—H7键的键能很高说明此化学键较稳定,其断裂需要较高的能量,在很高的温度下才能发生。乙醛氧化生成乙酸的过程需要有氧化剂的存在,氧化剂的存在可能会促进自由基的生成,降低链引发过程的能垒。乙醛和氧气发生化学反应会有电子跃迁,通常是从一个分子的最高占有分子轨道(HOMO)跃迁到另一个分子的最低未占有分子轨道(LUMO),电子跃迁过程的难易与反应物的最高占有分子轨道能级(EHOMO)和最低未占有分子轨道能级(ELUMO)有关[16]。

(2)
为了研究乙醛和氧气反应的难易和电子的转移过程,分别计算了乙醛分子和氧气分子的EHOMO和ELUMO,如图2所示。从图2可知,氧气分子的EHOMO为-666.61 kJ/mol,ELUMO为-444.76 kJ/mol;乙醛分子的EHOMO为-558.18 kJ/mol,ELUMO为-175.12 kJ/mol。如果电子从氧气分子转移到乙醛分子上,即电子从氧气分子的HOMO跃迁到乙醛分子的LUMO上,所需能量为491.49 kJ/mol,而电子从乙醛分子转移到氧气分子上所需的能量仅为113.42 kJ/mol。因此乙醛与氧气的反应过程更容易发生电子从乙醛向氧气的转移,反应过程如式(3)所示。通过对反应(3)的过渡态搜索得到反应能垒为116.26 kJ/mol,计算结果与上述分析基本一致。
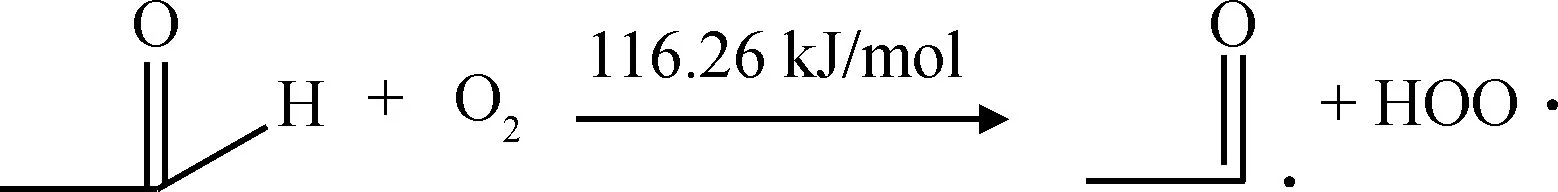
(3)

图2 乙醛和氧气分子的EHOMO和ELUMOFig.2 EHOMO and ELUMO of acetaldehyde and oxygen
2.2 链增长反应
链引发过程生成了乙酰基自由基和氢过氧自由基,乙酰基自由基可以与氧气反应生成过氧乙酸自由基,过氧乙酸自由基可以进一步和乙醛反应生成过氧乙酸和乙酰基自由基;氢过氧自由基可以和乙醛反应生成乙酰基自由基和过氧化氢,从而实现自由基链的增长。反应过程和反应能垒分别如式(4)~式(6)所示。从各反应的反应能垒可以看出,乙酰基自由基和氧气反应基本没有反应能垒,说明此反应非常容易发生,因此当反应体系中氧气充足时,乙酰基自由基一旦生成与氧气接触,立即生成过氧乙酸自由基,基本不会有乙酰基自由基的累积。氢过氧自由基和过氧乙酸自由基与乙醛反应的反应能垒均较低,分别为18.38 kJ/mol和10.27 kJ/mol,说明2个反应过程也都非常容易发生。2个过程产生的乙酰基自由基可以进一步通过反应(4)、(5)生成过氧乙酸自由基和过氧乙酸,从而实现自由基链的增长和传递。

(4)

(5)

(6)
过氧乙酸生成后,其会进一步反应生成乙酸。目前,一般认为主要有2种路径[9-10],如图3所示。路径(a)认为是过氧乙酸中的过氧键发生均裂生成乙酸自由基和羟基自由基,乙酸自由基再与乙醛反应生成乙酸。路径(b)认为是过氧乙酸和乙醛反应生成乙醛单过氧乙酸酯中间化合物,然后其进一步分解生成两分子乙酸。
对过氧乙酸的结构参数进行量子化学计算,以推断2条反应路径发生的可能性。过氧乙酸中各原子所带电荷和各化学键的键级、键长分别如图4和

图3 过氧乙酸生成乙酸的反应路径Fig.3 Reaction paths of peracetic acid to acetic acid

图4 过氧乙酸分子的结构和各原子所带电荷Fig.4 Structure of peracetic acid and Mulliken charge of each atom(a) Molecule structure; (b)Mulliken charge of atom Oxygen atom; Hydrogen atom; Carbon atomThe numbers on atoms in Fig.4(a) and Fig.4(b) are a series of numbers and Mulliken charges of atoms respectively.
表2所示。从过氧乙酸各化学键的键级可以得出O2—O5形成的共价键键级最小、键长较长,同时O2和O5原子都带有较多的负电荷,分别为-0.245 和-0.265,2个原子之间存在较大的静电斥力,说明此化学键不稳定较容易断裂。上述分析说明路径(a)存在合理性。通过计算路径(a)中各基元反应的反应能垒(式(7)~式(10))得出过氧乙酸均裂过程反应能垒为147.18 kJ/mol,反应能垒较高,此过程较难发生。然而,反应生成的乙酸自由基和羟基自由基与乙醛反应的过程以及乙酰基自由基和羟基自由基反应生成乙酸的过程基本不需要能垒就能发生。

表2 过氧乙酸分子中各共价键的键级和键长Table 2 Bond orders and bond lengths ofcovalent bonds in peracetic acid

(7)

(8)

(9)

(10)
过氧乙酸中O5—H9的键级也相对较小,同时H9原子上含有较多正电荷(+0.284),而乙醛分子中羰基上的O2原子上含有较多的负电荷(-0.350),其比过氧乙酸中的O5原子所带的负电荷(-0.265)更多。当2种分子同时存在时,乙醛中的O2原子和过氧乙酸中的H9原子容易发生静电吸引,这为二者反应提供了条件,说明路径(a)也存在合理性。由于乙醛分子的O2原子比过氧乙酸中的O5原子所带的负电荷更多,其对过氧乙酸中的H9原子静电吸引力更强,反应过程中过氧乙酸上的O5—H9键将断裂,H9原子与乙醛中的O2原子形成共价键变为羟基。同时过氧乙酸中的O5原子和乙醛中的C1原子由于都带有1个单电子将形成共价键,生成了乙醛单过氧乙酸酯反应中间产物,反应过程及反应能垒如式(11)所示。

(11)
乙醛单过氧乙酸酯将进一步反应生成乙酸,为了深入理解此反应过程,对乙醛单过氧乙酸酯的结构参数进行量子力学计算,计算结果如图5和表3所示。计算结果显示,反应中间产物中O9—O12的键级很小只有0.892,键长较长达到0.1506 nm,并且O9和O12原子都带有较多的负电荷,分别为-0.234、-0.306。说明O9和O12原子之间存在较强的静电斥力,O9—O12的化学键很不稳定,较容易断裂。同时C1原子和H7原子都带有正电荷,二者之间也存在静电斥力,说明C1—H7键也不太稳定。O9—O12键断裂后,由于O9原子上带有较多的负电荷,其将对H7原子产生静电吸引力,C1、H7原子的静电排斥和O9、H7原子的静电吸引共同作用促使C1—H7键的断裂,同时O9—H7原子之间形成了新的化学键。由于C1和O12原子各存在1个单电子,其将形成新的化学键,即C1—O12之间的化学键从单键变为双键。总的结果就是乙醛单过氧乙酸酯分解产生了两分子乙酸。通过对路径(b)中的2个反应进行过渡态搜索,计算反应能垒得出,过氧乙酸和乙醛反应生成乙醛单过氧乙酸酯中间化合物以及乙醛单过氧乙酸酯中间化合物分解生成乙酸过程的反应能垒均较高,分别为137.21 kJ/mol和93.74 kJ/mol(式(11)~(12)),说明此过程较难发生,反应速率较慢。

图5 乙醛单过氧乙酸酯分子的结构和各原子所带电荷Fig.5 Structure of acetaldehyde monooxyacetate and Mulliken charge of each atom(a) Molecule structure; (b)Mulliken charge of atom Oxygen atom; Hydrogen atom; Carbon atomThe numbers on atoms in Fig.5(a) and Fig.5(b) are a series of numbers and Mulliken charges of atoms respectively.

BondBond orderBond length/nmC1—C30.9720.1524C1—H70.9580.1097C1—O21.0090.1403C1—O120.9130.1430C3—H40.9710.1098C3—H50.9740.1094C3—H60.9730.1095O2—H160.9440.0973C8—C111.0050.1497C8—O101.8930.1212C8—O91.0340.1379O9—O120.8920.1506C11—H130.9580.1095C11—H140.9750.1092C11—H150.9580.1097
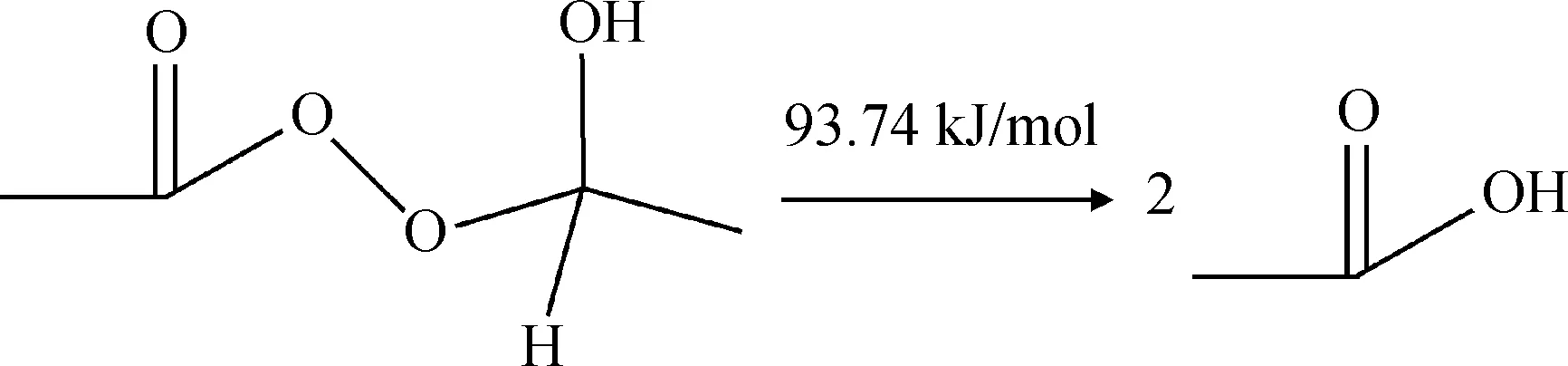
(12)
2.3 链终止反应
当反应体系中缺氧或者氧扩散较慢时将发生链终止反应,链终止反应主要是乙酰基自由基和过氧乙酸自由基以及过氧乙酸自由基之间反应生成稳定的物质[9],反应过程和反应能垒如式(13)~式(15)所示。链终止反应主要是自由基之间的反应以及反应形成的不稳定物质所发生的进一步反应,反应能垒较低,较容易发生。

(13)

(14)

(15)
综合上述各反应步骤可以得出,乙醛氧化生成乙酸的过程中,无氧条件下链引发过程最难发生,但是采用氧气作为氧化剂可以显著降低此过程的反应能垒;链增长中,乙酰基自由基生成过氧乙酸的各反应步骤的反应能垒均较低,反应过程较快;过氧乙酸转化为乙酸的反应较难发生,此过程中2个可能的反应路径中均存在较高的反应能垒步骤,为整体反应过程的速率控制步骤,其中路径(a)的反应能垒相对更高一些。然而,在不同的反应条件下2条反应路径的乙醛转化效率和反应剧烈程度有所差异。由于路径(a)中生成了更多的自由基,可以继续进行自由基链反应过程,反应相对剧烈,当反应体系中氧气较充足时,路径(a)有利于将更多的乙醛氧化生成乙酸;路径(b)中由于没有新的自由基产生,反应条件相对平稳,但其对乙醛的转化率相对较低。当反应体系中的氧气消耗完后,2条路径对于乙醛的转化效率是相同的,均为一分子过氧乙酸氧化一分子乙醛生成乙酸。链终止过程中各反应能垒均较低,较容易发生。
在醛转化为酸的生产过程中,要加速此反应过程,需要降低链引发过程和过氧羧酸转化为羧酸过程的反应能垒,或者提高反应温度使2个过程反应速率加快。降低链引发过程的反应能垒通常采用加入合适的氧化剂或者自由基引发剂[17]。降低过氧羧酸转化为羧酸过程的反应能垒通常采用合适的催化剂[5,9]。在抑制醛转化为酸的过程中应控制反应条件,抑制链引发过程和过氧羧酸转换为羧酸的过程。一方面可以控制氧化剂的混入,提高链引发过程的反应能垒;另一方面可以降低反应温度,使链引发过程和过氧羧酸转换为羧酸过程的反应速率较慢。同时可以加入适当的抗氧剂使产生的自由基尽快终止和/或产生的过氧羧酸尽快分解为非活性组分[13],防止自由基和过氧羧酸将更多的醛氧化为酸。
3 结 论
(1)以氧气为氧化剂时,过氧乙酸转换为乙酸的过程是乙醛氧化生成乙酸反应过程的速率控制环节。此过程有2条可能的反应路径,均存在较高反应能垒的步骤,其中路径(a)的反应能垒相对更高。路径(a)中速率控制步骤为过氧乙酸均裂生成乙酸自由基和羟基自由基的过程;路径(b)中速率控制步骤为过氧乙酸和乙醛反应生成乙醛单过氧乙酸酯中间化合物的过程。
(2)过氧乙酸转换为乙酸的2条反应路径中,当反应体系中氧气较充足时,路径(a)反应相对剧烈,有利于将更多的乙醛氧化生成乙酸;路径(b)反应条件相对平稳,但其对乙醛的转化率相对较低。当反应体系中的氧气消耗完后,2条路径对于乙醛的转化效率是相同的,均为一分子过氧乙酸氧化一分子乙醛生成乙酸。
(3)调控醛转换为酸的反应过程主要通过加入适当的添加剂/催化剂调节链引发过程和过氧羧酸转换为羧酸过程的反应能垒和/或调节反应条件使其促进或抑制上述2个过程。
