β-甘露糖苷酶酶解对HOVM结构与胰蛋白酶抑制活性的影响
2019-02-16侯惠静吴子健石振鹏姜宇峰
侯惠静,吴子健,石振鹏,姜宇峰
(1.天津天狮学院生物与食品工程学院,天津301700;2.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
鸡卵类黏蛋白(hen-egg ovomucoid,HOVM)是一种鸡蛋卵清蛋白(分子量为28 kDa),是典型的Kazal型丝氨酸蛋白酶抑制剂,具有3个相互对立的同源Kazal结构域,每个结构域约含有60个氨基酸残基以及3个域内二硫键[1],可有效抑制胰蛋白酶的活力,其抑制β-牛胰蛋白酶的主要活性位点位于第二结构域上,HOVM是单头胰蛋白酶抑制剂(single-headed trypsin inhibitor),1分子HOVM只能抑制1分子的胰蛋白酶[2-3]。
HOVM分子不仅含有蛋白部分,还含有约20%~25%的糖基部分[4],有3类五触角杂合型的N-连接寡糖基团参与了糖基的构成,这些寡糖基团以含3个甘露糖的五糖残基(Manα1→6(Manα1→3)Manβ1→4GlcNAcβ1→4GlcNAc)为核心,单糖残基主要包括N-乙酰葡萄糖胺、甘露糖、半乳糖以及唾液酸等;寡糖基团与蛋白部分的链接位点位置都具有Asn-XThr/Ser 序列[5],分别位于 Asn10、Asn53、Asn69、Asn75以及Asn175[4]。
HOVM可用于纯化胰蛋白酶的亲和柱的配基,但如何调整利用其与胰蛋白酶之间的结合对于亲和柱的开发制备具有很重要的意义,同时HOVM上糖基含量与其抑制胰蛋白酶活性之间的关系对于研究HOVM的胰蛋白酶抑制作用也有十分重要的意义。
1 材料与方法
1.1 材料及仪器
1.1.1 材料
胰蛋白酶250 U/mg、N-苯甲酰基-L-精氨酸乙酯盐酸盐(Nα-Benzoyl-L-arginine ethyl ester hydrochloride BAEE)、8-苯氨基-1-萘磺酸(8-Anilino-1-naphthalenesulfonic acid,ANS)、β-甘露糖苷酶:Sigma公司。
1.1.2 仪器
3-18k离心机:德国Sigma公司;FDU-810型EYELA冷冻干燥机:日本东京理化公司;UV-2700紫外可见分光光度计:日本岛津公司;Nicolet5700傅里叶红外光谱仪:美国尼高力仪器公司;MOS-450/AF-CD圆二色谱仪:法国Biologic公司。
1.2 方法
1.2.1 鸡卵类黏蛋白的制备工艺
HOVM的分离与纯化按照吴子健等的方法[6]进行,具体方法为:手工分离得到的鸡蛋清与去离子水按体积比1∶1混合降低黏度,然后加入2倍体积的10%三氯乙酸溶液混合均匀后,用1.0 mol/L NaOH溶液调节pH值至3.5,0~4℃下静置过夜,离心后所得上清于4℃下透析过夜除去三氯乙酸,然后再进行硫酸铵(硫酸铵饱和度为50%)盐析,所得的上清中的硫酸铵饱和度再调至80%,静置24 h,离心,得到的沉淀透析除盐后冻干,就得到了HOVM样品。
1.2.2 β-甘露糖苷酶酶切处理HOVM[7-9]
HOVM蛋白用β-甘露糖糖苷酶进行酶解处理,具体方法如下:20 mg/mL HOVM蛋白溶液(100 mmol/L乙酸-乙酸钠缓冲液,pH5.5),分别按比例加入3.75 U/100 mg、7.50 U/100 mg、15.00 U/100 mg 的 β-甘露糖苷酶于37℃下反应,空白组为不加β-甘露糖苷酶的20 mg/mL HOVM溶液。酶解后立即用冰浴冷却至4℃,然后加入无水硫酸铵至饱和度为40%,4℃下静置6 h后,离心(4℃,4 000×g)15 min后取上清;上清液中继续添加无水硫酸铵至饱和度为80%,4℃下静置6 h后,离心(4℃,4 000×g)15 min取沉淀得到经糖苷酶酶解的HOVM蛋白,再经透析除硫酸铵后进行真空冷冻干燥。
1.2.3 总糖的测定
总糖的测定按照苯酚-硫酸法测定。
1.2.4 圆二色谱法
按照Yamamoto等[10]的方法进行圆二色谱(circular dichroism,CD)检测及分析,具体操作步骤为:0.2 mg/mL蛋白样品溶液(10 mmol/L磷酸盐缓冲液,pH7.4)。圆二色谱的参数为:光径为1.0 cm、扫描波长范围190 nm~250 nm、带宽1.0 nm、扫描速率60 nm/min。蛋白二级结构含量利用DichroWeb程序(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)在线分析。
1.2.5 蛋白表面疏水性的测定
蛋白表面疏水性的测定按照Ruan等[11]的方法,以ANS作为外源性荧光探针,2 mL 500 μg/mL HOVM样品液(10 mmol/L KH2PO4-K2HPO4缓冲液,pH7.4)加入10 μL ANS溶液(5.0 mmol/L),于20℃下避光孵育1.0 h,然后扫描测定发射波长在400 nm~700 nn范围内蛋白样品的荧光发射光谱,激发波长设为380 nm,狭缝校正宽度为5 nm,扫描速率为1 200 nm/min。
1.2.6 胰蛋白酶抑制率的测定[12]
胰蛋白酶活性测定加样见表1。

表1胰蛋白酶活性测定加样表Table 1 Sample application table for trypsinase activity determination
按照表1所示加样并检测,每隔30 s读A253nm的数值并记录,计时5 min,计算胰蛋白酶活性。
一个胰蛋白酶活力单位定义为:以BAEE为底物,pH 7.6,温度25℃,反应体积3.2 mL胰蛋白酶酶解BAEE每分钟产生0.001单位的A253nm变化。

式中:A0为反应初测得的光吸收变化值;A1为反应5 min后测得的光吸收变化值;A2为不加HOVM时得到的光吸收变化值;A3为加HOVM时得到的光吸收变化值。
1.2.7 试验数据统计与分析
3次重复试验,数据采用SPSS16.0统计软件进行相关处理以及显著性分析,结果均以平均值±标准差来表示,利用软件origin8.8进行图表制作。
2 结果与分析
2.1 β-甘露糖苷酶酶解对HOVM中糖基含量的影响HOVM经过β-甘露糖苷酶酶切处理后,HOVM
蛋白中所含糖基的含量变化如图1所示。
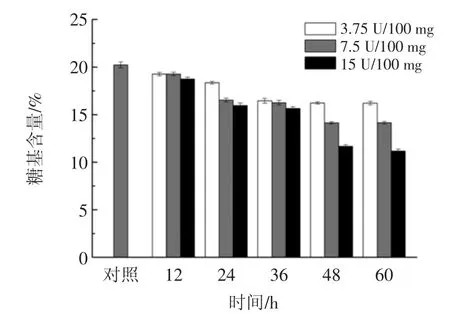
图1 β-甘露糖苷酶酶切处理对HOVM中糖基含量的影响Fig.1 Effects of enzymolysis by β-mannosidase on contents of sugar group in HOVM
通常鸡卵清中的HOVM蛋白约含20%~25%的糖基,其中第三个结构域中的Asn175若未糖基化,则HOVM中的糖基含量为20%,而本研究中的对照组(Control组)的糖基含量为20%,可能是由于其一级结构中的Asn175未被糖基化。图1的结果表明:酶解时间延长和酶活力单位添加的增大是有利于糖苷酶酶切HOVM中糖基的效果;HOVM所含糖基中甘露糖残基约占6.50%~8.50%,当用β-甘露糖苷酶酶解处理HOVM,当两者按15.00 U/100 mg混合时,酶解48 h后,HOVM上的糖基含量趋于稳定,此时HOVM上剩余糖基含量约为11.18%。
2.2 β-甘露糖苷酶酶解对HOVM表面疏水性的影响
通常水溶性蛋白表面的氨基酸残基为亲水性氨基酸残基,而带有疏水侧链的氨基酸残基常处于分子核心内部。表面疏水性是蛋白质的重要特性之一,通过检测蛋白质表面疏水性的变化可以监控蛋白质构象的变化[13]。酶底比为15Uβ-甘露糖苷酶/100 mg HOVM条件下,β-甘露糖苷酶酶解HOVM后,利用疏水探针ANS,激发波长380 nm,测定发射波长400 nm~700 nn范围荧光发射光谱,其结果如图2所示。
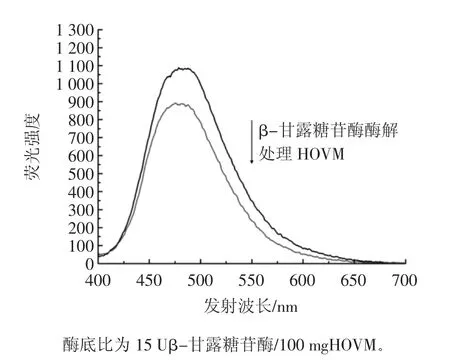
图2 β-甘露糖苷酶酶解对HOVM蛋白表面疏水性的影响Fig.2 Effects of enzymolysis by β-mannosidase on surface hydrophobicity of HOVM
相对与未进行酶处理的HOVM来说,β-甘露糖苷酶酶解后的HOVM的最大发射波长几乎没有出现红移或蓝移,但荧光强度增大了,表明β-甘露糖苷酶酶解提高了HOVM蛋白表明疏水性,可能的原因在于:其一、HOVM中的糖基含量较高,而且每个糖基化位点上的寡糖链为杂合型的N-链接糖链,五糖核心又延伸出5个支链,这些寡糖链多处于HOVM空间结果的表面,会在空间上掩蔽蛋白中一部分疏水性氨基酸残基,但当这些寡糖链上的糖残基被酶切下来脱离了蛋白部分,那么原本被掩蔽的疏水性部分就会被暴露出来,从而使得被酶切去部分糖基的HOVM与疏水性ANS荧光探针的结合能力提高;其二、寡糖基团含有亲水性的羟基,当糖残基从蛋白质上脱离开来,势必也会使亲水性减弱。
2.3 β-甘露糖苷酶酶解对HOVM胰蛋白酶抑制率的影响
酶底比为15Uβ-甘露糖苷酶/100 mgHOVM,酶解处理时间(12、24、36、48、60 h),HOVM 上糖基含量与酶解后HOVM对胰蛋白酶酶活力抑制率之间的关系如图3所示。

图3 β-甘露糖苷酶酶解对HOVM胰蛋白酶抑制率的影响Fig.3 Effects of enzymolysis by β-mannosidase on HOVM trypsin inhibition rate
随着β-甘露糖苷酶酶解时间的延长,HOVM蛋白上的糖基含量是下降的,而HOVM对胰蛋白酶抑制率呈现上升趋势,当酶解36 h后,HOVM胰蛋白酶抑制率达到90.4%,基本达到最高程度,48 h以及60 h,HOVM胰蛋白酶抑制率基本不再变化,也就是HOVM上寡糖基团含量的减少会提高其对胰蛋白酶的抑制率。其可能的原因在于:HOVM是典型的Kazal型蛋白酶抑制剂,HOVM的第二个结构域是直接与胰蛋白酶接触作用,该结构域上的Arg89的侧链会深入到胰蛋白S1腔内,除此之外,包括这个Arg89总共有12个与蛋白酶接触的氨基酸残基[14],寡糖糖基会影响这些位点与蛋白酶的接触作用,但当这些寡糖基团被水解处理下来后,其空间位阻会减少,也就是第二结构域与胰蛋白酶接触的可能性会增大,其抑制酶活力的效果会提高。
2.4 β-甘露糖苷酶酶解对HOVM二级结构的影响
β-甘露糖苷酶处理后的HOVM按照浓度0.5mg/mL溶于磷酸盐缓冲液中,其圆二色谱图及其二级结构组成分析如图4所示。
在溶液状态下,HOVM各二级结构相对含量的变化范围较红外表征的结果小:α-螺旋为34.4%~35.2%、β-折叠为 10.6%~11.1%、β-转角为 22.7%~23.3%、无规则卷曲为30.9%~32.5%。通过CD的表征表明:糖苷酶酶切处理对HOVM规正的二级结构(α-螺旋和β-折叠)以及β-转角的组成的影响较小,可能的原因在于HOVM的蛋白质部分含3个相对独立的结构域,且每个结构域均3个二硫键,极大地限制了构象变化以及维系着其天然构象的稳定性,这一点与2013年Sara Benedé等[15]的CD表征结果相一致。但是不同的是,β-甘露糖苷酶处理会降低其二级结构组成中无规则卷曲的组成,无规则卷曲的组成由32.5%降低到了30.9%。


图4 β-甘露糖苷酶酶解后HOVM二级结构组成的CD光谱分析Fig.4 Secondary structure composition analysis of post-βmannosidase-digestion HOVM by circular dichroism
2.5 β-甘露糖苷酶酶解对HOVM各个二级结构组成的影响
酶底比为5.0Uβ-甘露糖苷酶/100 mg HOVM底物条件下,经过酶解处理后,HOVM蛋白上的各个二级结构组成与其胰蛋白酶抑制活性之间的变化关系如图5所示,采用SPSS16.0统计软件进行了显著性分析,如表1所示。
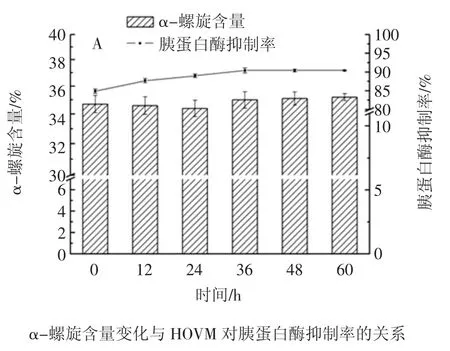
结果表明:经β-甘露糖苷酶酶解处理,HOVM对胰蛋白酶抑制活性的变化与该蛋白中无规则卷曲含量的变化呈显著相关性(p<0.01),而与其它二级结构组成含量的变化无相关性;在12 h~60 h时间范围内,随酶解时间延长,HOVM对胰蛋白酶抑制率会提高,而无规则卷曲的含量下降。其可能的原因在于:β-甘露糖苷酶酶解处理降低了HOVM分子寡糖基团含量,一方面会使HOVM分子中原本受寡糖基团空间掩蔽的含疏水性基团的氨基酸残基被暴露出来,而这些失去掩蔽的疏水性基团是无法长时间暴露在蛋白质亲水性表面的,它们彼此之间会发生疏水相互作用,进而HOVM局部结构做微小调节;另一方面,原本的无规则卷曲主要是由含有亲水性基团的氨基酸残基组成,分布于水溶性蛋白质的表面,而蛋白质中的寡糖基团中的羟基会与无规则卷曲中氨基酸残基侧链的亲水性基团形成氢键,而寡糖基团被酶解去除后,原有的氢键消除,而新的氢键会形成,蛋白质的结构也会发生改变,原本某些无规则卷曲的部分可能会变成规正或部分规正的二级结构。但更深层次的原因还需要进一步探讨。

图5 β-甘露糖苷酶处理后HOVM各二级结构组成与胰蛋白酶抑制率Fig.5 Variation of HOVM’s secondary structure component and trypsin inhibition rate after β-mannosidase treatment

表2 β-甘露糖苷酶处理后HOVM二级结构组成与其胰蛋白酶抑制率之间的相关性分析Table 2 Analysis of the correlation between secondary structure component variation of HOVM and trypsin inhibitory rate following β-mannosidase treatment
3 结论
经β-甘露糖苷酶酶解处理,随着酶解时间(12、24、36、48、60 h)的延长,HOVM上寡糖基团含量由20%降低至11.8%并且不再降低;随着寡糖基团含量的降低,HOVM蛋白的疏水性提高;蛋白中无规则卷曲的含量由32.5%降低至30.9%,同时胰蛋白酶的抑制率由84.9%逐渐增高至90.1%,且两者之间的变化具有极其显著的相关性。
