miR-130b对宫颈癌细胞修复TNF-α诱导性基因组双链DNA断裂作用的影响及机制
2019-02-15杨磊刘涛段继惠穆红
杨磊,刘涛,段继惠,穆红
(天津市第一中心医院,天津300192)
基因组完整性和稳定性对于细胞生存至关重要,化学刺激物能破坏DNA分子影响细胞生存。H2A蛋白家族是核小体组蛋白八聚体的组成成分,而H2AX是该蛋白家族中的一个变体。双链DNA发生断裂后,H2AX会被磷酸化形成γ-H2AX,作为DNA双链断裂的标志物[1]。利用化学药物损伤基因组DNA是杀伤肿瘤细胞的重要手段,然而细胞内的DNA修复系统能够清除DNA损伤[2,3]。因此,干扰DNA修复功能有利于药物破坏DNA,增强细胞对药物毒性的敏感性。报道称,miR-138能抑制修复点形成诱导DNA损伤[4];miR-338-5p和miR-890可干扰肿瘤细胞修复紫外线、电离辐射造成的DNA损伤[5,6]。miRNA能影响细胞修复损伤的DNA,那么,利用miRNA干扰DNA修复,应该能增强细胞对药物基因组毒性的敏感性。细胞周期蛋白依赖性蛋白激酶抑制物1A(CDKN1A)属于Cip/Kip家族成员,其能够抑制细胞增殖和DNA复制。2017年10月~2018年6月,我们观察了miR-130b 对宫颈癌细胞修复TNF-α诱导性基因组DNA双链断裂作用的影响,并进一步分析CDKN1A基因与miR-130b之间的靶向关系,为miR-130b作为一种潜在治疗宫颈癌的生物学药剂提供理论基础。
1 材料与方法
1.1 主要材料 宫颈癌细胞Siha购于中国科学院典型培养物保藏委员会细胞库,miR-130b mimics、阴性对照核酸NC(中国Genepharma),核酸引物(中国AuGCT);RPMI1640培养基、胎牛血清(美国Gibco BRL);DNA损伤剂TNF-α(美国Sigma),DNA损伤增强剂AZD2461(美国Merck Inc);RNA/DNA X-fect transfection转染试剂、PrimeScriptTMⅡReverse Transcriptase、SYBR Premix Ex Taq Ⅱ荧光定量PCR试剂盒(日本Takara);CDKN1A抗体、HRP联接IgG Fc抗体(美国Proteintech),GADPH抗体、ECL显色剂(美国Bosterbio),γ-H2AX蛋白抗体、Alexa Fluor®488 dye 联接抗体(美国Abcam);mirVana RNA提取试剂盒(美国Ambion),LightCycle96 荧光定量PCR仪(瑞士Roche),Alpha Innotech FluroChem FC2凝胶成像分析系统(美国Alpha Innotech),EnSpire Mutilabel Reader酶标仪(芬兰PerkinElmer);Annexin-V 凋亡检测试剂盒、BD Accuri C6 Plus流式细胞仪(美国BD Sciences)。
1.2 细胞分组与转染 将Siha细胞分6组,分别转染CDKN1A基因过表达质粒pcDNA3.1-CDKN1A(CDKN1A组)、pcDNA3.1空载质粒(pcDNA3.1组)、miR-130b mimics (miR-130b组)、miR-130b阴性对照核酸(NC组),共转染pcDNA3.1-CDKN1A和miR-130b mimics (CDKN1A+miR-130b组)、pcDNA3.1和miR-130b mimics (pcDNA3.1+miR-130b组)。转染4 h,更换新鲜培养液继续培养。
1.3 miR-130b、CDKN1A影响细胞修复双链DNA断裂观察
1.3.1 细胞干扰处理 CDKN1A组、pcDNA3.1组细胞转染培养24 h后,分别用终浓度为100 ng/mL TNF-α或PBS处理细胞3 h;miR-130b组、NC组细胞转染培养24 h后,分别用TNF-α、PBS处理细胞24 h;CDKN1A+miR-130b、pcDNA3.1+miR-130b组细胞转染培养24 h后,用TNF-α处理24 h。
1.3.2 细胞基因组DNA尾距测定 采用彗星试验。将各组细胞与低熔点琼脂糖凝胶混合铺在载玻片上;固定后,裂解细胞;电泳分离后,碘化丙啶染色,拍照,测量DNA尾距;尾距越长,说明双链DNA断裂位点越多。
1.3.3 细胞中γ-H2AX 蛋白测定 采用流式细胞术。乙醇固定细胞,用PBS、封闭液BSA清洗细胞;抗γ-H2AX蛋白一抗、染料联接二抗标记后,上流式细胞仪测定γ-H2AX蛋白。检测细胞荧光强度,确定γ-H2AX蛋白相对表达量。
1.4 miR-130b影响CDKN1A表达观察 取 miR-130b组、NC组细胞,分别检测细胞中的CDKN1A mRNA及蛋白。① CDKN1A mRNA:采用Real-time PCR法。用SCNRT、Oligo(dT)18逆转录CDKN1A、内参β-actin mRNA;用CDKN1A、β-actin上下游引物扩增CDKN1A、β-actin cDNA。反应条件:95 ℃ 预变性3 min,95 ℃ 10s 、60 ℃ 15 s、72 ℃ 15 s, 35个循环;以2-ΔΔCT法计算CDKN1A mRNA相对表达量。CDKN1A mRNA上游引物5′-CCCGTGAGCGATGGAACTT-3′,下游引物5′-CCCGTGGGAAGGTAGAGCTT-3′; β-actin上游引物5′-AGTTGCGTTACACCCTTTCTTG-3′,下游引物5′-TGTCACCTTCACCGTTCCAGT-3′。②CDKN1A蛋白:采用Western blotting法。蛋白上样,经SDS-PAGE凝胶电泳分离、转膜和封闭后,用抗CDKN1A、GADPH抗体标记目的、内参蛋白;HRP联接二抗标记后,显色;测定目的、内参蛋白灰度值,以目的蛋白与内参蛋白灰度比值作为目的蛋白相对表达量。
1.5 miR-130b与CDKN1A靶定关系的预测与验证 登陆Target Scan Human网站,在靶基因标识一栏中输入“CDKN1A”,点击提交后预测CDKN1A mRNA 3′非编码区中是否存在与miR-130b种子序列反向互补的序列。将pcDNA3.1/EGFP(空载)、pcDNA3.1/EGFP-CDKN1A-wtUTR(野生型)和pcDNA3.1/EGFP-CDKN1A-mutUTR(突变型) 3种荧光报告质粒分别与miR-130b mimics或NC共转染细胞,激发光照射细胞后测定细胞发出的散射荧光,根据荧光强度确定报告基因相对表达水平。
1.6 miR-130b影响细胞凋亡观察 取miR-130b、NC、CDKN1A+miR-130b及pcDNA3.1+miR-130b组细胞,用含终浓度分别为100 ng/mL TNF-α和2 μmol/L AZD2461的细胞培养液培养细胞48 h。采用磷脂酰丝氨酸免疫标记与DNA碘化丙锭(PI)染色双标记法,用抗体FITC-Annexin-V、PI标记细胞,流式细胞术检测凋亡细胞,计算细胞凋亡率。

2 结果
2.1 CDKN1A、miR-130b表达对细胞DNA双链断裂修复的影响 见表1。
2.2 miR-130b对细胞CDKN1A表达的影响 见表2。
2.3 miR-130b与CDKN1A靶定关系的预测与验证结果 CDKN1A mRNA 3′非编码区中存在与miR-130b种子序列反向互补的序列,是miR-130b潜在的靶定位点。将空载、野生型和突变型分别与miR-130b mimics共转染细胞后其荧光相对活性分别为0.97±0.10、0.85±0.03、1.04±0.07,与NC共转染细胞后其荧光相对活性分别为1.00±0.07、1.00±0.03、1.00±0.06,仅野生型与miR-130b mimics共转染细胞的荧光相对活性低于与NC共转染细胞(P<0.05)
2.4 miR-130b对细胞凋亡水平的影响 经TNF-α + AZD2461处理后,miR-130b组细胞凋亡率11.84%±1.19%,高于NC组的8.63%±0.33%(P<0.05);CDNK1A+miR-130b组细胞凋亡率18.23%±2.75%,高于pcDNA3.1+miR-130b组的11.07%±0.67%(P<0.05)。
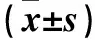
表1 CDKN1A、miR-130b表达对细胞DNA尾距、γH2AX蛋白表达的影响
注:与同组PBS处理细胞比较,aP<0.05;与pcDNA3.1组比较,bP<0.05;与NC组比较,cP<0.05;与pcDNA3.1+miR-130b组比较,dP<0.05。
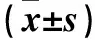
表2 NC、miR-130b组细胞中CDNK1A mRNA及蛋白表达比较
注:与NC组比较,aP<0.05。
3 讨论
TNF-α是一种参与不同炎症反应过程的多功能细胞因子,其能破坏鼠肝细胞、L929细胞和外周血淋巴细胞中的基因组DNA[7~9]。小鼠CDKN1A基因敲除实验发现,CDKN1A蛋白具有抑制肿瘤发生的功能,该基因缺失的小鼠在生长过程中会出现内皮瘤及表皮瘤等一系列疾病[10]。在细胞基因组DNA发生损伤时,CDKN1A蛋白能够通过抑制细胞周期蛋白E、细胞周期蛋白A/细胞周期蛋白依赖性蛋白激酶2复合物的活性阻碍细胞由G1期进入S期,给细胞修复DNA争取时间[11]。CDKN1A蛋白通过与PCNA蛋白的伴随定位和相互作用,在核苷酸、碱基剪切修复和双链断裂修复中发挥重要作用[12~14]。本研究结果显示,与PBS相比,TNF-α处理会增加pcDNA3.1组细胞中DNA尾距、γ-H2AX蛋白水平,但不改变CDKN1A组细胞中相应的参数。这说明,TNF-α刺激能诱发DNA双链断裂,而CDKN1A蛋白能修复双链DNA的断裂位点。
miRNA通过种子序列识别靶基因mRNA后,能降解靶基因mRNA或抑制其翻译调控基因表达[15]。信息学预测结果显示,CDKN1A mRNA 3′非编码区存在miR-130b的靶定位点,这说明CDKN1A基因是miR-130b潜在的靶基因。与共转染NC相比较,共转染miR-130b的细胞中pcDNA3.1/EGFP-CDKN1A-wtUTR报告基因荧光活性降低,说明miR-130b能与CDKN1A mRNA的3′非编码区结合影响靶基因表达;共转染NC与共转染miR-130b细胞中pcDNA3.1/EGFP-CDKN1A-mutUTR报告基因的无差异性表达,说明miR-130b是通过结合mRNA上预测的靶定位点抑制基因表达的。与NC组相比,miR-130b组细胞中CDKN1A mRNA及蛋白水平降低。这说明miR-130b能通过结合CDKN1A mRNA 3′非编码区促进mRNA降解,进而抑制蛋白翻译的方式抑制CDKN1A基因表达。与NC组相比,TNF-α刺激升高了miR-130b组细胞中DNA尾距、γ-H2AX蛋白水平;与pcDNA3.1+miR-130b组细胞相比,CDKN1A+miR-130b组细胞中DNA尾距、γ-H2AX蛋白降低了。这说明miR-130b通过抑制CDKN1A基因表达干扰了CDKN1A对TNF-α诱导性双链DNA断裂的修复。
双链DNA断裂是DNA损伤中最严重的损伤形式,单一断裂点足以诱发细胞死亡。因此,修复双链DNA断裂位点对于细胞生存至关重要[16]。多聚ADP-核糖聚合酶(PARP)抑制剂能使细胞产生大量单链断裂位点,该位点可转变成双链DNA断裂点[17]。双链断裂位点诱发抑癌基因p53的表达,促进细胞凋亡。用TNF-α、PARP抑制剂AZD2461处理细胞后,miR-130b mimics增加细胞凋亡率而转染pcDNA3.1-CDKN1A减轻miR-130b对细胞凋亡的促进作用。这些说明利用miR-130b mimics来干扰CDKN1A基因表达,抑制CDKN1A蛋白对TNF-α诱导性DNA双链断裂的修复作用,能促进细胞凋亡。
综上所述,我们认为在TNF-α和AZD2461存在的条件下,miR-130b可以通过抑制CDKN1A基因表达阻止宫颈癌对TNF-α药物诱导性DNA双链断裂的修复作用,进而增强细胞对TNF-α杀伤作用的敏感性。因此,miR-130b有望成为一种潜在的治疗宫颈癌的生物学药剂。
