应力刺激调控Sirt1在肌腱腱病中的作用研究进展
2019-01-18张晓蕊胡毓诗沈海孙君志
张晓蕊胡毓诗 沈海孙君志
1成都体育学院运动医学与健康学院(成都 610041)
2四川省骨科医院(成都 610041)
肌腱腱病(tendinopathy)是一切在肌腱处表现出的疼痛、肿胀和的功能障碍的综合征[1],跟腱、髌腱、肩袖、冈上肌腱、前臂伸肌腱以及肱骨外上髁伸肌总腱止点等是其多发部位。由于肌腱在运动中承受着高强度的负荷,易在运动中造成损伤,腱病已成为竞技运动和日常生活中十分常见的疾病,且尤以跟腱腱病最为频发。竞技运动中,许多运动员因饱受腱病折磨运动能力下降。有关研究显示,精英长跑运动员一生患跟腱腱病的风险为52%,芬兰416名征兵者的跟腱腱病的发病率为5.9%[2]。日常生活中,随着生活节奏不断加快,肌腱腱病在普通人群中的发病率也不断升高。据报道,荷兰每1000个患者中就有1.85人发生腱损伤[3]。据有关数据显示,美国每年约1440万人出现肌腱或韧带损伤[4],消耗美国数十亿的医疗保健费用。随着中国老龄化社会的不断加剧以及不科学的运动方式的增多,腱病也在增加。
肌腱是运动中重要的受力组织,正常的应力刺激在肌腱的自我调节之内,过度的应力刺激会超过肌腱自我恢复的能力而使肌腱受损,损伤后的肌腱愈合十分缓慢,容易形成瘢痕组织,力学性能受到影响[5]。修复后的肌腱在应力刺激下再次发生损伤的几率往往更大,长期的慢性损伤的积累导致肌腱出现诸多退行性改变,表现出如腱细胞凋亡以及由肌腱干细胞异常分化导致的脂肪堆积、黏液形成和组织钙化等病理表现,逐渐积累最终导致肌腱腱病的产生[6,7]。在腱病的发生发展过程中,Sirt1作为一类NAD+(烟酰胺腺嘌呤二核苷酸)细胞依赖的去乙酰化酶家族的成员之一,参与了腱病形成过程中的腱细胞凋亡以及肌腱干细胞异常分化的调节,并受到了力学因素的影响。鉴于此,本文就应力刺激与Sirt1信号通路及应力刺激调控下的Sirt1信号通路在肌腱腱病中作用研究进展情况作一综述。
1 Sirt1信号通路的生物学特性
Sirtuin是生命体中广泛存在的一类依赖于 NAD+的组蛋白去乙酰化酶,目前证实该家族有7个亚型,从Sirtuin1(Sirt1)到Sirt7[8]。Sirt1即沉默信息调节因子1最具有特征性,基因定位于10q21.3[9]。人类的Sirt1基因包含747个氨基酸,在3’和 5’端均有一个53 bp和1793 bp的非翻译区,包含8个内含子以及9个外显子,具有脱乙酰基酶活性,含有一个大结构域和一个小结构域,前者主要由保守性较高的罗斯曼(Rossmann)折叠构成,后者则由保守性很低的一个螺旋构件以及一个锌带结构构成。近年越来越多的研究表明Sirtuin家族参与各种功能的调节,从基因组稳定性到各种疾病,特别是Sirt1的高表达会降低与年龄有关的疾病和代谢疾病的风险,如在糖尿病、退行性病变、肿瘤等疾病发生发展过程中具有十分重要的作用[10-13]。
Sirt1通常定位于细胞核,存在依赖于细胞的环境和细胞类型,有时也可转移到细胞质或线粒体中[14]。Sirt1在细胞中具有多种不同的功能,从胚胎发育、骨骼肌分化、染色质修饰、表观遗传学、代谢途径到炎症和应激反应[15]。研究发现在不同的疾病模型中,Sirt1实现上述功能同它与组蛋白和许多非组蛋白底物相互作用和去乙酰化关系密切。这些物质主要包含:第一,P53基因。Sirt1与P53在细胞核中相互作用,去乙酰化P53,影响P53依赖性的凋亡通道,使细胞免于凋亡、延缓衰老并调控细胞应激反应。miR-34a是一种肿瘤抑制因子,直接与Sirt1的3'-UTR(3'非翻译区)结合,从而抑制其表达并增强p53介导的细胞凋亡,Rui[16]等在研究中发现,Sirt1可以在非酒精性脂肪肝病中抑制miR-34/p53信号通路。最新研究表明,许多物质如新型DNA损伤化合物0404及早老素PS等都是通过影响p53/miR-34a/Sirt1信号反馈来促进细胞凋亡和治疗疾病的[17,18]。第二,P73基因。P73是一种与P53高度同源的基因,尤其表现在中心区域。它编码TAp73a和TAp73b两个蛋白质。P53与P73在结构上的相似性反映两者在功能上也可能具有很大的相似性,可共同诱导细胞凋亡的发生。Dai[19]等在研究中发现,Sirt1也可以通过去乙酰化P73,抑制P73基因转化的活性,从而抑制P73诱导细胞凋亡的作用,促进细胞的生存。第三,ku70蛋白。Sirt1去乙酰化ku70抑制凋亡调节因子Bax介导的细胞凋亡并促进DNA修复[20,21]。Bax是启动细胞凋亡的重要物质,修复蛋白Ku70的K331、K539、K542等被乙酰化,释放出与其结合的Bax,Bax进入线粒体启动细胞凋亡。当Ku70被Sirt1去乙酰化时,Bax介导的细胞凋亡被抑制,细胞凋亡数目明显减少。同时,Sirt1还可促进与增强KU70介导的与非同源末端连接DNA修复相关联的BCR-ABL融合基因获得突变。第四,核转录因子NF-kB(nuclear factor kappa-B)。Sirt1可以通过使复合物的p65亚基脱乙酰调节NF-kB信号传导达到控制炎症和影响细胞凋亡的作用,最终抑制NF-kB信号传导[15],通过与细胞凋亡抑制蛋白(cellular inhibitor of apoptosis protein,cIAP)中抑制基因的启动子结合,去乙酰化该区域内的组蛋白,使NF-kB无法激活cIAP,达到抑制细胞凋亡的作用,同时引起肿瘤坏死因子(tumor necrosis factor alpha,TNF-α)诱导的凋亡敏感性增加。反过来,NF-kB信号通过调节miR-34a、干扰素γ(interferon gamma ,IFNγ)和活性氧的表达来降低Sirt1活性。除调节炎症和细胞凋亡外,Sirt1还可以影响细胞自噬。NF-kB可通过抑制自噬基因Beclin1来调节细胞自噬。Nopparat等[22]通过研究Sirt1的去乙酰活性对NF-kB亚单位RelA/p65的作用,探讨Sirt1对细胞自噬的作用和褪黑激素能否延缓衰老,结果显示褪黑激素可以提高Sirt1、Beclin1和自噬标志性蛋白(microtubule-associate protein 1 light chain 3,LC3-Ⅲ)的表达水平,降低衰老细胞中NF-kB的p65亚基中乙酰化Lys310的水平。第五,转录因子FOXO(forkhead box protein O)。Sirt1可使FOXO诱导的细胞周期产生停滞,增强应激抵抗能力,在氧化应激条件下去乙酰化FOXO3a,减弱由FOXO3a诱导的凋亡作用,从而影响细胞的衰老与凋亡[23]。miR-34a与FOXO3也有一定关系,目前有研究发现,Sirt1的降低可导致miR-34a启动子失活,并可能增强miR-34a激活FOXO3转录而促进细胞凋亡[24]。第六,过氧化物酶体增殖物激活受体-γ辅激活子-1α(peroxisome proliferator-activated receptorgamma coactivator1-alpha,PGC-1α)。Sirt1通过去乙酰化PGC-1调节体内的葡萄糖代谢和控制线粒体生物发生。已有研究发现,Sirt1可负向调控信号转导和转录活化因子3(signal transducer and activator of transcription 3,STAT3)的表达、信号转导的磷酸化以及STAT3介导的细胞呼吸[15]。第七,Sirt1还可以去乙酰化Runt相关转录因子2(runt-related transcription factor 2,Runx2)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma ,PPARγ)、肝X受体(liver X receptor,LXR)等物质调节成脂、成骨、胆固醇代谢等[25,26,15],Sirt1 对成骨和成脂的调节作为肌腱腱病发生发展的主要原因,在下文中将做详细介绍。
2 应力刺激与腱病
腱病是肌腱的一种慢性损伤,目前病因病机尚不清楚,但普遍认为与肌腱过度使用中的应力刺激有关[27]。身体剧烈活动期间肌腱的过度负荷被认为是肌腱退行性病变发生的主要外因。过度应力刺激导致肌腱细胞凋亡过度伴随肌腱干细胞的分化异常,使肌腱产生结缔组织的排列变化、肌腱组织的生物力学缺陷、局部缺血缺氧等一系列退行性改变,超出自身修复范围,最终导致肌腱腱病的产生。Kannus在研究腱损伤时,曾通过肌腱应力应变曲线图清晰解释了肌腱受到的力学因素与损伤的关系,如图1所示。静息时,肌腱腱纤维具有波纹形状,这是胶原纤维弯曲的结果。应变水平小于4%时,肌腱可以恢复其原始构型消除载荷影响。随着纤维的变形,形变与增加的载荷的变化趋势呈线性改变。在4%至8%之间的应变程度时,分子间交联失败,胶原纤维开始彼此滑过,微损伤开始逐渐积累。在大于8%的应变水平时,由于纤维的拉伸失效和纤维的破坏而发生宏观破裂[28,29]。Cook等[30]在研究中建议肌腱病理学应连续地分为三个阶段:反应性肌腱炎、肌腱功能障碍和退行性腱病,并提出肌腱腱病病理的第一阶段来自跟腱急性超应力负荷。一项关于股内斜肌在不同负载条件下髌腱近端受力情况的研究也显示,异常应力刺激下髌腱内外侧受力发生变化,加速髌腱腱病的产生[31]。
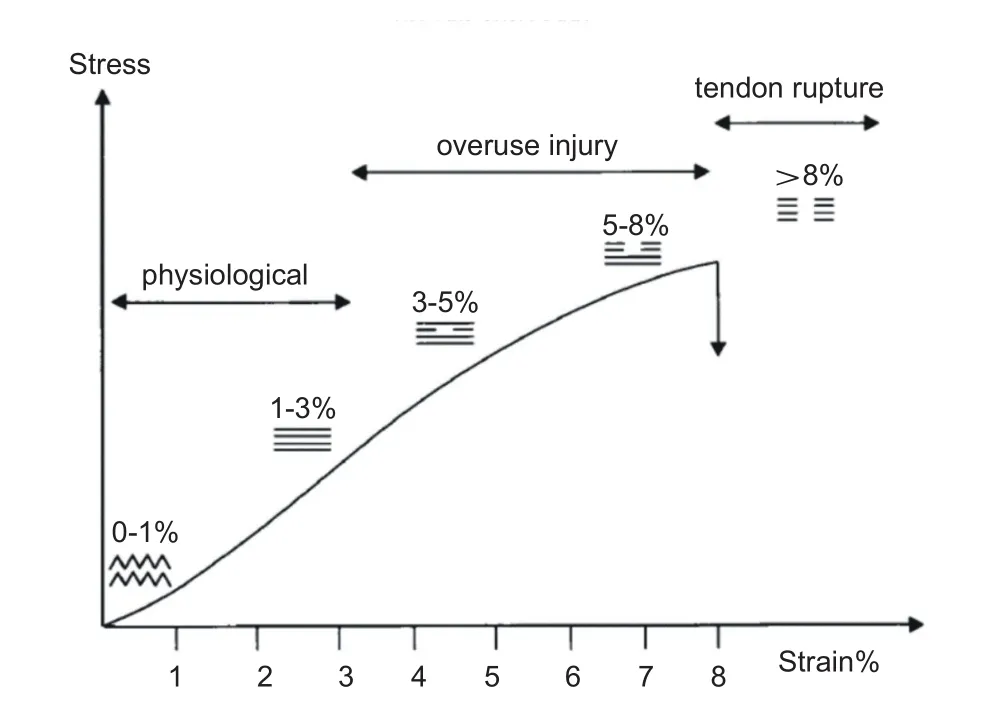
图1 肌腱应力应变曲线图[28]
Duenwald-Kuehl[32]通过应力刺激使肌腱发生过度伸展(超过组织的弹性极限的应变)诱发肌腱腱病的产生。在测量肌腱力学的同时使用临床超声记录回波强度,结果发现过度拉伸导致的弥漫性损伤降低了组织中所给定应变的应力,降低了肌腱组织粘弹性响应。过度拉伸在应力松弛和循环测试期间也使回波强度降低。随着过度拉伸的输入,应变增加,应力水平和回波强度变化逐渐减小。Lee等[33]通过超声研究大鼠胶原酶诱导的肌腱腱病模型的生物力学性能发现,与对照组相比,受伤肌腱的机械性能不断下降,呈现有缺陷的愈合,表现为更高的组织病理学分数、更低的杨氏模量和更高的超声特征分数。与此同时,机械性能下降的肌腱所能承受的最大应力减小,在不断的应力刺激过程中,逐渐表现出肌腱腱病的特征。更值得关注的是,Abat[34]在最近关于肌腱腱病病变趋势的研究中提出,有证据显示,通过引起肌腱组织超载或欠载来改变典型的应力载荷模式,证明了机械载荷与腱炎发病存在相关性。Abat还提出导致肌腱腱病产生的原因并不是最大应力载荷,而是较低水平的重复应力负载导致了肌腱内胶原纤维的损伤,从而使传递肌肉力量的肌腱横截面积减小,这一改变是加重肌腱损伤的重要原因,促进了肌腱腱病的发生与发展。
Raney[35]在其“肱二头肌肌腱病的发病机制与疼痛的关系”的研究中指出,肌腱腱病产生机制的机械理论认为肌腱腱病是肌腱在正常生理应激范围内重复加载应力刺激所引起的腱疲劳和肌腱损伤。在重复和/或长时间的应力刺激下,牵伸应力越大,肌腱发生的微观变性越严重。肌腱的微观变性与肌腱细胞程序性死亡增加有着密切关系。过度的应力刺激导致肌腱细胞应激增加引起细胞程序性死亡的加剧,可能是肌腱腱病恶化的原因。对犬肌腱细胞的研究表明,应力的量和持续时间以及循环方式会诱导一种应激激活的蛋白激酶c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的增加,持续的JNK的激活与肌腱细胞凋亡有关,这种细胞凋亡增加了胶原分解,使肌腱更容易被撕裂。
3 应力刺激与Sirt1
Sirt1作为一类依赖于NAD+的组蛋白去乙酰化酶,在调节应激反应中具有重要保护作用。研究表明,Sirt1可被不同类型的应力刺激激活调控,在细胞凋亡、活性氧(reactive oxygen species,ROS)清除和内环境稳态的维持等细胞存亡的重要方面中表现出关键作用[36],保护细胞免受应力刺激的损伤。
在调控细胞凋亡与自噬方面,有研究显示剪切应力可以调控Sirt1启动子的活性,活化的Sirt1可以通过抑制细胞凋亡促进细胞自噬的发生,从而达到保护细胞的作用。此外,剪切应力诱导的Sirt1可能作为一种介导活性氧引起自噬的氧化还原反应的传感器,保护细胞免受应力的损伤[37]。
在ROS清除方面,Patricia等的研究表明,Sirt1的RNA和蛋白质表达是由肌肉受到的牵拉应力所引起的,肌肉受到应力拉伸刺激导致Sirt1启动子区域与人早期生长反应基因(early growth response protein 1,EGR1)结合物的占有率提高,引起Sirt1启动子的活性增强,促进肌管活性氧簇(ROS)水平的恢复。整个过程如图2所示,EGR1参与骨骼肌细胞牵拉后Sirt1的诱导和ROS的清除。肌管受到的机械拉伸增加了超氧阴离子的生成和EGR1的表达,此后EGR1与Sirt1启动子结合激活Sirt1表达。被激活表达的 Sirt1与FOXO结合并提高了FOXO与超氧化物歧化酶2(superoxide dismutase 2,SOD2)启动子的结合率,引起ROS水平降低至正常水平。综合以上过程,在机械拉伸刺激后,Sirt1可刺激SOD2的表达而促进ROS的清除,达到保护骨骼肌细胞免受损伤的效果。整个过程是基于Sirt1对应力刺激最敏感时Sirt1蛋白和EGR1之间相互的物理作用而引发的一系列自动循环调节[38,39]。
在内环境稳态方面,Sirt1也表现出了类似的保护性能。Kai等[40]在研究中发现,将大鼠血管平滑肌细胞体外进行幅度为10%、频率为1.25 Hz的循环拉伸,结果发现,与静态对照组相比,Sirt1和FOXO3在牵拉刺激下表达明显增加,但FOXO4的表达下降。通过siRNA转染下调Sirt1表达减弱了由于牵拉刺激引起的收缩血管平滑肌细胞的标志物和FOXO3a的表达。最终证实物理循环牵拉通过Sirt1/FOXO通路促进了血管平滑肌收缩分化,从而维持血管内环境稳定。
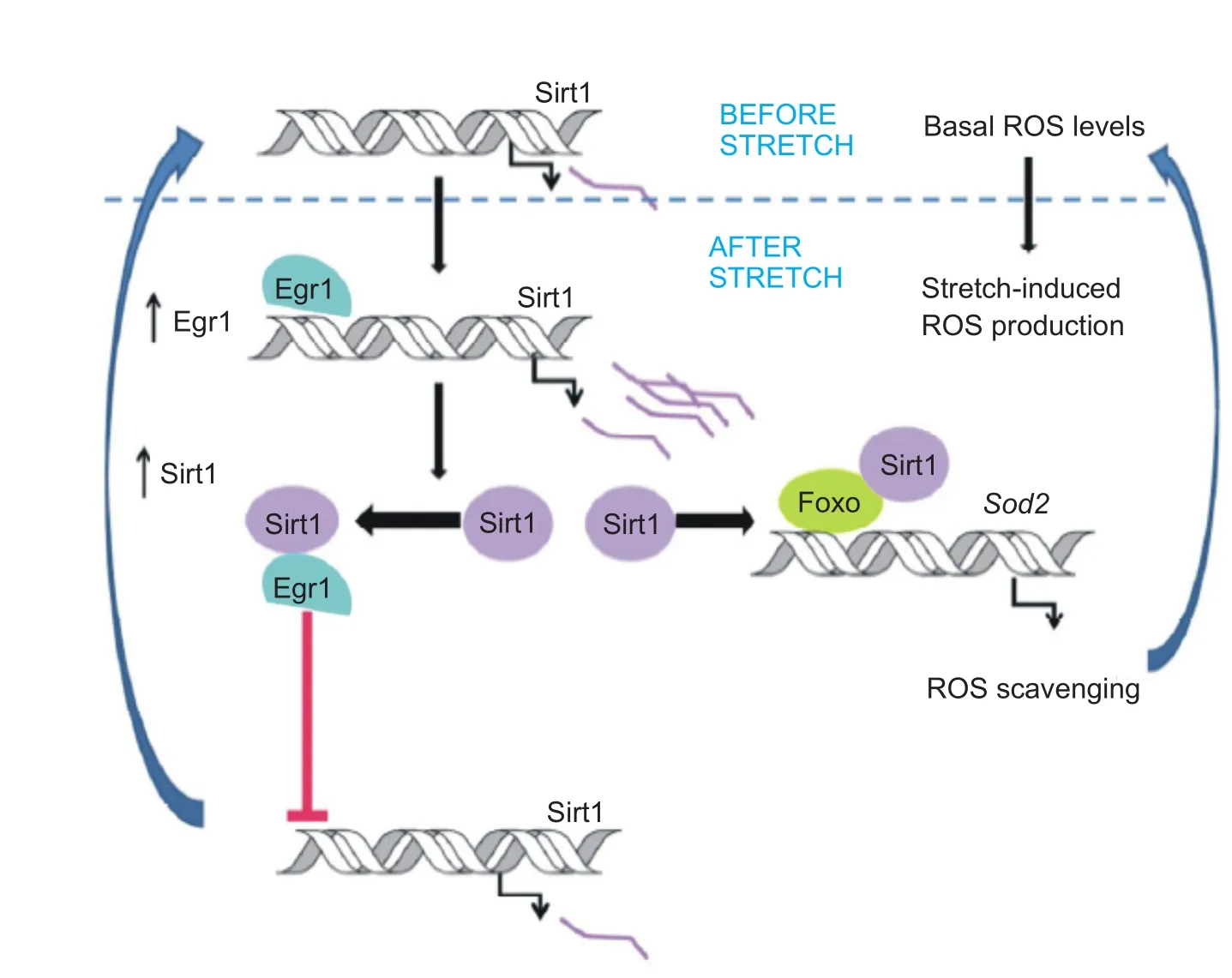
图2 骨骼肌细胞牵拉后Sirt1的变化及反应[39]
4 Sirt1与腱病
4.1 Sirt1 与肌腱细胞的凋亡
细胞凋亡是细胞高度规律的死亡形式,生理过程被称作细胞的“程序性死亡”。肌腱细胞对运动的机械应力的应变反应激活蛋白激酶,蛋白激酶触发细胞凋亡程序,导致肌腱细胞发生失去控制的细胞凋亡[41]。目前研究显示,JNK[42]的激活和细胞色素C相关的半胱氨酸天冬氨酸特异性蛋白酶3(cysteine aspastic acidspecific protease 3,caspase-3)的活化是肌腱退变诱导细胞凋亡的两条途径[43]。Chao等[44]发现白藜芦醇诱导凋亡涉及caspase-3介导的机制,siRNA-Sirt1转染和去乙酰化转移酶抑制剂MS-275均显著抑制了白藜芦醇诱导的人软骨肉瘤细胞中caspase-3的活性。亦有研究表明,Sirt1与成骨细胞的凋亡关系密切,可在细胞中过表达而增加细胞活力,降低凋亡百分比,Sirt1的过表达通过脱乙酰赖氨酸残基结合蛋白激酶B并降低caspase-3的活性,抑制随后的反应,显著激活抗凋亡作用[45,46]。
4.2 Sirt1与肌腱干细胞异常分化
肌腱干细胞(tendon stem cells,TSCs)是一种衍生于肌腱伞状细胞的间充质干细胞。与成熟肌腱细胞相比,TSCs具有更高的细胞增殖和胶原合成的潜力。在某些条件下,TSCs可以分化为成熟肌腱细胞,细胞外基质分泌增加,有效修复腱损伤。但是,TSCs分化的潜在机制仍然没有完全清楚。TSCs是多能的,能够分化成腱细胞、脂肪细胞、软骨细胞和成骨细胞。其多向分化潜能在腱修复过程中起着重要作用。尤其在肌腱受到损伤后,肌腱干细胞生存环境发生改变,导致肌腱干细胞分化异常。Rui等[47]在研究中发现过度应力刺激促进了肌腱干细胞的成骨分化,Zhang[48]则直接使用能够模拟体内负载条件的体外系统,对TSCs进行体外拉伸,发现过度的机械负荷会使TSCs在肌腱中向非腱细胞方向分化,从而导致脂质积聚、粘液样和组织钙化,表现出腱病样病理表现。
在成骨分化的调节中,Sirt1表现出促进成骨的作用。Cohenkfir等[49]发现Sirt1通过去乙酰化SOST(sclerosteosis)基因启动子上的H3K9位点实现对间充质干细胞成骨分化的调控。Simic[50]发现Sirt1通过将Runx2和β连环蛋白(β-catenin)去乙酰化,调节间充质干细胞分化。在对软骨分化的调节中,Sirt1促进软骨特异性基因在软骨细胞及软骨组织中的表达,抑制软骨细胞凋亡。白藜芦醇也能够激活Sirt1增加Runx2的表达促进成骨分化[51]。Liu[52]通过用SIRT1的激动剂SRT1720和SIRT1特异性抑制剂EX527处理肌腱干细胞,通过RT-qPCR和蛋白质印迹分析发现Sirt1水平升高后,相关因子β-catenin、Runx2等也升高,显示Sirt1可通过上调β-catenin和Runx2促进TSCs的成骨分化。当应力作用时,应力刺激可调控Sirt1表达促进成骨分化。关于继发性骨关节炎的研究显示,机械外力刺激是主要的发生原因之一,关节软骨的受损以及软骨下骨反应增生是主要的病理特征[53,54]。另有文献证据显示,正常的应力载荷作用于非炎性环境中的软骨细胞时,Sirt1正常表达并维持软骨的健康状态。当非正常载荷施加到关节表面时,软骨细胞在炎性因子环境中的短期暴露使Sirt1呈现一种保护性结果,通过增加Sirt1向细胞质的输出以提高软骨细胞的存活[55]。
Sirt1在成脂肪分化的调节中存在明显的抑制作用。PPARγ可被Sirt1去乙酰化,诱导白色脂肪中出现褐色脂肪组织。过度表达Sirt1可以通过锚定PPARγ的核受体协同抑制因子NcoR(nuclear receptor co-repressor)和 SMRT(silencing mediator of retinoid and thyroid hormonereceptors),而抑制PPARγ和转录因子CCAAT增强子结合蛋白α(CCAAT/enhancer-binding protein,C/EBPα)的表达,减少前脂肪细胞向脂肪细胞的转化,从而抑制脂肪细胞生成[56]。在成脂肪分化过程中,Sirt1蛋白的mRNA随着C/EBPα水平的增加而增加[57]。Liu 等[58]采用前列腺素 E2(prostaglandin E2,PGE2)连续7天刺激大鼠肌腱干细胞后,通过定量PCR和免疫印迹法发现,高浓度的PGE2刺激下Sirt1的表达明显升高,同时改善了细胞向成骨成脂肪分化的能力。此过程中,Sirt1抑制了丝/苏氨酸蛋白激酶2(serine/threonine protein kinase 2,AKT2)的活性,并与Akt2和C/EBPα发生作用,产生以下两种结果或者其中之一。其一沉默Akt2,其二Sirt1通过影响与C/EBPα通路起协同作用的PI3K(phosphoinositide 3-kinase)/Akt通路影响有胰岛素刺激的前脂肪的生成。因此,Sirt1介导成骨能力增强的同时,CEBPα和PPARγ降低,显示通过PI3K/AKT通路下调CEBPα和PPARγ抑制TSCs的脂肪形成的分化[58]。
5 总结
腱病的发生与发展同过度的应力刺激有着密切的联系已经在大量研究中得到了证实,Sirt1本身在腱细胞的凋亡及成脂成骨分化的过程中起重要作用,亦有大量研究证明应力刺激直接影响Sirt1启动子的活性,调控Sirt1并影响细胞凋亡和细胞的分化。可以确定当肌腱受到异常应力刺激时,Sirt1作为保护性因子表达增强,同时可推断应力刺激促使Sirt1高表达抑制腱细胞凋亡、改变腱细胞成骨与成脂肪进程,但直接实验相对缺乏,未来仍需更多的研究进一步证实。另外,Sirt1影响通路本身较为复杂,可去乙酰化多种物质,虽然目前研究表明Sirt1可以通过上调或者下调caspase-3、βcatenin和Runx2、CEBPα和PPARγ等影响细胞凋亡和干细胞成骨成脂肪分化,但在应力刺激下的具体调控机制仍不完全清楚,需要进一步探究。综合以上,应力刺激可促进腱细胞Sirt1表达增强,应力作用下高表达的Sirt1可能发挥抑制腱细胞凋亡,改变腱细胞成骨和成脂进程的作用。同时,鉴于Sirt1在腱病中发挥的作用,Sirt1也有可能成为肌腱腱病康复与治疗过程中的重要研究靶点。
