白皮杉醇对DN大鼠肾小球内皮细胞损伤的保护作用及其机制
2019-01-10张云霞邱书娟孙秀菊郭振涛郭民
张云霞,邱书娟,孙秀菊,郭振涛,郭民
(潍坊医学院附属医院,山东潍坊261031)
糖尿病肾病(DN)是临床最常见的微血管并发症之一,也是引起慢性肾脏疾病和终末期肾病的重要原因。研究证实,氧化应激和炎症反应在内皮细胞损伤中具有重要作用,而DN发病的重要环节是肾小球内皮细胞损伤[1]。因此,抑制氧化应激和炎症反应可改善肾小球内皮细胞损伤,延缓DN进展。白皮杉醇(PIC)是白藜芦醇的衍生物,主要存在于葡萄、大黄、甘蔗等植物中,是一种多酚化合物。研究证实,PIC具有多种生物学活性,如抗氧化应激、清除自由基、抑制炎症反应、抗细胞凋亡等作用[2],尤其在抗氧化应激方面较白藜芦醇效果更明显。但目前国内对PIC的研究较少,其作用机制亦不十分清楚。为此,2016年11月~2017年12月,我们观察了PIC对DN大鼠肾小球内皮细胞损伤的保护作用,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 材料 健康雄性SD大鼠50只,清洁级,8周龄,体质量(200±20)g,购自中国科学院上海实验动物中心。所有大鼠分笼饲养,每5只1笼,自由摄食、饮水,饲养环境:温度21~23 ℃、湿度50%~60%、自然昼夜节律光照。PIC,杭州广林生物医药公司;链脲佐菌素(STZ),美国Sigma公司。所有引物由美国Invitrogen公司设计合成。Modular DPP全自动生化分析仪,瑞士Roche公司;RM-2145石蜡切片机,德国徕卡公司;梯度PCR仪、核酸蛋白测定仪,德国Eppendor公司。大鼠内皮素1(ET-1)、血管内皮生长因子(VEGF)ELISA试剂盒,上海谷研生物科技有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒,南京建成生物科技有限公司;兔抗大鼠p38 MAPK、TNF-α单克隆抗体,美国Sigma公司;DAB显色试剂盒,武汉博士德生物工程有限公司。
1.2 动物分组处理 所有大鼠适应性喂养1周,随机分为对照组、模型组及PIC低、中、高剂量组,每组10只。模型组及PIC低、中、高剂量组高糖高脂饲料喂养4周,给予STZ 30 mg/kg一次性腹腔注射,制备DN模型。腹腔注射次日,PIC低、中、高剂量组分别给予PIC 50、100、200 mg/(kg·d)灌胃,模型组给予等量生理盐水灌胃,连续灌胃12周。对照组普通饲料喂养,不予注射STZ,同期等量生理盐水灌胃。
1.3 相关指标观察
1.3.1 肾功能及血糖 各组灌胃12周末,置于代谢笼中,留取24 h尿液,采用全自动生化分析仪、免疫透射比浊法检测24 h尿白蛋白(U-Alb);禁食12 h,3%水合氯醛100 mg/kg腹腔注射麻醉,麻醉完全后腹主动脉取血3 mL,采用全自动生化分析仪检测空腹血糖(FPG)及血清肌酐(Scr)、胱抑素C(Cys-C)。
1.3.2 肾小球内皮细胞功能及氧化应激状态 各组麻醉完全后无菌条件下摘取右侧肾脏,于冰冷的生理盐水中漂洗。取适量肾组织,充分研磨,制成10%组织匀浆,2 500 r/min离心10 min,取上清。采用ELISA法检测上清液ET-1、VEGF,硝酸还原酶法检测上清液NO,黄嘌呤氧化酶法检测上清液SOD活力,比色法检测上清液MDA含量。所有操作严格按照试剂盒说明进行。
1.3.3 肾组织病理形态 取部分肾皮质,10%甲醛固定24 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,4 μm厚连续切片。切片经二甲苯脱蜡至水,1%高碘酸氧化10 min,蒸馏水冲洗;Schiff氏液避光染色10 min,蒸馏水冲洗;0.5%偏重亚硫酸钠浸洗2次,蒸馏水冲洗;苏木素染核3~5 min,自来水冲洗;1%盐酸乙醇分化,自来水冲洗;1%氨水返蓝,流水冲洗;梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下随机选择10个400倍无重叠视野,观察肾小球、肾小管、系膜基质病理形态及炎性细胞浸润情况。
1.3.4 肾组织p38丝裂原活化蛋白激酶(p38 MAPK)、TNF-α表达 ①肾组织p38 MAPK、TNF-α mRNA表达:采用RT-PCR法。取部分肾组织,按TRIzol法提取组织总RNA,经紫外分光光度计和2%琼脂糖凝胶电泳鉴定,提取的总RNA符合实验要求。按cDNA合成试剂盒说明将总RNA逆转录为cDNA。以cDNA为模板进行PCR扩增。引物序列:p38 MAPK上游引物5′-AGGGCGATGTGACGTTTG-3′,下游引物5′-CTGGCAGGGTGAAGTTGG-3′,扩增片段1 083 bp;TNF-α上游引物5′-TGATCGGTCCCAACAAGGA-3′,下游引物5′-TGCTTGGTGGTTTGCTACGA-3′,扩增片段368 bp;β-actin上游引物5′-GGCATCCACGAATCTACCT-3′,下游引物5′-GCTGTCACCTTCACCGTTC-3′,扩增片段480 bp。PCR反应体系共25 μL:10×扩增缓冲液 2.5 μL,2.5 mmol/L dNTP 2.0 μL,上下游引物各1.0 μL,TaqDNA聚合酶0.4 μL,模板cDNA 2.0 μL,双蒸水补齐至25 μL;反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃(p38 MAPK)、53 ℃(TNF-α)或57 ℃(β-action)退火30 s,72 ℃延伸30 s,重复30个循环;最后72 ℃延伸10 min。以β-action为内参,采用2-ΔΔCT法计算目的基因相对表达量。实验重复3次,取平均值。②肾组织p38 MAPK、TNF-α蛋白表达:采用免疫组化法。取上述石蜡切片,置于60 ℃烘箱烘片30 min,二甲苯脱蜡,梯度乙醇脱水,0.01 mmol/L枸橼酸缓冲液加热抗原修复,自然冷却至室温,3% H2O2灭活内源性过氧化物酶活性。山羊血清封闭15 min,分别加入兔单克隆抗p38 MAPK、TNF-α一抗,37 ℃孵育2 h;然后加入生物素标记的二抗,37 ℃孵育30 min;DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。用美国Sigma公司提供的阳性切片作为阳性对照,PBS代替一抗作为阴性对照。p38 MAPK阳性表达定位于细胞质,呈棕褐色;TNF-α阳性表达定位于细胞质,呈棕黄色。每张切片随机取10个400倍不重叠视野,采用Image-Pro Plus软件分析每视野光密度值,以此代表目的蛋白相对表达量。实验重复3次,取平均值。

2 结果
2.1 各组血糖及肾功能相关指标比较 见表1。
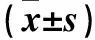
表1 各组血糖和肾功能相关指标比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与PIC低剂量组比较,△P<0.05;与PIC中剂量组比较,▲P<0.05。
2.2 各组内皮细胞功能和氧化应激相关指标比较 见表2。
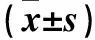
表2 各组内皮细胞功能和氧化应激相关指标比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与PIC低剂量组比较,△P<0.05;与PIC中剂量组比较,▲P<0.05。
2.3 各组肾组织病理形态观察 对照组肾小球、肾小管结构清晰,基底膜厚度正常,间质中未见明显炎症细胞浸润。模型组出现明显肾小球和肾小管基底膜增厚,系膜基质增多,肾小管上皮细胞脱落、空泡变、管腔扩大,结构紊乱伴有萎缩,毛细血管腔严重受压。与模型组比较,PIC各组肾组织损伤减轻,且随着PIC浓度升高,肾组织损伤逐渐减轻。
2.4 各组p38 MAPK、TNF-α表达比较 见表3。
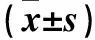
表3 各组p38 MAPK、TNF-α mRNA和蛋白相对表达量比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与PIC低剂量组比较,△P<0.05;与PIC中剂量组比较,▲P<0.05。
3 讨论
DN是糖尿病最常见的微血管并发症之一,即使严格控制血糖、规律应用ACEI/ARB类药物亦不能阻止其进展。研究证实,肾小球内皮细胞损伤是DN发病的重要环节之一[3]。长期高血糖会通过激活蛋白激酶C通路、糖基化终产物蓄积、激活血管紧张素-醛固酮系统、氧化应激等途径损伤内皮细胞,其电荷屏障和机械屏障破坏可导致蛋白尿,引起炎症免疫反应,继而导致系膜基质增生、肾小球硬化等[3,4]。内皮细胞可分泌多种细胞因子,如NO、ET-1、VEGF等,调控这些细胞因子可改善肾内微循环,抑制炎症细胞浸润,保护内皮细胞。高血糖可引起内皮细胞损伤,NO等舒张血管物质生成减少,ET-1等收缩血管物质生成增多[5],同时IL-8、IL-1、VEGF等细胞因子生成增多,促进肾脏炎症反应、内皮细胞损伤及肾脏纤维化[6]。本研究模型组肾组织ET-1、VEGF明显增多,NO明显降低,证实DN大鼠肾组织存在明显内皮细胞损伤。
PIC是白藜芦醇的衍生物,主要存在于葡萄、大黄、甘蔗等植物中,是白藜芦醇的羟基化衍生物,也是其代谢产物。研究证实,PIC具有抗氧化应激、抗细胞凋亡、抑制炎症反应等作用,尤其在抗氧化应激方面效果更明显[7]。有研究表明,PIC预处理能够抑制棕榈酸诱导的人脐静脉内皮细胞损伤,增加NO生成,抑制氧化应激反应[8];PIC还能通过活化PI3K/AKT信号通路,促进内皮型一氧化氮合酶合成,促进NO释放,继而保护内皮细胞[9]。此外,PIC还能减轻胰岛素抵抗,降低糖尿病小鼠血糖水平[10]。而DN的发生与炎症反应和氧化应激密切相关,故PIC有可能延缓DN进展。但目前相关研究报道较少。
为探讨PIC对DN的作用效果,本研究对DN大鼠给予PIC 50、100、200 mg/(kg·d)灌胃处理12周,观察其血糖、肾功能、内皮细胞功能及氧化应激相关指标变化。结果显示,模型组血糖和肾功能相关指标均明显高于对照组;肾组织NO水平、SOD活性均明显低于对照组,ET-1、VEGF水平及MDA含量均明显高于对照组;且其肾组织出现明显损伤,而对照组肾组织未见明显异常。表明DN大鼠可出现明显的肾小球内皮细胞损伤,且其损伤可能与氧化应激反应有关。本研究结果还发现,PIC各组均能改善肾小球内皮细胞损伤,抑制氧化应激反应,且随着PIC浓度升高,其效果越来越明显。表明PIC能够抑制氧化应激反应,保护肾小球内皮细胞功能,延缓DN进展。
p38 MAPK是生物体内重要的信号转导通路,能够调控炎症因子分泌[11],而内皮细胞损伤与炎症反应密切相关。因此,在信号通路水平阻断和调控MAPK表达,可减轻内皮细胞损伤。TNF-α、IL-6、IL-10等炎症因子均可引起p38 MAPK通路活化[12,13],磷酸化的p38 MAPK入核后又能通过调控NF-κB等基因表达,促进单核巨噬细胞分泌TNF-α、IL-6、IL-10等炎症因子,使得炎症反应级联扩大,加重内皮细胞损伤[14,15]。为探讨PIC的作用机制,我们观察了各组肾组织p38 MAPK、TNF-α表达。结果发现,模型组肾组织p38 MAPK、TNF-α表达明显高于对照组,表明DN大鼠体内存在明显的p38 MAPK通路激活。既往研究发现,抑制p38 MAPK通路活化能抑制内皮细胞释放炎症因子,缓解炎症反应[16,17]。本研究结果显示,PIC各组肾组织p38 MAPK、TNF-α表达均明显低于模型组,且随着PIC浓度升高,其效果越来越明显。表明PIC可能通过抑制p38 MAPK通路活化,减轻炎症反应、缓解氧化应激反应,从而发挥肾小球内皮细胞保护作用。
综上所述,PIC能剂量依赖性地减轻肾小球内皮细胞损伤,保护肾功能,延缓DN进展,其作用机制可能与抑制p38 MAPK通路活化,减轻炎症反应、缓解氧化应激反应有关。
