不同提取方法对蓝靛果果渣花色苷提取效率的影响
2018-12-10刘雪可苏梦飞杨宁王月华孟龙月张美善
刘雪可,苏梦飞,杨宁,王月华,孟龙月,*,张美善
(1.延边大学工学院,吉林延吉133002;2.延边大学理学院,吉林延吉133002)
蓝靛果是一种具有丰富营养价值的浆果,富含氨基酸和维生素等多种活性物质且具有丰富的紫红色素等高附加食用、药用价值,广泛应用于医药、保健、美容等领域[1]。然而,目前在实际加工过程中利用的是其果汁,残留的果渣大多被直接废弃,没有得到有效的再利用,并且导致了区域环境及生态污染问题。因此,如何合理再利用蓝靛果果渣受到了社会上的广泛关注。
花色苷是一类呈紫红色的生物类黄酮,由花青素与糖以糖苷键结合而成[2-3],因其独特的化学结构特征具有保护视力、保护血管、抗癌抗肿瘤等生理功能[4-5]。根据赵玉红等[6]和等[7]的研究可知蓝靛果果渣含有比果汁更多的花色苷,故从中提取花色苷是解决果渣再资源化问题的一个非常有效的方法。然而,因蓝靛果果渣中含有比果汁中更为丰富的纤维素与果胶等物质造成从果渣中提取花色苷的难度增加[8],故而从其中提取花色苷的工艺研究较少,因此如何使纤维素断裂,使更多的花色苷得以溶出可以作为判别提取工艺优劣的参数。
目前,传统的溶剂浸提法、超声辅助提取、微波辅助提取和酶解法等是提取花色苷的常用工艺[9]。其中传统的溶剂浸提法主要利用提取液对不同成分溶解度的差异将花色苷从植物组织内溶解出来,但此方法具有耗时长、提取率低的缺陷。在传统提取方法的基础上适当升高温度,可以使花色苷在提取液中的溶解度增大利于提取,但温度过高则会破坏花色苷的结构[10]。目前,天然产物提取中使用最为普遍的提取工艺是超声辅助提取,超声工艺在天然产物提取中的理论基础主要有3个,即空化作用、热效应和机械作用。超声波是一种弹性波,其在介质中产生的机械效应与空化作用使溶剂与物料间产生摩擦与剪应力加剧细胞破裂,促进胞内物质的释放与扩散,而热效应又加大了花色苷在溶剂中的溶解度,缩短提取时间,提高效率[6,11]。微波作为一种电离辐射,能使被辐射物质产生撕裂与摩擦而发热,且能量传递快速均匀,促进成分提取进程,提高产物的提取率,同时微波还具有选择性好、穿透率强、提取率高、操作时间短等优点[12-13]。然而,到目前为止采用不同的提取技术对蓝靛果果渣中有效提取花色苷的研究鲜见报道,科研工作者更多的是从蓝莓等材料中进行优化提取。为此,本文通过选取提取时间作为因素以提取液中花色苷浓度做指标进行试验,研究传统的溶剂提取、超声辅助提取、微波辅助提取的提取效率的高低,旨在为谋求高效快捷的蓝靛果果渣中花色苷工业化生产工艺提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
蓝靛果:吉林省汪清县东北红豆杉生物科技有限公司。
无水乙醇、盐酸:天津市科密欧化学试剂有限公司;乙酸钠、氯化钾:上海阿拉丁生物科技股份有限公司;乙酸:天津市鼎盛鑫化工有限公司,均为分析纯。
循环水式真空泵(SHB-ⅢA型):上海豫康科教仪器设备有限公司;电子分析天平(JE1002型):上海蒲春计量仪器有限公司;磁力搅拌器(HJ-2A型):金坛区西城新瑞仪器厂;超声清洗机(JP-020型):深圳市洁盟清洗设备有限公司;家用微波炉(EG7KCGW3-NA型):九阳股份有限公司;紫外-可见分光光度计(UV-2550型):岛津公司。
1.2 方法
1.2.1 pH试差法的原理
随pH值的改变花色苷的色调及色度也会改变,但pH值的改变却不会对干扰杂质的吸光度造成影响。pH 1.0时检测液中花色苷存在形式为花色苷元离子,此时检测液的吸光度为花色苷与杂质两者的吸光度;pH 4.5时检测液中的花色苷转化为无色的查尔酮,此时检测液的吸光度仅为杂质的吸光度。
1.2.2 缓冲溶液的配制
pH 4.5缓冲液的制备:取1.64 g乙酸钠并使用蒸馏水定容到100 mL,然后通过乙酸调节pH(4.5±0.1)。
pH 1.0缓冲液的制备:取1.49 g KCl并使用蒸馏水定容为100 mL。精确量取1.7 mL盐酸之后通过蒸馏水定容到100 mL,配制盐酸溶液为0.2 moL/L,而后将两种溶液以25∶67的体积比混合。用HCl溶液调pH(1.0±0.1)。
1.2.3 常温溶剂浸提中得率随时间的变化
取2 g果渣与60%乙醇以固液比1∶25(g/mL)混合,常温下在磁力搅拌器上提取。将浸提液每30分钟抽滤一次,共抽滤6次。在pH 1.0和pH 4.5的缓冲液中将抽滤后的浸提液稀释一定倍数,而后采用UV-2550型紫外-可见分光光度计检测其在520 nm处的吸光度,不同提取时间下的浸提液中花色苷浓度可由pH试差法[2]计算得出。
1.2.4 加热溶剂浸提工艺下得率随时间的变化
将提取温度升至50℃后,参照常温溶剂浸提进行花色苷加热溶剂浸提工艺的提取。
1.2.5 超声工艺下得率随时间的变化
取2 g果渣与60%乙醇以固液比1∶25(g/mL)混合,在50℃下超声辅助提取。从25 min时每5分钟将提取液抽滤一次,共有6次抽滤。在pH 1.0和pH 4.5的缓冲液中将抽滤后提取液稀释,而后采用UV-2550型紫外-可见分光光度计扫描检测其吸光度,不同提取时间下浸提液中花色苷浓度可由pH试差法得出。
1.2.6 微波工艺下得率随时间的变化
取2 g果渣分为6组与60%乙醇以固液比1∶25(g/mL)混合,50℃下在1分钟内以10 s的递增梯度微波辅助提取后抽滤。在pH 1.0和pH 4.5的缓冲液中稀释将抽滤后提取液,而后采用UV-2550型紫外-可见分光光度计扫描检测其吸光度,不同提取时间下的提取液中花色苷浓度可由pH试差法得出。
1.2.7 花色苷得率的计算
花色苷含量可依据FULEKIT等[14]及宋德群等[15]的研究并联合比尔定律得出。

式中:An、A1为 pH 1.0、pH 4.5 时花色苷吸光度;V为提取液总体积,mL;n稀释倍数;M为矢车菊-3-葡萄糖苷相对分子质量,449;ε为矢车菊-3-葡萄糖苷消光系数,29 600;m为样品的初重,g。
2 结果与分析
2.1 常温溶剂浸提工艺中得率随时间的变化
常温溶剂浸提工艺中花色苷得率随浸提时间的变化可见图1。
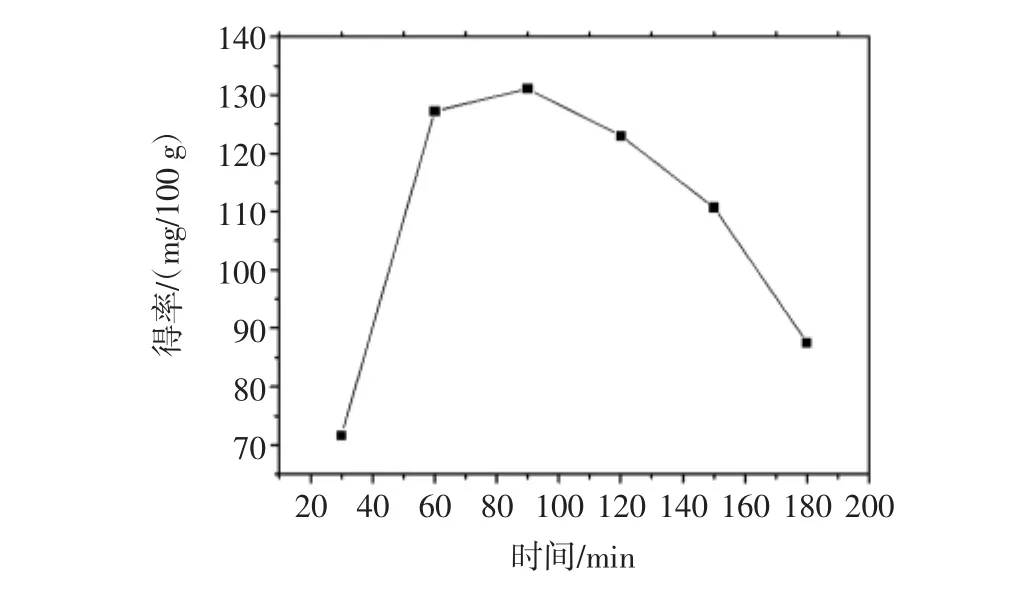
图1 常温溶剂浸提工艺中得率随时间的变化Fig.1 Variation of yield over time in solvent extraction process at room temperature
由图1可知,以70%乙醇为提取液、在固液比1∶25(g/mL)的条件下提取花色苷,花色苷得率随着提取时间的增加也持续升高,在90 min时达到最高为131.06 mg/100 g。而后继续延长提取时间,果渣中花色苷的得率不升反降,原因在于此提取条件下,花色苷在溶剂中的溶解已经达到饱和,继续增加提取时间,也不能使花色苷得率有明显的提高,反而会有部分花色苷分解。
2.2 加热溶剂浸提工艺下得率随时间的变化
加热溶剂浸提工艺中花色苷得率随浸提时间的变化可见图2。

图2 加热溶剂浸提工艺下得率随时间的变化Fig.2 Variation of yield over time in the heating solvent extraction process
由图2可知,以70%乙醇为提取液、在固液比为1∶25(g/mL)的条件下,花色苷的得率随着加热时间的增加也持续升高,在90 min时达到最高为134.92 mg/100 g。继续延长提取时间,花色苷的得率反而有所下降,原因在于提取90 min后花色苷在溶剂中的溶解已经达到饱和,继续提取使花色苷在50℃下长时间受热而部分发生分解,从而使花色苷得率有所下降,不利于花色苷的提取。
2.3 超声工艺下得率随时间的变化
常温工艺中花色苷得率随浸提时间的变化可见图3。
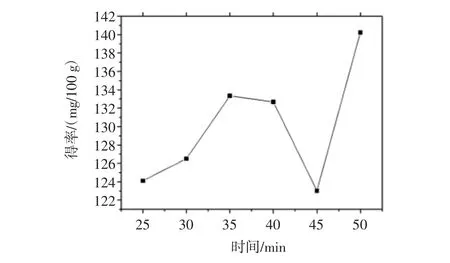
图3 超声工艺中得率随时间的变化Fig.3 Variation of yield over time in ultrasonic process
由图3可知,以70%乙醇为提取液、在固液比为1∶25(g/mL)的条件下提取花色苷,花色苷得率随着超声时间的延长也持续升高,在35 min时达到一个小高峰,为133.35 mg/100 g,而后继续增加提取时间,花色苷得率反而略有少许下降,而后在50 min时又有明显的上升,为140.23 mg/100 g。超声辅助提取中由于超声的空化效应、热效应及机械作用,会加速花色苷的在溶剂中溶解。但在此过程中超声时间过短,植物细胞内的花色苷尚不及溶出而使提取量过少;超声时间过长使花色苷长时间处于高压受热状态而发生分解现象,同样对花色苷提取不利。因此,超声辅助提取工艺的最佳提取时间为35 min。
2.4 微波工艺下得率随时间的变化
微波工艺中花色苷得率随浸提时间的变化可见图4。
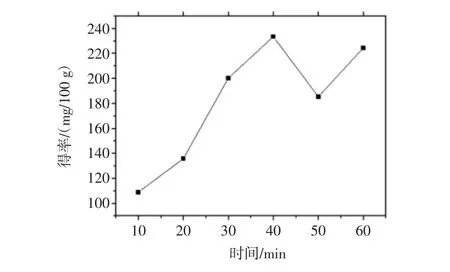
图4 微波工艺中得率随时间的变化Fig.4 Variation of yield over time in microwave process
由图4可知,在以70%乙醇为提取液、固液比为1∶25(g/mL)的条件下,随着微波时间的延长,花色苷得率也持续增加,在0.67 min(40 s)时达到最高,为233.4 mg/100 g,继续延长微波时间提取液中花色苷得率先降后升,其原因可能为随着微波时间的增加整个提取体系内的温度升高过快而使提取液中花色苷的提取速率与花色苷的分解速率不平衡,从而导致在0.67 min后花色苷的含量先降后升,继续延长提取时间可能会使体系的温度过高导致更多的花色苷结构破坏,以致得率降低。因此,在微波辅助提取工艺中的最佳提取时间为0.67 min。
2.5 不同工艺比较
不同浸提工艺下花色苷得率的变化可见图5。
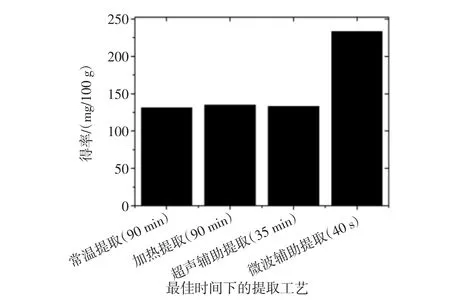
图5 不同工艺下花色苷得率比较Fig.5 Comparison of anthocyanin yields under different processes
由图5可知,在提取液浓度、固液比一定的条件下,4种提取工艺中微波辅助提取的提取效率最好,提取时间最短仅为0.67 min;超声次之,之后提取效果较好的是加热溶剂浸提,最后是常温溶剂浸提。与传统溶剂提取相比,超声辅助提取法对果渣和提取剂的机械振动,空化效应和热效应,有效的破坏了植物细胞细胞壁的结构,在得到的花色苷提取量相同的情况下,超声辅助提取的时间缩短了两倍;而与传统的溶剂提取相比,微波产生的能量在果渣与提取液中传播快速均匀,体系热效率高[16],不仅使提取液中花色苷得率得到极大提高,同时微波辅助提取的时间也由90 min压缩至0.67 min。
2.6 紫外光谱分析
为了对4种工艺所得花色苷的特征基团进行比较研究,利用UV-2550型紫外-可见分光光度计对4种方法得到的花色苷在240 nm~750 nm范围内扫描进行紫外光谱分析,结果见图6。

图6 4种提取工艺下紫外光谱扫描曲线对比图Fig.6 Comparison of ultraviolet spectral scanning curvesunder four extraction processes
在紫外区于270 nm~280 nm和465 nm~550 nm之间有显著吸收峰的物质基本可视为花色苷类化合物,花色苷类物质可通过检测提取液的最大吸收波长来判断,花色苷中酰基的存在及其个数可由440 nm和300 nm~330 nm处的吸收峰表明[17]。由图可知4种方法所得到的花色苷无明显不同。
3 结论
本文通过4种工艺对蓝靛果果渣中花色苷类物质进行了有效提取,并对其效率进行比较,结果表明:4种提取工艺中,微波辅助提取的效果最好,最优提取时间极短仅为0.67 min,花色苷得率也明显提高为233.4 mg/100 g;其次是超声辅助提取,提取时间35 min,花色苷得率为133.35 mg/100 g;之后是加热溶剂浸提,提取时间90 min,花色苷得率为134.92 mg/100 g;最后是常温溶剂浸提,提取时间90 min,花色苷得率为131.06 mg/100 g。其中,与传统的溶剂浸提相比,超声辅助提取的提取时间缩短了一半,花色苷得率也比之增加;微波辅助提取更是极大地缩短了提取时间,花色苷得率相比溶剂浸提提高了近两倍。此外,紫外光谱分析表明4种提取工艺所得花色苷基团基本相同。本研究通过对4种常见提取方法最佳提取时间的优化验证了各方法的优劣,为科研工作者在蓝靛果果渣中花色苷的进一步研究提供理论参考。
