水稻低温敏感叶色突变体tcd32鉴定与遗传分析
2018-11-09王妍斌林冬枝董彦君
王妍斌, 周 优, 林冬枝,2*, 董彦君,2*
(1.上海师范大学 生命与环境科学学院,上海 200234; 2.上海师范大学 遗传研究所,上海 200234)
0 引 言
光合作用是影响水稻(OryzasativaL.)产量的关键因素之一,叶片是进行光合作用的主要器官,叶色深浅程度影响着光合作用的效率[1].叶色突变体是由叶绿素(CHL)合成和叶绿体发育相关基因沉默或失活引起的,直接或间接影响着叶绿素的合成和降解,改变叶绿素含量.大量研究表明,叶色突变体是研究植物光合作用机制、叶绿素生物合成途径、叶绿体的结构功能、遗传发育调控机理和农作物标记性状等的理想材料[2-3].水稻叶色突变体有很多种,有一类突变体在不同温度条件下呈现出不同的叶色表型,称为水稻温敏感叶色突变体,根据温度对叶色表达的影响,将水稻温敏感叶色突变体分为3种,即高温表达型、低温表达型和特殊温敏感型[4-5].低温表达型(水稻低温敏感叶色)突变体是指水稻突变体的叶色表型在相对低的温度条件下才会发生与正常叶色有差异的变化[6].目前报道有cde2[7],fan5[8],tsc1[9],tsl11[10],tcm11[6],tcm12[11],tws[12],lta1[13],1103(s)[14],ygl3[15],tsv3[16],tcd9[17],tcd5[18],tcd10[19],tcd11[20],OsGluRS[21].但其低温诱导临界温度为20~28 ℃不等[22].高温表达型(水稻高温敏感叶色)突变体是指水稻突变体的叶色表型在相对高的温度条件下会发生与正常叶色有差异的变化,与低温条件下生长的水稻叶色表型无异(如tcm5[23]).鉴于温度对温敏感叶色水稻突变体叶绿体发育的影响,可以利用它们探究水稻的叶绿素合成、叶绿体发育,及光合温度响应的分子机制.同时在水稻遗传改良,高产育种中具有重要的潜在应用价值.
本研究通过60Coγ辐射水稻粳稻“嘉花1号”得到一个新的低温敏感叶色突变体tcd32,对该突变体的叶色表型、光合色素含量、叶绿体显微结构进行观察和分析,并利用DNA分子标记对该突变基因进行了定位,为该基因的分子克隆及其作用机理的研究奠定基础.
1 材料与方法
1.1 材 料
所用的低温敏感叶色突变体tcd32是用粳稻“嘉花1号”干种子,经60Coγ射线辐照诱变所得,经多代在上海和海南自交繁育和选种,其农艺性状已稳定.
1.2 方 法
1.2.1 苗期叶色表型观察
将突变体tcd32与野生型(WT)“嘉花1号”的种子分别在30 ℃ 条件下催芽3 d后,将发芽的种子分别播种于20,25,30 ℃的光照培养箱(GXZ智能型,宁波江南仪器厂)中,每天光照12 h,光照照度为180 μmol·m-2·s-1.每隔2 d观察1次幼苗的生长情况,观察并记录叶片的表型变化.
1.2.2 叶片光合色素含量的测定
苗期叶片中叶绿素a(CHLa),叶绿素b(CHLb)和类胡萝卜素(CAR)含量的提取以及测定方法参考[24].分别选取在20,25,30 ℃条件下生长的突变体tcd32和野生型的三叶期幼苗的第三叶,剪取其叶片中间部分,称取20 mg,剪碎后放入试管中,加入5 mL叶绿素提取液(体积比为:V乙醇∶V丙酮∶V水=5∶4∶1) 于试管中,密封后,轻轻摇匀,后置于室温暗条件下处理18~24 h,直至叶片完全褪色.用METASH-UV5100分光光度计分别测定提取液对波长为470645663 nm的光的吸光度值,并分别计算出叶绿素a,叶绿素b和类胡萝卜素的含量.实验重复3次,计算其平均值.
1.2.3 叶片叶绿体显微结构观察
叶片取样方法与上述1.2.2相同,然后将叶片沿叶脉方向剪成面积约1 mm2的正方形,放入2.0 mL的离心管中,之后立即放入2.5%(体积分数)的戊二醛固定液(体积比为:V25%戊二醛∶V0.2mol/L磷酸缓冲液∶
V无菌水=1∶4∶5),24 h后换新鲜的固定液,于4 ℃下保存,固定好后,进行清洗,再固定、洗涤、脱水与硬化,再经置换、浸渍、包埋、聚合、修块、切片、染色等一系列处理过程后,用透射电镜(Hitachi765型)进行观察拍照.
1.2.4 遗传分析与群体构建
利用培矮64S为母本,tcd32作为父本进行杂交,按常规种植加代收获的F1代和F2代种子,作为遗传研究和基因定位的群体.
1.2.5 水稻DNA提取
用十六烷基三甲基溴化铵(CTAB)法[25]提取亲本突变体tcd32和培矮64S植株的DNA,F2代中用于定位的植株群体的DNA是用简单、快速、便捷的Tris physiological saline(TPS)法[26]提取.
1.2.6 突变体基因定位
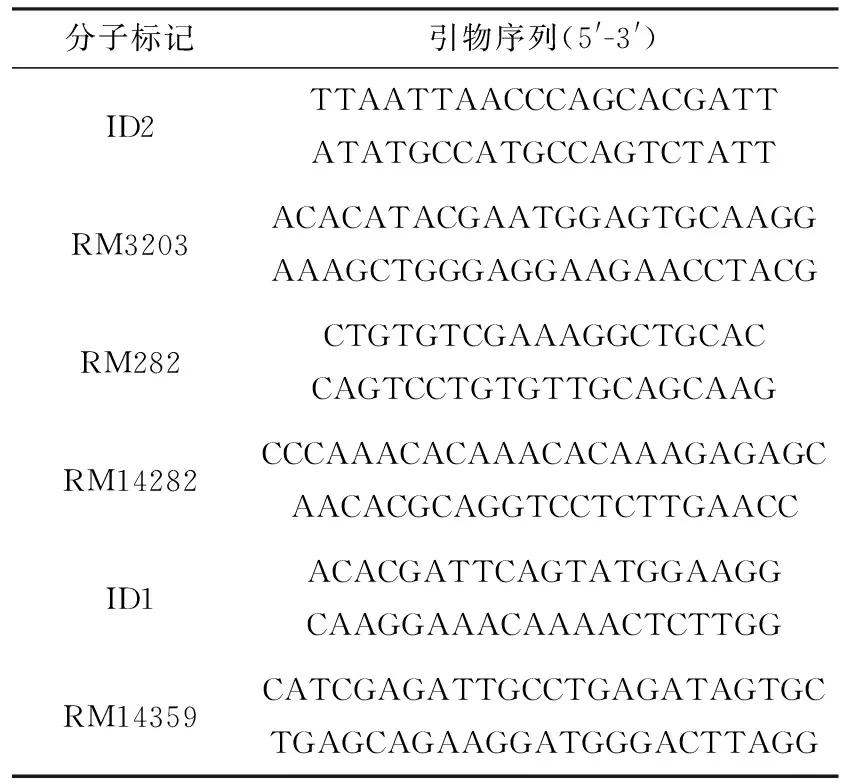
表1 用于基因定位的分子标记
利用本实验室保存的水稻SSR和InDel引物,检测突变体tcd32与培矮64S间的多态性.选取在染色体均匀分布且具有多态性的5~6对引物,对20 ℃低温下生长的水稻中分离出的22个F2突变型株的DNA进行扩增,分析其带型,确定突变基因所在染色体位置,并进一步扩大F2群体数进行基因定位.在目标区域内,根据美国国立生物技术信息中心(NCBI)公布的粳稻日本晴的全基因组序列和籼稻9311的全基因组序列间的差异InDel位点,利用Primer Premier5.0软件设计引物(表1),进一步对突变基因进行定位.实验DNA聚合酶链式反应(PCR)体系和PCR反应条件参照[26].PCR反应产物用2.0%~3.5%(质量分数)的琼脂糖凝胶电泳检测,经溴化乙锭染色后在紫外线凝胶成像仪上成像,并拍照记录.用MapMaker/exp3.0软件构建目的基因区域内的遗传图谱.
2 结果与分析
2.1 苗期突变体的表型

图1 (a) 突变体tcd32和(b) 野生型“嘉花1号”在20,25,30 ℃条件下三叶期后生长过程
观察突变体tcd32和野生型“嘉花1号”苗期植株叶色(图1),结果显示:tcd32突变体在20 ℃条件下,第一,二,三,四叶片均表现为白化表型,植株最终枯萎死亡;在25 ℃条件下,第一,二,三叶片表现为黄化表型,从第四叶期开始,叶片转为黄绿色;但在30 ℃条件下,tcd32的植株表型与野生型没有明显差异.结果表明,tcd32的苗期叶色表型与生长温度密切相关,具有低温敏感叶色属性.
2.2 突变体的光合色素含量变化
在3种不同温度(20,25,30 ℃)条件下生长的突变体tcd32和野生型“嘉花1号”幼苗的三叶期叶片的光合色素测定结果(图2)显示:在20 ℃条件下,tcd32的光合色素含量(包括叶绿素a、叶绿素b以及类胡萝卜素)与野生型相比显著降低;在25 ℃条件下,tcd32的光合色素含量与野生型相比明显降低;在30 ℃条件下,tcd32的光合色素含量与野生型的光合色素含量无明显差异.此结果表明,苗期突变体光合色素含量与叶色表型相一致,具有温敏属性.
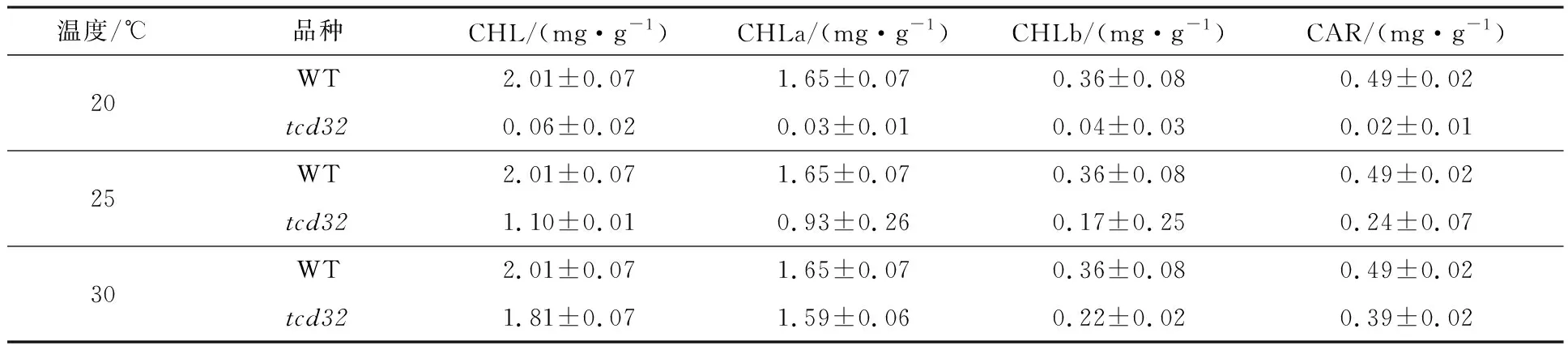
表2 突变体tcd32和野生型“嘉花1号”在不同温度条件下的三叶期叶片光合色素含量
2.3 突变体叶绿体显微结构
对在20 ℃和30 ℃下生长的突变体tcd32和野生型“嘉花1号”三叶期的第3叶中的叶绿体的显微结构进行观察(图3),发现野生型“嘉花1号” 的叶绿体在高温和低温下都发育正常;而突变体tcd32在20 ℃下几乎观察不到一个完整的叶绿体结构,而在30 ℃下,突变体tcd32中的叶绿体又恢复正常发育,具有完整清晰的内囊体片层结构,与野生型相一致.这说明在低温条件下该突变体tcd32的叶绿体发育分化受到严重影响,光合色素合成受阻,不能进行正常光合作用,进而产生突变表型.
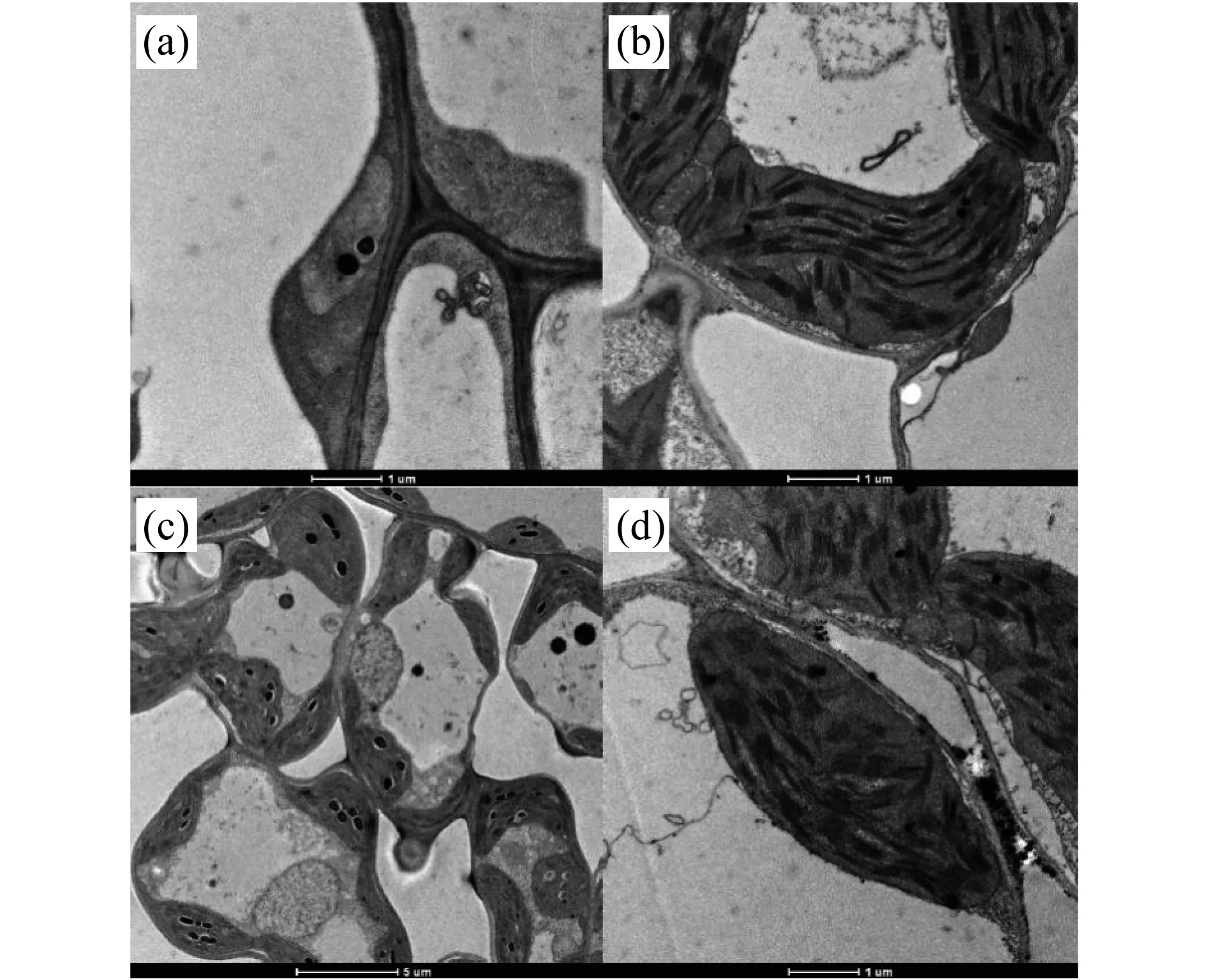
图3 野生型“嘉花1号”和突变体tcd32植株在不同温度条件下的叶绿体显微结构.(a) 突变体tcd32,20 ℃;(b) 突变体tcd32,30 ℃;(c) WT,20 ℃;(d) WT,30 ℃
2.4 遗传分析

2.5 基因定位
从F2代突变型白化苗中,选取22株进行连锁分析,发现水稻第3号染色体上的分子标记RM14359有强烈的偏态扩增,如图4(a)所示,表明tcd32位于第3染色体上,然后扩大F2群体至288株,将该基因tcd32定位在RM14359的上游,与其遗传距离为9.2 cM,如图4(b)所示,然后在RM14359的上游设计新的4个分子标记(ID1,ID2,RM14282,RM3203),将定位群体扩大至2887株,发现分子标记ID1和ID2均与突变基因tcd32表现共分离,而RM14282与tcd32基因的遗传距离为1.3 cM,最终将tcd32基因锁定在RM14282的上游的染色体顶端的537 kb内.
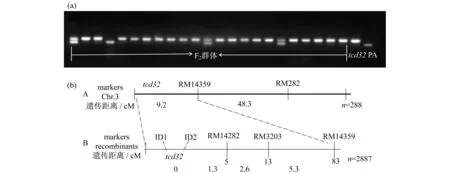
图4 突变体在分子标记RM14359的(a) 电泳图和(b) 遗传定位图
3 讨 论
水稻是禾本科和单子叶植物的模式植物.随着水稻基因组测序的完成,水稻的功能基因组学受到越来越多的关注[28].其中,叶色突变体是研究叶绿体发育与功能以及叶绿素代谢的理想材料.就不完全统计,缺乏叶绿素导致水稻叶色发生改变的突变体至少有297个,其中已定位到染色体上的突变基因有163个,在水稻12条染色体上均有分布.其中,第1,3,5,6,11染色体上居多,尤其第3染色体上多达38个,而在第12染色体上发现最少时只有4个[5,29-31].但在这些叶色突变体中,表现温敏感的也有67个,其中低温敏感型56个,高温敏感型9个,特殊温敏感型2个[5,29-30].分布在第1,3,4,9,11染色体上较多,在第3染色体上有13个,其中低温敏感型有12个,高温敏感型有1个(ST1[32]).而目前被克隆的低温敏感型的叶色基因有:V1,V2,TCD5,TCD9,TCD10,TCD11.其中:V1基因编码一个叶绿体蛋白NUS1[33];V2基因编码一个调节叶绿体翻译的新型鸟苷酸激酶(pt/mt GK)[34];TCD5基因编码单加氧酶蛋白[18];TCD9基因编码分子伴侣蛋白Cpn60α[17];TCD10编码一个PPR蛋白[19];TCD11编码核糖体S6蛋白[20],这些基因在低温条件下对质体编码基因的转录起调节作用,导致低温条件下早期叶绿体发育异常.这表明水稻早期叶绿体发育过程中存在多种低温响应的分子机制.另外,突变体tcd32表型与v1,v2,tcd5,tcd9,tcd10,tcd11类似,均表现为低温敏感,即在低温条件下叶片表现为黄化或白化,但在持续低温条件下突变体tcd32死亡.在本研究中,将tcd32基因定位在第3染色体的顶端上的537 kb区间内,该区域包含89个候选基因,预测其中23个可能与叶绿体发育或叶绿素的合成相关,目前尚未被报道和克隆.今后,将在此基础上继续扩大定位群体,在染色体顶端设计更多新的分子标记.进一步对该突变体进行图位克隆和功能分析,将有助于进一步了解水稻叶绿体发育分子作用机理.
