低氧环境下SDF-1对间充质干细胞迁移影响的初探
2018-10-19姜杨李永涛徐桂清郭林娜张彧婷沈雷姚立杰王玉
姜杨 ,李永涛 ,徐桂清 ,郭林娜 ,张彧婷 ,沈雷 ,姚立杰 ,王玉
1.齐齐哈尔医学院解剖学教研室,黑龙江齐齐哈尔 161006;2.齐齐哈尔医学院基础医学院,黑龙江齐齐哈尔 161006;3.齐齐哈尔医学院细胞生物学教研室,黑龙江齐齐哈尔 161006
肌腱损伤是常见的运动性损伤,疾病多见于大量运动和年龄老化人群,主要表现为肌腱断裂、肿胀、运动受限,严重影响患者的身体健康。据报导,全球每年大约有3 000万肌腱损伤患者,由于肌腱组织缺少血液和细胞,再生修复能力较弱,很多患者存在严重后遗症。肌腱治疗方法主要是自体肌腱移植、异体肌腱移植、外科手术治疗,但存在异体排斥反应、移植后再次断裂等不良反应。目前利用干细胞组织工程移植到损伤肌腱部位修复技术日益彰显良好的诊疗效果,并有报道其可对损伤肌腱愈合有促进作用[1]。间充质干细胞(Mesenchymal Stem Cells,MSCs)是骨髓主要来源的多向能分化细胞,受到诱导可分化为骨组织、软骨组织、脂肪组织。多向MSCs是较理想肌腱损伤修复的种子细胞。SDF-1又称基质细胞衍生因子-1,是CXC类趋化因子,与受体CXCR4受体结合激活[2]。研究显示,损伤部位高表达SDF-1可有效募集循环系统或损伤部位留存的CXCR4激活间充质细胞到达损伤部位,修复受损组织[3]。目前利用组织工程修复损伤肌腱的研究不是很多,如何招募体内MSCs归巢到组织工程肌腱,促进宿主自身MSCs参与肌腱修复。如何激发宿主自身MSCs参与再生修复、降低免疫排斥反应、加速肌腱修复。该实验在2017年3月—2018年3月期间利用体外实验模拟体内低氧微环境观察一定浓度SDF-1刺激间充质干细胞迁移及细胞活性,为临床研究提供有力的研究支撑。
1 材料与方法
1.1 主要试剂和仪器
DMEM 培养基(HyClone,美国),胎牛血清(Gibco,美国),青链霉素(Gibco,美国),胰蛋白酶,4%多聚甲醛,大鼠 SDF-1(Abcam,美国),MTT 试剂盒(Sigma,美国)。
超净工作台,CO2恒温细胞培养箱,O2/CO2/N2三气培养箱,倒置相差显微镜(Olympus,日本),Transwell(Corning,美国),高速离心机(Eppendorf,德国),震荡仪(跃进仪器厂),Emax酶标仪为美国 Molecular Devices。公司产品。
1.2 实验动物
4~6周龄SD大鼠雄性购自齐齐哈尔医学院动物实验中心。
1.3 实验方法
1.3.1 细胞低氧微环境 利用三气培养箱建立低氧微环境。
1.3.2 间充质干细胞的分离、培养及鉴定 大鼠断颈处死,无菌处理取大鼠股骨两端剪开,5 mL DMEM培养基冲洗骨髓腔3~5次,收集细胞悬液1 000 r/s,离心10 min,上清液倒掉,用培养液吹均匀离心管下层组织,在25 cm2培养瓶培养,48 h换液,观察细胞培养瓶有雾状细胞集落,去除未贴壁细胞,以后每3 d换液。显微镜观察细胞形态、状态,细胞长满80%~90%进行消化、传代,使用第3代间充质干细胞进行实验。
1.3.3 实验分组 低氧环境下培养的间充质干细胞为低氧对照组,在低氧环境下加入120 ng/mL SDF-1为实验组,正常环境下培养的间充质干细胞为正常对照组。
1.3.4 Transwell实验 参考文献方法[4],将第3代MSC用0.25%胰酶消化1~2 min,调整细胞密度1×105cells/mL,Transwell小室的上室加入 200 μL 细胞悬液,24孔板加入120 ng/mL浓度SDF-1的DMEM培养液500 μL,对照组为500 μL DMEM培养液,每组设3个复孔,其分别放入37℃和5%CO2培养箱内和低氧环境37℃培养箱,12~15 h进行培养,上室培养液倒掉,PBS冲洗3遍,将聚碳酸酯膜上细胞擦拭掉,4%多聚甲醛固定,PBS冲洗3遍,20 min苏木精染色,倒置相差显微镜下观察拍照,每个复孔随机选取5个视野进行计数统计。
1.3.5 MTT实验 将第3代间充质干细胞用胰酶消化1~2 min,1×105cells/mL 种于 96 孔板, 每孔 200 μL,每组设3个复孔。DMEM培养液培养过夜,24 h后加入含120 ng/mL SDF-1培养液培养和不含SDF-1培养液培养,37℃、5%CO2培养箱和低氧培养箱内,每孔加入 5%MTT 20 μL,避光孵育 4 h,然后添加 100 μL二甲基亚砜(DMSO),490 m波长测定每个样品吸光度(OD值)。
1.4 统计方法
实验数据采用SPSS 18.0统计学软件分析,计量资料以(±s)表示,行t检验,P<0.05 为差异有统计学意义。
2 结果
Transwell细胞迁移实验:检测正常对照组、低氧对照组和实验组间充质干细胞的迁移影响。实验结果表明细胞迁移率实验组(43.5±8.4)×103与正常对照组(26.7±5.6)×103比较差异有统计学意义 (P<0.01);低氧对照组(37.5±7.2)×103与正常对照组(26.7±5.6)×103相比较差异有统计学意义(P<0.05)。见图1。
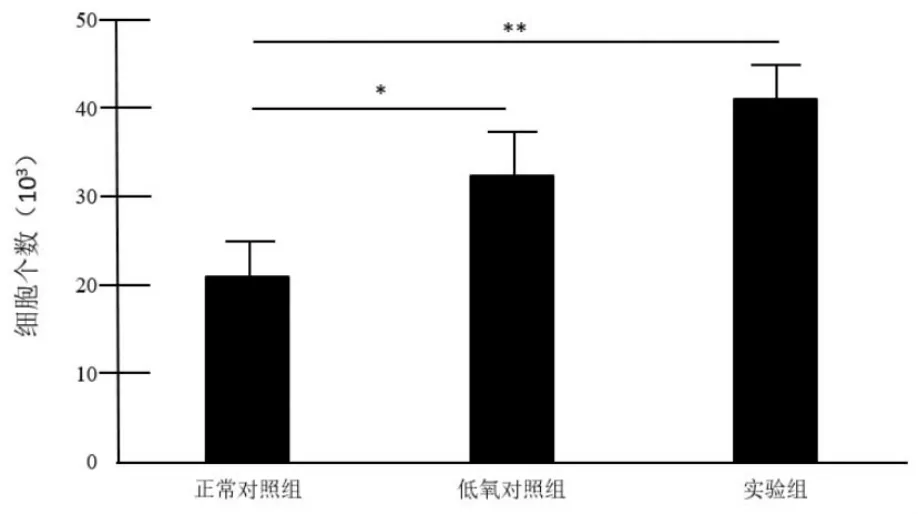
图1 低氧环境下120 ng/mL SDF-1对MSCs趋化作用
MTT实验检测正常对照组、低氧对照组和实验组间充质干细胞活性的影响。在低氧环境下加入120 ng/mL SDF-1因子对间充质干细胞增殖能力。结果是实验组加入120 ng/mL SDF-1因子对间充质干细胞增殖数量比较正常对照组和低氧对照组增加,差异有统计学意义。见表1。
表1 低氧环境下120 ng/mL SDF-1对MSCs相对吸光度的影响(±s)
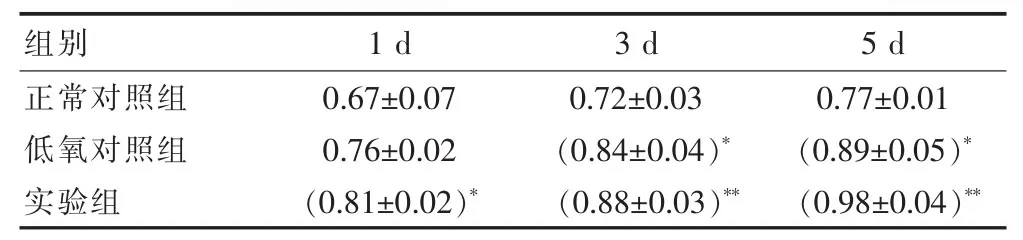
表1 低氧环境下120 ng/mL SDF-1对MSCs相对吸光度的影响(±s)
注:与正常对照组相比较 *P<0.05,**P<0.01。
?
3 讨论
肌腱损伤是目前医学较难解决的问题之一,是运动性损伤治疗的瓶颈问题,临床治疗方案主要停留在手术治疗,虽有一定治疗效果,但只能恢复原肌腱力学的40%,还伴有肌腱断裂、粘连等一些列并发症,给患者带来较大的身体、心理及精神创伤。近年来,组织工程技术的日渐成熟,前景广阔[5],许多研究者运用干细胞复合支架来修复损伤组织、器官。间充质干细胞取材简单方便,易于培养,适应生存在微环境,具有免疫源性低,而且分化能力强,是理想的种子细胞。本实验通过模拟体内肌腱损伤周围低氧微环境加入趋化因子SDF-1来观察间充质干细胞迁移能力和活性。目前趋化因子共50多种,有CXC、CC、C和CX3C四大亚家族[6]。SDF-1是应用较多是趋化因子,属于CXC家族,SDF-1与CXCR4结合,激活受体蛋白,并下一步激活下游蛋白,募集间充质干细胞到损伤部位,参与修复再生。
郝璐等[7]研究发现:在不加入SDF-1因子低氧环境下BMSCs迁移能力增强,加入趋化因子SDF-1后BMSCs迁移能力加强。该实验通过Transwell实验结果表明:低氧对照组较正常氧对照组的MSCs迁移效果增强,在加入120 ng/mL浓度SDF-1趋化因子在低氧环境下MSCs趋化现象也明显增强于低氧对照组,同时在低氧的环境下,随着培养时间的延长MSCs细胞的趋化能力也高于正常氧的环境。因此,该研究认为SDF-1及低氧环境对MSCs细胞有趋化作用,进而推测在低氧环境下及低氧环境下加入SDF-1因子能够使MSCs细胞趋化至损伤肌腱部位,从而参与修复损伤肌腱,为进一步实验开展提供了实验依据。
以往研究资料表明[8]可以利用MTT实验检测在不同浓度下 10、50、100 ng/mL和 200 ng/mLSDF-1因子在低氧环境下细胞的增殖活性。黄晓等[8]报道,在SDF-1浓度小于100 ng/mL时,对BMSCs细胞活力无影响;在SDF-1浓度等于100 ng/mL时,BMSCs细胞活力减弱。该实验通过MTT实验检测发现:在低氧环境下加入120 ng/mL浓度SDF-1组细胞增殖活性相对比正常氧MSCs组,低氧SDF-1组细胞增殖活性明显增高,表明低氧加入120 ng/mL SDF-1能够有效地加强MSCs细胞增殖活性;低氧对照组细胞增殖活性与正常对照组相比较也有差别,低氧对照组MSCs细胞增殖活性也明显强于正常对照组。
综上所述,上述的实验研究结果可作为临床肌腱损伤招募肌腱干细胞归巢并修复损伤部位奠定了理论支撑。但SDF-1因子招募细胞归巢机制目前尚不明确,需要进一步实验验证,以及间充质干细胞在损伤组织发挥修复作用机理等,尚需要进一步讨论研究。
