马铃薯野生种Solanum pinnatisectmumgn与栽培种下寨65原生质体融合与培养研究
2018-10-16孙海宏叶广继
孙海宏,王 芳,叶广继
(1.青海大学农林科学院,青海西宁810016;2.青藏高原生物技术教育部重点实验室,青海西宁810016)
马铃薯(Solanum tuberosum L.)是茄科茄属的一年生草本植物,粮菜兼用,在世界上种植范围广,抗旱,耐瘠薄,是继水稻、小麦、玉米之后的第四大粮食作物。其抗病、抗寒、抗旱、早熟性、丰产性等优良性状的选育一直备受关注。马铃薯现有的栽培种遗传背景狭窄,亲缘关系近,后代变异仅停留在近交水平,所以常规育种很难选育出优良抗性品种[1]。在马铃薯的野生种中含有大量的抗病基因和特殊基因,这为马铃薯育种提供了丰富的基因库[2]。然而,生产上应用的普通马铃薯基本为四倍体,野生种为二倍体,由于胚乳平衡数(EBN)的差异,很多野生种与栽培种存在杂交障碍,常规育种技术不能满足现在的育种需要。利用体细胞杂交技术可以克服马铃薯栽培种和野生种间由于倍性不同引起的生殖隔离,将野生种的优良基因导入栽培种以改良品种性状[3]。马铃薯原生质体融合培养是利用细胞杂交技术进行育种的基础。但所用材料的基因型不同,会导致原生质体融合和培养的结果存在差异。影响原生质体融合培养的因素主要包含基因型、培养条件,培养基组成等[4-5],马铃薯野生种 Solanum pinnatisectmum有丰富的抗性基因,包括高抗晚疫病(PVX、PVY、PLRV)和抗病毒病等,栽培种下寨65是青海省主栽品种,但该品种极易感染晚疫病。本试验通过对影响原生质体融合、培养的相关因素进行研究,旨在获得一种稳定的适合于马铃薯野生种Solanum pinnatisectmum与栽培种下寨65试管苗叶片的原生质体分离融合培养体系,为马铃薯野生种及与栽培种之间的体细胞杂交奠定基础。
1 材料与方法
1.1 融合亲本原生质体的分离纯化与活力检测
选用青海省农林科学院青藏高原生物技术教育部重点实验室保存的马铃薯野生种Solanum pinnatisectmum和下寨65无菌苗,通过单节切段扩繁于不含任何激素的MS培养基中继代培养;取培养21 d左右的试管苗上部充分展开的3~4张叶片,于超净工作台中切成3 cm左右宽的细长条带放入10 mL酶解液中。酶解液成分:纤维素酶(OnozukaR-10)、果胶酶(Y-23)、离析酶(OnozukaR-10)、3 mmol/L MES[2-(N -吗啉)乙磺酸]、2%PVP(聚乙烯吡咯烷酮)、0.2%BSA、0.35 mol/L甘露醇。将含有叶片的酶解液置于25℃、40 r/min的恒温摇床中黑暗解离12~14 h(本研究所用培养基均参照周宇波等的基础配方[6],不再列出)。
酶解液用100目的尼龙膜过滤到10 mL离心管中,于600 r/min离心5 min,弃上清液,缓慢加入2 mL MR(含有63.75% 甘露醇)混合均匀后,缓缓加入到有7 mL高浓度蔗糖溶液(含有23%的蔗糖)的10 mL离心管中,600 r/min离心6 min。用微量移液器将液体中环状原生质体吸出,用MPS再次将其悬浮,600 r/min离心5 min,重复2次,得到的沉淀物即为纯化的原生质体。调整S.pinnatisectmum原生质体的终密度为2×105个/mL左右,用于原生质体融合。
原生质体活力检测:采用荧光素双醋酸酷(FDA)法检测原生质体活力,FDA先用丙酮制备成0.5%的贮备液,0℃保存。活力检测时,取0.5 mL纯化好的原生质体,加入10μL FDA使FDA终浓度为0.01%,混匀后置于室温下5 min。在荧光显微镜下观察,激发滤光片为QB24,压制滤光片为JBS。由于叶绿素的存在,有活力的叶肉原生质体发黄绿色荧光。每个数据为10个视野的平均数,原生质体活力计算为发黄绿荧光的原生质体数占原生质体总数的百分率。
1.2 原生质体的融合方法研究
1.2.1 化学融合方法 融合诱导液(FA)的组成为8 mmol/L CaCl2+0.7 mmol/L KH2PO4+25% 聚乙二醇(PEG),pH 值为5.8,过滤灭菌,4℃下保存备用,聚乙二醇为PEG-6000。融合固定液(FB)为80 mmol/L CaCl2,溶液pH值为10,高温灭菌。
融合方法:将纯化好的双亲原生质体悬浮液(密度约为2×106个/mL)按1∶1比例混合,用滴管将原生质体悬浮液均匀地滴于一无菌的培养皿底部,静置3 min,在悬浮液顶部加入1滴融合诱导液EA,室温下静置15 min,然后在其顶部加入1滴融合固定液FB,再静置10 min,用MPS培养基漂洗2次,调整密度培养。
1.2.2 电融合方法 电融合仪为Eppendorf的Multiporator 4308型融合仪,融合室为250μL螺旋型铂金电极,间距0.2 mm。
电融合液的组成:0.35 mol/甘露醇 +0.2 mmol/L CaCl2,pH值为5.8,高温灭菌。
将双亲的原生质体按1∶1比例混合,用加样枪吸取245μL细胞悬浮液小心地加入到融合池底部,操作过程中避免打湿融合池的边缘及内侧,以免产生气泡而影响融合效率。将铂金电极小心地插入融合池中,缓慢旋紧,然后连接到共轴连接头上,进行融合。基本融合参数为交变电压80 V/cm,成串时间10 s,直流脉冲1 000 V/cm,作用时间60μs,脉冲1次。
1.3 增殖培养基激素水平的筛选研究
1.3.1 材料 以S.pinnatisectmum和下寨65融合再生的愈伤组织为试验材料。
1.3.2 方法 将约0.1 mm的增大的细胞团从MPScul培养基中转入增殖培养基中,增殖培养基在0.4 mg/L细胞分裂素(6-BA)条件下,设置了3个NAA浓度处理(表1)。

表1 愈伤增殖培养基中NAA浓度试验设计
1.4 芽分化培养基中的激素浓度搭配试验
1.4.1 材料 以S.pinnatisectmum和下寨65融合再生的愈伤增殖组织为试验材料。
1.4.2 方法 研究前人关于马铃薯愈伤组织芽分化过程中激素使用浓度基础上,选取直径大于3 mm的愈伤组织为试验材料,设置了4种分化培养基(表2),4个月时统计愈伤组织的最初芽分化时间和分化率(最初芽分化时间指愈伤组织接种到分化培养基上的时间到初次芽分化的天数,分化率为每皿能够分化的愈伤数占接种总愈伤数的百分率)。
2 结果与分析
2.1 原生质融合方法研究
通过化学融合和电融合2种融合方式的比较,结果表明,2种融合方式的细胞融合率没有显著差异,在前期优化融合条件和融合参数的条件下,其最高融合率均在40%以上,但是融合后的原生质体培养反应存在显著差异(表3)。电融合的细胞培养反应迅速,培养后24 h细胞开始膨大,而PEG融合的细胞需要48~72 h才开始膨大,培养至第10天时统计细胞的植板率,电融合细胞的植板率为33.6%,显著高于化学融合方式的20.8%。方差分析结果表明,在愈伤组织分化成苗能力上,电融合的细胞也显著强于化学融合。但是两者的愈伤组织挑出后转移至分化培养基上均生长正常,表现在初次分化成苗的时间和杂种植株比例上并没有显著差异。由此可见,PEG对细胞的生长存在一定的抑制作用,集中表现在原生质体培养前期。
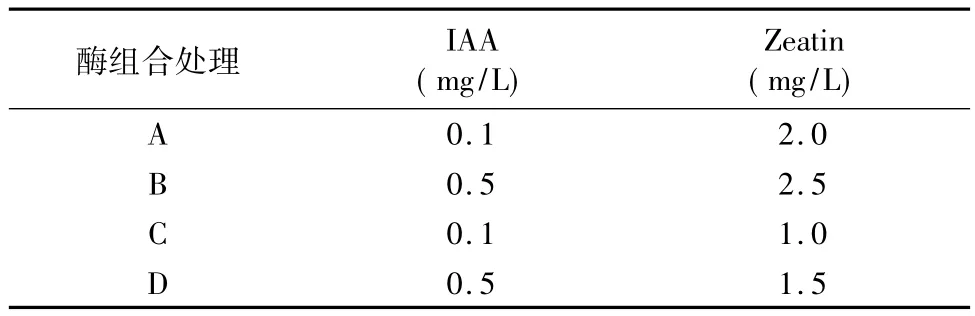
表2 芽分化培养基中的激素浓度搭配试验
将含有融合细胞的混悬液滴于3 mm无菌培养皿(培养皿中含有2 mL MPScul培养基,每皿3~4滴)进行黑暗培养,此阶段培养时间约为3周。随着细胞的继续分裂,可见米白色的“小点”,经过14 d培养,一部分细胞团能长成直径约1 mm的小愈伤。此时,可以陆陆续续将小愈伤组织挑至愈伤增殖培养基上。
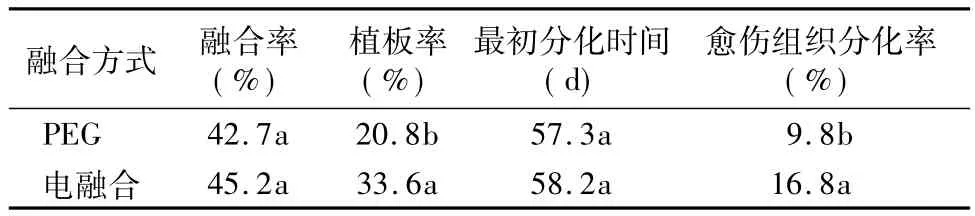
表3 不同的融合方式对原生质体融合及培养效果的影响
2.2 增殖培养基激素水平的筛选研究
愈伤组织接种到不同分化培养基上以后,愈伤组织形态特征表现出差异,只有在B处理(NAA浓度为1 mg/L)上,愈伤组织生长旺盛,进一步增大,颜色由浅绿色逐渐变为鲜绿,而在其他处理的分化培养基上,愈伤组织均生长缓慢,并出现了不同程度的黄化现象(表4)。

表4 愈伤增殖培养基中NAA浓度对愈伤组织生长的影响
2.3 芽分化培养基中的激素浓度搭配试验
在本试验条件下,愈伤组织的生长速度适中,愈伤组织的状态适宜进一步分化培养要求,以NAA的浓度为1.0 mg/L配合0.4 mg/L 6-BA,具体结果见表5所示。结果表明,虽然4种激素浓度搭配处理都可以诱导马铃薯愈伤组织分化,但不同处理间的分化时间和分化频率差异显著。对于愈伤组织而言,以 B 处理(0.5 mg/L IAA+2.5 mg/L Zeatin)的诱导分化效果最好,愈伤组织在分化培养基上生长约60 d时开始分化形成小芽,平均的分化频率达16.7%,显著好于其他分化处理。
培养过程中还发现,在愈伤组织快速增殖阶段,马铃薯的愈伤组织培养区别于其他作物,不需要作渗透压的降压处理,改变渗透压反而对愈伤组织生长不利。
在愈伤中分化出3 mm芽时将芽切下,移入普通的MS培养基中进生根培养成完整植株,亲本融合率及倍性分析由流式细胞仪(Guava EasyCyte 10)进行检测,形成的六倍体有双亲的染色体组杂种,占总杂种的30%。整个原生质体分离纯化及融合培养过程见图1。
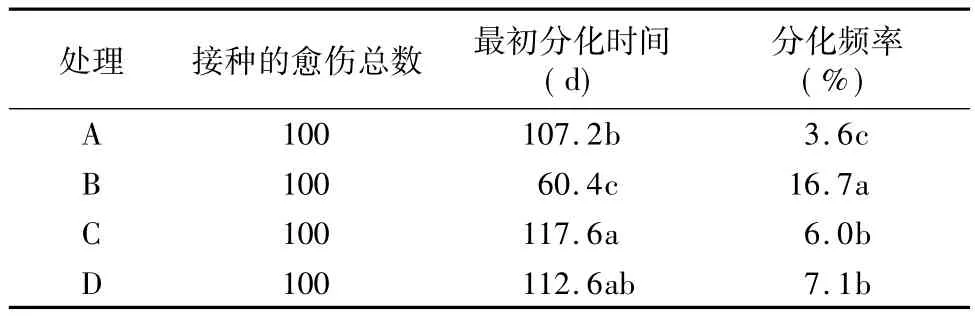
表5 愈伤增殖培养基中不同激素配比对芽分化的影响

3 结论与讨论
细胞融合对于有杂交障碍亲本是一个非常有用的育种手段,要有目的地选择亲本材料,应该多选择近缘种进行原生质体融合。但不同基因型之间的融合细胞对培养反应有较大差异,本试验是众多亲本组合中筛选出来的容易培养的组合,其细胞启动分裂较快,培养25~30 d时可形成直径达1 mm的小愈伤组织,继而可以形成数量庞大的愈伤组织。能够分化的愈伤组织初次分化时间相差不大,约为60 d左右,但表现出较长的持续分化时间,往往需要4个月的时间,因此,在分化培养基上要定期更换新鲜培养基以保证愈伤组织生长对营养的需求。愈伤组织增殖阶段对光照强度异常敏感,置于光照条件下,愈伤组织生长缓慢,结构变得异常致密,少量愈伤出现褐化现象。本研究中,不确定这是2个亲本的最佳融合培养体系,但确定是有效的体系。在今后的原生质体融合研究中,将根据育种目标,进行更多的亲本组合研究,进一步改良融合培养体系,更有效将此技术用于马铃薯的育种工作当中。
