结直肠癌术后辅助卡培他滨为基础化疗方案的临床疗效及相关药物基因组学分析*
2018-10-16刘世举张慧俭王金榜杨会举张新春刘翔刘佃温
刘世举 张慧俭 王金榜 杨会举 张新春 刘翔 刘佃温
结直肠癌(colorectal cancer,CRC)是全球发病率排名第3位的恶性肿瘤[1],目前在中国每年新发病例约为37.5万,死亡为19.1万例[2-3]。基于对“IDEA”研究的认可,2018年第1版美国国立综合癌症网络(NCCN)指南推荐对于低危Ⅲ期结直肠癌推荐3个月的卡培他滨联合奥沙利铂的辅助化疗方案[4]。因此,CRC术后辅助化疗仍是以卡培他滨为基础的化疗方案[5]。卡培他滨需要经过3步酶联反应转化为5-FU,其中最重要的为被胞苷脱氨酶(cytidine deaminase,CDD)和胸苷磷酸化酶(thymidine phosphorylase,TYMP)代谢成5-FU而发挥细胞毒作用。5-FU的主要作用靶标为胸苷酸合成酶(thymidylate synthase,TS),被二氢嘧啶脱氢酶(dihydropyrimidine dehydroge⁃nase,DPD)灭活[6]。因此,在卡培他滨代谢为5-FU过程中,CDD具有重要作用。
CDD基因位于染色体1p36.12,包含4个外显子。该基因的表达在体内普遍存在,主要表达于肝脏,既往研究结果表明肿瘤细胞内较高的CDD表达水平和对卡培他滨的敏感性呈显著正相关[7]。CDD基因-451C>A位点在既往研究中发现可以影响CDD基因的活性[8]。近期在188例接受贝伐珠单抗联合紫杉醇卡培他滨治疗的晚期乳腺癌患者中发现,CDD基因-451C>A位点的GA/AA基因型患者的客观缓解率达到66.7%,显著高于野生型的患者[9]。然而,目前在CRC辅助化疗领域,尚缺乏CDD基因-451C>A位点和预后的关联性研究。
因此,本研究旨在评估CDD基因-451C>A位点与接受卡培他滨为基础辅助化疗方案的CRC患者预后相关性,并探讨该位点对外周血单核细胞中CDD基因mRNA表达的影响。
1 材料与方法
1.1 病例资料
本研究回顾性分析2010年1月至2017年6月河南中医药大学第三附属医院收治术后接受辅助化疗的CRC患者215例。入组标准:1)年龄≥18岁,ECOG评分为0~2分,心功能正常(左心室射血分数>50%),肾功能正常(肌酐≤1.5×ULN),骨髓功能正常(中性粒细胞计数≥1.5×109/L,血小板计数≥100×109/L,血红蛋白≥9 g/dL);2)预期寿命≥3个月。排除标准:家族性腺瘤性息肉病、其他遗传性CRC综合征及失访的患者。
辅助化疗的用法用量:术后3~4周,卡培他滨,1 000 mg/m2,2次/d,第1~14 d,每21 d为1个周期。奥沙利铂,80~130 mg/m2,静脉滴注,第1 d。辅助化疗结合患者情况为6~8个周期。根据治疗过程中出现的血液学或非血液学毒性调整相应的给药剂量,如发生威胁生命的不良反应则中止治疗。本研究获得河南中医药大学第三附属医院伦理委员会的批准(批号:科研-2016-013),所有入组患者均签署知情同意书。
1.2 方法
1.2.1 血液样本收集及基因分型 治疗过程中收集患者的外周血样本4 mL,用苯酚氯仿法提取基因组DNA,之后于-20℃保存。设计包含-451C>A(rs532545)位点的上下游PCR引物,上游引物:5′-TCAAAGGTCC AAGCTCCAAG-3′;下游引物:5′-GGGCTAGGGCAAA GAGAAGT-3′,产物片段为208 bp,通过限制性片段长度多态性聚合酶链反应(PCR-RFLP)方法对该位点进行基因分型。分析设置阴性参照,>10%的样本至少分析1次确保样本未被污染,部分样本的分型结果通过直接测序方法进行验证。
1.2.2 外周血单核细胞提取及CDD基因mRNA表达分析 收集85例患者化疗前的外周血标本,采用淋巴细胞分离液Histopaque-1077(购自美国Sigma公司)对标本进行外周血单核细胞的提取。用Trizol试剂(购自大连宝生物工程有限公司)提取PBMC中的RNA。用real-time PCR法进行CDD mRNA表达实验,CDD基因的上游引物:5′-TGGCCCAGAAGCGT CCTG-3′;下游引物:5′-TCACTGGGTCTTCTGCAGG TCC-3′。实时定量PCR反应体系:SYBN Premix Ex Tag溶液10 μL,TYMP F primer(20 μM)0.2 μL,TYMP R primer(20 μM)0.2 μL,ddH2O 7.6 μL,cDNA2 μL,反应体系总计20 μL,GAPDH mRNA表达用作内参。CDD mRNA用相对定量法2-△△Ct进行计算。
1.2.3 随访 全部患者入组后开始随访,前期随访在患者就诊医院接受固定周期辅助化疗期间进行,此阶段可以明确获取每例患者复发的原因和日期。后期对总生存期(overall survival,OS)与患者后线接受的治疗情况进行电话随访,重点询问死亡状态和日期。本研究最后一次随访时间为2017年12月,所有患者从纳入研究到最后1次随访的中位随访时间为4.21(0.5~6.1)年。
1.3 统计学分析
本研究采用SPSS 19.0软件进行统计学分析。采用χ2检验分析多态性位点基因分型是否符合哈迪温伯格平衡。在基线临床资料中,离散型变量和-451C>A位点不同基因型的分布采用χ2检验,当数据较少时采用Fisher精确检验。连续型变量和-451C>A位点不同基因型的分析采用非参检验的Mann-Whitney U(两组间)或Kruskal-Wallis H(多组间)检验。采用Stata 14.0软件绘制Kaplan-Meier曲线比较不同基因型患者无病生存期(disease-free survival,DFS)和OS的差异,曲线间的差异采用对数秩检验进行比较。DFS定义为从手术开始到疾病复发或任何原因引起死亡的时间。OS定义为从手术开始到任何原因引起死亡的时间。不良反应的多变量分析采用二元的Logistic回归分析,生存分析的多变量分析通过Cox风险比例模型校正。采用向后LR的选择步骤来筛选和校正潜在的混杂变量。以P<0.05为差异具有统计学意义。
2 结果
2.1 215例患者基线临床资料及-451C>A位点基因分型情况
215例患者的基线临床资料见表1。入组患者中位年龄为52岁,ECOG评分为0分的患者139例(64.65%),结肠癌和直肠癌分别为129例和86例,肿瘤分化中等患者149例(69.30%)。在临床分期上,Ⅱ期患者57例,Ⅲ期158例。所有患者均接受术后辅助化疗,其中卡培他滨单药方案67例(31.16%),卡培他滨联合奥沙利铂方案148例(68.84%)。
-451C>A位点的基因分型结果为:野生GG型157例(73.02%),GA型53例(24.65%),AA型5例(2.33%),最小等位基因频率为0.15,3种基因型分布频率符合哈迪温伯格平衡(P=0.834)。
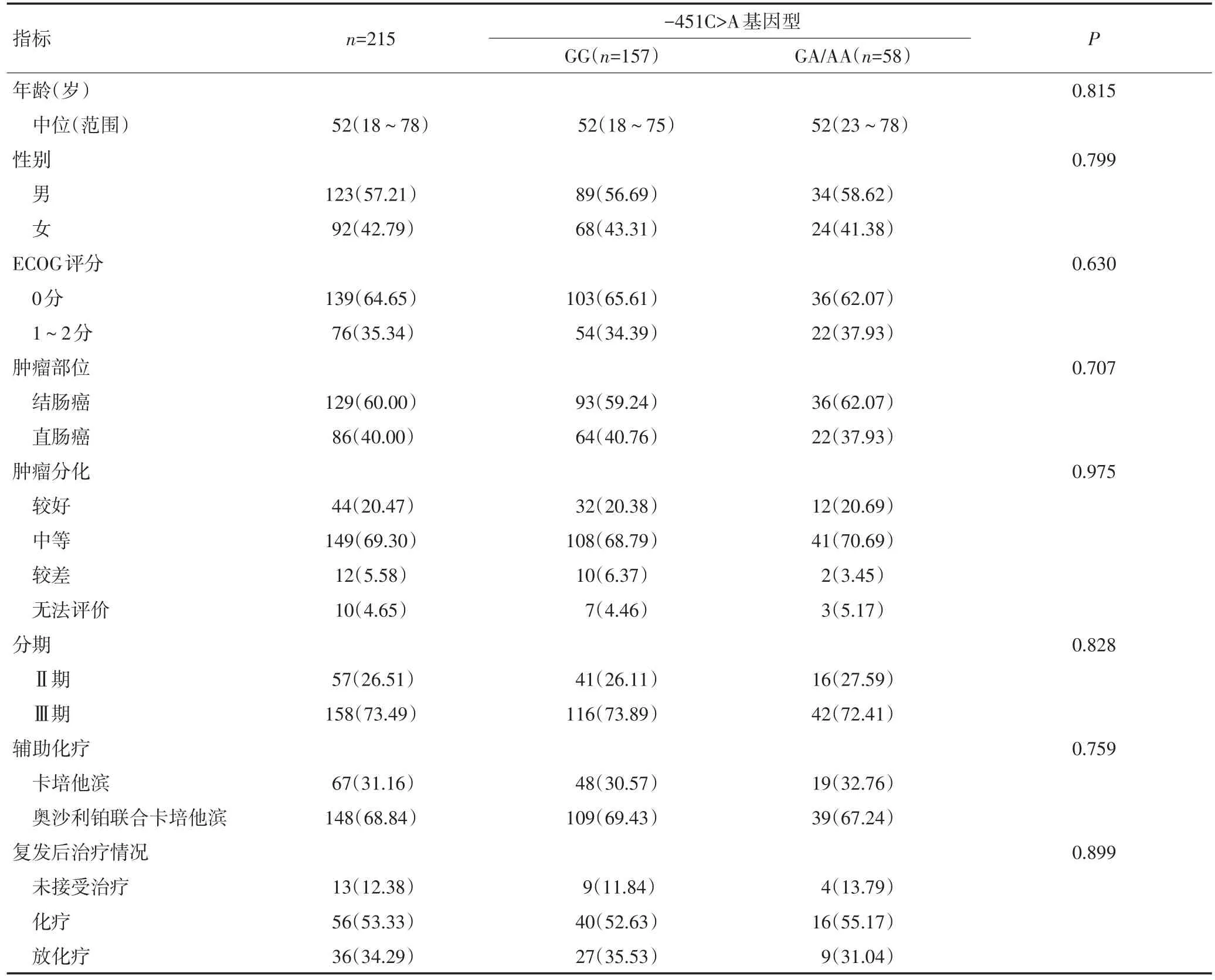
表1 215例CRC患者的基线临床资料及-451C>A位点基因型的基线临床资料对比 n(%)
2.2 CDD基因-451C>A位点和DFS及OS的关联
-451C>A位点突变纯合子AA型患者仅5例,故后期分析将GA和AA患者合并,共计58例。野生型GG型和突变的GA/AA基因型患者在基线临床资料上分布均衡(表1)。
对215例患者的总体数据分析发现,患者3年DFS为67.44%(95%CI:60.93%~73.49%),5年OS为58.60%(95%CI:51.21%~68.82%)。
-451C>A位点不同基因型患者的3年DFS呈显著性差异。携带A等位基因的GA/AA基因型患者和野生型GG型患者的3年DFS分别为81.03%和62.42%,差异具有统计学意义(P=0.002,图1)。另外,本研究构建Cox风险比例模型,将可能影响DFS的风险因素如年龄、性别、ECOG评分(1~2分归为一组)、肿瘤分期及-451C>A位点不同基因型纳入该模型。经过多变量校正,-451C>A位点对DFS独立的影响意义依然存在,差异具有统计学意义(OR=0.55,P=0.011)。在Cox模型中差异具有统计学意义的变量还有 ECOG 评分(OR=1.88,P=0.009)和肿瘤分期(OR=2.95,P<0.001)(表2)。
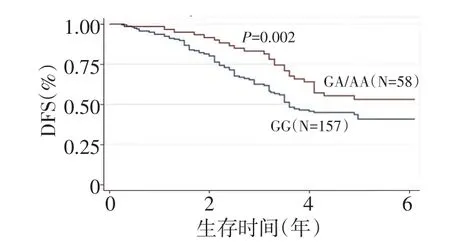
图1 215例CRC患者中CDD基因-451C>A位点不同基因型患者的DFS曲线
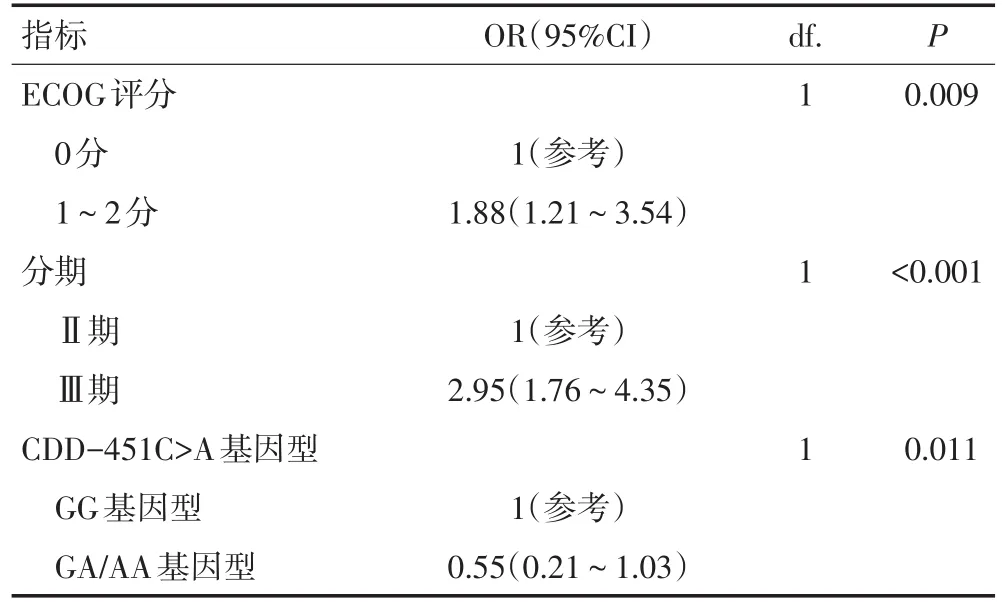
表2 影响DFS的基线临床资料以及多态性位点的多变量Cox回归分析
在针对OS的单因素变量分析中,两组基因型患者OS呈显著性差异,GA/AA基因型患者和GG基因型患者的5年OS率分别为72.41%和53.50%,差异具有统计学意义(P=0.016,图2)。
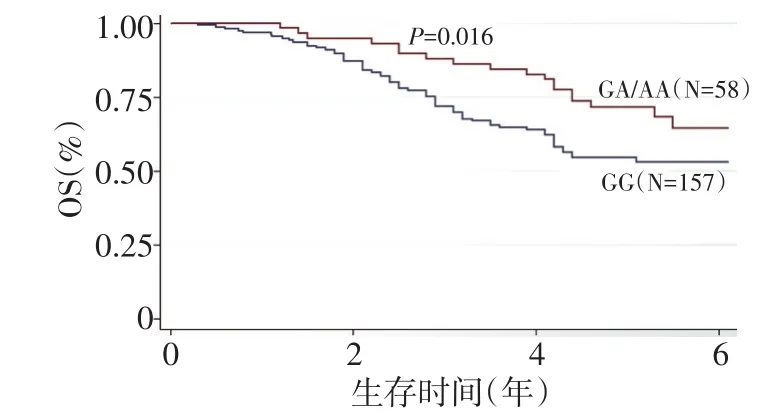
图2 215例CRC患者中CDD基因-451C>A位点不同基因型患者的OS曲线
本研究对手足综合征(hand foot syndrome,HFS)的发生情况进行分析,结果表明215例患者中出现2级及以上HFS患者为67例(31.16%)。GA/AA基因型患者中2级及以上HFS的发生率为44.83%,GG基因型患者中发生率为26.11%。GA/AA基因型患者中HFS的发生率显著高于GG型患者,差异具有统计学意义(P=0.009)。
2.3 -451C>A位点对CDD基因mRNA表达的影响
本研究纳入85例从患者的外周血单核细胞标本,通过提取的RNA对CDD的mRNA表达情况进行分析,并和-451C>A位点的基因型进行相关性分析。在85例PBMC标本中,GG型62例,GA型21例,AA型2例,3种基因型分布频率符合哈迪温伯格平衡(P=0.889)。AA型患者相对较少,将AA型和GA型患者合并,共计23例。携带A等位基因的GA/AA型患者相对于GG型患者,CDD mRNA表达水平明显较高(3.02±0.16vs.2.33±0.32),差异具有统计学意义(P<0.001,图3)。
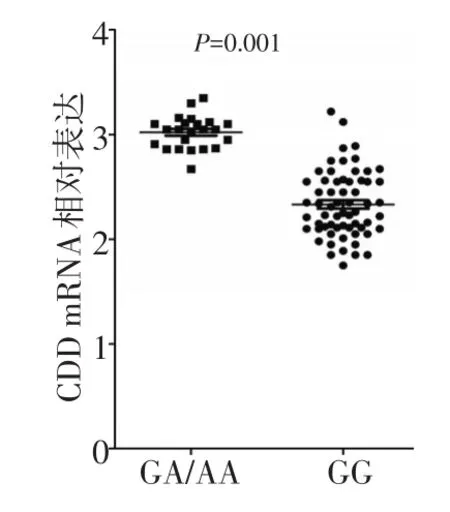
图3 CDD基因-451C>A位点不同基因型患者的相对CDD mRNA表达
3 讨论
本研究发现-451C>A位点野生型GG基因型患者相较于携带A等位基因的GA和AA基因型患者具有显著较差的DFS和OS,并发现不同基因型患者的CDD基因mRNA表达水平呈较大的差异。-451C>A位点可能通过影响CDD基因的表达使CRC患者从卡培他滨为基础的辅助化疗中获益。
本研究215例患者3年DFS率为67.44%(95%CI:60.93%~73.49%),5年OS率为58.60%(95%CI:51.21%~68.82%),低于NO.16968研究的3年DFS为70.9%和 5年 OS为 77.6%[10],可能因为本研究中ECOG评分为0分的患者比例低于NO.16968研究(64.65%vs.77.00%)。可能因为回顾性分析相对于设计严谨、给药方案规范的Ⅲ期临床研究的疗效较低,本研究结果与张德志等[11]的研究结果相符。
另外,本研究中57例Ⅱ期结直肠癌患者是否能从卡培他滨为基础的化疗方案治疗中获益,目前尚存争议,在Ⅱ期具有MSI-H/d-MMR的患者中未能从氟尿嘧啶为基础的辅助化疗当中获益,这部分患者可能在Ⅱ期患者中的分布频率只有不到20%[12]。
本研究结果表明,部分中国CRC患者接受卡培他滨为基础的辅助化疗方案时,CDD基因-451C>A位点的A等位基因携带者可通过影响该基因的表达,使得该基因型患者对卡培他滨更为敏感,进而从卡培他滨的辅助化疗中获益。本研究结果与Lam等[9]的研究结果相符,该研究纳入188例接受紫杉醇、卡培他滨联合贝伐珠单抗治疗的晚期乳腺癌患者,通过对CDD基因-451C>A等位点进行基因分型并和疗效进行关联分析,发现了该位点GA/AA基因型患者具有显著较高的客观缓解率和显著较长的中位无进展生存期。但是该研究并未进一步分析该位点和CDD基因表达及活性的关联。另外,Caronia等[13]的一项研究纳入130例接受卡培他滨治疗的CRC和乳腺癌患者,结果表明在高加索人群中-451C>A位点的等位基因频率达到0.30,而本研究中该位点仅为0.14,说明该位点具有较大的种族差异。该研究表明,-451C>A位点的A等位基因携带者具有显著较高的3级HFS发生率,与本研究结果一致。既往的研究结果提示,出现3级HFS的患者具有较好的预后[14]。然而,在表达分析中并未发现该位点和CDD基因mRNA表达的相关性,与本研究结果不一致,可能是因为该位点存在较大的种族差异。本研究基因表达的结果也可以部分解释CDD基因-451C>A多态性位点具有较好预后的原因:GA/AA基因型的个体通过引起CDD mRNA的高表达从而在卡培他滨代谢过程中更多地代谢为5-FU,进而使患者从卡培他滨的术后辅助化疗中获益。
综上所述,本研究结果表明在部分中国CRC人群中CDD基因-451C>A位点是一个独立的DFS影响因素。本研究也存在部分局限性,首先,纳入研究的样本量较小。其次,作为回顾性分析,无法避免偏倚。然而,本研究对-451C>A位点的预后影响进行了较为充分的评估,也从CDD基因mRNA表达层面揭示了该位点造成预后差异的可能因素,对结直肠癌术后辅助卡培他滨为基础化疗方案的患者预后评估具有一定的参考价值。亟需大样本前瞻性临床研究进一步验证。
