酵母双杂交技术筛选人95D细胞中肺癌转移相关蛋白1相互作用蛋白及其验证
2018-09-22李彦芹梁丽玲
李彦芹,刘 扬,梁丽玲,许 阳
在我国乃至全球,肺癌都具有高发病率和高死亡率的特点,研究与肺癌相关的基因对肺癌的诊断及治疗有重要意义。肺癌转移相关蛋白1(lung cancer metastasisrelated protein 1,LCMR1)基因是从人肺巨细胞癌细胞系中分离的与肺癌转移明显相关的基因[1],GenBank 数据库注册号 (Gene ID:AY148462)。该基因全长949 bp,分子量约19 kD,编码177个氨基酸,在人体多种组织中广泛分布。前期研究发现,LCMR1基因的表达水平可以影响肺癌细胞的凋亡[2],并且对癌症的侵袭性起关键作用[3]。肺癌的发生发展在体内存在复杂的信号网络,本研究通过酵母双杂交技术及免疫共沉淀、GST pull-down筛选及验证LCMR1基因与其相互作用的蛋白,为肺癌的研究机制提供科学依据。
1 材料与方法
1.1 主要试剂与材料 诱饵质粒pGBKT7-LCMR1、pGEX-5T质粒、pGEX-5T-LCMR1质粒、pCMV-Myc质粒及pcDNA3.0-flag质粒由本实验室前期构建并保存。pGBKT7 Cloning Vector、阳性对照载体pCL1、酵母菌株AH109、Matchmarker试剂盒购自美国Clontech公司,感受态大肠杆菌DH5α购自北京天根生物公司。人胚肾293细胞、A549细胞、95D细胞、大肠杆菌BL21由我室保存。质粒提取纯化试剂盒购自美国QIAGEN公司,GST Bind Resin购自美国Novagen公司,TNT T7 Quick体外翻译转录试剂盒购自美国Promega公司。Flag标签抗体购自Sigma公司,Myc标签抗体购自Abcam公司,β-acting抗体购自SantaCruz公司。
1.2 诱饵质粒转化入AH109 复苏转化有pGBKT7-LCMR1的冻存菌液于LB培养液中,37 ℃、200 r/min过夜振荡培养,增菌后提取质粒pGBKT7-LCMR1。按照Clontech说明书将pGBKT7-LCMR1转化入AH109中,AH109/pGBKT7作为空载体对照,转化后的各组菌液取100 μl 接种至SD/- Trp平板,30 ℃倒置培养,观察克隆生长情况。未转化质粒的AH109作为阴性对照,接种至YPDA培养液中,30 ℃ 250 r/min振荡培养18~20 h。从SD/-Trp平板上挑取1个转化了诱饵载体的AH109菌落,加入YPDA培养液中30 ℃ 250 r/min振荡培养,提取酵母蛋白,Western blot 验证BD-LCMR1 融合蛋白的表达。
1.3 95D细胞cDNA文库的构建与筛选 复苏肺癌95D细胞,按照TRIZOL说明书提取95D细胞总RNA,1%甲醛变性凝胶电泳验证RNA完整性,合成cDNA第一链后,应用长距离PCR扩增ds cDNA,将ds cDNA、pGADT7-Rec、pGBKT7 -LCMR1共转化酵母菌AH109,涂布于150 mm SD/-Ade/-His/-Leu/-Trp四缺板,以共转pGBKT7-Lam及pGADT7-RecT为阴性对照,以共转pGBKT7-53、pGADT7 - RecT为阳性对照,30 ℃培养3~8 d。
1.4 排除假阳性克隆 选择SD/-Ade/-His/-Leu/-Trp培养板上的生长良好的白色克隆重复划线2~3轮,再将克隆涂布于SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板培养,观察菌落生长及显色情况,排除假阳性克隆。提取候选克隆酵母质粒,转化大肠杆菌DH-5α,涂布于LB/Amp+(60 μg/ml)平板,37 ℃倒置培养过夜,挑取单个克隆,接种于5ml LB/Amp+,提取文库质粒。将单个文库质粒与pGBKT7- LCMR1诱饵质粒共转入酵母菌AH109。将菌液涂于SD/-Ade/-His/-Leu/-Trp和SD/ -Ade / -His/-Leu/-Trp/X-α-Gal,回复验证候选文库质粒与诱饵蛋白的相互作用。提取阳性克隆测序。
1.5 免疫共沉淀法细胞内验证蛋白相互作用 TRIzol法提取293细胞RNA,合成cDNA第一链,设计含特殊酶切位点的基因引物,引物序列如下。RPL29上游:ggaggatccatggccaagtccaagaacc;下游:ggcctcgagctactctgaagcctttgtag。GNG5上游:ggggatccaccatgtctggctcctcc;下游ggcctcgagaggagtggtttgggaaacc。LCMR1上游:atgtgtcgaccatgagggaactgccaggtag;下游:taatgcggccgcttagcgtaggctgctgctgc。按Promega内切酶说明书对RPL29的PCR产物、GNG5的PCR产物及pcDNA3.0-flag质粒进行BamH Ⅰ和Xho Ⅰ双酶切,对LCMR1的PCR产物及pCMV-Myc质粒进行Sal Ⅰ及Not Ⅰ双酶切,酶切产物经DNA连接酶4 ℃过夜,转化入感受态DH5α。提取重组质粒,对质粒进行回复酶切验证及测序验证。将带Myc标签的pCMV- Myc- LCMR1质粒及有Flag标签的pcDNA3.0- flag- RPL29质粒共转染293细胞,提取细胞蛋白,用Flag抗体进行免疫共沉淀反应,用Myc抗体进行Western blot分析,以单独转染pCMV- Myc- LCMR1质粒及单独转染pcDNA3.0- flag- RPL29质粒作为阴性对照。
1.6 GST pull down体外验证蛋白相互作用 将pGEX-5T质粒、pGEX-5T- LCMR1质粒转化DH-5α,挑取菌落增菌,加入终浓度为0.6 mM 的IPTG,20 ℃诱导4 h,超声破碎细菌蛋白,经GST琼脂糖珠纯化,12.5%SDS-PAGE 电泳,考马斯亮兰染色,检测GST蛋白及GST-LCMR1 融合蛋白诱导表达情况。利用TNT兔网织红细胞裂解液体系,根据TNT T7 Quick体外翻译转录试剂盒说明书在体外分别转录翻译RPL29蛋白及GNG5蛋白,用35S 标记蛋白全长。向预处理好的GST Bind Resin中加入GST 融合蛋白粗提液、体外翻译蛋白、10% BSA及裂解Buffer,共同孵育后,离心收集混合物通过12.5% SDS-PAGE电泳。凝胶经干胶仪60 ℃干胶60 min,置于暗盒,-80 ℃曝光。
2 结 果
2.1 诱饵质粒转化AH109 以pGBKT7-LCMR1质粒DNA为模板,经PCR反应并电泳,获得600 bp单一特异产物(图1)。诱饵质粒无自激活作用,对宿主无毒性(结果略)。pGBKT7-LCMR1质粒转化入酵母菌AH109后,涂于SD/-Trp平板,30 ℃倒置培养4 d,出现2~3 mm白色菌落,质粒成功转化酵母菌。提取转化有pGBKT7-LCMR1的酵母菌总蛋白,经12%SDS-PAGE电泳,Western blot结果显示,所检测蛋白分子量约40 kD,条带单一,表明BD-LCMR1融合蛋白表达正确。
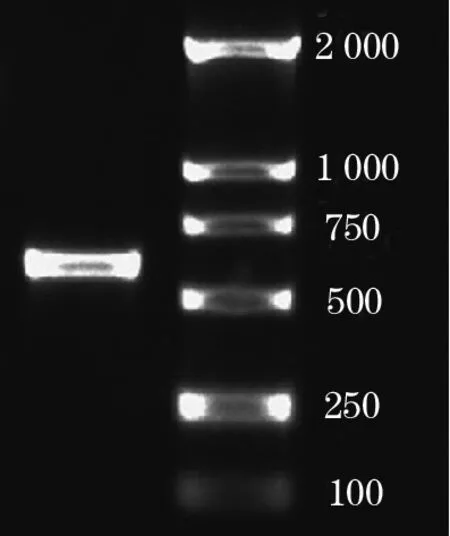
图1 LCMR1编码区PCR产物琼脂糖电泳
2.2 95D细胞cDNA文库的构建与筛选 肺癌95D细胞总RNA完整性经1%甲醛变性凝胶电泳检测,出现3条带,分别是28S、18S和5S,且28S亮度是18S的2倍,提示总RNA质量合格(图2)。以95D总RNA为模板长距离PCR产物经电泳结果显示出完整弥散状条带,大小在250~6000 bp,符合文库构建要求(图3)。将共转化菌液涂布于SD/-Ade/-His/-Leu/-Trp四缺平板,3~8 d后平板上有2~3 mm白色菌落长出,共获得20个候选克隆。
2.3 排除假阳性克隆 将20个候选克隆在SD/-Ade/-His/-Leu/-Trp培养板上划线培养2~3次,有16个克隆生长良好。将16个克隆在SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板培养,获得12个蓝色克隆。将上述12个文库质粒与诱饵质粒再次共转化酵母菌,经四缺平板及X-α-Gal筛选,最终获得6个阳性克隆。对6个阳性克隆质粒进行测序分析并BLAST比对,确定6种文库片段,分别是GNG5、核糖体蛋白L29(RPL29)、DEK、CCAR1、G3BP1及LGMN。
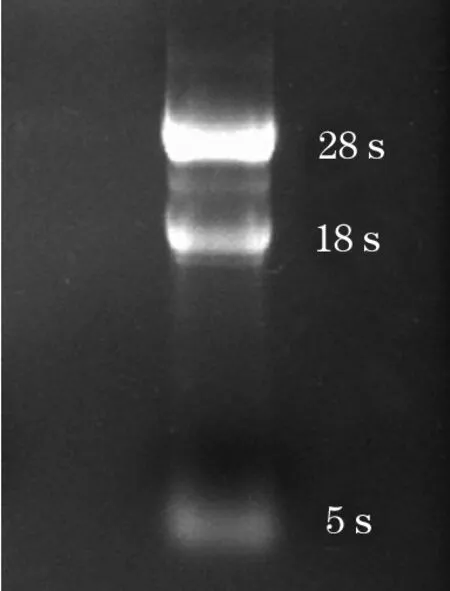
图2 总RNA 1%甲醛变性电泳
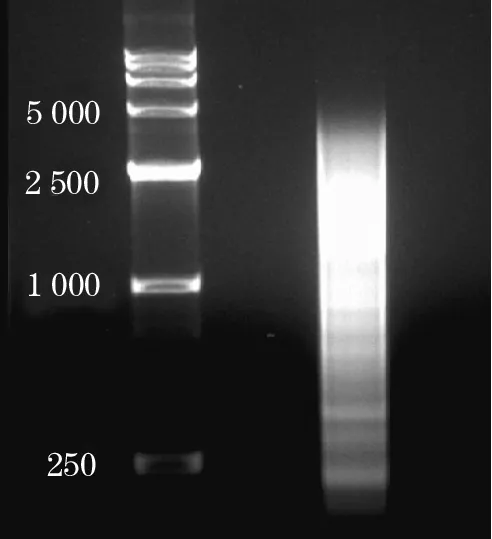
图3 琼脂糖凝胶电泳
2.4 免疫共沉淀法细胞内验证蛋白相互作用 通过对LCMR1及目的文库基因RPL29、GNG5设计含特殊酶切位点引物,PCR产物经琼脂糖电泳验证,扩增成功(图4)。对PCR产物及工具载体双酶切连接后,提取重组载体pcDNA3.0-flag -RPL29、pcDNA3.0 -flag-GNG5和pCMV-Myc-LCMR1,经双酶切回复验证及测序比对,证实重组质粒构建成功。免疫共沉淀实验结果显示,单独转染pCMV- Myc- LCMR1质粒或单独转染pcDNA3.0- flag- RPL29质粒蛋白上样孔,利用Flag抗体进行免疫共沉淀反应,用Myc抗体进行Western blot分析,没有检测到蛋白Myc-LCMR1的存在(阴性对照);在pCMV- Myc- LCMR1质粒和pcDNA3.0- flag- RPL29质粒共转染细胞蛋白,经Flag抗体免疫沉淀下来的蛋白混合物中,才可检测到Myc-LCMR1的存在(图5)。
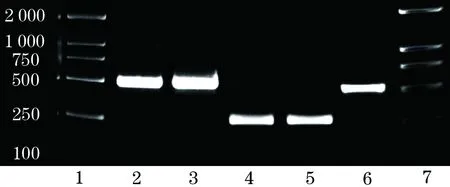
图4 琼脂糖电泳
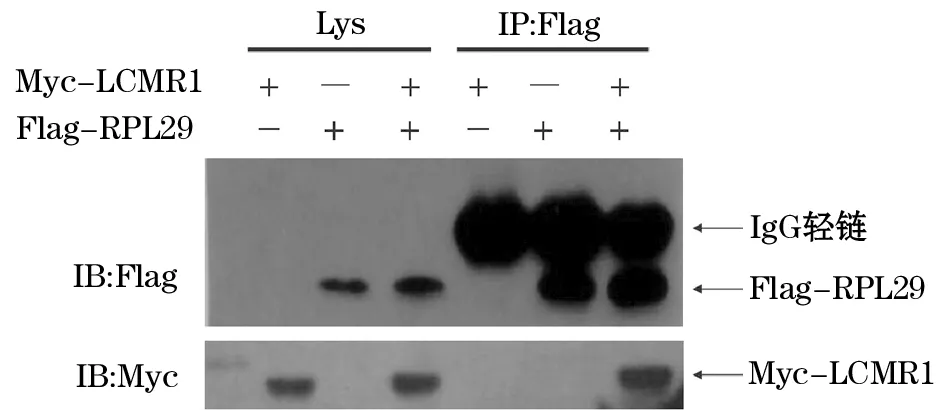
图5 免疫共沉淀方法验证LCMR1与RPL29
2.5 GST pull down体外验证蛋白相互作用 GST及GST-LCMR1经过IPTG诱导后,提取蛋白并纯化,经12.5%SDS-PAGE ,以GST蛋白为阴性对照,在分子量26 kD处出现单一特异条带,而GST-LCMR1融合蛋白在47 kD处有单一特异性蛋白条带,大小与GST-LCMR1融合蛋白理论分子量相符(图6),提示GST 蛋白及GST-LCMR1 融合蛋白纯化成功。
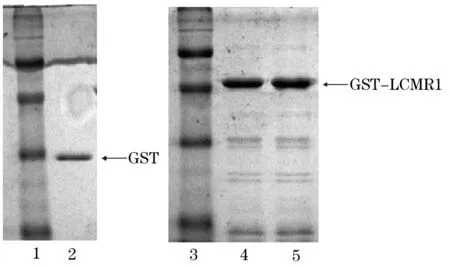
图6 GST琼脂糖珠纯化后的GST及GST-LCMR1融合蛋白
将纯化的融合蛋白GST-LCMR1与RPL29共同孵育,混合物经洗涤后经SDS-PAGE电泳,所得凝胶进行放射自显影实验。结果显示,在GST-LCMR1泳道出现与Input阳性对照组在同一位置出现单一特异条带,证明LCMR1蛋白与RPL29蛋白可以在体外发生特异性结合,两者有直接相互作用(图7)。不同的是,GST-LCMR1组没有检测到与Input阳性对照组相同的条带(图8),证实LCMR1与GNG5蛋白不能在体外发生相互作用。
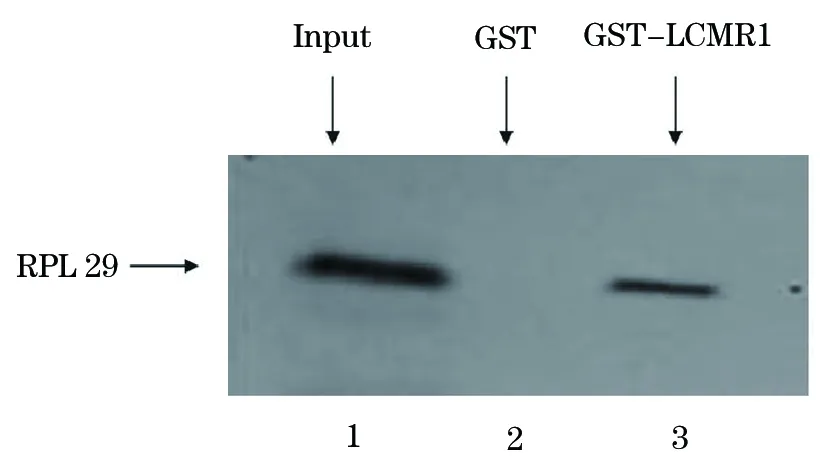
图7 GST pull down验证LCMR1与RPL29体外相互作用
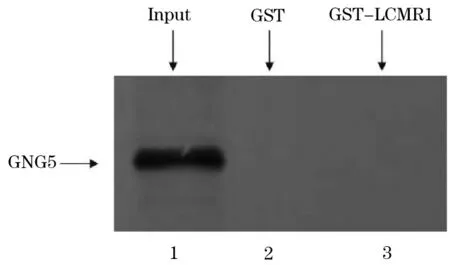
图8 GST pull down验证LCMR1与GNG5体外相互作用
3 讨 论
蛋白质必须通过与其他蛋白质发生相互作用才能实现其功能,这个过程贯穿于细胞的整个生理过程。酵母双杂交系统正是这样一种能高效筛选活细胞体内蛋白质相互作用的技术[4],能为蛋白质功能研究提供大量信息。经研究证实95D细胞系为非小细胞肺癌中具有高侵袭性和转移性的肺癌细胞系[5,6],因此,本研究应用该技术以LCMR1为诱饵蛋白,对肺巨细胞癌95D细胞cDNA文库进行筛选,最终获得了6个阳性克隆,分别是GNG5、核糖体蛋白L29(RPL29)、DEK、CCAR1、G3BP1及LGMN,该6种蛋白对研究非小细胞肺癌具有很重要的科学价值。
DEK为原癌基因,其编码蛋白由375个氨基酸残基组成,在多种肿瘤组织中高表达。据文献[7]报道,DEK蛋白与P53、NF-kB等蛋白发生相互作用,调节肿瘤细胞的凋亡、转移、血管生成等重要功能。CCAR1主要参与细胞生长与凋亡,与β-catenin、P53等共同调节肿瘤细胞生长与凋亡,并在多种组织中高表达[8]。LGMN又名legumain,该蛋白在多种实体瘤中高表达[9]。G3BP1能负向调节病毒的转录水平[10]。由此可见,本研究筛选出的与LCMR1相互作用的蛋白都参与了肿瘤形成的重要环节,我们推测LCMR1与相互蛋白一起,在癌症复杂的机制网络中发挥了重要作用。
由于酵母双杂交系统也存在假阴性的特点,RPL29蛋白和GNG5蛋白作为最感兴趣蛋白,本实验继而通过免疫共沉淀实验及GST-pull down技术重点验证了与LCMR1相互作用的RPL29蛋白和GNG5蛋白。GNG5蛋白是一种三聚膜相关蛋白,能与膜表面相关受体结合,参与能量代谢。经免疫共沉淀实验及GST-pull down技术证实,LCMR1与其相互作用为假阴性。
RPL29基因定位于染色体3p21.3-p21.2[11],该基因属于核糖体蛋白L29E家族,编码大60S亚基核糖体蛋白的部分蛋白,由159个氨基酸组成。该蛋白除表达于细胞质外,还以膜蛋白的形式表达于细胞表面。多项研究显示,RPL29积极参与血管生成[12],对肿瘤细胞血管营养再生有重要意义[13]。RPL29又名肝素结合蛋白 (heparin interacting protein,HIP),早期研究即发现该蛋白能与肝素特异性结合,增强肿瘤细胞的粘附和亲和能力[14]。肿瘤细胞核糖体蛋白异常表达的一个最显著特点就是持续增殖,而核糖体主要是参与蛋白合成,肿瘤的进展需要更高效的核糖体翻译机制,因此在结肠癌和甲状腺癌组织中观察到RPL29表达增加[15,16],而抑制RPL29的表达后能激活caspase-3及磷脂酰丝氨酸外翻,导致肿瘤细胞凋亡增加,并增强了肿瘤细胞的化疗敏感性[17]。HIP/RPL29可与细胞表面及细胞外基质中众多肝素/硫酸乙酰肝素蛋白聚糖(HSPGs)相作用[14],调节肿瘤细胞的生长、增殖和分化[18-21]。由此可见,HIP/RPL29在癌症的发生发展中发挥了很重要的作用。核糖体蛋白家族其他成员蛋白在肺癌中的作用已被阐明,在NSCLC患者组织中核糖体蛋白表达减少或磷酸化水平升高,提示预后不良[22-24],但有关HIP/RPL29与LCMR1相互作用在NSCLC中的研究仍鲜有报道。
既往成果显示,LCMR1蛋白表达与肺癌临床分期相关[1],该基因表达下调能抑制肿瘤细胞的转移能力[2]。结合本研究酵母双杂交技术及验证结果,LCMR1与HIP/RPL29在体内、体外存在真实相互作用,但目前两者在肺癌中的具体机制还不清楚。我们推测,LCMR1有可能通过调节HIP/RPL29磷酸化水平或共同作用于下游相关分子,对NSCLC发挥重要作用,这一推测还有待验证。因此,本研究在95D细胞中检测到多种LCMR1相互作用蛋白,并验证了LCMR1与RPL29蛋白有相互作用,与GNG5蛋白无相互作用,为进一步研究LCMR1蛋白在NSCLC中发挥的作用建立了科学的实验方法。
