奶牛源金黄色葡萄球菌临床分离株的耐药特性、生物膜及其相关基因分布研究
2018-08-16伍晔晖孟庆玲蔡扩军王登峰李重阳才学鹏
伍晔晖,孟庆玲,乔 军 *,蔡扩军,王登峰,孟 丹,马 帅,李重阳,才学鹏
(1. 石河子大学动物科技学院, 新疆 石河子 832003; 2. 乌鲁木齐市动物疾病控制与诊断中心,新疆 乌鲁木齐 830063;3. 新疆畜牧科学院兽医研究所,新疆 乌鲁木齐 830000;4. 中国农业科学院兰州兽医研究所,甘肃 兰州 730046)
【研究意义】奶牛乳房炎和子宫内膜炎是奶牛最常见和最高发的疾病之一,给奶牛养殖业造成了严重的经济损失。病原学调查发现,引起奶牛乳房炎和子宫内膜病原种类多样,其中金黄色葡萄球菌(Staphylococcusaureus,SA)是引起上述炎性疾病的主要病原菌之一[1]。【前人研究进展】目前,抗生素是治疗奶牛SA感染的主要手段[2]。然而,由于畜牧业生产中抗菌药物不合理的滥用现象,导致SA耐药菌株逐年增多,致使抗生素疗法的治愈率降低[3]。与此同时,由于抗生素在乳中的残留,致使鲜奶受到一定程度的耐药菌株和抗生素污染,导致牛奶的品质下降,并且耐药菌株和耐药基因可通过奶制品传播给人群,给人们的身体健康带来严重的威胁[4]。作为最重要的人兽共患食源性细菌之一,近年来随着抗菌药物的滥用SA耐药菌株不断增多,尤其是耐甲氧西林SA(Methicillin-resistantStaphylococcusaureus,MRSA)的大量出现,给奶牛乳房炎和子宫内膜炎的防治带来了更大的困难[5]。【本研究切入点】研究发现,SA生物膜的形成能力与SA菌株毒力和耐药性密切相关,许多MRSA流行株不仅具有多重耐药性,还具有形成生物膜的能力,致使细菌的毒力进一步增强[6-7]。黏附素具有使MRSA黏附到宿主靶细胞的作用,其黏附能力对MRSA的感染及生物膜的形成起着重要作用[8]。【拟解决的关键问题】新疆是我国重要的奶源地之一,牛奶产量位居西部地区前列。为了了解新疆地区MRSA流行株的耐药情况和生物膜的形成能力及其相关基因的分布情况,本实验对奶牛源MRSA新疆流行株的耐药表型和生物膜及其相关基因进行了检测研究,为MRSA分子流行病学调查和临床合理用药提供科学依据。
1 材料与方法
1.1 实验材料
Baird-Parker培养基、BHI液体培养基、胰蛋白胨大豆肉汤(TSB)均购自青岛高科园海博生物技术有限公司;大肠杆菌 (E.coli) DH5α菌种由本实验室保存;细菌基因组DNA提取试剂盒、pMD19-T载体、DNA Marker均购自TaKaRa公司;生化化鉴定管购自杭州滨和微生物试剂有限公司;抗菌药物纸片购自杭州微生物试剂有限公司;结晶紫购自天津市北联精细化学品开发有限公司;96孔微孔板购自上海市蔚宏生物科技有限公司。
1.2 奶牛乳样品的采集
在2015年1月至2017年5月期间,从新疆五家渠、石河子、沙湾、玛纳斯、阿克苏5个地区的规模化奶牛场分别采集临床型乳房炎牛乳及子宫内膜炎脓液样品386份,通过温水清洗乳房、肛门及外阴部,并使用75 %酒精棉球对其进行消毒处理,收集第3把奶后的奶样及子宫内容物分别放于灭菌的试剂管中,置于冰盒内,运送实验室进行分离培养。
1.3 SA分离鉴定
将采集的样品接种于Baird-Parker培养基,放于37 ℃恒温箱培养12~48 h。挑取具有典型特征的单菌落,在营养琼脂培养基上进行纯化培养。对纯化菌进行涂片、革兰氏染色、镜检,然后随机选取分离株用SA生化鉴定管测定其生化反应特性;根据GenBank中已公布的SA 16S rRNA的序列设计通用引物,对SA分离株进行16SrRNA序列比对分析。将分离鉴定的SA在BHI肉汤中37 ℃培养24 h,再将500 μl 所得新鲜菌液加入到500 μl 40 %甘油中震荡混合均匀制成20 %甘油菌,-20 ℃保存备用。
1.4 SA分离株药敏试验及MRSA鉴定
用无菌接种环挑取单个菌落,接种于BHI培养液于37 ℃培养20~24 h,再用灭菌生理盐水将细菌浓度调至0.5麦氏浊度,取200 μl菌液,均匀涂布于MHA培养基,涂布均匀后贴上15种药敏纸片,用镊子轻压纸片使其与培养基表面紧密接触。放入37 ℃恒温培养箱中培养48 h后测量抑菌圈直径。通过药敏试验,初步判定30 μg头孢西丁抑菌环直径≤21 mm的菌株为MRSA;采用PCR方法(检测MecA基因)进一步筛选和鉴定MRSA流行株,引物设计参照文献[9]。
1.5 MRSA和MSSA菌株基因组DNA的提取
抽取MRSA和MRSA流行株接种至无菌BHI培养液于37 ℃振荡过夜,取1.5 mL细菌培养液于无菌EP管内,12 000 r/min离心1 min,弃上清液,余下操作严格按细菌基因组DNA提取试剂盒说明书进行。DNA产物在1 %琼脂糖凝胶上电泳进行检测。
1.6 MRSA和MSSA生物膜的检测
采用改良微量孔板法检测SA不同分离株生物膜形成能力。用无菌接种环挑取单个菌落,接种于TSB培养基中,振荡过夜。将活化的菌液以1∶100的比例转接于TSB肉汤中继续培养,使其OD600mm达到0.2左右,分别吸取菌液200 μl加入到96孔微孔板中,每株分别移入8个平行孔中,静置于37 ℃恒温培养箱中培养24 h;然后用微量移液器吸去孔中的培养基,加入200 μl无菌蒸馏水洗涤微孔板重复3次,置于室温条件下干燥45 min,然后向每个孔中加入150 μl浓度为1 %的结晶紫溶液在室温条件下染色30 min,弃去染色液,再加入200 μl无菌蒸馏水洗涤微孔板4次,在空气中干燥30 min;再向每个孔中加入150 μl浓度为95 %的乙醇溶液脱色30 min,用酶标仪测定其OD570nm;将脱色后的微孔板直接放在倒置显微镜下观察生物膜的形态,拍照记录。
1.7 MRSA和MSSA生物膜形成相关基因的检测
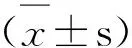
2 结果与分析
2.1 SA分离鉴定
从新疆5个地区采集到386份临床型乳房炎牛乳及子宫内膜炎脓液样品中共分离出164株SA。SA在Baird-Parker培养基上长出灰或黑色菌落,菌落周围有一浑浊带,挑取的单菌落经革兰氏染色镜检后可见像葡萄样串状紫色球菌(图1)。生化鉴定结果显示,SA能发酵蔗糖、乳糖、蕈糖、果糖、甘露糖、麦芽糖,缺氧环境中产酸不产气,尿素、精氨酸水解,乙酰葡糖胺、硝酸盐还原反应阳性,VP反应弱阳性,木糖、木醇、蜜二糖、山梨醇反应阴性。
2.2 16SrRNA序列比对分析
对分离株SA-xj45、SA-xj46、SA-xj47、SA-xj64、SA-xj65、SA-xj66、SA-xj75与SA标准株S.aureusECNU-UA1,大肠杆菌标准株E.coliATCC35469、E.coli51Sh,链球菌标准株S.Oligoferm-entansAS1.3089、S.australisChDCB189,绿脓杆菌标准株P.aeruginosaNAPCC-1、P.aeruginosaATCC 19660,肠炎沙门氏菌标准株S.entericaATCC9150、S.entericaLGS4进行16SrRNA序列比对分析,结果显示分离株与SAS.aureusECNU-UA1亲缘性最近,同源性达96 %,与大肠杆菌、链球菌、绿脓杆菌、肠炎沙门氏菌亲缘性相对较远(图2)。
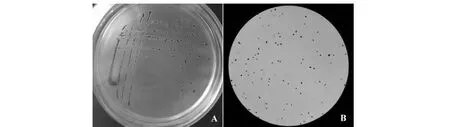
A:SA在Baird-Parker培养基的菌落形态;B:革兰氏染色镜检SA菌体图1 SA分离株菌落及镜检形态Fig.1 Colony morphology of SA in Baird-Parker and gram staining
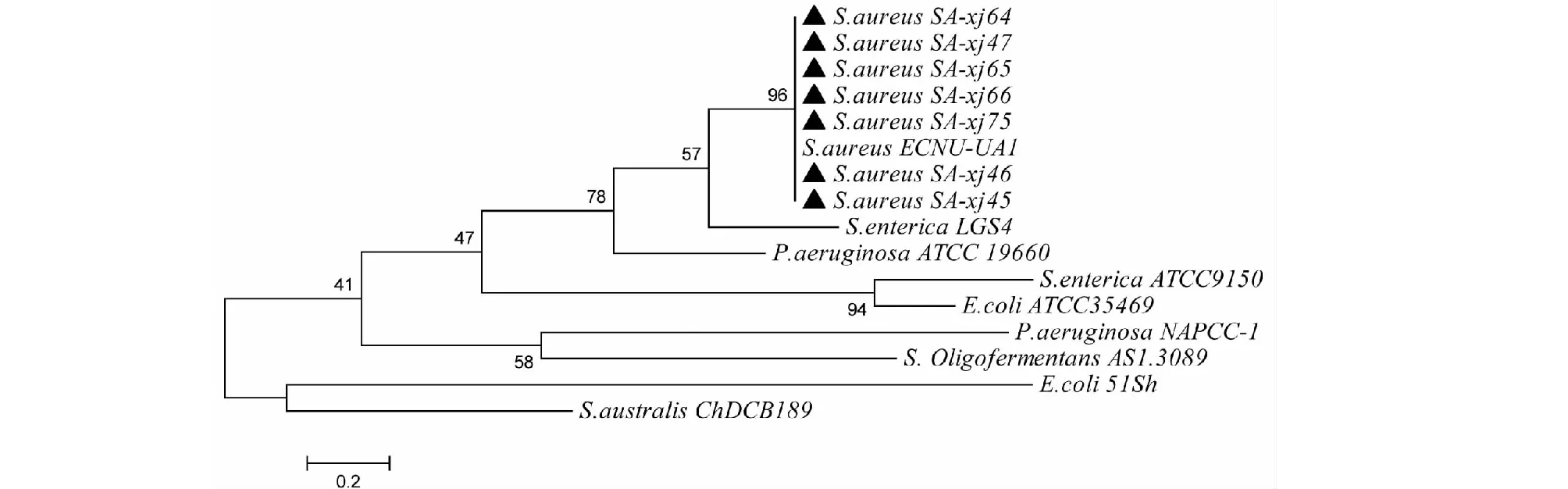
图2 16SrRNA序列比对结果Fig.2 Results of sequence alignment of 16SrRNA
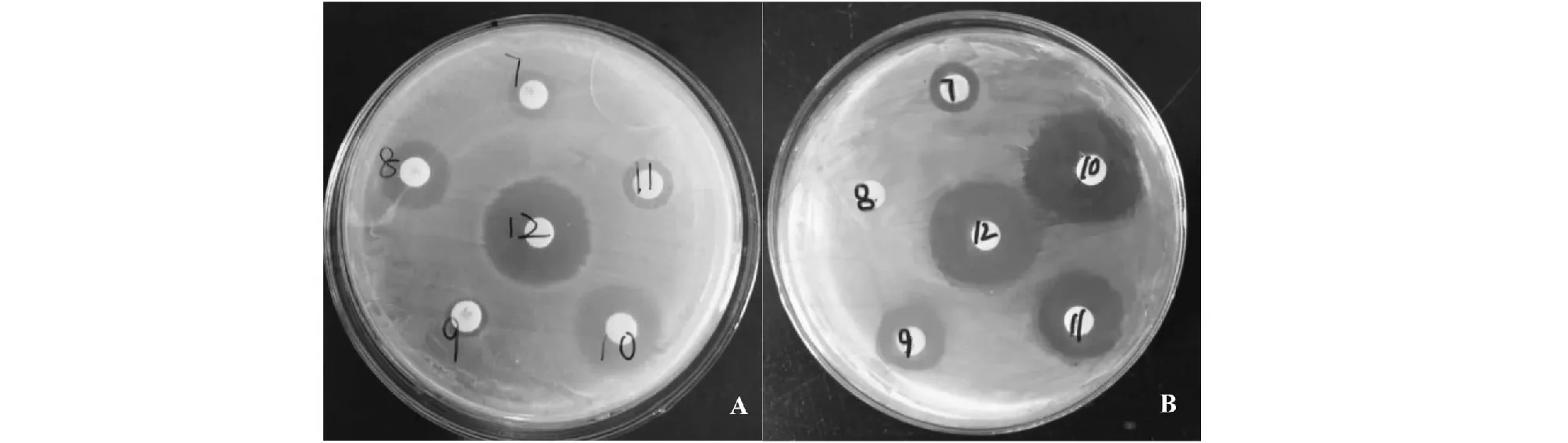
7.苯唑西林8.青霉素9.红霉素10.头孢西丁11.四环素12.利福平7.Oxacillin; 8.Penicillin; 9.Erythromycin; 10.Cefoxitin; 11.Tetracycline 12. Rifampicin图3 MRSA(A)和MSSA(B)药敏试验结果Fig.3 Assay of drug susceptibility of MRSA(A) and MSSA(B) isolates
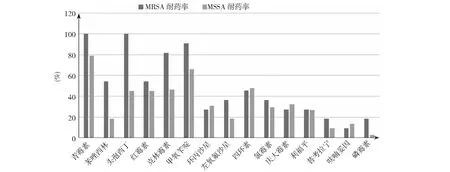
图4 MRSA与MSSA对抗菌药物的耐药率Fig.4 Drug resistance rates of MRSA and MSSA isolates
2.3 MRSA检出率及药敏试验
164株SA中检出22株MRSA,MRSA检出率为13.41 %,其余均为MSSA流行株。MRSA对抗菌药物的耐药表型明显多于MSSA(图3);MRSA对多种抗菌药物的耐药率也明显高于MSSA(图4)。
2.4 MRSA生物膜生成能力测定
通过酶标仪测定OD570nm,结果显示,在24 h时MRSA和MSSA生物膜生成能力差异显著(P<0.05),MRSA菌株的生物膜生成能力显著高于MSSA菌株(图5~6)。通过倒置显微镜观察在24 h时,MRSA和MSSA菌株都生成了典型的生物膜形态,MRSA菌株生物膜厚度显著高于MSSA菌株(图6)。
2.5 MRSA和MSSA生物膜形成相关基因的检测
生物膜形成相关基因检测结果显示,MRSA菌株clfA 、clfB、fnbA、fnbB、Fib、cna、FnBP基因检出率分别为100 %(n=22)、95.45 %(n=21)、40.91 %(n=9)、90.91 %(n=20)、86.36(n=19)、54.55
%(n=12)、54.55 %(n=12);除基因fnbA,其余检出率均高于MSSA菌株(图7~8)。
3 讨 论
大量耐药性菌株的出现已经成为SA性奶牛乳房炎防控的瓶颈[11]。药物敏感性监测不仅可以反映SA的耐药现状,同时也为此病的治疗提供用药依据。本研究中,在奶牛临床乳房炎样品中MRSA的检出率达13.41 %,所有MRSA菌株均耐青霉素和头孢西丁。与MSSA相比,MRSA菌株对红霉素、克林霉素、四环素、甲氧苄啶、左氧氟沙星的耐药率明显增高,同时还出现了对环丙沙星、氯霉素、庆大霉素的耐药菌株,且同一株菌出现耐多种抗生素的情况,提示SA流行株耐药性十分严峻。本研究结果显示,MRSA菌株对利福平的耐药率有所升高,可能由于自发性突变和在生产中经常使用氟喹诺酮类药物的共同作用[12]。MRSA菌株对呋喃妥因、替考拉宁、磷霉素的耐药率低于19 %,这可能与临床较少使用有关,可作为治疗SA感染引起的奶牛乳房炎和子宫内膜炎的优选药,特别适用于治疗MRSA和β-内酰胺类耐药株的严重感染。
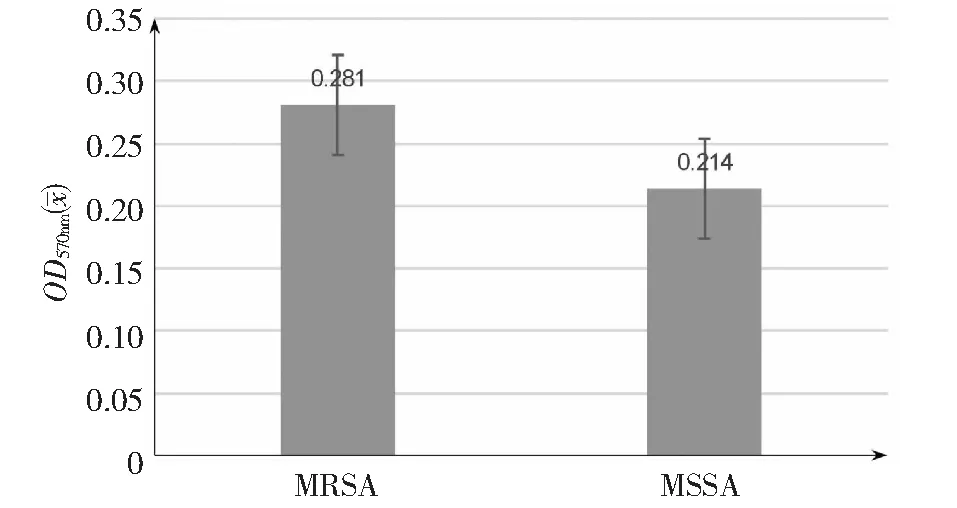
图5 MRSA与MSSA分离株生物膜检测结果(OD570nm)Fig.5 Biofilm determination of MRSA and MSSA isolates (OD570nm)
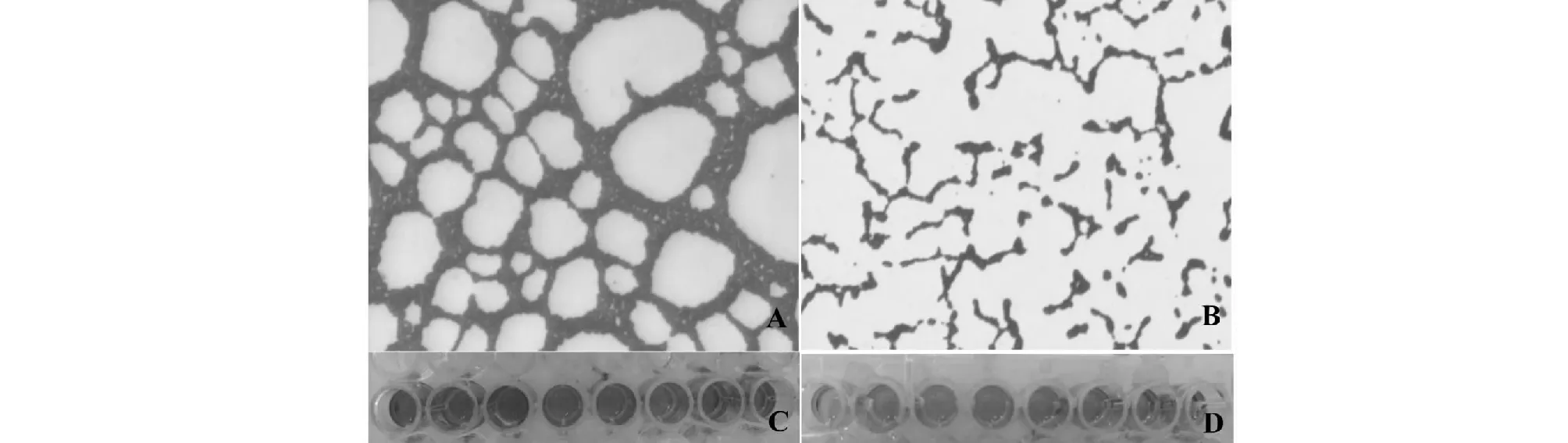
A与B:倒置显微镜下呈现的生物膜形态(400);C与D:96孔微孔板中乙醇脱色后小孔A and B: The biofilm morphology under inverted microscope(400 );C and D: 96-well polystyrene microtiter plates after decolorization of ethanol图6 MRSA与MSSA分离株形成的生物膜Fig.6 Formation of biofilm by MRSA (A/C) and MSSA(B/D) isolates
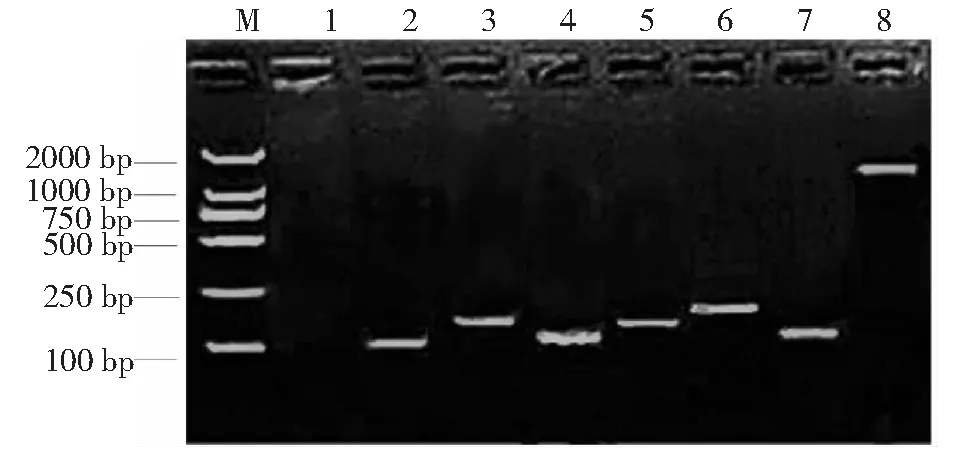
M.DNA标志物(DL-2000); 1.阴性对照; 2. clfA基因(104 bp); 3. clfB基因(194 bp); 4. fnbA:基因(133 bp); 5. fnbB(197 bp); 6. Fib基因(239 bp); 7. cna基因(156 bp); 8. FnBP基因(1500 bp)M.DNA marker 2000; 1. Negative control; 2. clfA gene; 3. clfB gene; 4. nbA gene; 5. fnbB gene; 6. Fib gene; 7. cna gene; 8. FnBP gene图7 MRSA菌株检测黏附素电泳结果Fig.7 Electrophoresis result of adhesin in MRSA isolates
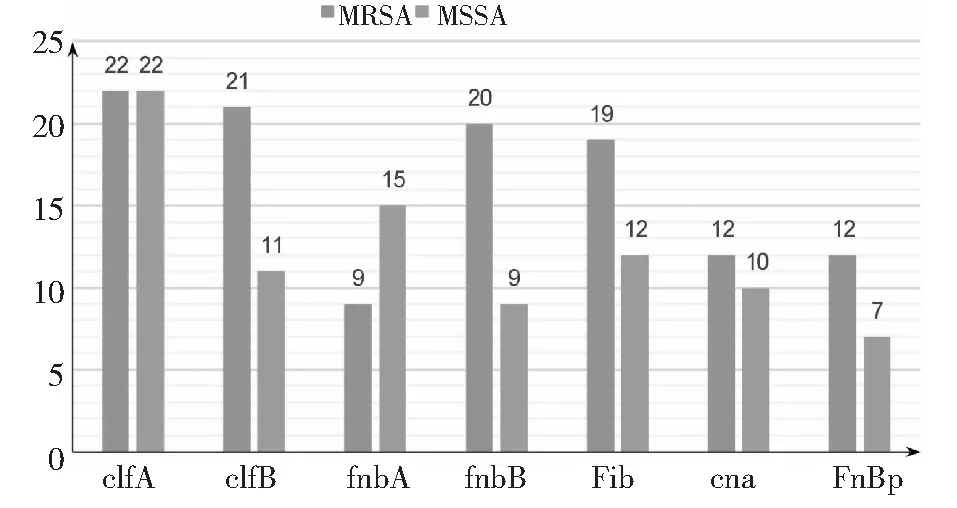
图8 MRSA与MSSA菌株生物膜相关基因阳性分布Fig.8 Positive distribution of biofilm related genes in MRSA and MSSA isolates
研究表明,细菌生物膜(bacterial biofilm,BBF)可以通过形成特殊结构以逃避宿主免疫系统对其的清除作用,还可通过抗生素渗透限制、营养限制和形成特殊表型来抵抗抗生素,因此,BBF的形成是细菌产生耐药性的主要因素,也是动物和人类发生持续性感染的重要因素[13-15]。本研究结果显示,MRSA菌株的生物膜生成能力均显著高于MSSA菌株(P<0.05),且MRSA菌株比MSSA菌株表现出多重耐药和较强的抗性。由此可知,SA菌株的生物膜生成能力与其耐药性密切相关。
在BBF形成过程中,细菌的群体感应(QS)系统可通过合成和分泌自诱导分子(AI)的浓度来控制整个细菌群体,当AI浓度随着细菌群体密度达到一定阈值时,即可启动特异性基因的表达,使细菌对外界环境刺激做出反应,以增强细菌群体的生命力,导致细菌侵袭力和致病性明显增强[16-17]。本研究结果显示,超过90 %的MRSA菌株携带凝聚因子A(clfA)和B(clfB)、纤连蛋白结合蛋白B(fnbB);大多数MRSA菌株携带纤维蛋白原结合蛋白(Fib)、胶原结合蛋白(cna)。有研究指出,fnbA、fnbB介导的生物膜形成是MRSA生物膜形成的主要途径;clfA基因在乳酸乳球菌中表达后,使得菌株毒力增强[18-19]。由本研究结果可知,在MRSA菌株中,fnbB 的检出率远高于fnbA,且clfA的检出率高达100 %,由此推测clfA、fnbB在MRSA生物膜的形成中具有更为重要的作用。国外学者Szezuka等[20]收集了80株临床MRSA菌株进行生物膜相关基因检测,结果超过50 %的菌株携带fnbB基因,但未检测出fnbA基因,这与本研究的实验结论相一致。此外,SA表面黏附素在生物膜生产中同样起着重要的作用。本研究结果显示,MRSA菌株clfA 、clfB、fnbB、Fib、cna、FnBP基因检出率均高于MSSA菌株,提示这与MRSA菌株较强的生物膜生成能力及其较强抗性具有相关性。由于不同的生物膜相关基因的表达水平可能存在差异[21],因此有必要对生物膜形成相关基因在MRSA菌株中的表达水平进行检测。MRSA较强的生物膜生成能力、黏附素的高携带率与MRSA毒力之间的相关性尚需进一步开展动物试验研究。
4 结 论
在临床用药时,可将呋喃妥因、替考拉宁、磷霉素作为优选药用于治疗SA引发的奶牛乳房炎、子宫内膜炎及MRSA和β-内酰胺类耐药株引起的严重感染。MRSA菌株比MSSA菌株具有较强的生物膜形成能力,clfA 、clfB、fnbB、Fib、cna、FnBP基因在其中发挥着重要作用。MRSA菌株较强的生物膜形成能力及其较强抗性之间具有相关性。
