腺嘌呤加高磷饮食快速建立慢性肾脏病血管钙化动物模型法
2018-07-19龚财判张丽玲欧三桃
蒲 江,魏 晓,龚财判,刘 琦,张丽玲,李 丽,欧三桃
慢性肾脏病(Chronickidneydisease,CKD)患者均可能存在不同程度的血管钙化,CKD3期患者血管钙化发生率约40%,CKD5期则高达80-90%[1]。同时血管钙化也是CKD患者心血管疾病发病率和病死率增加的主要危险因素[2],有研究报道血管钙化导致的死亡率约占终末期肾病总死亡率的30%[3]。近年研究发现血管平滑肌细胞(vascularsmoothmusclecells,VSMCs)表型转换、钙化抑制物缺乏、矿物失衡等多种因素均参与该过程,其中VSMCs表型转换是关键环节。而目前关于血管钙化发生的确切机制尚不完全明确,需要研制出一种准确、 简便、稳定性好的CKD血管钙化的动物模型。腺嘌呤能诱导与临床高度类似的慢性肾衰竭动物模型,而高磷血症在CKD血管钙化的发生发展中也起着十分重要的作用,因此本研究拟采用腺嘌呤加高磷饮食的造模方法以期构建出与临床高度相似的CKD血管钙化模型。
1材料与方法
1.1试验动物SPF级雄性SD大鼠45只,体重190-270g(7-8周龄),购自西南医科大学实验动物中心。(动物使用许可证:SYXK(川)2013-065)。
1.2主要试剂 腺嘌呤(Sigma公司,美国);1.8%高磷饲料(北京科澳协力,中国);小鼠抗α-SMA单克隆抗体(武汉博士德);兔抗Runx2单克隆抗体(北京博奥森);DAB显色试剂盒(北京中杉金桥);Eastep®SuperTotalRNAExtractionKit、Eastep®RTMasterMix(5×)Kit、Eastep®qPCRMasterMix(2×)Kit(上海普洛麦格);5%硝酸银溶液、5%硫代硫酸钠溶液(上海源叶生物);钙含量测定试剂盒(微板法)(南京建成生物)。
1.3实验分组及CKD血管钙化模型制备SPF级雄性SD大鼠45只,适应性喂养10天后,随机分为CKD组(n=24只)和对照组(n=21只)。1g腺嘌呤溶于40ml蒸馏水,磁力搅拌器上适当加温混匀,制成2.5%混悬液。第1-4周CKD组每日给予2.5%腺嘌呤混悬液(220-250mg/kg.d)灌胃,联合使用1.8%高磷饲料喂养,第5-6周给予腺嘌呤混悬液隔日灌胃;对照组给予等量生理盐水灌胃,普通饲料喂养。
1.4标本采集及指标检测 实验第2、4、6周末,分别于2组中随机选取大鼠,收集24h尿液检测尿蛋白定量(24hoururineprotein,24hUpro),处死大鼠后留取血液、肾脏及主动脉标本;血液用于检测BUN、Scr、血钙、血磷;将两侧肾脏,置于10%福尔马林溶液中固定用于HE染色;剥离主动脉,一部分固定于10%福尔马林溶液中,用于免疫组化检测及VonKossa染色,一部分保存于-80℃冰箱中,用于测定主动脉钙含量,剩余组织保存在装有RNA保存液的冻存管中,并置于-80℃冰箱用于PT-PCR检测。
1.4.124h-Upro、肾功能和钙磷检测:采用全自动生化分析仪测定24h-Upro、肌酐(Scr)、尿素氮(BUN)及钙磷的水平。
1.4.2肾脏HE染色:肾脏组织常规石蜡切片,进行苏木精-伊红(HE) 染色,观察肾小球、肾小管及肾间质的病理改变。
1.4.3主动脉VonKossa染色:主动脉组织进行石蜡包埋、切片、脱蜡、脱水,置于5%的硝酸银溶液中,紫外光灯照射60分钟,置于5%硫代硫酸钠溶液中5分钟,碱性品红复染、脱水、透明、封片,于光学显微镜下观察。
1.4.4钙含量测定:准确称取主动脉组织,按照重量体积比=1:9,加入生理盐水,冰水浴下匀浆,3500r/min,10min,留取上清液测量。按照试剂说明书,在测定孔、标准孔、空白孔各加入10ul样本、标准液、去离子水,再分别加入250ul工作液,充分混匀后静置10min,将酶标仪波长调至610nm,再测定各孔的OD值。采用BCA蛋白浓度检测计算出总蛋白浓度。根据公式钙含量(mmol/gprot)=(测定OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度(1mmol/L)÷待测样本蛋白浓度(mmol/gprot),计算出钙含量。
1.4.5免疫组化法测定主动脉上α-SMA、Runx2蛋白的表达:按照免疫组化试剂盒操作说明书,将主动脉组织石蜡切片脱蜡水化,修复抗原,先后予以3%H2O2灭活内源性过氧化物酶10min、10%山羊血清室温封闭处理15min,各加入小鼠抗α-SMA和兔抗Runx2单抗,经4℃冰箱过夜后,加入生物素标记二抗(室温20min),清洗后DAB显色,脱水、透明、封片后镜检。采用Image-ProPlus6.0软件进行分析,各切片随机观察视野,测定阳性部位(棕黄色颗粒)的吸光度值,计算其平均值和标准差。
1.4.6RT-PCR检测α-SMAmRNA、Runx2mRNA的表达:根据Eastep®SuperTotalRNAExtractionKit说明书提取主动脉组织中的总RNA,按照逆转录酶试剂盒Eastep®RTMasterMix(5×)Kit操作步骤将mRNA逆转录为cDNA,RT-PCR程序如下:95℃ 预变性 10min,40个循环(95℃ 变性 15s,55℃ 退火 30s,71℃ 延伸 30s)。根据样品PCR反应得到的Ct值,计算出目的基因的相对表达量,并进行统计学分析。
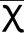
2结 果
2.124h-Upro及肾功能结果 与对照组相比,各时间点CKD组大鼠的24h-Upro、尿素氮及肌酐均明显升高(P<0.01),见图1。
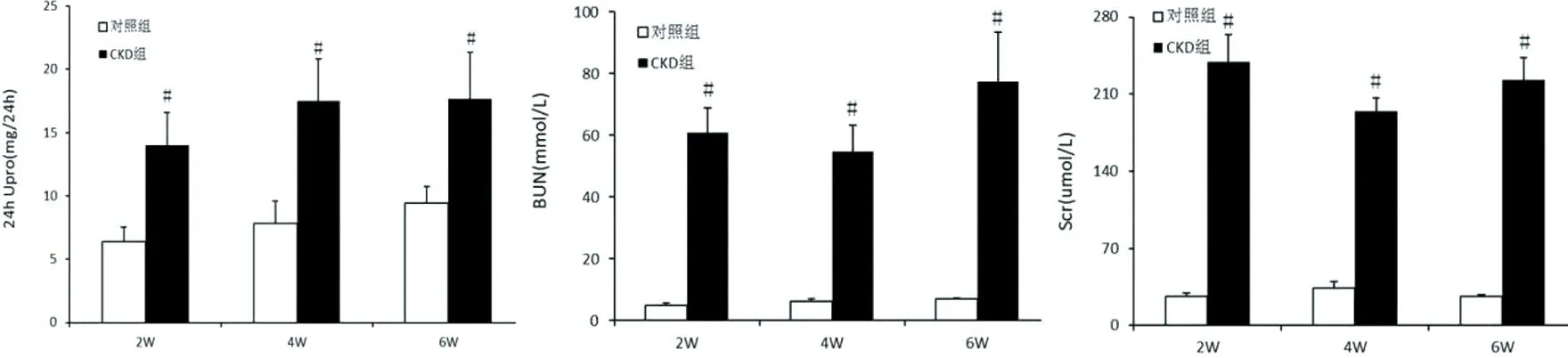
图1:各时间点24h-Upro、尿素氮及肌酐值
2.2血清钙、磷及钙磷乘积 与对照组相比,从第4周开始CKD组血清钙水平明显降低,差异具有统计学意义(P<0.05);CKD组血清磷水平均显著增加,差异具有统计学意义(P<0.01);CKD组血清钙磷乘积水平均显著增加,差异具有统计学意义(P<0.01)。见图2。
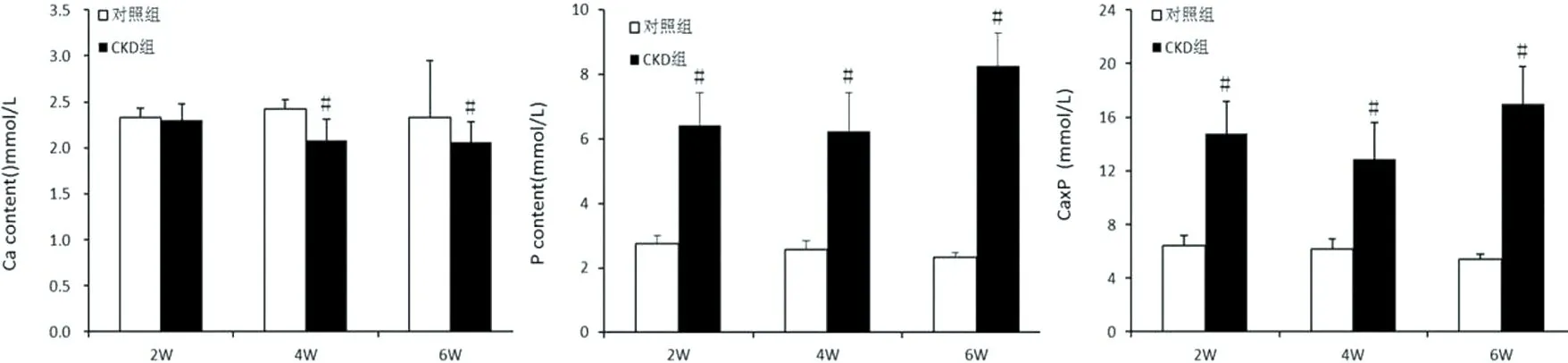
图1:各时间点钙、磷及钙磷乘积水平
2.3肾脏HE染色病理改变 对照组:肾脏皮髓质界限清楚,肾小球、肾小管及肾间质形态正常。CKD组:第2周末可见少数肾小球囊腔轻度扩张,近端小管扩张,管内少许棕黄色颗粒物质沉积;第4周末肾小球囊腔明显扩张,肾小球部分萎缩,近端小管扩张显著加重,管内棕黄色颗粒物质沉积较前明显增多,肾间质可见纤维化;第6周末肾脏结构紊乱,皮髓质分界不清,肾小球显著萎缩,囊腔显著扩张,全程肾小管重度扩张,部分上皮细胞变性坏死,管内可见大量棕黄色颗粒物质沉积,肾间质明显纤维化,血管明显减少,可见炎性细胞浸润。见图3。
A1.对照组第2周; B1. CKD组第2周
2.4主动脉VonKossa染色 对照组各时间点主动脉组织形态结构正常;CKD组2周末时血管形态结构基本正常;4周末时可见少量黑色颗粒物质沉积;6周末时可见大量黑色颗粒物质沉积,主动脉中膜平滑肌纤维断裂,血管僵硬度显著增加,见图4。
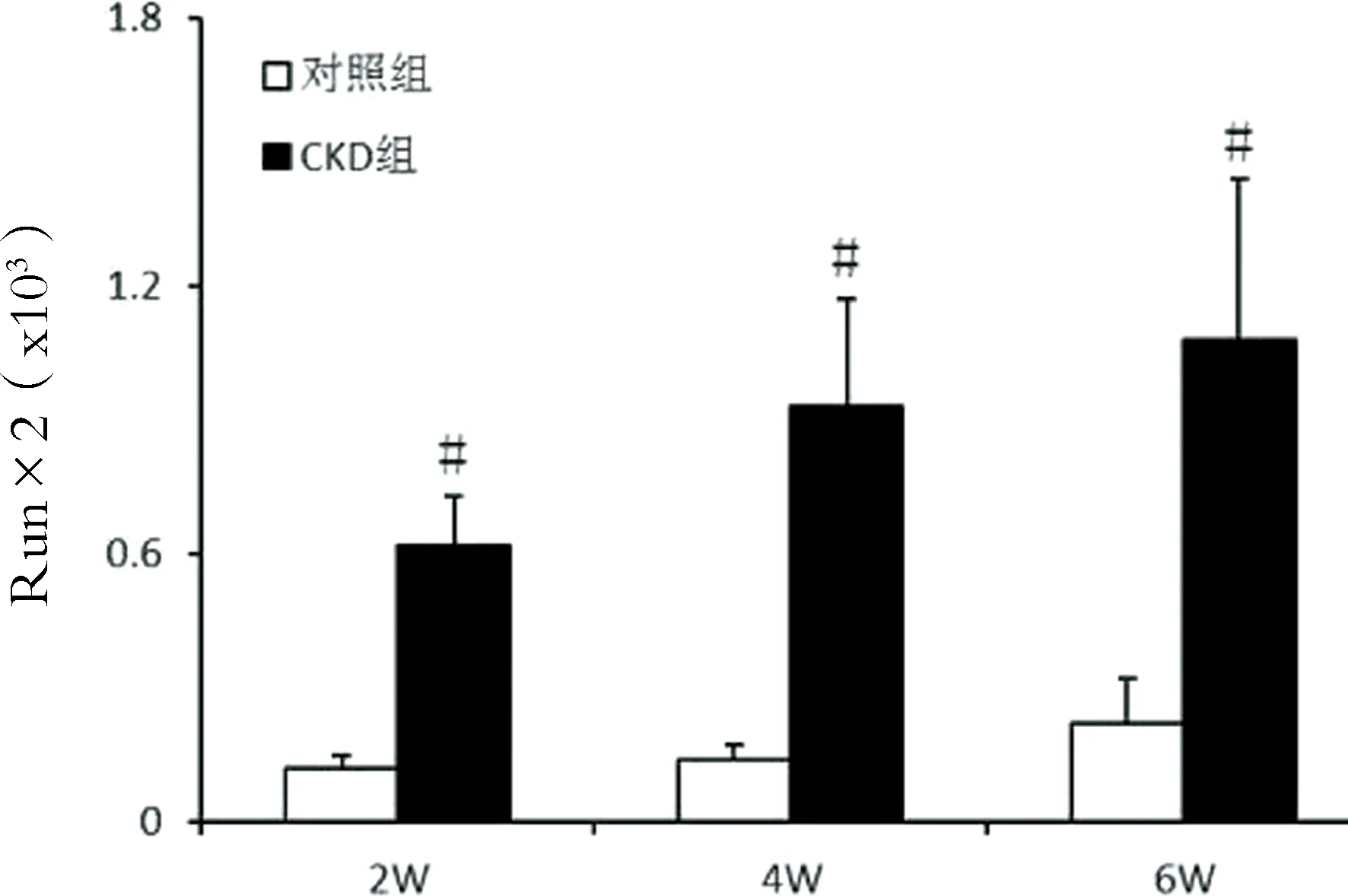
2.5主动脉钙含量测定 与对照组相比,各时间点CKD组主动脉钙含量水平显著增高,差异具有统计学意义(P<0.01)。见图5。
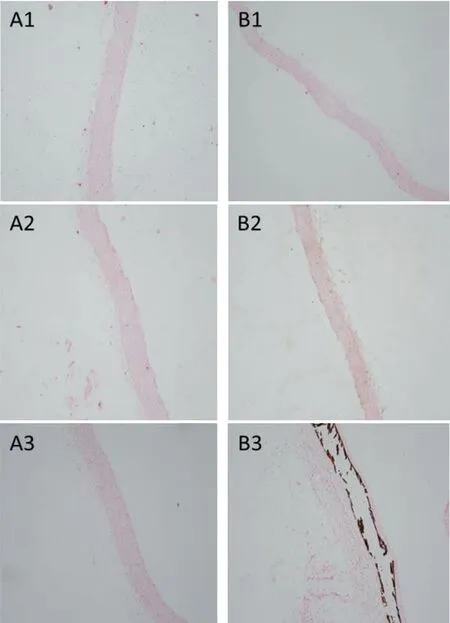
A1.对照组第2周; B1. CKD组第2周A2.对照组第4周; B2. CKD组第4周A3.对照组第6周; B3. CKD组第6周
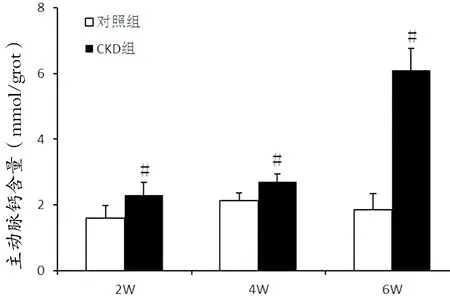
图5:各时间点主动脉钙含量水平
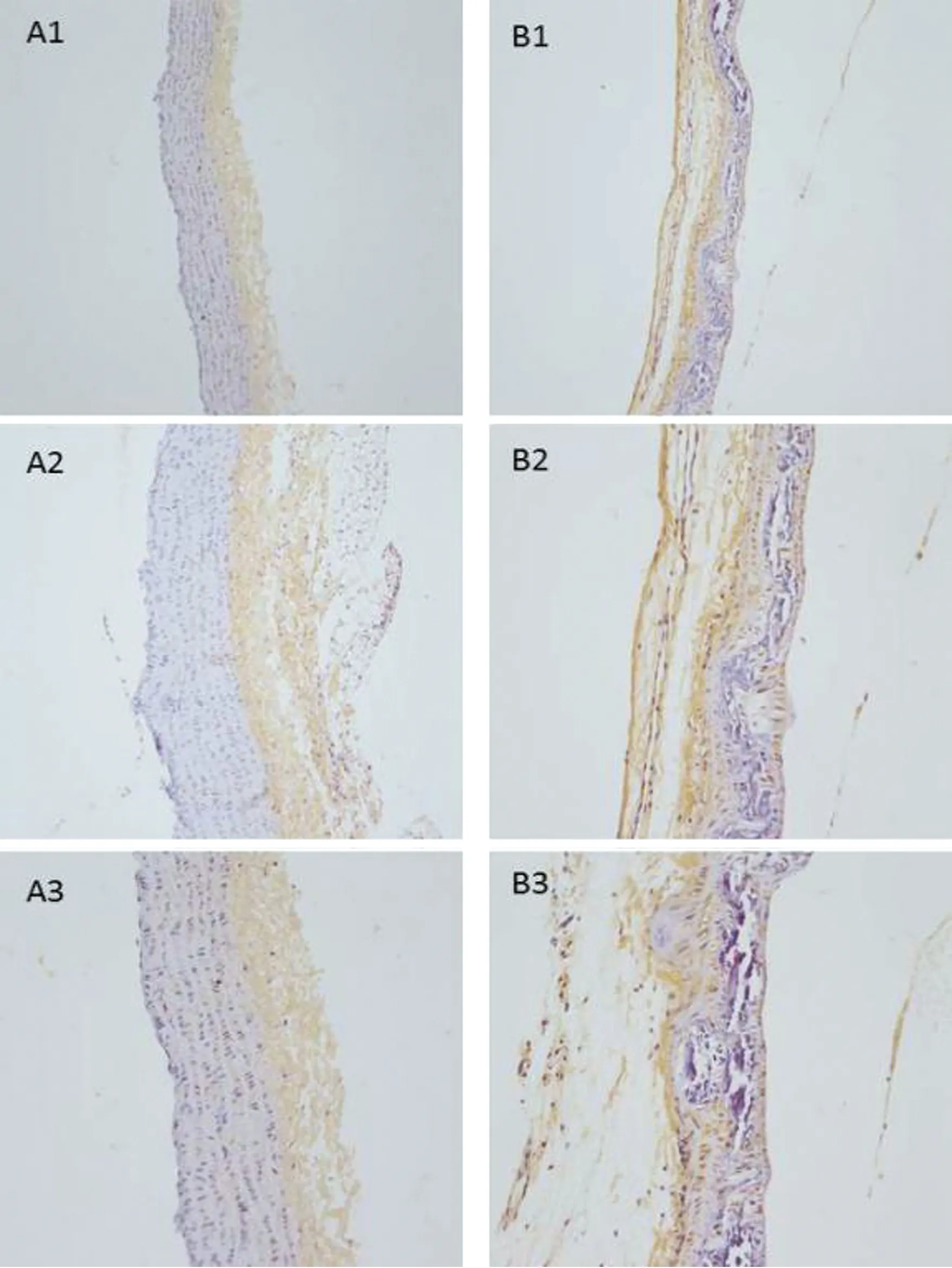
2.6主动脉组织α-SMA、Runx2蛋白的表达 对照组主动脉平滑肌可见α-SMA蛋白广泛表达,呈棕黄色;与对照组相比,CKD组各时间点主动脉平滑肌α-SMA蛋白表达明显减少(P<0.05),见图6;对照组主动脉平滑肌Runx2蛋白极少表达;与对照组相比,CKD组各时间点主动脉平滑肌可见Runx2蛋白广泛表达(P<0.05),见图7。
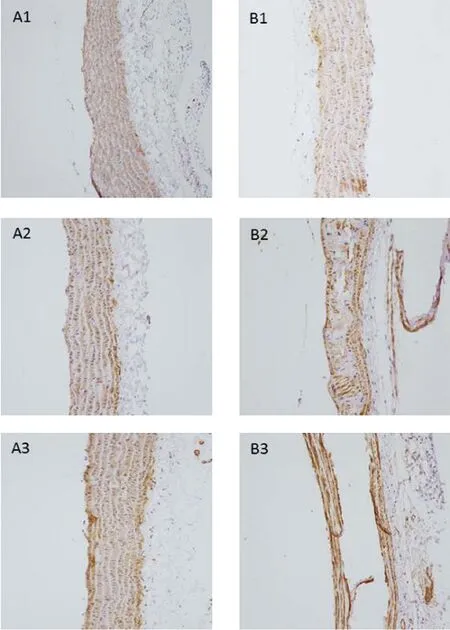
A1.对照组第2周;B1.CKD组第2周
A2.对照组第4周;B2.CKD组第4周
A3.对照组第6周;B3.CKD组第6周
图6:各时间点α-SMA的表达
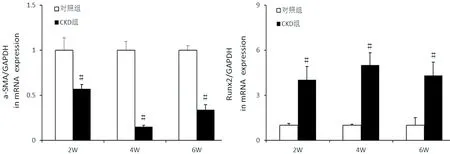
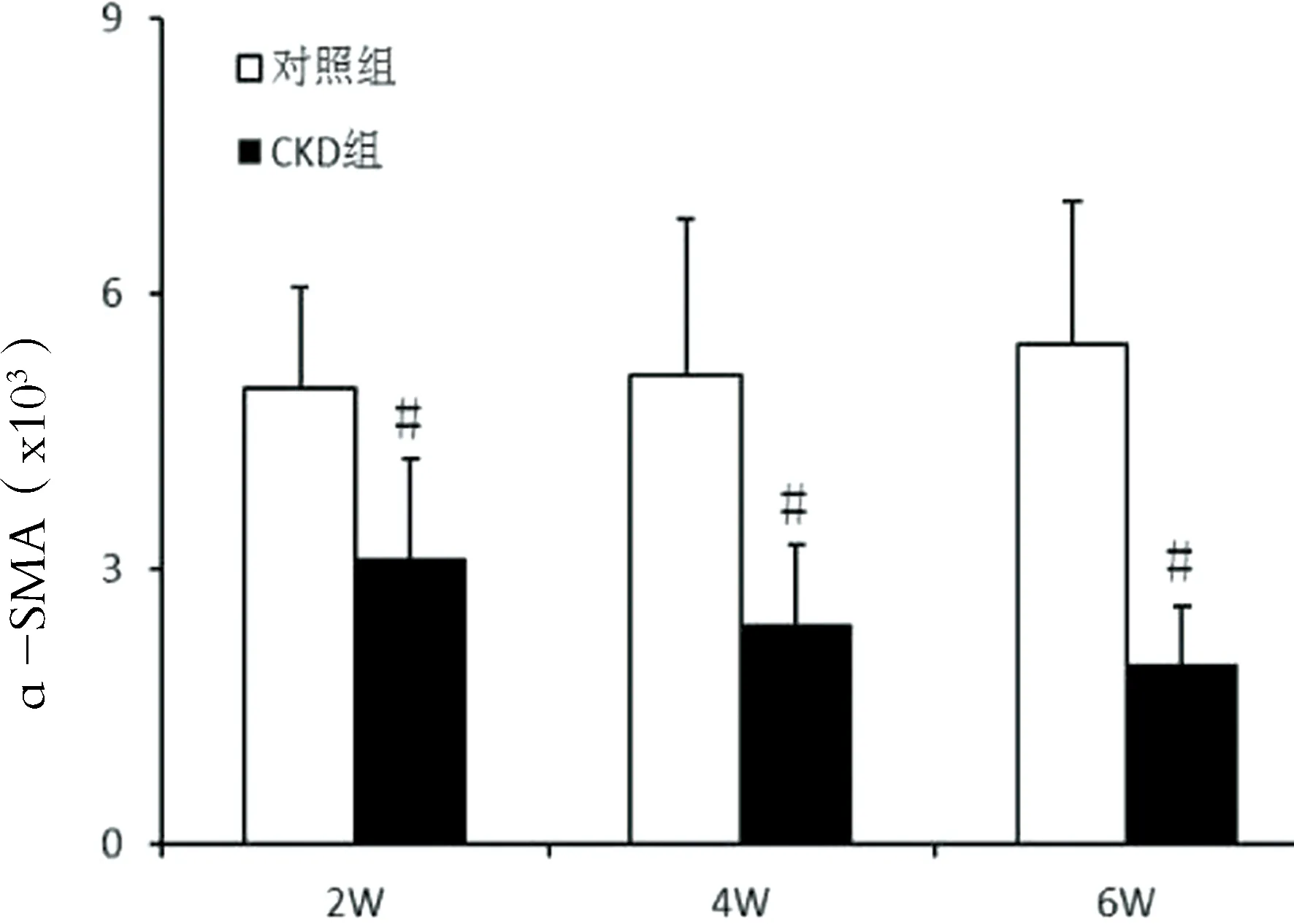
图8:各时间点α-SMA mRNA和Runx2 mRNA的水平
2.7主动脉组织α-SMAmRNA和Runx2mRNA的表达 与对照组相比,CKD组主动脉各时间点α-SMAmRNA表达显著降低(P<0.01),而Runx2mRNA表达明显升高(P<0.05),见图8。
A1.对照组第2周;B1.CKD组第2周
A2.对照组第4周;B2.CKD组第4周
A3.对照组第6周;B3.CKD组第6周
图7:各时间点Runx2的表达
3讨 论
CKD患者死亡的首要原因是心血管疾病(cardiovasculardisease,CVD),且CVD发生风险比一般人群高20-30倍[4],有报道约50%的CKD5D期患者发生并死于CVD[5,6]。血管钙化广泛存在CKD患者,而且是CKD患者心血管疾病及全因死亡率的强力预测因子。为了探究CKD血管钙化的发生机制及防治方法,需选用CKD诱导血管钙化的模型,然而既往CKD模型出现血管钙化的时间较长,延长了实验周期,因此为了便于研究,需建立一种快速简便的CKD血管钙化模型。
目前可用于制作血管钙化模型的实验动物有小鼠、大鼠、兔、微型猪等,常用的造模方法有药物诱导(如维生素D3、华法林等)、基因敲除(如基质Gla蛋白缺陷小鼠、Klotho基因缺陷小鼠、骨桥蛋白缺陷小鼠等)、高脂及高胆固醇饮食喂养的近交系小鼠、慢性肾衰竭诱导等[7],上述方法中慢性肾衰竭诱导模型更适合本研究。制作CKD动物模型的常用方法包括:腺嘌呤混悬液灌胃、5/6肾切除、UUO模型、肾动脉分支结扎等方法,上述方法各存在优缺点。其中腺嘌呤诱导CKD大鼠模型历史悠久。腺嘌呤进入机体后,通过堵塞肾小管、炎性反应及氧化应激等途径诱导CKD的发生[8]。Yokozawa[9]等首创该模型,通过0.75%腺嘌呤饮食喂养大鼠40、50和60天,分别制作出轻、中、重的CKD模型,随后郑平东[10]等研制出用腺嘌呤混悬液灌胃的方法制作CKD大鼠模型。然而关于腺嘌呤诱导CKD血管钙化的研究较少报道。在CKD血管钙化的发生发展中,高磷血症起着十分重要的作用,研究发现高磷血症可通过促进VSMCs成骨样分化、诱导VSMCs凋亡、促进基质小泡释放等途径而促进血管钙化[11]。但是单独予以高磷饮食喂养大鼠,需要6个月的时间才出现血管钙化[12]。
本研究拟在腺嘌呤混悬液灌胃的基础上联合高磷饮食制作大鼠CKD血管钙化的模型。结果显示CKD组血肌酐、尿素氮均较对照组明显升高,同时出现高磷低钙,肾脏病理改变也符合CKD病理特征,说明CKD造模成功;同时第4周末VonKossa染色可见主动脉有少量黑色颗粒物质沉积,主动脉钙含量测定也明显增加;CKD组主动脉平滑肌细胞的特异性标志物α-SMA及其mRNA水平明显减低,而成骨样分化调节因子Runx2及其mRNA水平明显增加,即成功制作出CKD血管钙化动物模型。
制作血管钙化模型的常见方法,如基因敲出、药物诱导、高脂饮食喂养等,从致病机制上讲并不能模拟CKD血管钙化的过程。然而在本研究模型中,随着肾功能的不断下降,逐渐出现低钙高磷而启动血管钙化,并观察到明显的钙化结节沿主动脉中膜连续性分布,同时出现平滑肌细胞由收缩表型向成骨样细胞表型转换等相关复杂过程,能很好模拟CKD血管钙化的病理生理过程。目前常用的CKD血管钙化动物模型包括5/6肾切除大鼠模型和腺嘌呤肾毒性大鼠模型,然而5/6肾切除大鼠模型存在如下缺点:1需通过外科手术建立模型,手术耗时长,增加了感染及麻醉风险,大大增加了死亡率;2建模周期长,需配合高磷饮食诱导血管钙化且发生率低,有研究报道5/6肾切除+高磷饮食模型大鼠在第3个月时仍未出现明显的血管钙化[13];单纯腺嘌呤饮食干预诱导CKD模型所需时间长,约8-12周,且血管钙化发生率仅15%左右,而单独高磷饮食诱导血管钙化需要6个月[12]。本研究采用腺嘌呤混悬液灌胃联合高磷饮食制作大鼠CKD血管钙化模型,具有以下优点:1建模时间短,成模率高,血管钙化发生率高,明显缩短了试验周期;2能很好模拟CKD血管钙化的病理生理过程;3不用外科手术,操作过程简便易行。因此该模型为进一步研究CKD血管钙化发生机制及防治提供了一个快速准确的动物模型,值得进一步推广。
