磁性分子印迹聚合物的制备及对食品中氯霉素残留的检测
2018-06-28李增威付珍珍刘书亮敖晓琳陈姝娟
李增威,王 娜,雷 婵,曾 月,付珍珍,何 利,刘书亮,周 康,敖晓琳,陈姝娟
(四川农业大学 食品学院,四川 雅安 625014)
磁性分子印迹聚合物的制备及对食品中氯霉素残留的检测
李增威,王 娜,雷 婵,曾 月,付珍珍,何 利,刘书亮,周 康,敖晓琳,陈姝娟*
(四川农业大学 食品学院,四川 雅安 625014)
摘 要:将磁性分离技术和表面分子印迹技术相结合,首先通过化学改性的方式在Fe3O4磁性纳米粒子表面接枝双键,以氯霉素(chloramphenicol,CAP)为模板分子、甲基丙烯酸(methacrylic acid,MAA)为功能单体、乙二醇二甲基丙烯酸酯(ethylene glycol dimethacrylate,EDGMA)为交联剂、偶氮二异丁腈(azobisisobutyronitrile,AIBN)为引发剂,采用悬浮聚合法合成CAP的磁性分子印迹聚合物微球(magnetic molecularly imprinted polymer,MMIP),以及对应的非印迹微球(magnetic molecularly non-imprinted polymer,MNIP)。在表征试验中,用傅里叶变换红外光谱仪对每一步合成的产物进行红外光谱检测,用扫描电子显微镜对MMIP和MNIP的微观形态进行观察,用振动磁强计测定磁性纳米粒子和MMIP的饱和磁强度。对MMIP和MNIP的吸附性能进行研究,将MMIP作为固相萃取剂应用于实际样品检测,进行方法学考查。试验结果表明,合成的磁性分子印迹聚合物微球直径400~700 nm,分散性较好,在溶剂中可在外加磁场作用下快速分离。MMIP的最大表观吸附容量可达29.18mg·g-1,具有良好的选择识别性能。MMIP作为固相萃取剂在对实际样品进行检测时回收率(86.30%~94.21%)、精密度(RSD≤1.53%)、稳定性(RSD≤1.87%)均良好,且具有较低的检测限(3.0μg·kg-1)。将MMIP作为固相萃取剂用于食品中残留氯霉素的分离检测具有良好的效果。
关键词:氯霉素;磁性分离;表面印迹;固相萃取;高效液相色谱
氯霉素(chloramphenicol,CAP),又名氯胺丙醇,于1947年在链霉菌的培养液中分离制得,是第一个可以完全人工合成的抗生素[1-2]。CAP是一种广谱抗生素,对革兰氏阴性和阳性菌,以及部分衣原体、立克次氏体均有抑制作用,曾被广泛用于人类,以及畜牧业、渔业各种细菌性疾病的治疗[3-4]。但CAP的毒副作用不可忽视:CAP可抑制骨髓的造血功能[5-6];如果进入婴儿体内还会导致“灰婴综合征”[7];此外,长期微量摄入CAP,会引起肠道菌群的失调,使人容易感染各种疾病[8]。现在,包括我国在内的许多国家都已禁止将CAP用于养殖业,但由于CAP廉价高效,违规使用CAP的现象依然存在[9]。
由于在实际样品中CAP的含量较低,因此需要在检测前对目标分子进行富集,同时须排除样品基质,特别是类似物的干扰。固相萃取(solid phase extraction,SPE)是一种常用的富集、分离手段,操作简单快速,但由于其吸附作用主要基于极性差异、氢键、离子交换作用等,所以对分子结构类似的物质缺乏选择性,在处理基质较为复杂的样品时,很难排除干扰[10-12]。
分子印迹技术(molecularly imprinted technique,MIT)是从仿生的角度,用人工的方法制备出对某一特定分子具有选择性和亲和性的高分子化合物——分子印迹聚合物(molecularly imprinted polymer,MIP)的技术[13-14]。该聚合物对模板分子具有较高的选择识别能力,并且在较为恶劣的条件下,MIP不会丧失对目标分子结合的能力[15-17]。近年来,分子印迹固相萃取技术由于选择性较强、稳定性好、易于制备而受到广泛关注[18-20]。目前,对CAP分子印迹的研究较多,但制备CAP磁性分子印迹并应用于实际样品检测的研究还较少[21-23]。磁性分子印迹聚合物(magnetic molecularly imprinted polymer,MMIP)采用表面印迹技术,在磁性纳米粒子表面合成分子印迹壳层。MMIP不仅具有分子印迹的优势——能够特异性识别和吸附目标分子,而且能在磁场的作用下快速分离,同时由于其粒径较小,具有较大的比表面积,故吸附容量较大[24-26],是一种更为理想的样品前处理吸附材料。
本研究结合磁性分离技术和表面印迹技术,在Fe3O4磁性纳米粒子表面合成能特异性选择和吸附CAP的分子印迹壳层,得到MMIP。运用红外光谱检测合成过程的产物,用扫描电子显微镜观察MMIP和磁性非印迹聚合物(magnetic molecularly non-imprinted polymer,MNIP)的微观形态,并用振动磁强计测定磁性纳米粒子和MMIP的饱和磁强度。同时,对MMIP和MNIP进行等温吸附、吸附动力学和选择性吸附试验,并对等温吸附过程进行Scatchard分析,深入研究其吸附能力和机理,在选择性试验中计算其印迹因子和分离因子,评价其对类似物的选择吸附能力。此外,本研究对MMIP运用于实际样品的检测能力进行了全面的方法学评价,涉及回收率、精密度、稳定性及检测限等4个方面,全面评价了MMIP作为样品前处理吸附材料的可靠性,充分发挥MMIP吸附容量大、检测限低、吸附速度快等优势,为MMIP用于食品中CAP的检测提供了重要依据,也为开发食品安全检测中新型CAP样品前处理吸附材料提供了重要参考。与传统的固相萃取材料相比,MMIP克服了选择性差的缺点,并且借助磁性,分离更为方便,在对复杂样品检测中能有效排除干扰,提高结果的可靠性。
1 材料与方法
1.1 仪器与试剂
JJ-1电动搅拌器;DZF-6020真空干燥箱;DZKW-4电子恒温水浴锅;KQ-250DB超声波清洗仪;Agilent 1260液相色谱配DAD检测器(型号:G4212B);NICOLET iS10傅里叶红外光谱仪;SHA-C恒温振荡器;UV-1800PC紫外可见分光光度计;7404型振动样品磁强计;日立S-3400N Ⅱ扫描电子显微镜。
氯霉素(CAP,98%)、甲砜霉素(TAP,99%)、氟苯尼考(FF,98%)、正硅酸乙酯(TEOS,分析纯)、3-(甲基丙烯酰氧)丙基三甲氧基硅烷(KH570,分析纯)、乙二醇二甲基丙烯酸酯(EGDMA,分析纯)、聚乙烯吡咯烷酮(PVP,分析纯)购于成都化夏试剂公司。甲基丙烯酸(MAA,分析纯)、氢氧化钠(NaOH,分析纯)、柠檬酸钠(分析纯)、FeCl3·6H2O(分析纯)、FeSO4·7H2O(分析纯)、无水乙醇(分析纯)、甲醇(分析纯),购于成都市科隆化学品有限公司。试验用水为超纯水。
1.2 CAP磁性分子印迹聚合物的制备
1.2.1 Fe3O4磁性纳米粒子的制备
将含有0.01mol FeSO4·7H2O和0.02mol FeCl3·6H2O的100mL超纯水在30min内滴加到含有45mL 2.0mol·L-1NaOH和8mL 0.2mol·L-1柠檬酸钠溶液的三颈烧瓶中,并不断搅拌。滴加完成后继续反应1h,全程通氮除氧。用磁场分离磁性纳米粒子,用超纯水洗涤至中性,得到含有磁性纳米粒子的磁流体。
1.2.2 Fe3O4@SiO2纳米粒子的制备
测定磁流体的含水量,称取含有100mg磁性纳米粒子的磁流体,将其分散在50mL乙醇-水混合液(乙醇-水体积比8∶2)中,同时加入1mL 25%氨水。超声10min之后,加入2mL正硅酸乙酯,再超声10min。将混合物置于三角瓶中,通氮除氧后密封,30℃水浴振荡反应6h,得到Fe3O4@SiO2。
1.2.3 双键修饰的Fe3O4@SiO2纳米粒子的制备
用甲醇-水混合液(甲醇-水体积比1∶1)洗涤Fe3O4@SiO2数遍后,将Fe3O4@SiO2分散在50mL甲醇-水混合液中,加入2mL KH570,超声10min使其混合均匀。将混合物置于三角瓶中,通氮除氧后密封,60℃水浴振荡反应24h。
1.2.4 MMIP和MNIP的制备
用无水乙醇洗涤双键修饰的磁性纳米粒子数遍后,将双键修饰的磁性纳米粒子和含有1mmol CAP、5mmol MAA的50mL乙醇溶液混合,然后加入含有6mmol EGDMA和0.1 g PVP的50mL乙醇溶液,最后加入0.025 g引发剂偶氮二异丁脐(AIBN)。每次加入试剂后均超声10min,使其分散均匀。通氮除氧后置于60℃恒温水浴摇床反应24h。将得到的MMIP用适量甲醇-乙酸混合液(甲醇-乙酸体积比8∶2)洗脱模板分子,直到洗脱液在278 nm处检测不出CAP的紫外吸收峰后,再用甲醇洗涤数遍。最后置于30℃真空干燥箱干燥48h。用同样的方法不加CAP制备MNIP。
1.3 MMIP及MNIP的吸附试验
1.3.1 色谱条件
色谱柱:Sepax HP-C18,4.6mm×250mm,5μm;流速:1mL·min-1;柱温:25℃;进样量:10μL;检测波长:278 nm;流动相及比例:乙腈-水,体积比35∶65[27-28]。
1.3.2 吸附动力学试验
称取20mg MMIP和MNIP分散于5mL含40mg·L-1CAP的甲醇溶液中,25℃恒温振荡。分别测定其在10、20、30、40、50、60、120、180min的吸附量。测定时,在外加磁场作用下将上清液与聚合物分离,吸取上清液,过0.45μm滤膜,按照1.3.1节色谱条件测定其浓度。
1.3.3 等温吸附试验
移取5mL浓度分别为20、40、60、80、100、120mg·L-1的CAP甲醇溶液,分别置于50mL离心管中。称取6份20mg的MMIP和MNIP,分散于不同浓度的CAP甲醇溶液中,每个浓度梯度设置3个平行试验。25℃恒温振荡4h后,在外加磁场作用下将上清液与聚合物分离,吸取上清液,过0.45μm滤膜,按照1.3.1中色谱的条件测定其浓度。
1.3.4 MMIP及MNIP的选择性试验
选取TAP和FF作为CAP的类似物,进行选择性吸附试验。分别称取20mg MMIP和MNIP分散于5mL浓度均为40mg·L-1的CAP、TAP和FF的甲醇混合溶液中。25℃振荡4h后,在外加磁场作用下将上清液与聚合物分离,吸取上清液,过0.45μm滤膜,按照1.3.1节色谱条件测定CAP及其类似物的浓度。
1.4 MMIP用于实际样品检测的方法学评价
为全面评价MMIP作为固相萃取剂用于实际样品检测时的可靠性,进行方法学试验。试验的色谱条件同1.3.1节。
1.4.1 标准曲线的建立
配制浓度分别为0.01、0.02、0.05、0.1、0.5、1、5、10mg·L-1的CAP甲醇溶液。按照1.3.1节色谱条件进行测定,以浓度为横坐标,以峰面积为纵坐标进行线性回归。
1.4.2 样品处理方法
选取猪肉和蜂蜜作为检测对象。
猪肉前处理方法。称取10 g样品于50mL离心管中,并根据加标水平加入相应量的CAP,用乙酸乙酯提取3次,合并3次的提取液。将提取液于旋转蒸发器上浓缩至干,分2次加入5mL超纯水洗涤瓶中残余物,并转移至10mL离心管中,然后加入正己烷提取脂肪2次,得到的试液用MMIP进一步提取。称取20mg MMIP分散于试液中,振荡60min后用磁铁吸沉粒子,吸弃上清液。加入1mL洗液(甲醇-乙酸体积比8∶2),超声洗脱3次,合并3次洗脱液。将洗脱液于45℃氮吹仪上吹干,然后加入2mL甲醇溶解残余物,过0.45μm有机相滤膜后待测[29]。蜂蜜前处理方法不用正己烷除脂肪,其余与猪肉相同[30]。
1.4.3 回收率测定
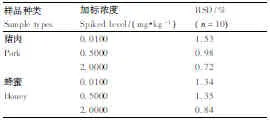
分别称取4份10 g猪肉和蜂蜜,按照0、0.01、0.5、2mg·kg-1的加标水平加入相应量的CAP。用1.4.2节相应的样品前处理方法处理样品后,按照1.3.1节色谱条件进行测定。每个试样平行进样3次。
1.4.4 精密度测定
分别称取4份10 g猪肉和蜂蜜,按照0、0.01、0.5、2mg·kg-1的加标水平加入相应量的CAP。用1.4.2节相应的样品前处理方法处理样品后,按照1.3.1节色谱条件进行测定。每个试样平行进样10次。
1.4.5 稳定性试验
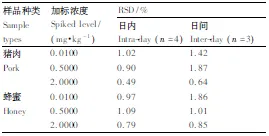
包括日内和日间稳定性。日内取4个时间点(间隔6h),日间取3个时间点(间隔24h)。称取相应的样品,按照0、0.01、0.5、2mg·kg-1的加标水平加入相应量的CAP,按照1.4.2节相应的样品前处理方法处理样品后,按照1.3.1节色谱条件进行测定。
1.4.6 检测限试验
分别称取6份10 g猪肉和蜂蜜,按照1.0、1.5、2.0、2.5、3.0、3.5μg·kg-1的加标水平加入相应量的CAP,按照1.4.2节相应的样品前处理方法制备试样。以3倍信噪比的信号为准,考查本方法最低检测限[31]。
2 结果与分析
2.1 MMIP的表征测定
2.1.1 磁性测定
用样品振动磁强计来研究所合成的Fe3O4磁性纳米粒子和MMIP的磁性。图1中曲线A和B分别是Fe3O4和MMIP的磁滞回线。两者的曲线均经过原点,显示Fe3O4磁性纳米粒子和MMIP均具有超顺磁性,说明在Fe3O4磁性纳米粒子表面进行印迹后,并未影响其超顺磁性。根据曲线得出Fe3O4磁性纳米粒子和MMIP的饱和磁强度分别为49.851、21.276 A·m2·kg-1,因此,虽然在Fe3O4表面合成分子印迹壳层后磁性减弱,但仍能在磁场作用下快速分离,便于MMIP与样品的分离。
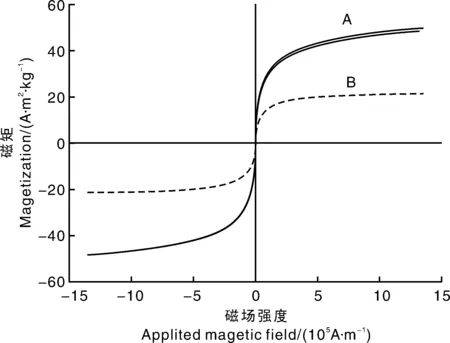
图1 Fe3O4磁性纳米粒子和MMIP磁滞回线Fig.1 Magnetic hysteresis loop of Fe3O4 and MMIP
2.1.2 红外光谱检测
Fe3O4磁性纳米粒子、Fe3O4@SiO2、双键修饰的Fe3O4@SiO2和MMIP的红外光谱表征见图2。图中B线在1 096cm-1的强峰为Si-O的伸缩振动特征峰,说明通过第1步正硅酸乙酯的修饰,在Fe3O4磁性纳米粒子表明形成了硅烷包覆膜,形成Fe3O4@SiO2。图中C线在1 720cm-1处的吸收峰是α-不饱和酯键的特征吸收峰,说明通过修饰,KH570成功接枝到Fe3O4@SiO2表面,得到双键修饰的Fe3O4@SiO2,为能够在Fe3O4磁性纳米粒子表面形成分子印迹壳层提供了基础。图中D线在2 975cm-1处较宽的吸收峰是羧基的特征吸收峰,说明MAA通过交联聚合反应在磁性纳米粒子表面形成了分子印迹壳层,制备出MMIP。
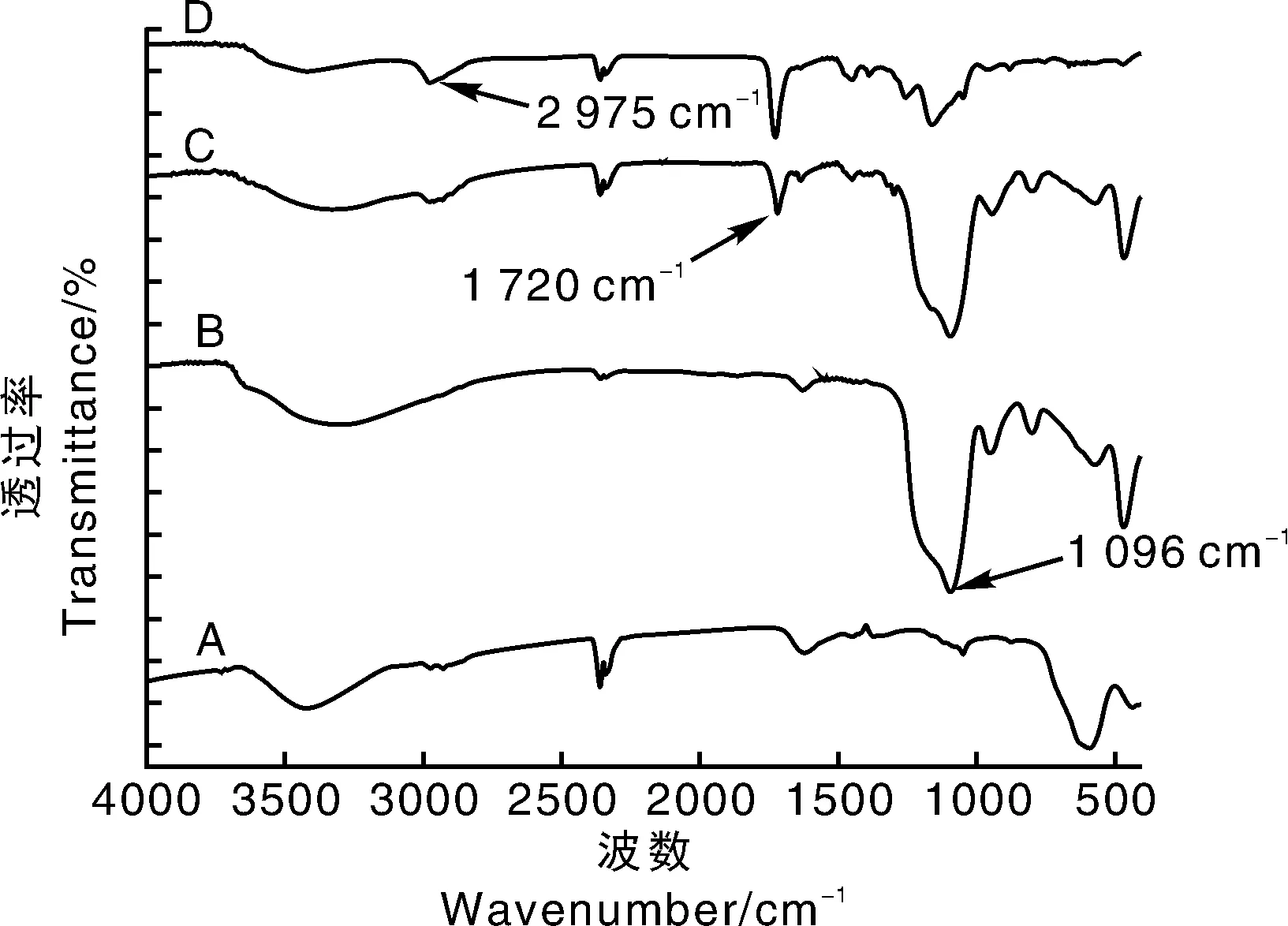
图2 Fe3O4磁性纳米粒子(A)、Fe3O4@SiO2(B)、双键修饰的Fe3O4@SiO2(C)和MMIP(D)的红外光谱图Fig.2 Infra-red spectra of Fe3O4 magnetic nanoparticles(A),Fe3O4@SiO2(B),double bonds modified Fe3O4@SiO2(C) and MMIP(D)
2.1.3 扫描电子显微镜检测
用扫描电镜考查MMIP和MNIP的粒径和形貌特征。图3显示,MMIP和MNIP均有良好规整的形貌,粒子的直径在400~700 nm之间。由于粒子处于干燥状态,所以其聚集也较为明显。由于粒子的直径小,因此具有较大的比表面积,使得MMIP表面印迹位点较多,具有较大的吸附容量,同时也有效避免了印迹位点包埋在聚合物内部,有利于对CAP的吸附。同时,由于具有较大的比表面积,使得MNIP会一定程度地非特异性吸附一部分CAP。
2.2 吸附性能研究
2.2.1 吸附动力学
为了研究合成材料的动态吸附规律,进行吸附动力学试验。从图4可以看出:在前60min,MMIP对CAP的吸附速度很快;60min之后,吸附量增加速度下降,基本达到吸附平衡。这是因为在吸附初始阶段,MMIP表面有较多与CAP结合的位点,CAP可以快速和印迹位点结合,而在大多数印迹位点和CAP结合后,传质阻力增大,MMIP对CAP的吸附速率下降,直到达到吸附平衡。与一般的分子印迹聚合物相比,MMIP达到平衡的吸附时间较短、吸附速度快,具有较大优势[5]。同时,MNIP的吸附趋势与MMIP类似,由于其表面没有和CAP相匹配的印迹位点,因此很难将CAP分子牢固吸附在表面,吸附容量较小。
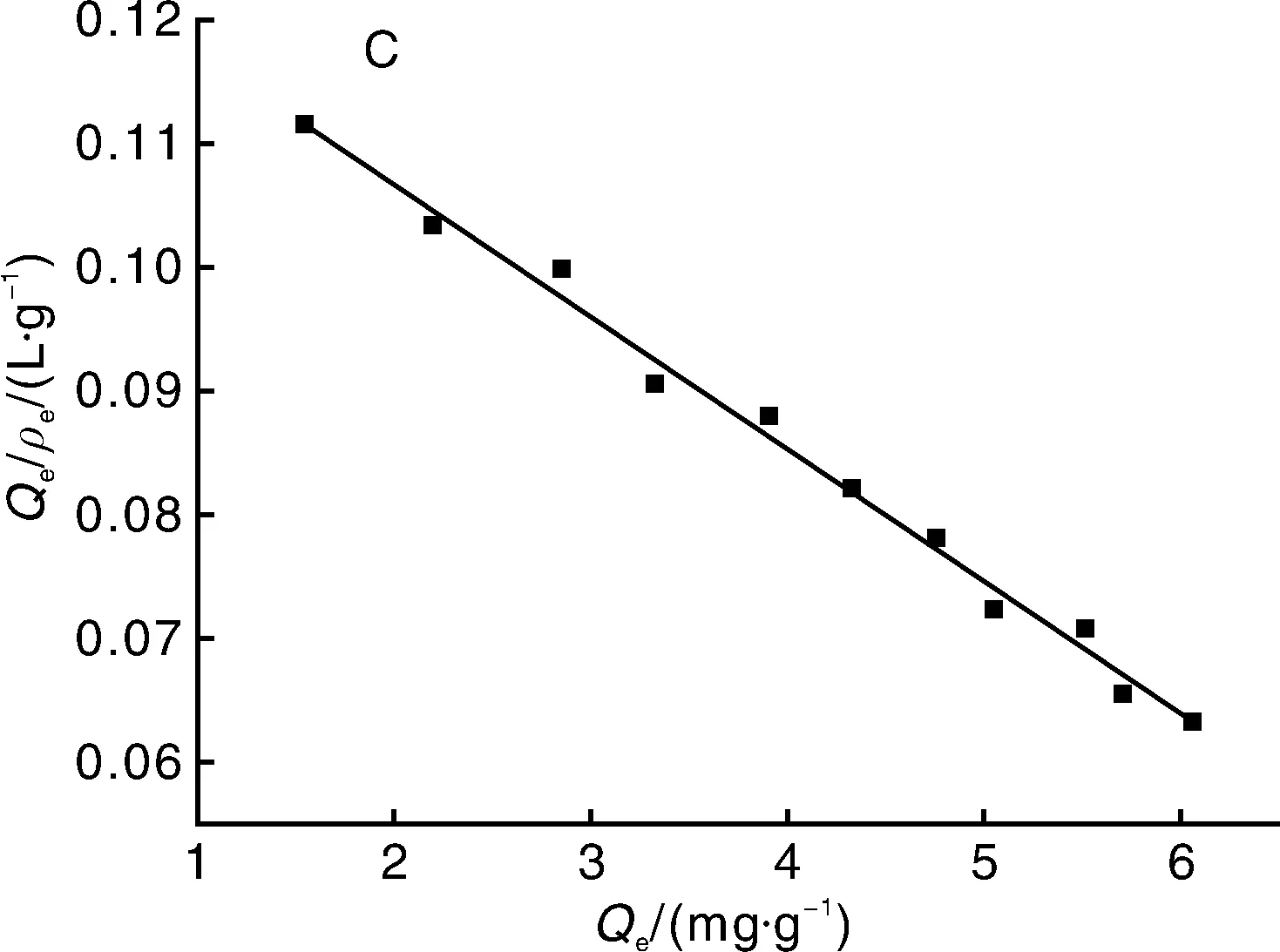
2.2.2 等温吸附
为了研究聚合物的吸附特性,测定MMIP和MNIP的吸附容量对不同浓度CAP的等温吸附曲线。图5-A为MMIP和MNIP的等温吸附曲线。随着CAP浓度的升高,MMIP的平衡吸附容量随之增高,而MNIP的吸附容量不到MMIP的一半。

图3 MMIP(A)和MNIP(B)扫描电子显微镜图Fig.3 Scanning electron microscope of MMIP(A) and MNIP(B)
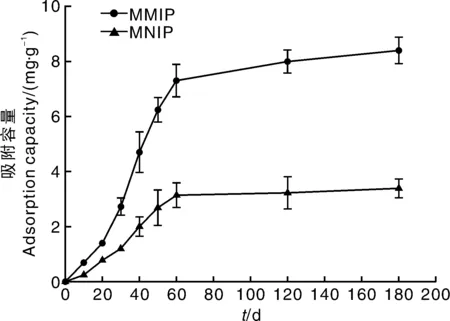
图4 MMIP和MNIP吸附动力学曲线Fig.4 Adsorption kinetics curves of MMIP and MNIP
采用Scatchard分析进一步研究MMIP和MNIP的吸附情况,其方程为
Qe/ρe=(Qmax-Qe)/Kd。
(1)
式(1)中:Qmax(mg·g-1)为MMIP或MNIP的最大表观结合量;Qe(mg·g-1)为某一浓度下,MMIP或MNIP的平衡吸附容量;ρe(mg·L-1)为达到吸附平衡时溶液中CAP的浓度;Kd(mg·L-1)为结合位点的解离平衡常数。
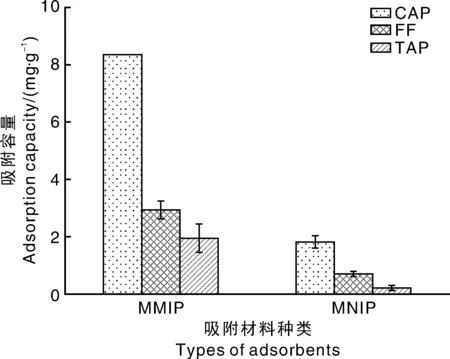
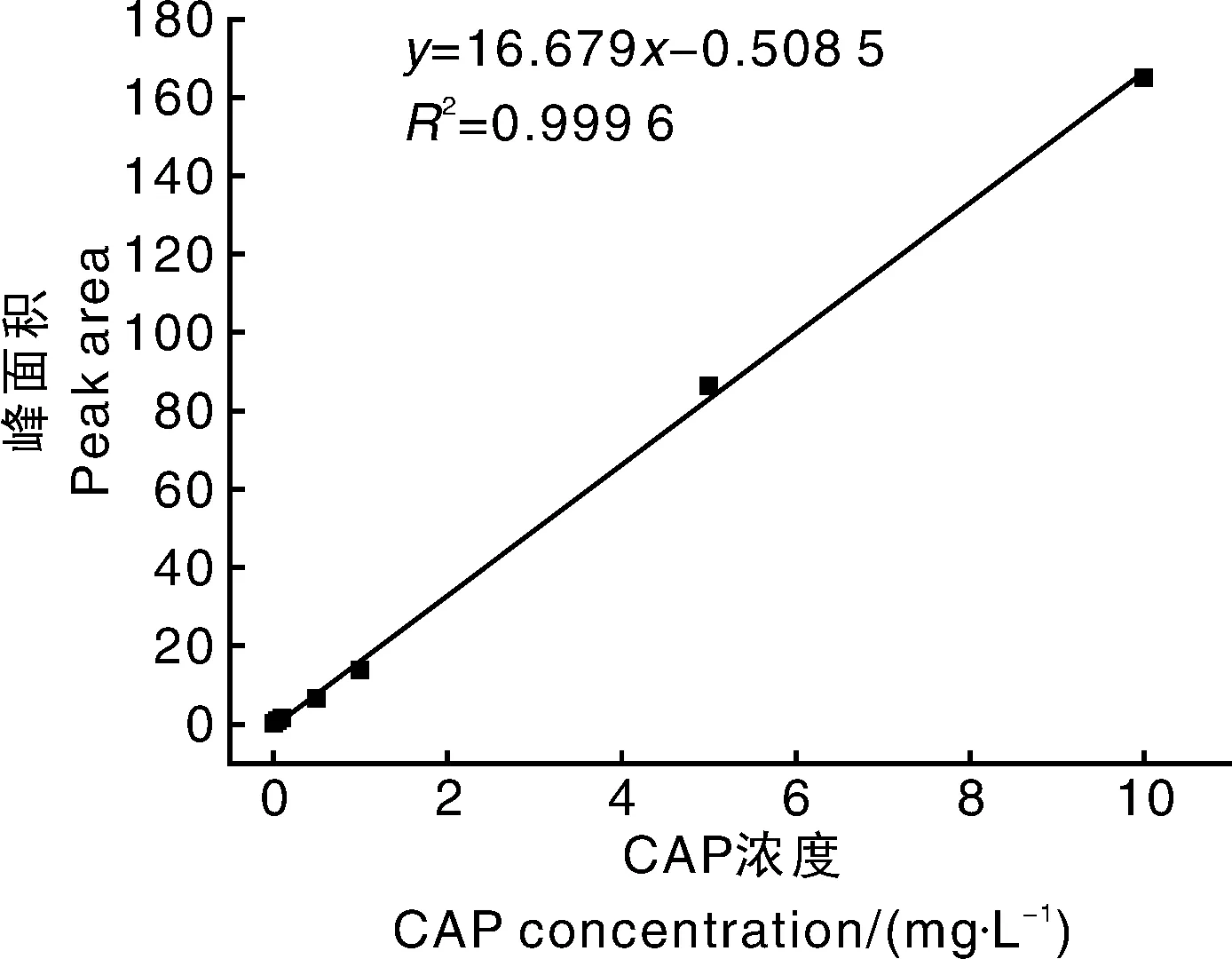
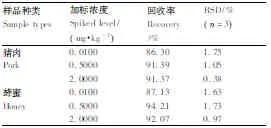
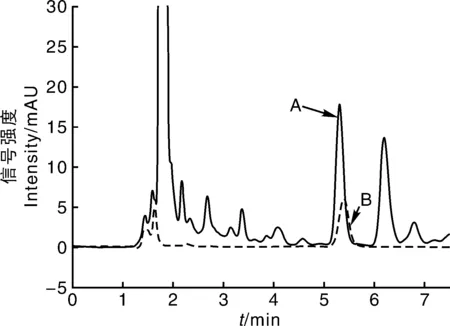
如图5-B所示,Qe/ρe与Qe呈非线性关系,但是将左右两部分分别进行线性回归,均能呈现良好的线性关系。左边的线性回归方程为Qe/ρe=-0.997 7Qe+19.310 83(R2=0.990 5),根据斜率和截距可求得Kd1=1.002mg·L-1,Qmax1=19.36mg·g-1;右边的线性回归方程为Qe/ρe=-0.256 9Qe+7.498 1(R2=0.991 8),根据斜率和截距可求得Kd2=3.892mg·L-1,Qmax2=29.18mg·g-1。由于Kd1 由图5-C可知,MNIP只存在1种结合位点,线性回归方程为Qe/ρe=-0.010 7Qe+0.128 2(R2=0.990 4),Kd=93.46mg·L-1,Qmax=11.98mg·g-1,其解离平衡常数远大于MMIP的Kd1和Kd2。 通过Scatchard分析的数据可以说明,MMIP存在不同的结合位点,在对CAP的吸附过程中具有非均一性。可能是由于不同结合位点,功能单体与模板分子结合的比例不同,从而造成等温吸附过程中存在不同的热力学现象。在合成MNIP时,由于没有加入模板分子,使得其对模板分子的亲和力很低,也不存在不同的吸附位点,吸附过程为非特异性,通过比较其与MMIP的解离常数进一步证明了MMIP为特异性吸附。 2.2.3 选择性研究 图5 MMIP和MNIP等温吸附曲线(A),以及MMIP(B)和MNIP(C)的Scatchard曲线Fig.5 Isothermal adsorption curves of MMIP and MNIP(A) and Scatchard plots of binding of methomyl onto MMIP(B) and MNIP(C) 选择TAP和FF作为CAP的类似物来研究MMIP。图6为MMIP和MNIP对浓度均为40mg·L-1的CAP和干扰物的吸附容量,计算印迹因子α和分离因子β: α=QMMIP/QMNIP; (2) β=Q模板分子/Q干扰物分子。 (3) 式(2)、(3)中:α为印迹因子;QMMIP和QMNIP分别是MMIP和MNIP对模板分子的吸附容量;β为分离因子;Q模板分子与Q干扰物分子分别是MMIP对模板分子和干扰物分子的吸附容量。 计算可得,当浓度为40mg·L-1时,βCAP/FF=2.84,βCAP/TAP=4.08,α=4.61,表明MMIP表面有大量与CAP相匹配的印迹位点,即使是结构相类似的TAP和FF也很难被识别,进一步表明MMIP具有特异性吸附CAP的能力,能够在检测中排除干扰。 2.3.1 标准曲线的制作 按照1.3.1节的色谱条件对不同浓度的CAP标准液进行测定,以浓度为自变量(x)、峰面积为因变量(y)作图。回归方程为y=16.679x+0.508 5,R2=0.999 6,标准曲线线性良好。 图6 MMIP和MNIP的选择性吸附Fig.6 Selective adsorption of MMIP and MNIP 图7 CAP标准曲线Fig.7 Standard curve of CAP 2.3.2 回收率 将MMIP作为样品前处理吸附材料对猪肉和蜂蜜进行检测。由表1可知,其回收率分别为86.30%~91.39%和87.13% ~94.21%,相对标准偏差(relative standard deviation,RSD)分别为0.38%~1.75%和0.97%~1.73%。表明本方法回收率较为理想,为将MMIP运用于实际样品的检测提供了基础。 2.3.3 精密度 将MMIP作为样品前处理吸附材料对猪肉和蜂蜜进行精密度试验,每种样品的每个加标水平平行进样10次。从表2可以看出,每种样品的每个加标水平的RSD均低于2%,表明方法精密度较好,在对试剂样品检测中具有较高的可靠性,重现性较高。 2.3.4 稳定性 稳定性是衡量一个方法是否能用于对实际样品检测的另一个重要指标。在稳定性试验中,日内间隔6h,日间间隔24h。表3表明,MMIP作为固相萃取剂的方法,日内RSD基本小于1.1%,日间RSD不超过1.87%。表明方法具有良好的稳定性,在实际检测中不会因时间的变化而对检测结果产生较大影响。 表1 MMIP回收率试验 表2 MMIP精密度试验 表3 MMIP稳定性试验 2.3.5 检测限 对不同加标水平的样品进行检测,以3倍信噪比信号衡量方法的检测限。结果表明,在取样量为10 g的情况下,以MMIP作为固相萃取剂的方法对猪肉和蜂蜜中CAP的检测限均为3.0μg·kg-1。与传统的CAP分子印迹作为固相萃取剂的检测方法相比具有更低的检测限[21,32-33]。图8为猪肉和蜂蜜的加标样品色谱图。 A,蜂蜜加标样品;B,猪肉加标样品。A,Standard sample of honey;B,Standard sample of pork.图8 加标样品色谱图Fig.8 Chromatogram of spiked samples 本试验采用正硅酸乙酯和KH570两步修饰的方法在磁性纳米粒子表面合成分子印迹壳层,合成过程较为简单。利用磁性分离,使模板分子的洗脱和萃取过程变得简单快速方便。由于合成的粒子具有较大的比表面积,因而具有较大的吸附容量,且印迹位点位于粒子表面。吸附试验表明,MMIP的最大表观吸附容量达到29.18mg·g-1,在60min时达到吸附平衡,达到吸附平衡时间较短,且具有较高的选择性。将合成的MMIP作为固相萃取剂应用于对实际样品的检测,方法学试验表明,以MMIP作为固相萃取剂的检测方法具有良好的回收率、精密度、稳定性和较低的检测限,说明其具有较高的可靠性,重现性良好。和大多数CAP分子印迹材料相比,CAP的磁性分子印迹具有吸附容量大、吸附速度快、在磁场作用下易于分离、检测限较低等优势,并且重现性更好。基于上述研究工作,MMIP作为一种新型的固相萃取材料,可以应用于食品中痕量CAP残留的检测,并具有传统固相萃取材料所不具备的优势:高选择性,易分离,吸附容量大,重现性好。 : [1] SARMAH A K,MEYER M T,BOXALL A B.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs) in the environment[J].Chemosphere,2006,65(5):725-759. [2] 李桂伟,花丽茹.禁用兽药—氯霉素[J].黑龙江水产,2015(3):23-25. LI G W,HUA L R.Prohibition of veterinary drug-chloramphenicol[J].HeilongjiangFisheries,2015(3):23-25.(in Chinese) [3] CHEN H X,CHEN H,YING J,et al.Dispersive liquid-liquid microextraction followed by high-performance liquid chromatography as an efficient and sensitive technique for simultaneous determination of chloramphenicol and thiamphenicol in honey[J].AnalyticaChimicaActa,2009,632(1):80-85. [4] PARK I S,KIM N.Development of a chemiluminescent immunosensor for chloramphenicol[J].AnalyticaChimicaActa,2006,578(1):19-24. [5] 汤尚文,胡中山,江远致,等.氯霉素分子印迹聚合物的合成及应用[J].现代农业科技,2015(22):284-285. TANG S W,HU Z S,JIANG Y Z,et al.Synthesis of chloramphenicol molecularly imprinted polymer and its analytical application[J].ModernAgriculturalSciencesandTechnology,2015(22):284-285.(in Chinese with English abstract) [6] 李秀萍,尉新华,孙艳霞.浅谈氯霉素的危害及控制[J].中国动物检疫,2003(5):18. LI X P,WEI X H,SUN Y X,at al.Discussion on the harm and control of chloramphenicol[J].ChineseJournalofAnimalQuarantine,2003(5):18.(in Chinese) [7] 陈雅琼.分子印迹-碳纳米管电极的制备及其对氯霉素的选择性检测[D].大连:大连理工大学,2012. CHEN Y Q.Preparation of molecularly imprinting-carbon nanotubes electrode and its selective determination of chloramphenicol[D].Dalian:Dalian University of Technology,2012.(in Chinese with English abstract) [8] ALLEN E H.Review of chromatographic methods for chloramphenicol residues in milk,eggs,and tissues from food-producing animals[J].Journal-AssociationofOfficialAnalyticalChemists,1985,68(5):990. [9] 卢颖.氯霉素在动物体内残留情况及研究进展[J].中国畜牧兽医文摘,2014,30(6):207. LU Y.Residue and research progress of chloramphenicol in animals[J].ChineseAbstractsofAnimalHusbandryandVeterinaryMedicine,2014,30(6):207.(in Chinese) [10] 闫宏远,杨更亮.分子印迹固相萃取技术在动物源食品中药物残留检测中的应用进展[J].色谱,2011,29(7):572-579. YAN H Y,YANG G L.Application of molecularly imprinted solid-phase extraction on drug residues in animal source foods[J].ChineseJournalofChromatography,2011,29(7):572-579.(in Chinese with English abstract) [11] ANDAÇ M,GALAEV I Y,DENIZLI A.Affinity based and molecularly imprinted cryogels:applications in biomacromolecule purification[J].JournalofChromatographyB,2016,1021:69-80. [12] ANSARI S,KARIMI M.Novel developments and trends of analytical methods for drug analysis in biological and environmental samples by molecularly imprinted polymers[J].TrACTrendsinAnalyticalChemistry,2017,89:146-162. [13] 贺敏强.表面分子印迹微/纳米复合材料的制备及其性能研究[D].镇江:江苏大学,2012. HE M Q.Synthesis and evaluation of surface molecular imprinted micro-nano composite materials[D].Zhenjiang:Jiangsu University,2012.(in Chinese with English abstract) [14] 苏晓濛,刘敏,李小燕,等.食品中核-壳型罗丹明6G磁性分子印迹固相萃取材料的制备及应用[J].食品科学,2014,35(24):9-14. SU X M,LIU M,LI X Y,et al.Preparation and adsorption performance of core-shell magnetic molecularly imprinted polymer microspheres for solid phase extraction and detection of rhodamine 6G in foods[J].FoodScience,2014,35(24):9-14.(in Chinese with English abstract) [15] 姚婷,李腾飞,秦玉昌,等.分子印迹表面等离子共振传感器在食品安全检测中的最新研究进展[J].分析测试学报,2015,34(2):237-244. YAO T,LI T F,QIN Y C,et al.Recent advances in application of surface plasmon resonance sensors based on molecular imprinted polymers in food safety detection[J].JournalofInstrumentalAnalysis,2015,34(2):237-244.(in Chinese with English abstract) [16] 韩霜.分子印迹技术及其研究进展[D].大庆:东北石油大学,2014. HAN S.Molecule imprinting technology and its research progress[D].Daqing:Northeast Petroleum University,2014.(in Chinese with English abstract) [17] 张腊梅,李道敏,李兆周,等.用于食品药品分析检测的新型分子印迹聚合物的研究进展[J].食品科学,2014,35(15):314-320. ZHANG L M,LI D M,LI Z Z,et al.Recent advances in the application of innovative molecularly imprinted polymers in the analysis of foods and drugs[J].FoodScience,2014,35(15):314-320.(in Chinese with English abstract) [18] 朱丽丽.基于磁性分子印迹纳米粒子的电化学传感器的制备及应用[D].无锡:江南大学,2014. ZHU L L.Preparation and application of the electrochemical sensor based on magnetic molecularly imprinted nanoparticles[D].Wuxi:Jiangnan University,2014.(in Chinese with English abstract) [19] 张曦雯,李兆周,李道敏,等.磁性分子印迹聚合物的制备与应用研究[J].化工进展,2016,35(12):3964-3969. ZHANG X W,LI Z Z,LI D M,et al.Preparation and application of magnetic molecularly imprinted polymer[J].ChemicalIndustryandEngineeringProgress,2016,35(12):3964-3969.(in Chinese with English abstract) [20] 丛姣姣,罗静,高雅涵,等.表面分子印迹研究进展[J].高分子通报,2015(5):10-20. CONG J J,LUO J,GAO Y H,et al.Research progress of surface molecular imprinting technique[J].ChinesePolymerBulletin,2015(5):10-20.(in Chinese with English abstract) [21] 陈海燕,丁兰,刘密兰.微波辅助合成分子印迹聚合物用于萃取蜂蜜中的氯霉素[J].高等学校化学学报,2015,36(1):67-73. CHEN H Y,DING L,LIU M L.Preparation of molecularly imprinted polymers by microwave-assisted polymerization for the extraction of chloramphenicol from honey[J].ChemicalJournalofChineseUniversities,2015,36(1):67-73. [22] 王小玉,孙复钱,曾国屏,等.基于离子液体辅助氯霉素分子印迹聚合物的制备及应用[J].分析测试学报,2017,36(1):18-24. WANG X Y,SUN F Q,ZENG G P,et al.Preparation and application of molecularly imprinted polymers for chloramphenicol based on ionic liquids assistance[J].JournalofInstrumentalAnalysis,2017,36(1):18-24. [23] CHEN L,LI B.Magnetic molecularly imprinted polymer extraction of chloramphenicol from honey[J].FoodChemistry,2013,141(1):23-38. [24] BELTRAN A,BORRULL F,MARCÉ R M,et al.Molecularly-imprinted polymers:useful sorbents for selective extractions[J].TrACTrendinAnalyticalChemistry,2010,29(11):1363-1375. [25] TURIEL E,TADEO J L,MARTIN-ESTEBAN A.Molecularly imprinted polymeric fibers for solid-phase microextraction[J].AnalyticalChemistry,2007,79(8):3099-3104. [26] QIN S,SU L,WANG P,et al.Mixed templates molecularly imprinted solid-phase extraction for the detection of sulfonamides in fish farming water[J].JournalofAppliedPolymerScience,2015,132(8):41491. [27] 陈少芸,严成钊,柴平海,等.食品中氯霉素残留检测方法应用的探索:高效液相色谱法[J].食品工业,2004(2):35-37. CHEN S Y,YAN C Z,CHAI P H,et al.Application of detection methods for chloramphenicol residues in food:high performance liquid chromatography[J].TheFoodIndustry,2004(2):35-37.(in Chinese with English abstract) [28] 陶昕晨,黄和,李志清,等.水产品中氯霉素、甲砜霉素和氟苯尼考的HPLC-UVD法测定[J].食品工业科技,2012,33(20):80-83. TAO X C,HUANG H,LI Z Q,et al.Determination of residues of chloramphenicol,thiamphnicol and florfenicol in fishery products by HPLC-UVD[J].ScienceandTechnologyofFoodIndustry,2012,33(20):80-83.(in Chinese with English abstract) [29] 中华人民共和国商务部.畜禽肉中氯霉素的测定:SB/T 10386—2004 [S].北京:中国标准出版社,2004. [30] 中华人民共和国国家质量监督检验检疫总局.蜂蜜中氯霉素残留量的测定方法 液相色谱-串联质谱法:GB/T 18932.19—2003[S].北京:中国标准出版社:2003. [31] 胡凯弟,朱佳雯,王兴洁,等.HPLC-UV法检测微生物降解体系中西维因含量[J].食品与发酵工业,2016,42(11):192-198. HU K D,ZHU J W,WANG X J,et al.Determination of carbaryl in microbial degradation systems by HPLC-UV[J].FoodandFermentationIndustries,2016,42(11):192-198.(in Chinese with English abstract) [32] 张杰,许家胜,刘连利.高效液相色谱法测定牛奶中的氯霉素残留[J].化学研究与应用,2013,25(4):593-595. ZHANG J,XU J S,LIU L L.Determination of chloramphenicol in milk by liquid chromatography[J].ChemicalResearchandApplication,2013,25(4):593-595.(in Chinese with English abstract) [33] 黄志勇,李森,孙茂营,等.养殖水产品中氯霉素残留量的高效液相色谱测定方法[J].食品科学,2005,26(5):191-194. HUANG Z Y,LI S,SUN M Y,et al.Determination of chloramphenicol residues in aquiculture products by HPLC[J].FoodScience,2005,26(5):191-194.(in Chinese with English abstract) Preparationofmagneticmolecularlyimprintedpolymeranddetectionofchloramphenicolinfoods LI Zengwei,WANGNa,LEI Chan,ZENG Yue,FU Zhenzhen,HE Li,LIU Shuliang,ZHOU Kang,AO Xiaolin,CHEN Shujuan* (CollegeofFoodScience,SichuanAgriculturalUniversity,Ya’an625014,China) Abstract:In the present study,magnetic separation method was combined with surface molecular imprinting.The magnetic molecularly imprinted polymer(MMIP) for chloramphenicol(CAP) was prepared by suspension polymerization method based on modified Fe3O4nanoparticles as support material,CAP as template molecule,methacrylic acid(MAA) as functional monomer,ethylene glycol dimethacrylate(EGDMA) as corss-linker and azobisisobutyronitrile(AIBN) as initiator.Meanwhile,the magnetic molecularly non-imprinted polymer(MNIP) was prepared accordingly with the absent of CAP.Each step of the products were characterized by Fourier transform infrared spectrometer,microscopic morphology of MMIP and MNIP were observed by scanning electron microscopy,and the saturation magnetic strength of magnetic nanoparticles and MMIP were detected by vibrating sample magnetometer.The adsorption capacity of MMIP and MNIP were studied by binding experiments.Methodology evaluation was performed for detecting chloramphenicol in foods by using MMIP as solid phase extractant.The obtained MMIPs were 400-700 nm in diameter and had good monodispersity.It could be rapidly separated under an applied magnetic field.The MMIP had high maximum apparent adsorption capacity which was up to 29.18mg·g-1and good selectivity.It had high recovery(86.30%-94.21%),high precision(RSD≤1.53%),good stability(RSD≤1.87%) and low detection limit(3.0μg·kg-1),when MMIP was used as solid phase extractant.Thus,the MMIP could be used to detect the chloramphenicol residue in food. Key words:chloramphenicol;magnetic separation;surface imprinting;solid phase extraction;high performance liquid chromatography 中图分类号:O657.72 A 文章编号:1004-1524(2018)06-1063-10 收稿日期:2018-02-17 基金项目:四川省大学生创新训练计划(201610626052);四川省教育厅项目(15ZB0018) 作者简介:李增威(1996—),男,浙江嘉兴人,食品检测方向本科生。E-mail:981687757@qq.com ,陈姝娟,E-mail:chenshujuan1@163.com 10.3969/j.issn.1004-1524.2018.06.25 (责任编辑张瑞麟)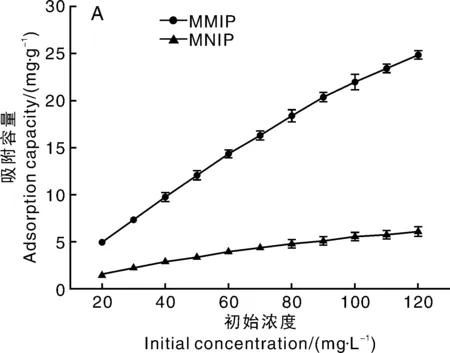

2.3 方法学考查
3 结论
