黄淮白山羊肠道黏膜组织结构及杯状细胞分布特点
2018-06-28周金星钱兆全靳二辉刘文举金光明
周金星,钱兆全,靳二辉,刘文举,金光明,*
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2.安徽科技学院 细胞与分子生物学研究中心,安徽 凤阳 233100)
黄淮白山羊肠道黏膜组织结构及杯状细胞分布特点
周金星1,2,钱兆全1,靳二辉1,刘文举2,金光明1,*
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2.安徽科技学院 细胞与分子生物学研究中心,安徽 凤阳 233100)
摘 要:为探明黄淮白山羊肠道黏膜组织结构和杯状细胞分布特点,取成年健康黄淮白山羊3头,经麻醉后颈静脉放血致死,立即取小肠和大肠各3段,投入到4%多聚甲醛固定液中固定72h,制作组织切片,经HE和PAS染色后,观察黄淮白山羊小肠和大肠黏膜组织结构和杯状细胞分布特点。结果表明,黄淮白山羊十二指肠和空肠的上皮细胞呈高柱状,固有层分布有较多的淋巴细胞,回肠黏膜的上皮细胞呈低柱状,黏膜下层中含大量的集合淋巴小结,盲肠、结肠和直肠的上皮细胞呈低柱状,大肠腺发达,腺体间弥散着淋巴细胞,直肠的固有层中可见淋巴小结,上皮之间的杯状细胞呈顶浆分泌的形式分泌黏多糖。黄淮白山羊小肠杯状细胞分泌的黏多糖以中性为主,大肠杯状细胞分泌的黏多糖以酸性为主。大肠三段杯状细胞数量极显著(P<0.01)高于小肠杯状细胞,大肠中结肠杯状细胞数量显著(P<0.05)高于盲肠和直肠,小肠中回肠杯状细胞数量显著(P<0.05)高于十二指肠和空肠。因此,黄淮白山羊从十二指肠到回肠,上皮细胞由高柱状逐渐向低柱状变化,杯状细胞主要分布于大肠,在结肠中数量最多。
关键词:杯状细胞;组织结构;小肠;大肠;黄淮白山羊
肠道作为营养物质消化和吸收、黏膜免疫的主要场所,其功能的执行者是肠道黏膜上皮细胞。黏膜上皮细胞主要有4种类型:单层柱状上皮细胞、杯状细胞、内分泌细胞和潘氏细胞。其中,杯状细胞在肠上皮发育早期出现,分为数量较少的低黏液杯状细胞和成熟杯状细胞[1],主要功能是分泌黏蛋白及生物活性因子,如三叶肽、抵抗素样分子β及Fc-γ结合蛋白等,共同形成肠道黏液凝胶,对动物肠道黏膜起重要的保护作用[2],并可修复肠黏膜上皮[3]。近年来,许多学者对不同动物肠的黏膜组织结构特点和杯状细胞进行研究,如陈付菊等[4]研究了新生犊牛小肠黏膜结构及淋巴细胞和杯状细胞的数量变化;田波等[5]研究了牦牛大肠组织结构及黏膜免疫相关细胞的分布;马兰等[6]观察了不同海拔藏绵羊小肠上皮内杯状细胞的数量。也有学者就添加剂、细菌、多糖和药物对动物肠道黏膜组织结构及杯状细胞的影响进行研究,如刘小龙等[7]研究了天蚕素和合生素对肉鸡小肠黏膜形态的影响;唐秀莹等[8]研究了大豆异黄酮对大鼠肠道上皮相关细胞的影响;张美曦等[9]研究了双歧杆菌对雏鸡肠道杯状细胞的影响;邢亚丽等[10]研究了树舌发酵浸膏多糖对肉鸡黏膜组织结构影响;闫晓刚等[11]研究了人参茎叶多糖对雏鸡小肠黏膜组织的影响;曹贵彬等[12]研究了陈皮苷制剂对爱拨益加肉鸡小肠黏膜形态结构的影响。
黄淮白山羊是安徽省优良的地方品种,目前对黄淮白山羊的基础研究主要包括黄淮白山羊的皮肤组织结构特点[13]、蹄的解剖及组织结构特点[14]、心肌组织结构特点[15]、瘤胃功能[16-17]、孤雌胚胎体外培养[18]和血清学调查[19]等,但关于黄淮白山羊肠黏膜的组织结构特点及杯状细胞的分布特征却未见报道。为此,我们开展了这方面的研究。现报道如下。
1 材料与方法
1.1 实验动物及取材
选用健康成年黄淮白山羊3头,雌雄不限,经麻醉后颈静脉放血致死,立即剖腹,按解剖部位分别取小肠(十二指肠、空肠和回肠)和大肠(结肠、盲肠和直肠)各3段,每段各长约1cm,立即投入4%(质量分数)的多聚甲醛磷酸盐缓冲液中,固定72h后备用。
1.2 主要仪器设备
CUT 5062半自动轮转切片机,德国SLEE公司;Acio Imager A2蔡司光学显微镜+显微摄影系统,德国蔡司公司;MNT冷热台包埋机,德国SLEE公司。
1.3 石蜡组织切片制作及染色
将固定好的小肠和大肠各段的组织样品,修成大小为0.5cm的肠段,经流水冲洗24h后,梯度酒精脱水、二甲苯透明、浸蜡、包埋,经轮转切片机切成5μm的连续切片,经水浴锅展片、捞片和烤片后,通过HE和PAS染色,分别观察黄淮白山羊小肠和大肠黏膜的基本组织结构和杯状细胞分布特征,蔡司光学显微镜摄影。
1.4 图像及数据分析
在100倍放大倍数下,随机选择黄淮白山羊小肠和大肠3段的10张组织切片,每张切片随机选择10个视野,利用Image-Pro Plus 6.0图像分析软件统计杯状细胞数量,所得数据在SPSS 20.0平台上进行单因素方差分析。
2 结果与分析
2.1 黄淮白山羊小肠黏膜基本组织结构特点
由图1可见,黄淮白山羊小肠黏膜可分为3层,分别为上皮、固有层和黏膜肌。黄淮白山羊十二指肠绒毛呈叶片状,空肠绒毛呈指状、排列紧密,上皮细胞都呈典型的长柱状,黏膜的固有层中含有较多的淋巴细胞,空肠的杯状细胞较十二指肠多。黄淮白山羊回肠绒毛呈指状,上皮细胞由高柱状变为低柱状,之间夹杂有较多的杯状细胞。固有层含有较多的淋巴细胞,小肠腺较空肠和十二指肠变少,黏膜下层含有典型的集合淋巴小结。
2.2 黄淮白山羊大肠黏膜基本组织结构特点
由图2可见,黄淮白山羊盲肠的上皮细胞形态变为低柱状,固有层中含有发达的大肠腺,腺体中充满杯状细胞,在大肠腺之间含有较多的淋巴细胞。黄淮白山羊结肠黏膜上存在上皮细胞,但细胞形态呈低柱状,大肠腺发达,腺体中含大量的杯状细胞,淋巴细胞数量较盲肠减少。直肠的黏膜固有层中大肠腺较盲肠和结肠减少,固有层中含有较多的淋巴细胞,并可见典型的淋巴小结,上皮细胞呈低柱状,杯状细胞顶部可见分泌黏原颗粒,呈现顶浆分泌的特性(如图2-F方框所示)。
2.3 黄淮白山羊小肠黏膜杯状细胞分布特征
黄淮白山羊小肠杯状细胞主要分布于黏膜上皮细胞和小肠腺上皮细胞之间(图3),回肠黏膜中杯状细胞分布较十二指肠和空肠多,且黏膜上皮细胞之间的杯状细胞明显多于十二指肠和空肠,十二指肠和空肠的杯状细胞通过PAS染色后紫色和蓝色共存,说明其杯状细胞分泌的黏多糖属于中性和酸性,且2种性质黏多糖的杯状细胞数量相当,但黄淮白山羊回肠黏膜中杯状细胞呈现较多的紫色,说明其分泌的黏多糖属于中性,且分泌中性黏多糖的杯状细胞显著多于分泌酸性黏多糖的杯状细胞。
2.4 黄淮白山羊大肠黏膜杯状细胞分布特征
黄淮白山羊大肠黏膜杯状细胞主要分布于大肠腺中(图4),由于结肠的大肠腺最发达,因此,其杯状细胞的数量也多于盲肠和直肠。盲肠的杯状细胞经PAS染色后大部分是蓝色少部分呈紫色,说明其分泌的黏多糖呈中性和酸性混合型,但结肠和直肠的大肠腺中杯状细胞经PAS染色后呈蓝色,说明其分泌的黏多糖呈酸性。直肠黏膜上皮处杯状细胞顶部可见分泌黏原颗粒,呈现顶浆分泌的特性(如图4-F方框所示)。
2.5 黄淮白山羊肠黏膜杯状细胞分布特点
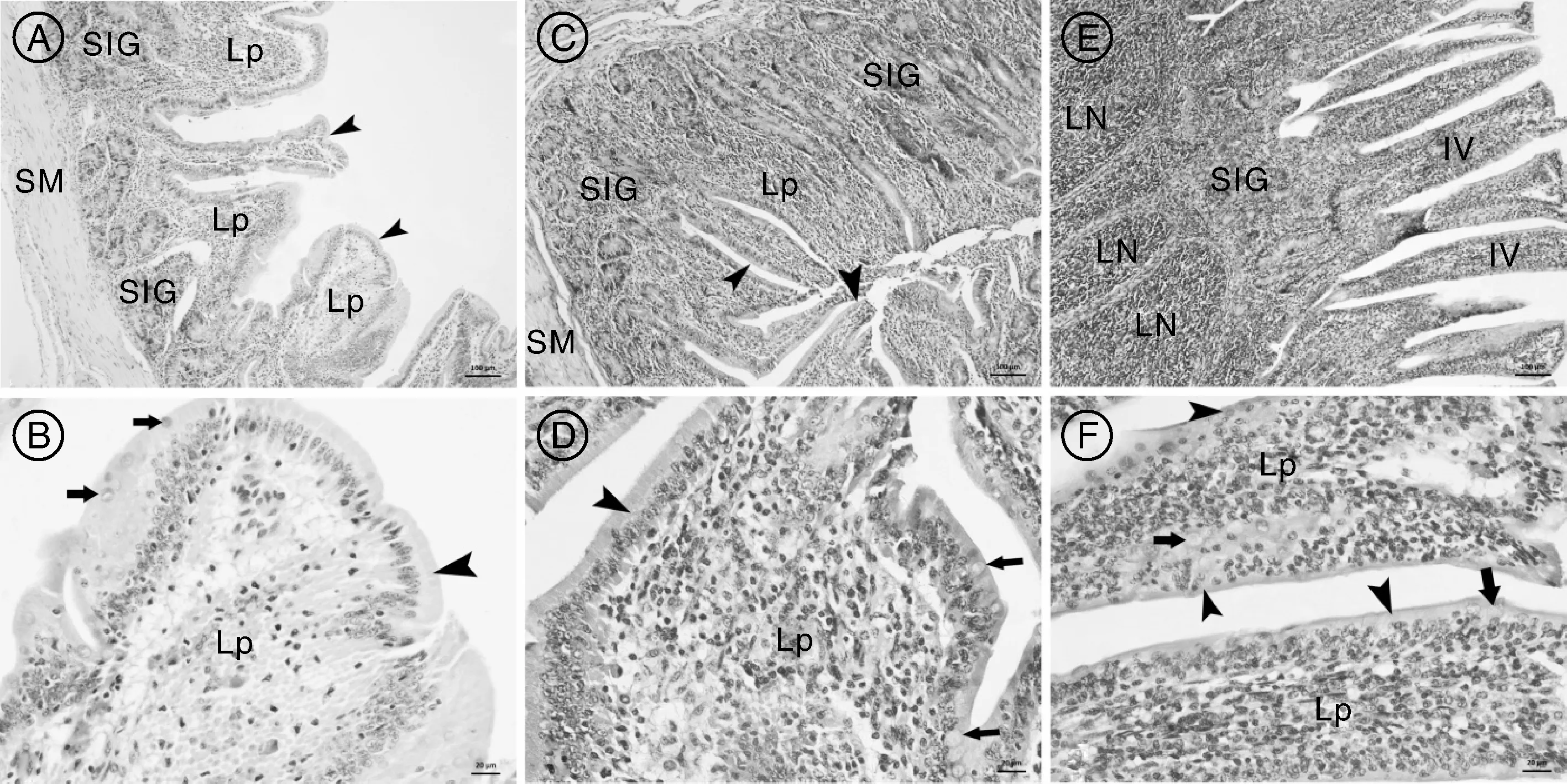
HE染色,A、C、E标尺示100μm;B、D、F标尺示20μm。A、B,十二指肠基本组织结构;C、D,空肠基本组织结构;E、F,回肠基本组织结构。SIG,小肠腺;Lp,固有层;SM,平滑肌;LN,淋巴小结;IV,肠绒毛。无柄箭头示上皮细胞,有柄箭头示杯状细胞。HE dyeing.Bars indicated100μm in A,C,E,and 20μm in B,D,F.A,B,Tissue structure of duodenum;C,D,Tissue structure of jejunum;E,F,Tissue structure of ileum.SIG,Small intestinal gland;Lp,Lamina propria;SM:Smooth muscle;LN,Lymphoid nodule;IV,Intestinal villus.Sessile arrowheads indicated epithelium cells;arrows indicated goblet cells.图1 黄淮白山羊十二指肠、空肠和回肠基本组织结构Fig.1 Tissue structure characteristics of duodenum,jejunum and ileum of Huanghuai white goat
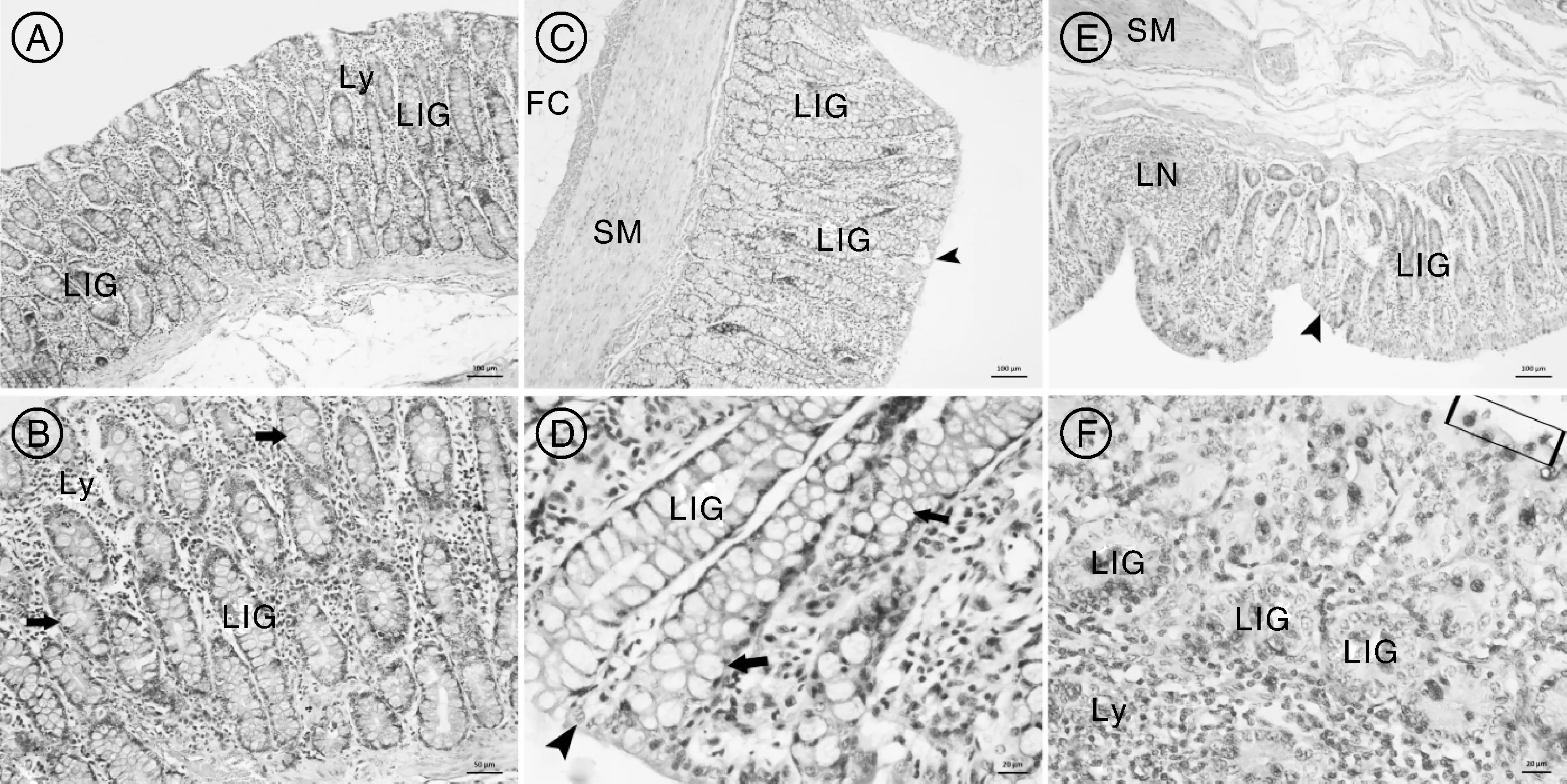
HE染色。A、C、E标尺示100μm;B、D、F标尺示20μm。A、B,盲肠基本组织结构;C、D,结肠基本组织结构;E、F,直肠基本组织结构。LIG,大肠腺;Ly,淋巴细胞;SM,平滑肌;LN,淋巴小结;FC,脂肪细胞。无柄箭头示上皮细胞;有柄箭头示杯状细胞。HE dyeing.Bars indicated100μm in A,C,E,and 20μm in B,D,F.A,B,Tissue structure of cecum;C,D,Tissue structure of colon;E,F,Tissue structure of rectum.LIG,Large intestinal gland;Ly,Lymphocyte;SM,Smooth muscle;LN,Lymphoid nodule;FC,Fat cells.Sessile arrowheads indicated epithelium cells;arrows indicated goblet cells图2 黄淮白山羊盲肠、结肠和直肠基本组织结构Fig.2 Tissue structure characteristics of cecum,colon and rectum of Huanghuai white goat
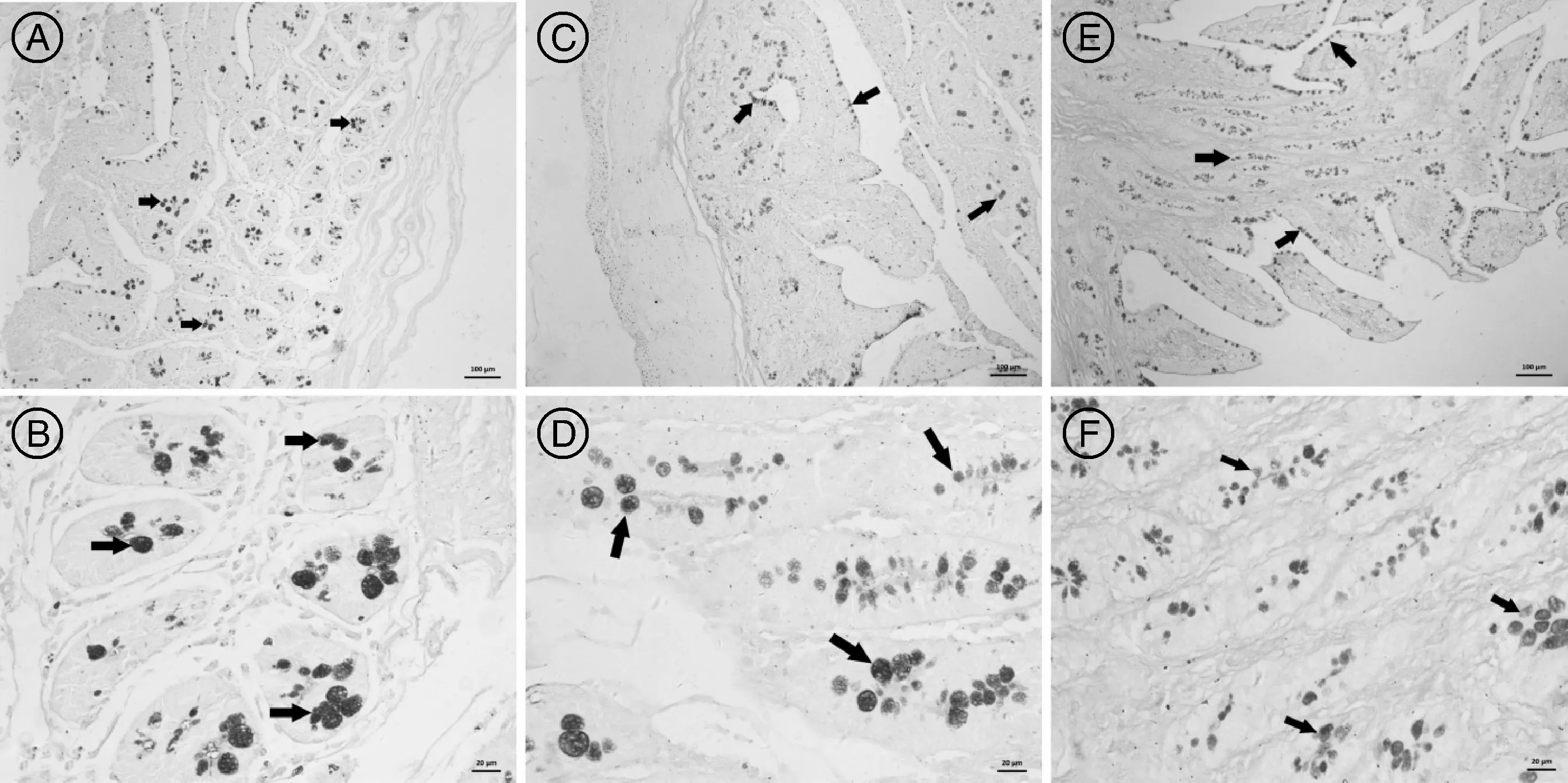
PAS染色。A、C、E标尺示100μm;B、D、F标尺示20μm。A、B,十二指肠黏膜杯状细胞和黏液特性;C、D,空肠黏膜杯状细胞和黏液特性;图E、F,回肠黏膜杯状细胞和黏液特性。有柄箭头示杯状细胞。PAS dyeing.Bars indicated100μm in A,C,E,and 20μm in B,D,F.A,B,Goblet cell distribution and slime feature of duodenum;C,D,Goblet cell distribution and slime feature of jejunum;E,F,Goblet cell distribution and slime feature of ileum.Arrows indicated goblet cells.图3 黄淮白山羊十二指肠、空肠和回肠黏膜杯状细胞及黏液特性Fig.3 Goblet cell distribution and slime feature of duodenum,jejunum and ileum of Huanghuai white goat
通过PAS染色观察,在黄淮白山羊小肠段,杯状细胞分泌的黏多糖以中性为主,酸性为辅,但到大肠段,杯状细胞分泌的黏多糖以酸性为主,中性为辅。经Image-Pro Plus 6.0图像分析软件对小肠3段和大肠3段组织切片中每100个细胞中杯状细胞所占的比例进行统计分析(图5),盲肠、结肠和直肠中杯状细胞的数量极显著(P<0.01)多于十二指肠、空肠和回肠。大肠三段中,结肠的杯状细胞数量最多,直肠的杯状细胞数量最少、但与盲肠差异不显著。小肠三段中,回肠段杯状细胞的数量显著高于十二指肠和空肠(P<0.05),但十二指肠和空肠之间差异不显著(P>0.05)。
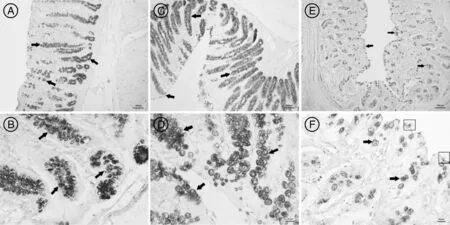
PAS染色。A、C、E标尺示100μm;B、D、F标尺示20μm。A、B,盲肠黏膜杯状细胞和黏液特性;C、D,结肠黏膜杯状细胞和黏液特性;E、F,直肠黏膜杯状细胞和黏液特性。有柄箭头示杯状细胞。PAS dyeing.Bars indicated100μm in A,C,E,and 20μm in B,D,F.A,B,Goblet cell distribution and slime feature of cecum;C,D,Goblet cell distribution and slime feature of colon;E,F,Goblet cell distribution and slime feature of rectum.Arrows indicated goblet cells图4 黄淮白山羊盲肠、结肠和直肠黏膜杯状细胞及黏液特性Fig.4 Goblet cell distribution and slime feature of cecum,colon and rectum of Huanghuai white goat
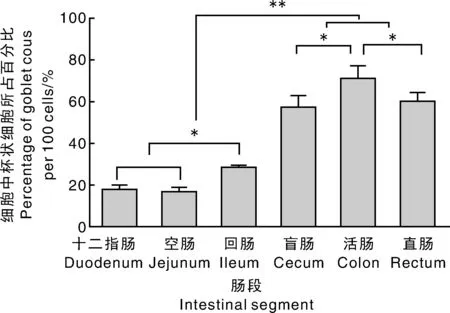
*,P<0.05;**,P<0.01。图5 黄淮白山羊各肠段杯状细胞分布数量比较Fig.5 Comparison of goblet cell quantity in different intestinal segments of Huanghuai white goat
3 讨论
3.1 黄淮白山羊肠黏膜基本组织结构
机体营养物质的吸收主要由小肠黏膜的上皮细胞完成,上皮细胞结构的完整性和小肠绒毛高度、绒毛宽度和隐窝深度等指标密切相关,这些指标都是反映肠营养物质吸收能力的重要功能指标[5,12,20]。闫金坤等[21]研究表明,肠上皮细胞完整性如受到破坏,可导致黏膜机械屏障受损,影响上皮细胞的吸收功能。肠道基本组织结构主要包括黏膜层、黏膜下层、肌层和外膜层。黏膜层主要由上皮细胞组成。本研究结果表明,黄淮白山羊小肠上皮细胞逐渐由单层高柱状上皮细胞向大肠单层低柱状上皮细胞转变,直至直肠段柱状上皮细胞消失。这种组织结构特点表明,黄淮白山羊营养物质的吸收功能从小肠向大肠逐渐减弱,至直肠段营养物质的吸收功能几乎消失。肠道黏膜免疫为动物机体重要的免疫屏障系统,细胞免疫的重要参与者之一为淋巴细胞,肠道黏膜中的淋巴细胞主要包括T淋巴细胞和NK细胞,参与重要的细胞免疫[8,22]。本研究结果表明,黄淮白山羊小肠三段黏膜固有层中弥散的淋巴细胞较多,特别是回肠段,黏膜下层可见大量的集合淋巴小结,大肠的盲肠固有层中弥散的淋巴细胞较多,但结肠淋巴细胞较少,直肠段弥散的淋巴细胞较少,但可见独立存在的淋巴小结,说明黄淮白山羊十二指肠、空肠、回肠、盲肠行使细胞免疫能力强于结肠和直肠,小肠是T淋巴细胞免疫功能执行的主要肠段。
3.2 黄淮白山羊肠黏膜杯状细胞分布
肠杯状细胞是散分布于肠黏膜上皮中的黏液分泌细胞,其主要功能是分泌黏液、参与肠道黏膜免疫和参与肠损伤表面重建,在肠道的固有屏障中发挥重要作用[23]。田波等[5]研究结果表明,牦牛直肠段杯状细胞数量最多,盲肠最少,且差异极显著,但结肠和直肠差异不显著。新生犊牛小肠杯状细胞数量从十二指肠向回肠呈增多趋势[4]。马兰等[6]研究了高海拔藏绵羊小肠杯状细胞,结果表明其数量极显著高于低海拔藏绵羊。本研究结果表明,黄淮白山羊大肠的杯状细胞极显著多于小肠,大肠的结肠杯状细胞数量最多,显著高于盲肠和直肠,但盲肠和直肠的杯状细胞数量差异不显著,其结果不同于牦牛杯状细胞在大肠分布规律[5]。杯状细胞分泌的黏蛋白对肠黏膜具有重要的保护作用,是构成肠道机械屏障的重要结构之一,黄淮白山羊小肠的杯状细胞数量少,大肠的杯状细胞数量极显著多于小肠,说明其在大肠分泌的黏蛋白也会相应增加,特别是在结肠,杯状细胞分泌的黏蛋白会被覆于结肠黏膜表面,对肠黏膜具有重要的保护作用,而且更利于粪便的排出。
:
[1] 朱继开,钟煜,王璐璇,等.肠道杯状细胞与黏蛋白的研究进展[J].继续医学教育,2017,31(7):139-140.
ZHU J K,ZHONG Y,WANG L X,et al.Research progress of intestinal goblet cells and mucin[J].ContinuingMedicalEducation,2017,31(7):139-140.(in Chinese with English abstract)
[2] 李冰,于岩波.肠黏液屏障在肠道中的作用[J].世界华人消化杂志,2017,25(19):1764-1771.
LI B,YU Y B.Role of mucus barrier in the gut[J].WorldChineseJournalofDigestology,2017,25(19):1764-1771.(in Chinese with English abstract)
[3] LUU Y,JUNKER W,RACHAGANI S,et al.Human intestinal MUC17 mucin augments intestinal cell restitution and enhances healing of experimental colitis[J].InternationalJournalofBiochemistry&CellBiology,2010,42(6):996-1006.
[4] 陈付菊,陈耀星,王子旭,等.新生犊牛小肠黏膜结构的早期发育及上皮内淋巴细胞和杯状细胞的数量变化[J].中国兽医科学,2007,37(6):519-523.
CHEN F J,CHEN Y X,WANG Z X,et al.Early development of mucosal structure and quantitative changes of intraepithelial lymphocyte and goblet cell in the small intestine of neonatal calf[J].VeterinaryScienceinChina,2007,37(6):519-523.(in Chinese with English abstract)
[5] 田波,李栋,方梅,等.牦牛大肠组织结构及黏膜免疫相关细胞的分布[J].中国兽医学报,2014,34(12):1989-1995.
TIAN B,LI D,FANG M,et al.Observation on the distribution of mucosal immunity-associated cells and micro-structure of yak large intestine[J].ChineseJournalofVeterinaryScience,2014,34(12):1989-1995.(in Chinese with English abstract)
[6] 马兰,常兰.不同海拔藏绵羊小肠上皮内淋巴细胞、杯状细胞的数量和分布比较及其意义[J].青海医学院学报,2012,33(2):99-102.
MA L,CHANG L.Comparative study and significance discussion of quantity and distribution on small intestine intraepithelial lymphocytes and goblet cells between Tibetan sheep at different elevation regions[J].JournalofQinghaiMedicalCollege,2012,33(2):99-102.(in Chinese with English abstract)
[7] 刘小龙,范寰,陈龙宾,等.天蚕素和合生素对AA肉鸡小肠黏膜形态和小肠免疫细胞的影响[J].中国畜牧兽医,2017,44(11):3187-3194.
LIU X L,FAN H,CHEN L B,et al.Effects of cecropin and synbiotics on the intestinal mucosal morphology and intestinal mucosal immune cells of AA broilers[J].ChinaAnimalHusbandry&VeterinaryMedicine,2017,44(11):3187-3194.(in Chinese with English abstract)
[8] 唐秀莹,陈正礼,罗启慧,等.大豆异黄酮对大鼠肠道上皮内淋巴细胞、杯状细胞及瘦素长型受体的影响[J].浙江大学学报(农业与生命科学版),2013,39(3):343-350.
TANG X Y,CHEN Z L,LUO Q H,et al.Effect of soy isoflavones on intraepithelial lymphocytes,goblet cells and long leptin receptor in intestinal of rats[J].JournalofZhejiangUniversity(Agriculture&LifeSciences.),2013,39(3):343-350.(in Chinese with English abstract)
[9] 张美曦,隋欣,刘超男,等.双歧杆菌对雏鸡肠道杯状细胞数量及黏蛋白2含量的影响[J].中国兽医杂志,2016,52(12):24-28.
ZHANG M X,SUI X,LIU C N,et al.Effects of bifidobacterium to the number of goblet cells and the content of MUC2 in intestinal tract of chicks[J].ChineseJournalofVeterinaryMedicine,2016,52(12):24-28.(in Chinese with English abstract)
[10] 邢亚丽,宋慧,姜云瑶,等.树舌发酵浸膏多糖对肉鸡肠黏膜组织结构及肠道免疫细胞的影响[J].中国农业大学学报,2015,20(3):126-132.
XING Y L,SONG H,JIANG Y Y,et al.Effects of the polysaccharides from the fermentation extract ofGanodermaapplanatumon the mucosal structure and intestinal immunocyte of broilers[J].JournalofChinaAgriculturalUniversity,2015,20(3):126-132.(in Chinese with English abstract)
[11] 闫晓刚,张芳毓,郎洪彦,等.人参茎叶多糖对雏鸡小肠黏膜组织发育和免疫细胞的影响[J].畜牧兽医学报,2015,46(1):144-155.
YAN X G,ZHANG F Y,LANG H Y,et al.Effects of ginseng stem and leaf polysaccharide on small intestinal mucous tissue development and immune cells of chicken[J].ActaVeterinariaetZootechnicaSinica,2015,46(1):144-155.(in Chinese with English abstract)
[12] 曹贵彬,易凤珍,游金明,等.陈皮苷制剂对爱拨益加肉鸡生长性能、免疫器官指数及小肠黏膜形态结构的影响[J].动物营养学报,2014,26(3):710-717.
CAO G B,YI F Z,YOU J M,et al.Effects of hesperidin preparation on growth performance,immune organ indexes and small intestinal mucosal morphology of arbor acres broilers[J].ChineseJournalofAnimalNutrition,2014,26(3):710-717.(in Chinese with English abstract)
[13] 周金星,盛洁,高文,等.黄淮白山羊兴盛期毛囊和皮肤组织结构的观察[J].中国兽医科学,2017,47(6):779-784.
ZHOU J X,SHENG J,GAO W,et al.Observation of tissue structure characteristics of the follicle and skin of Huanghuai white goat in a prosperous period[J].ChineseVeterinaryScience,2017,47(6):779-784.(in Chinese with English abstract)
[14] 周金星,盛洁,高文,等.黄淮白山羊蹄部形态结构的观察[J].中国兽医科学,2017,47(5):655-659.
ZHOU J X,SHENG J,GAO W,et al.Observation of morphological structures of the hoof in Huanghuai white goat[J].ChineseVeterinaryScience,2017,47(5):655-659.(in Chinese with English abstract)
[15] 周金星,靳二辉,胡倩倩,等.黄淮白山羊冠状动脉和心肌组织结构及CX-43蛋白的分布观察[J].中国兽医科学,2016,46(8):1031-1037.
ZHOU J X,JIN E H,HU Q Q,et al.Characteristic observation of coronary artery,myocardial tissue structure and CX-43protein distribution in Huanghuai white goat[J].ChineseVeterinaryScience,2016,46(8):1031-1037.(in Chinese with English abstract)
[16] 华金玲,郭亮,王立克,等.不同精粗比日粮对黄淮白山羊瘤胃内环境的影响[J].中国兽医学报,2013,33(6):913-917.
HUA J L,GUO L,WANG L K,et al.The effect of forage to concentrate ratio on ruminal parameters in Huanghuai white goat[J].ChineseJournalofVeterinaryScience,2013,33(6):913-917.(in Chinese with English abstract)
[17] 华金玲,郭亮,王立克,等.不同精粗比日粮对黄淮白山羊瘤胃挥发性脂肪酸影响[J].东北农业大学学报,2013,44(6):58-61.
HUA J L,GUO L,WANG L K,et al.Effect of different forage to concentrate ratios on VFA of Huanghuai white goat[J].JournalofNortheastAgriculturalUniversity,2013,44(6):58-61.(in Chinese with English abstract)
[18] 李斌,韩伟,方俊顺,等.黄淮白山羊孤雌胚胎的体外培养[J].中国兽医学报,2008,28(12):1480-1482.
LI B,HAN W,FANG J S,et al.Development of Huanghuai-white goat parthenogenetic embryosinvitro[J].ChineseJournalofVeterinaryScience,2008,28(12):1480-1482.(in Chinese with English abstract)
[19] 来景辉,范红杰.安徽省黄淮白山羊衣原体病的血清学调查[J].中国农学通报,2014,30(11):26-28.
LAI J H,FAN H J.Serological investigation of chlamydiosis in Huanghuai-white goats in Anhui province[J].ChineseAgriculturalScienceBulletin,2014,30(11):26-28.(in Chinese with English abstract)
[20] 陈珍,周作红,管远红,等.60日龄内玉山黑猪小肠形态学发育的研究[J].江西农业大学学报,2008,30(4):297-302.
CHEN Z,ZHOU Z H,GUAN Y H,et al.A study on the tissue morphological development of small intestine of Yushan black piglets in 60 day-age[J].ActaAgriculturaeUniversitatisJiangxiensis,2008,30(4):297-302.(in Chinese with English abstract)
[21] 闫金坤,陈耀星,王子旭.雌激素对大鼠肠黏膜结构及上皮内淋巴细胞和杯状细胞数量、分布的影响[J].畜牧兽医学报,2008,39(9):1267-1271.
YAN J K,CHEN Y X,WANG Z X.Effect of estrogen on structure of mucosal epithelium and number of intraepithelial lymphocytes and goblet cells in small intestine of rat[J].ActaVeterinariaetZootechnicaSinica,2008,39(9):1267-1271.(in Chinese with English abstract)
[22] WU X,RUAN Z,CAO Y,et al.Dietary supplementation withL-arginine orN-carbamylglutamate enhances intestinal growth and heat shock protein-70 expression in weanling pigs fed a corn and soybean meal-based diet[J].AminoAcids,2010,39(3):831-839.
[23] 刘玥宏,丁悦,徐敬东.肠道杯状细胞及其功能研究进展[J].世界华人消化杂志,2017,25(14):1279-1286.
LIU Y H,DING Y,XU J D.Goblet cells and their functions[J].WorldChineseJournalofDigestology,2017,25(14):1279-1286.(in Chinese with English abstract)
MucousmembraneorganizationstructurecharacteristicsandgobletcellsdistributionobservationofHuanghuaiwhitegoat’sintestinaltract
ZHOU Jinxing1,2,QIAN Zhaoquan1,JIN Erhui1,LIU Wenju2,JIN Guangming1,*
(1.CollegeofAnimalScience,AnhuiScienceandTechnologyUniversity,Fengyang233100,China;2.CellandMolecularBiologyResearchCenter,AnhuiScienceandTechnologyUniversity,Fengyang233100,China)
Abstract:To observe mucous membrane organization structure characteristics and goblet cells distribution of Huanghuai white goat’s intestinal tract,three adult healthy Huanghuai white goats were bleed from jugular vein to death,the samples of duodenum,jejunum,ileum,cecum,colon and rectum were taken immediately and immersed into 4% paraformaldehyde fixative to be fixed for 72h.Tissue slices were thus made,and stained with HE and PAS.The results showed that epithelial cells of the duodenum and jejunum of Huanghuai white goat were highly columnar,and lymphocytes were distributed in lamina propria.The epithelial cells of the ileum mucosa were low columnar,and a large collection of lymph nodes were distributed in submucosa.The epithelial cells of cecum,colon and rectum were also low columnar,large intestinal gland were developed,and there were diffused lymphocytes between glands.The lymphoid nodule was seen in the lamina propria of rectum.The goblet cells in the epithelium secreted mucopolysaccharide in the form of apical secretion.The small intestinal goblet cells of Huanghuai white goat secreted neutral-mucopolysaccharide,while the large intestinal goblet cells of Huanghuai white goat secreted acid-mucopolysaccharide.The goblet cell’s number of large intestine was significantly(P<0.01) higher than that of small intestine.The goblet cell number of colon were significantly(P<0.05) higher than those of the cecum and rectum,and the goblet cell number of ileum were significantly(P<0.05) higher than those of the duodenum and jejunum.Therefore,from duodenum to ileum,the epithelial cells gradually changed from high column to low column,the goblet cells were mainly distributed in the large intestine,and the highest number of goblet cells was found in the colon.
Key words:goblet cells;tissue structure;small intestine;large intestine;Huanghuai white goat
中图分类号:S852.16
A
文章编号:1004-1524(2018)06-0946-07
收稿日期:2018-01-04
基金项目:安徽省农业科技成果转化项目(1504032001);安徽省科技攻关项目(1301042102);安徽省高等学校自然科学研究重点项目(KJ2016A823);安徽省第七批“115”产业创新团队项目(皖人才〔2014〕4号);安徽科技学院重点建设学科项目(AKZDXK2015A04);安徽省高校优秀青年骨干人才国内访学研修项目(gxfx2017078)
作者简介:周金星(1976—),男,安徽五河人,博士,副教授,主要从事动物组织病理与细胞学研究。E-mail:zhoujx@ahstu.edu.cn
,金光明,E-mail:jingm@ahstu.edu.cn
10.3969/j.issn.1004-1524.2018.06.09
(责任编辑卢福庄)
