GCK家族蛋白激酶MoSOK1调控稻瘟病菌的生长发育与致病性
2018-06-28冯晓晓李海娇王教瑜林福呈卢建平
冯晓晓,李海娇,李 玲,王教瑜*,林福呈,卢建平,*
(1.水稻生物学国家重点实验室,浙江大学 生物技术研究所,浙江 杭州310058;2.浙江大学 生命科学学院,浙江 杭州310058;3.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州310021;4.浙江农林大学 农业与食品科学学院,浙江 杭州 311300)
GCK家族蛋白激酶MoSOK1调控稻瘟病菌的生长发育与致病性
冯晓晓1,李海娇2,李 玲3,4,王教瑜3,*,林福呈1,卢建平2,*
(1.水稻生物学国家重点实验室,浙江大学 生物技术研究所,浙江 杭州310058;2.浙江大学 生命科学学院,浙江 杭州310058;3.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州310021;4.浙江农林大学 农业与食品科学学院,浙江 杭州 311300)
摘 要:稻瘟病菌致病相关基因功能的研究有助于揭示其致病机理,为稻瘟病防治提供理论依据。本研究利用基因替换技术对稻瘟病菌SOK1同源基因(MoSOK1)进行了分析。MoSOK1编码GCK(germinal center kinase)家族的Ste20蛋白激酶,其与全蚀病菌中对应蛋白具有最高同源性。本研究表明,MoSOK1基因在附着胞分化关键期上调表达;与野生型菌株相比,MoSOK1基因缺失突变体菌落颜色加深,气生菌丝减少,生长速度变慢,产孢量下降,分生孢子萌发延迟,致病性降低。另外,交配实验表明,MoSOK1基因缺失突变体能够进行交配,但产子囊壳能力降低。本研究初步表明,MoSOK1基因参与稻瘟病菌生长发育和致病过程。
关键词:稻瘟病菌;致病相关基因;MoSOK1
稻瘟病是水稻上危害最严重的病害,给全世界水稻生产带来巨大威胁。稻瘟病菌(Magnaportheoryzae)是一种丝状子囊真菌,具有典型的生活史和侵染循环[1]。2002年10月稻瘟病菌70-15菌株全基因组序列草图绘制完成[2]。稻瘟病菌成为丝状真菌致病机理和分子生物学研究的理想模式之一。稻瘟病菌致病分子机制的研究,不仅为稻瘟病的防治提供理论依据,而且对了解其他病原真菌的致病机理及与寄主互作具有重要参考价值。利用同源重组对致病相关基因进行敲除,通过分析突变体的表型明确基因功能,是目前稻瘟病菌致病机制研究中最行之有效的技术手段[3-5]。
稻瘟病菌分生孢子接触到寄主叶片后,在温湿度适宜条件下萌发形成芽管[6],4h内,芽管顶端膨大形成附着胞(appressorium)[7-8]。稻瘟病菌附着胞细胞壁上沉积大量黑色素,内部积累高浓度甘油,从而形成强大的渗透压以穿透寄主表皮[7,9-10]。附着胞形成和分化是稻瘟病菌致病机理研究的一个热点。附着胞分化受多种理化因子的诱导[11-12],包括基物硬度[13]和疏水性[11]等。参与稻瘟病菌附着胞分化形成的主要信号传导途径已经相当明确,包括G蛋白途径[14-15]、MAPK途径[6,16-17]、cAMP途径[18]和RAS途径[19]等。RAS-cAMP途径通过调控cAMP依赖性蛋白激酶(PKA)起作用,从而参与众多的生物学过程,是环境胁迫条件下细胞生长的主要调控因子[20]。稻瘟病菌的CPKA基因缺失后,附着胞分化滞后、功能异常、无法穿透表皮,严重影响致病性。同时,生长、产孢和有性生殖均受到影响[21-22]。
SOK1基因编码一种GCK(germinal center kinase)家族的蛋白激酶。酿酒酵母(Saccharomycescerevisiae)中,SOK1基因的过表达能够抑制PKA(cyclic-AMP dependent protein kinase A)突变体的生长缺陷[23-24]。在哺乳动物中,SOK1基因可以被活性氧(reactive oxygen species,ROS)激活,诱导依赖半胱天冬酶的细胞凋亡过程[25-26]。而活性氧的产生和降解以及细胞凋亡对于病原真菌的致病性也都是至关重要的影响因子[27-31]。目前,SOK1基因是否可以影响植物病原真菌的生长发育和致病性,尚无报道。本研究利用基因敲除对稻瘟病菌SOK1基因(MoSOK1)的功能进行了分析,初步揭示了SOK1在稻瘟病菌生长发育和致病过程中的作用。
1 材料与方法
1.1 菌株与培养条件
稻瘟病菌野生型菌株Guy11与2539,为研究常用菌株,本实验室保存。MoSOK1基因敲除突变体菌株在本研究中获得。野生型菌株、各转化子与突变菌株,均在完全培养基(complete medium,CM)上28℃培养[32]。在液体CM中培养3d的菌丝体用于提取基因组DNA。转化子筛选采用含有100μg·mL-1氯嘧磺隆(Sigma,USA)的DCM培养基[33]。
1.2 生物信息学分析
以酿酒酵母SOK1基因的蛋白序列(YDR006C)为检索对象在稻瘟病菌基因组数据库(http://www.broad.mit.edu/annotation/fungi/magnaporthe/index.html/)中进行检索。序列比对使用在线程序mafft(http://mobyle.pasteur.fr/cgi-bin/portal.py#forms::mafft),参数 Gap opening penalty 设置为2.0,offset value 设置为0.1。序列连配结果导入GeneDoc 2.0 进行校准,导入MEGA 5.0 构建系统发育树。
1.3 MoSOK1基因敲除突变体的获得
以野生型Guy11基因组为模板,利用引物SOK1-up-p1和SOK1-up-p2扩增873bp的MoSOK1上游片段,以BamHⅠ-EcoRⅤ酶切连接入pBS-SUR[33]得到pBS-SOK1up;利用引物SOK1-dn-p1和SOK1-dn-p2扩增962bp的下游片段,EcoRⅠ-XbaⅠ酶切连接入pBS-SOK1up,获得基因置换载体pBS-SOK1。
利用原生质体转化法将pBS-SOK1导入野生菌株Guy11,利用氯嘧磺隆抗性筛选转化子。利用引物SOK1yz1和SOK1yz2对转化子进行PCR初筛,并进一步通过Southern杂交和定量PCR对可能的突变体进行验证。本研究所用引物详见表1。
1.4 致病性测定
采用生长14d的水稻CO39 与8d的大麦ZJ-8,参照Liu等[3]的方法,分别测定野生型、突变体对水稻和大麦叶片的致病力,5d后观察记录发病情况。实验重复3次。
1.5 菌落生长、产孢量、孢子萌发率与附着胞形成率的测定
将野生型及突变体菌株以0.5cm菌饼接种于CM平板上,25℃,12h/12h光暗交替培养,每处理3个重复,生长10d后观察菌落形态,测量菌落直径。取CM上生长10d的菌落,加入3mL无菌水,用玻棒轻轻刮取孢子,经3层擦镜纸过滤后用血球计数板测定分生孢子浓度,计算产孢量。用无菌水将分生孢子悬浮液浓度调节至1×105mL-1,滴于塑料盖玻片上,每滴200μL,25℃黑暗保湿培养,2、4和6h后分别取样,镜检孢子萌发和附着胞形成情况,计算萌发率和附着胞形成率。
1.6 菌株有性杂交
分别取0.5cm的菌株2539与Guy11(或MoSOK1突变菌株)菌饼,呈十字交叉接种于OMA平板上。20℃,24h连续光照培养30d,观察子囊壳、子囊及子囊孢子的形成情况。实验重复3次。
1.7 核酸操作及Southern杂交
基因组DNA提取采用CTAB(十六烷基三甲基溴化铵)法[32]。PCR、电泳、酶切、连接、Southern杂交等采用标准程序。真菌总RNA提取使用Trizol试剂(Invitrogen,USA),cDNA合成使用AMV反转录酶(TaKaRa Bio,Japan)。基因转录水平定量检测采用7500 实时定量PCR 系统(Applied Biosystems,Foster,USA),以β-Tubulin(MGG_00604)为内参基因。
2 结果与分析
2.1 MoSOK1基因的鉴定
以酿酒酵母SOK1基因的蛋白序列(YDR006C)在稻瘟病菌基因组数据库进行同源检索,发现假想基因MGG_12111与酵母SOK1最为相似(氨基酸相似度为31%),本研究定名为MoSOK1。根据基因组信息设计引物SOK1-CDS-p1与SOK1-CDS-p2,以菌丝孢子混合RNA合成的cDNA为模板,扩增MoSOK1编码区并进行序列测定。结果表明,MoSOK1开放阅读框由4个外显子,3个内含子组成,编码区总长度3 191bp,编码一个728氨基酸残基的多肽。不同物种SOK1的序列对比显示MoSOK1与全蚀病菌(Gaeumannomycesgraminis)SOK1同源基因序列最为接近(氨基酸一致性为62%)(图1-A)。
为了明确MoSOK1基因在稻瘟病菌中的表达动态,我们利用定量PCR检测基因在孢子萌发和附着胞形成过程中的转录水平,结果发现,MoSOK1在孢子萌发过程中逐渐上调表达,诱导12h后达到峰值,然后逐渐下降(图2)。孢子萌发10~12h是附着胞分化的关键时期,MoSOK1的表达模式提示该基因可能在孢子萌发和附着胞分化过程中发挥作用。
2.2 MoSOK1基因敲除突变体的获得
表1本研究所用引物列表
Table1Primers used in this study

名称Name序列Sequence作用FunctionSOK1-up-p15'-AggatccTGCCTGGGCTGCTGGTTAC-3'扩增敲除载体上臂Amplification of flank region upstream of MoSOK1SOK1-up-p25'-AgatatcGATGAAGAGATGGCGGCGAT-GAA-3'SOK1-dn-p15'-AgaattCTCGGCGGGATTCACTTAT-GTTTC-3'扩增敲除载体下臂Amplification of flank region downstream of MoSOK1SOK1-dn-p25'-AtctagaTCGCCCTGCAGTGACCTTTGT-GA-3'SOK1yz15'-GACTTTGTCTTTGAAGCACCTA-3'敲除突变体筛选Mutant selection and confirmationSOK1yz25'-TCTGCGTCGGATTTGGTA-3'SOK1-CDS-p15'-TAggatccATGACTGAGCAAGGGGCTG-3'扩增基因编码区Amplification of CDS of MoSOK1SOK1-CDS-p25'-TAggatccAGCGTCAGACATCTCCAT-3'SOK1qRTp15'-CAATATGAGGATCTGGAGCAGG-3'定量PCR检测Quantitative reverse-transcriptional PCRSOK1qRTp25'-CAGGGTTGAATAAAGCTTCGC-3'TubulinqRTp15'-ATTGTTCACCTTCAGACCGG-3'定量PCR内参Reference gene for qRT-PCRTubulinqRTp25'-TTGAAGTAGACGCTCATACGC-3'
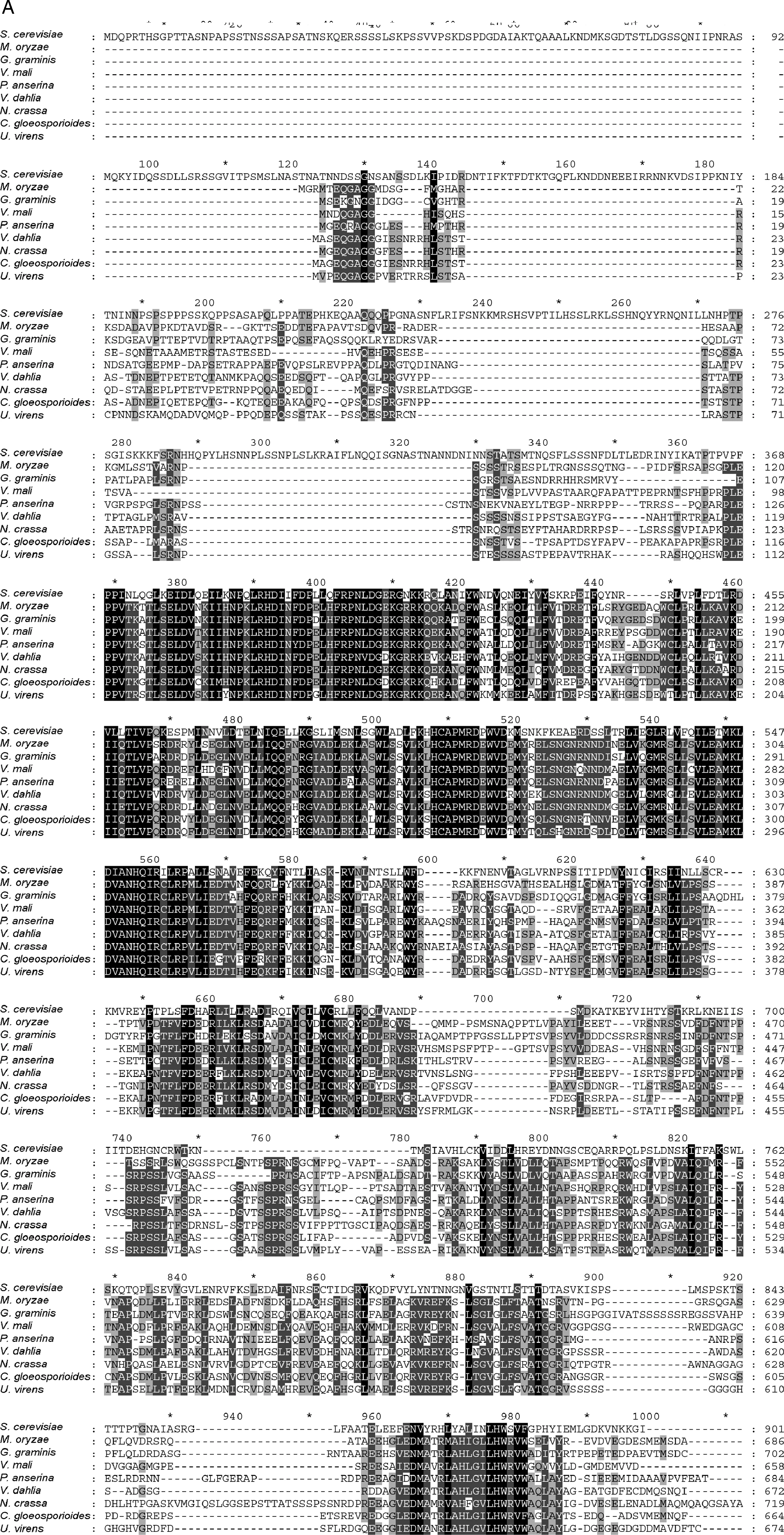
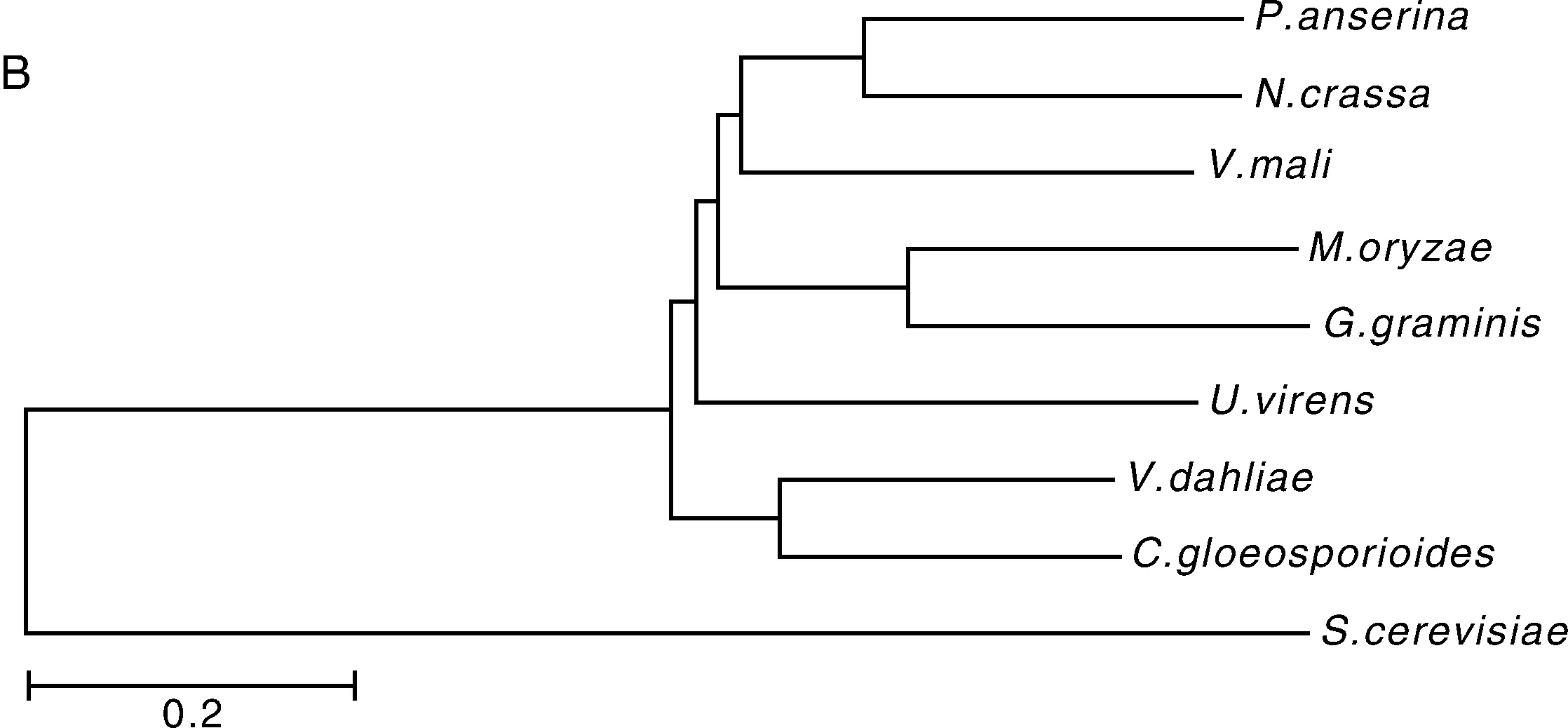
A,稻瘟病菌MoSOK1(MGG_12111)与酿酒酵母SOK1(YDR006C)及柄孢霉Podospora anserina(CDP30447.1)、粗糙脉孢菌Neurospora crassa(CAD21116.1)、苹果黑腐皮壳菌Valsa mali(KUI52511.1)、全蚀病菌Gaeumannomyces graminis(EJT79517.1)、稻曲病菌Ustilaginoidea virens(KDB18427.1)、大丽轮枝菌Verticillium dahlia(EGY15838.1)、胶孢炭疽菌Colletotrichum gloeosporioides(EQB58259.1)中同源基因的蛋白序列联配,氨基酸背景颜色越深表示保守性越高;B,根据序列联配结果,使用MEGA5.0 程序构建的SOK1基因的系统进化树。A,Amino acid sequences of MoSOK1(MGG_12111),Saccharomyces cerevisiae SOK1(YDR006C) and the homologues from Podospora anserina(CDP30447.1),Neurospora crassa(CAD21116.1),Valsa mali(KUI52511.1),Gaeumannomyces graminis(EJT79517.1),Ustilaginoidea virens(KDB18427.1),Verticillium dahlia(EGY15838.1) and Colletotrichum gloeosporioides(EQB58259.1) were aligned with ClustalW.The identical amino acids are highlighted against a black background,the conserved residues on a dark gray background,and the similar residues on a light gray background.B,Phylogenetic relationship of SOK1 homologs calculated with neighbor-joining method using the MEGA 5.0 program according to the alignment.图1 MoSOK1同源基因序列比对与系统发育进化分析Fig.1 Multiple sequences alignment and phylogeny evolution analysis of SOK1 homologs
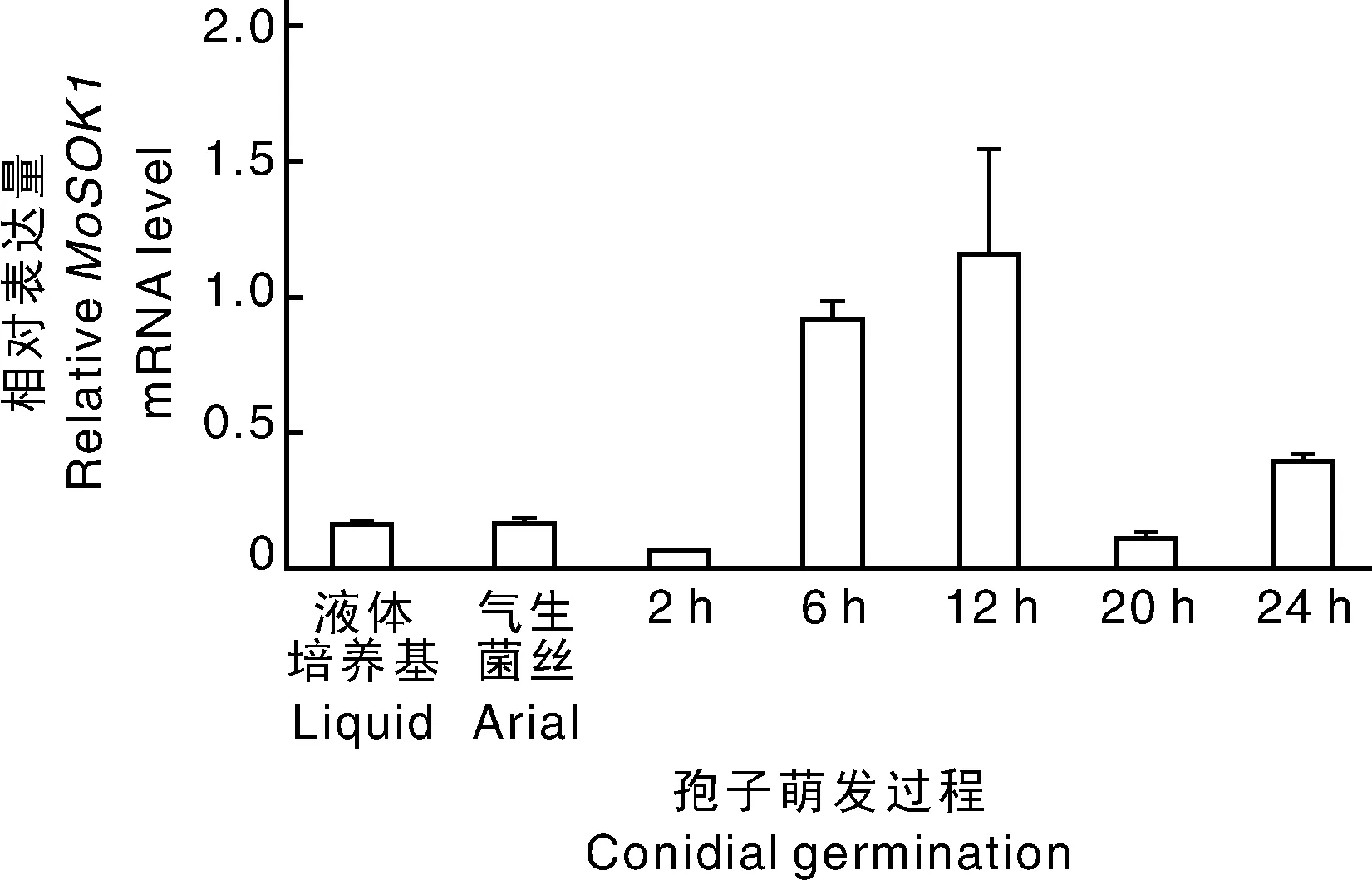
图2 MoSOK1基因在孢子萌发过程中的相对表达量Fig.2 Relative expression level of MoSOK1 during conidial germination
为了明确MoSOK1的功能,我们进行了基因敲除。分别扩增MoSOK1的上下游序列,插入到含有筛选标记基因SUR的载体pBS-SUR[33]中,获得敲除载体pBS-SOK1。利用原生质体转化导入稻瘟病菌野生型菌株,通过抗性筛选共获得36个氯嘧磺隆抗性转化子。利用引物SOK1yz1和SOK1yz2进行PCR初筛,进一步利用Southern杂交和定量PCR进行验证,表明菌株sok1-27,sok1-29为MoSOK1基因敲除突变体(图3)。
2.3 MoSOK1参与稻瘟病菌营养生长与产孢
在CM上生长10d,野生型菌株Guy11菌落呈灰褐色,气生菌丝浓密,菌落边缘绒毛状,而Δmosok1突变体sok1-27、sok1-29菌落气生菌丝明显减少,颜色加深,菌落边缘光滑(图4-A)。同时,Δmosok1比野生型Guy11的菌落直径小,表明在CM上Δmosok1的生长速度较野生型Guy11慢(图4-B)。
统计CM上生长10d菌落的产孢量,发现Guy11菌株单位面积产孢量为(2.03±0.58)×104mm-2,而Δmosok1突变体sok1-27、sok1-29菌株单位面积产孢量分别为(1.21±0.32)×104mm-2和(1.09±0.28)×104mm-2,约为Guy11的1/2(图4-C),但Δmosok1的孢子形态无明显改变。上述结果表明,MoSOK1基因影响稻瘟病菌的营养生长与产孢。
2.4 MoSOK1基因缺失导致分生孢子萌发延迟
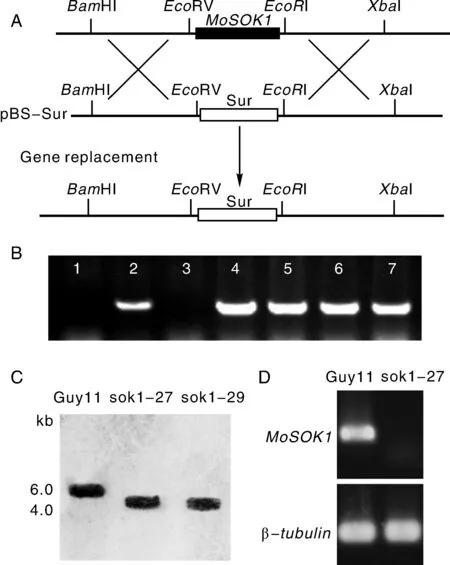
A,MoSOK1基因替换示意图,突变体中,MoSOK1被筛选标记基因SUR所取代。B,转化子的PCR筛选(部分),无扩增条带者为可能突变体。1,sok1-27;3,sok1-29;2,4-7,随机插入转化子。C,可能突变体(sok1-27、sok1-29)的Southern 杂交验证。D,突变体(sok1-27)的反转录PCR 验证,突变体中完全检测MoSOK1的转录本。A,Schematic map for targeted gene replacement of MoSOK1.B,Screening for potential knockout mutants.Lane 1,sok1-27(Δmosok1);Lane 3,sok1-29(Δmosok1);Lane 2,and 4 to 7,ectopic transformants.C,Δmosok1 mutants(sok1-27 and sok1-29) via Southern blotting.D,Check of the Δmosok1 mutant sok1-27 via RT-PCR.图3 MoSOK1基因敲除突变体的获得Fig.3 Generation of Δmosok1 mutants
野生型Guy11和突变体Δmosok1的分生孢子悬浮液在塑料盖玻片表面上诱导孢子萌发和附着胞形成,在2h时,野生型Guy11的平均萌发率为84.20%,而Δmosok1菌株的萌发率显著低于前者;4h时,Δmosok1菌株的孢子萌发率有较大增加,但仍然低于同等条件下野生型Guy11的萌发率;而Δmosok1的附着胞形成率与野生型Guy11相比差异不显著(表2)。结果表明,MoSOK1基因的缺失导致分生孢子萌发延迟,但不影响到附着胞的形成。
2.5 Δmosok1突变体致病性分析
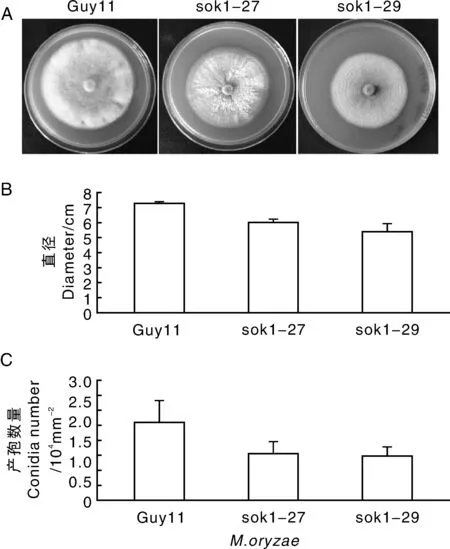
A,稻瘟病菌在完全培养基(CM)生长10d的菌落情况;B,菌落直径统计;C,产孢量统计。A,The wild type Guy11 and Δmosok1 were cultured on complete medium for 10d;B,The diameters of the colonies were statistically compared;C,Conidiation in Δmosok1 mutants.图4 Δmosok1突变体的营养生长及产孢情况Fig.4 Vegetative growth and sporulation of mutant Δmosok1

表2 Δmosok1的孢子萌发率和附着胞形成率
同一列数据后没有相同小写字母表示差异显著(P<0.05)。
The values in the same column without the same letters showed the significance(P<0.05).
为了明确MoSOK1在稻瘟病菌致病过程中的作用,我们将稻瘟病菌分生孢子接种于14d的水稻幼苗和8d的大麦离体叶片上进行致病性分析。结果显示,与野生型相比,Δmosok1突变体(sok1-27)致病性降低。Δmosok1突变体可在水稻上产生点状病斑,但病斑不能正常扩展。大麦叶片点接种呈现同样的结果,突变体病斑明显弱于野生型(图5)。表明MoSOK1基因参与稻瘟病菌的致病过程。
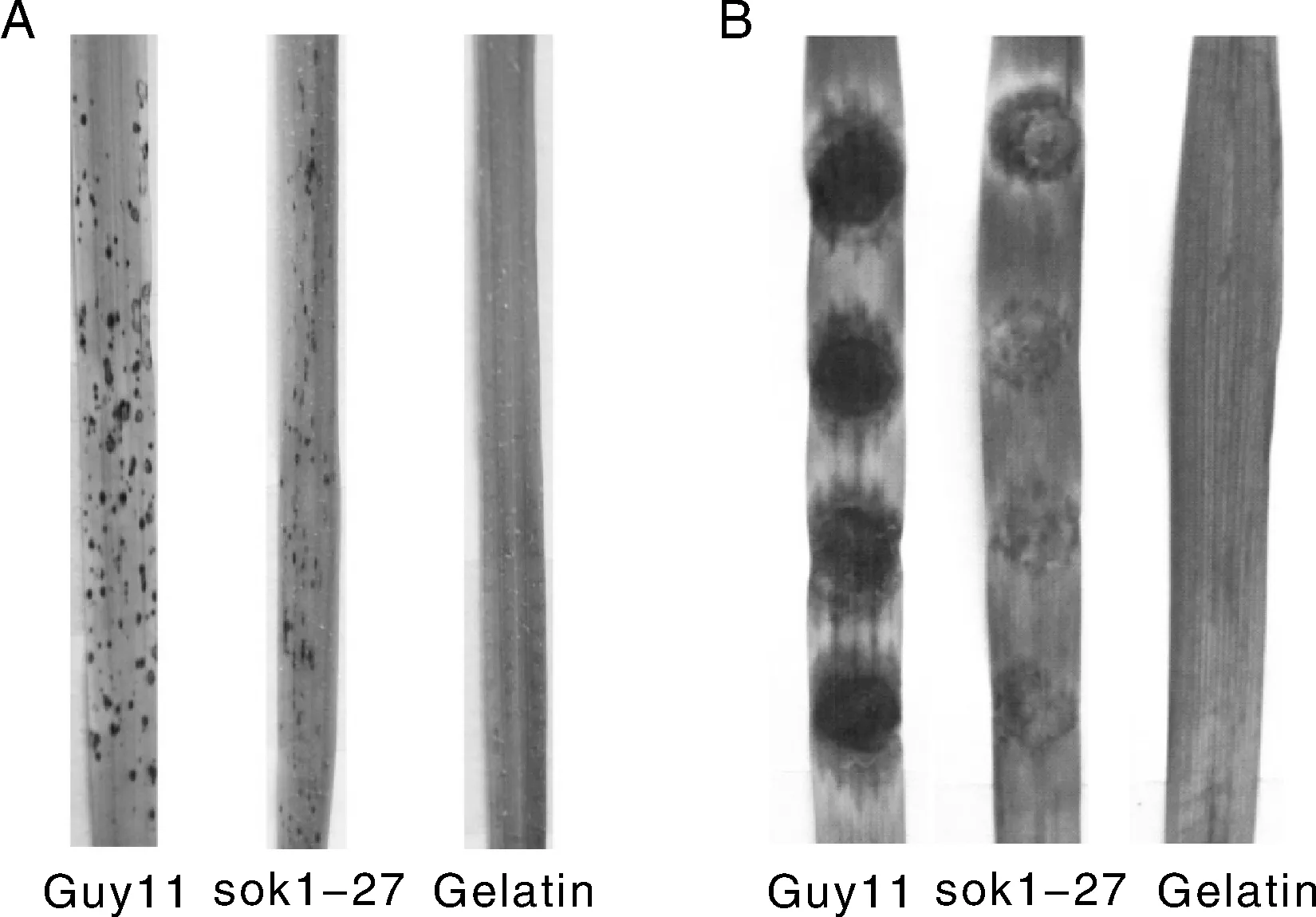
图5 Guy11和Δmosok1突变体在水稻(A)和大麦(B)叶片上的致病性Fig.5 Pathogenicity test of wild type Guy11 and Δmosok1 mutant on rice(A) and barley(B) leaves
2.6 MoSOK1参与稻瘟病菌的有性世代产生
为了探究MoSOK1基因是否在稻瘟病菌有性世代形成过程中起作用,我们进行了交配实验分析。我们将2539菌株(交配型MAT1-1)分别同Guy11和Δmosok1突变体sok1-27交叉接种于OMA进行交配试验。在20℃恒温持续光照下,OMA培养基上培养28d,野生型Guy11与2539的交界处形成大量子囊壳,而Δmosok1突变体sok1-27与2539形成的子囊壳明显偏少(图6)。结果表明,MoSOK1基因影响了稻瘟病菌有性世代的形成。
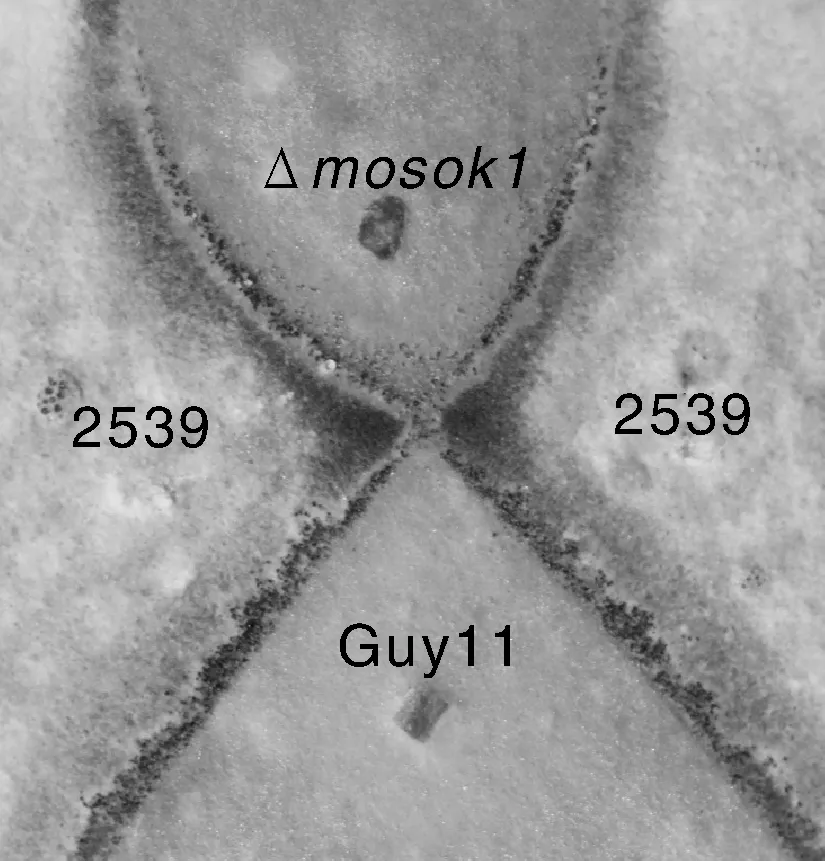
交界处黑色斑点为子囊壳。The black spot at the junction is the perithecium.图6 Δmosok1与2539的有性杂交Fig.6 Mating test of strain 2539 with Guy11 or Δmosok1(sok1-27) mutant
3 小结与讨论
作为丝状真菌致病机理和分子生物学研究的模式生物,稻瘟病菌致病相关功能基因的分析对于稻瘟病防治和探究丝状真菌生长发育和致病机制具有重要的科学意义[1]。通过反向遗传学方法,分析相关代谢途径,根据酵母、哺乳动物中的基因进行推测,从而克隆和分析可能影响致病性的同源基因,是稻瘟病菌功能基因分析的重要方法之一,利用此方法克隆和分析的功能基因有近百个[3-4,34]。本研究中我们对稻瘟病菌SOK1同源基因进行了分析,结果表明,该基因参与稻瘟病菌致病相关的多个过程,为进一步分析下游途径奠定了基础。
酿酒酵母中,SOK1基因的过表达能够抑制PKA突变体的生长缺陷[23-24]。PKA参与众多的生物学过程,包括环境胁迫条件下的细胞生长[19],但酵母SOK1基因缺失并不影响其生长。本研究表明,稻瘟病菌MoSOK1基因缺失造成多重影响,包括气生菌丝生长减弱、孢子萌发减慢和致病性降低,弥补了酵母中突变体表型不明显的缺陷,为SOK1基因功能的进一步揭示提供了可能。另外,也表明SOK1基因在不同生物体中参与的代谢过程并不完全相同,稻瘟病菌SOK1的调控机制比酵母更加复杂。
哺乳动物中,SOK1可被活性氧(reactive oxygen species,ROS)激活从而诱导细胞凋亡[25-26]。在植物与病原菌互作过程中,植物细胞产生大量ROS,诱发抗病反应,包括细胞凋亡,从而限制病原菌扩展[27],病原菌必须克服ROS才能成功寄生。稻瘟病菌谷胱甘肽过氧化物酶基因MoHYR1突变体对H2O2耐受性下降,同时对大麦和水稻叶片的致病力减弱[30]。稻瘟病菌过氧化氢酶基因CATB缺失导致稻瘟病菌菌丝、孢子和附着胞形态的改变,进而影响其致病力[29],表明了ROS在病菌侵染过程中的重要作用。本研究表明,MoSOK1突变体在叶片上形成病斑的扩展速度明显低于野生型,但病斑的数量较野生型并无明显变化。同时,突变体附着胞的形成率和侵染率并无明显变化。因此,突变体致病性的下降应该是由于孢子萌发速率降低和侵入后的侵染菌丝扩展减缓造成的。寄主活性氧对病菌的影响主要体现在对病菌侵入后的生长抑制作用[30]。因此,MoSOK1可能与病菌抵抗ROS有关联。另外,MoSOK1还影响分生孢子和有性世代的产生,表明了该基因功能的多样性,这与ROS能参与生物体的多种发育调控也是一致的[27]。MoSOK1如何受ROS激活从而调控病菌生长发育和发病过程,有待进一步研究。
:
[1] EBBOLE D J.Magnaportheas a model for understanding host-pathogen interactions[J].AnnualReviewofPhytopathology,2007,45:437-456.
[2] DEAN R A,TALBOT N J,EBBOLE D J,et al.The genome sequence of the rice blast fungusMagnaporthegrisea[J].Nature,2005,434(7036):980-986.
[3] LIU X H,LU J P,ZHANG L,et al.Involvement of aMagnaporthegriseaserine/threonine kinase gene,MgATG1,in appressorium turgor and pathogenesis[J].EukaryoticCell,2007,6(6):997-1005.
[4] WANG J,ZHANG Z,WANG Y,et al.PTS1 peroxisomal import pathway plays shared and distinct roles to PTS2 pathway in development and pathogenicity ofMagnaportheoryzae[J].PLoSOne,2013,8(2):e55554.
[5] LI L,WANG J,ZHANG Z,et al.MoPex19,which is essential for maintenance of peroxisomal structure and woronin bodies,is required for metabolism and development in the rice blast fungus[J].PLoSOne,2014,9(1):e85252.
[6] PARK G,BRUNO K S,STAIGER C J,et al.Independent genetic mechanisms mediate turgor generation and penetration peg formation during plant infection in the rice blast fungus[J].MolecularMicrobiology,2004,53(6):1695-1707.
[7] BOURETT T M,HOWARD R J.Invitrodevelopment of penetration structures in the rice blast fungusMagnaporthegrisea[J].CanadianJournalofBotany,1990,68(2):329-342.
[8] HOWARD R J,VALENT B.Breaking and entering:host penetration by the fungal rice blast pathogenMagnaporthegrisea[J].AnnualReviewofMicrobiology,1996,50:491-512.
[9] HOWARD R J,FERRARI M A,ROACH D H,et al.Penetration of hard substrates by a fungus employing enormous turgor pressures[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1991,88(24):11281-11284.
[10] DE JONG J C,MCCORMACK B J,SMIRNOFF N,et al.Glycerol generates turgor in rice blast[J].Nature,1997,389(6648):244-244.
[11] LEE Y H,DEAN R A.Hydrophobicity of contact surface induces appressorium formation inMagnaporthegrisea[J].FEMSMicrobiologyLetters,1994,115(1):71-75.
[12] GILBERT R D,JOHNSON A M,DEAN R A.Chemical signals responsible for appressorium formation in the rice blast fungusMagnaporthegrisea[J].PhysiologicalandMolecularPlantPathology,1996,48(5):335-346.
[13] XIAO J Z,WATANABE T,KAMAKURA T,et al.Studies on cellular-differentiation ofMagnaporthegrisea-physicochemical aspects of substratum surfaces in relation to appressorium formation[J].PhysiologicalandMolecularPlantPathology,1994,44(3):227-236.
[14] LIU S,DEAN R A.G protein alpha subunit genes control growth,development,and pathogenicity ofMagnaporthegrisea[J].MolecularPlant-MicrobeInteractions,1997,10(9):1075-1086.
[15] BOLKER M.Sex and crime:heterotrimeric G proteins in fungal mating and pathogenesis[J].FungalGeneticsandBiology,1998,25(3):143-156.
[16] XU J R,HAMER J E.MAP kinase and cAMP signaling regulate infection structure formation and pathogenic growth in the rice blast fungusMagnaporthegrisea[J].Genes&Development,1996,10(21):2696-2706.
[17] ZHAO X,KIM Y,PARK G,et al.A mitogen-activated protein kinase cascade regulating infection-related morphogenesis inMagnaporthegrisea[J].PlantCell,2005,17(4):1317-1329.
[18] LEE Y H,DEAN R A.cAMP regulates infection structure formation in the plant pathogenic fungusMagnaporthegrisea[J].PlantCell,1993,5(6):693-700.
[19] ZHOU X,ZHAO X,XUE C,et al.Bypassing both surface attachment and surface recognition requirements for appressorium formation by overactive ras signaling inMagnaportheoryzae[J].MolecularPlant-MicrobeInteractions,2014,27(9):996-1004.
[20] BROACH J R,DESCHENES R J.The function of ras genes inSaccharomycescerevisiae[J].AdvancesinCancerResearch,1990,54:79-139.
[21] MITCHELL T K,DEAN R A.The cAMP-dependent protein kinase catalytic subunit is required for appressorium formation and pathogenesis by the rice blast pathogenMagnaporthegrisea[J].PlantCell,1995,7(11):1869-1878.
[22] XU J R,URBAN M,SWEIGARD J A,et al.TheCPKAgene ofMagnaporthegriseais essential for appressorial penetration[J].MolecularPlant-MicrobeInteractions,1997,10(2):187-194.
[23] TODA T,CAMERON S,SASS P,et al.SCH9,a gene ofSaccharomycescerevisiaethat encodes a protein distinct from,but functionally and structurally related to,cAMP-dependent protein kinase catalytic subunits[J].Genes&Development,1988,2(5):517-527.
[24] WARD M P,GARRETT S.Suppression of a yeast cyclic AMP-dependent protein kinase defect by overexpression ofSOK1,a yeast gene exhibiting sequence similarity to a developmentally regulated mouse gene[J].Molecular&CellularBiology,1994,14(9):5619-5627.
[25] POMBO C M,BONVENTRE J V,MOLNAR A,et al.Activation of a human Ste20-like kinase by oxidant stress defines a novel stress response pathway[J].EMBOJournal,1996,15(17):4537-4546.
[26] POMBO C M,TSUJITA T,KYRIAKIS J M,et al.Activation of the Ste20-like oxidant stress response kinase-1 during the initial stages of chemical anoxia-induced necrotic cell death.Requirement for dual inputs of oxidant stress and increased cytosolic [Ca2+][J].JournalofBiologicalChemistry,1997,272(46):29372-29379.
[27] MARTINDALE J L,HOLBROOK N J.Cellular response to oxidative stress:signaling for suicide and survival[J].JournalofCellularPhysiology,2002,192(1):1-15.
[28] EGAN M J,WANG Z Y,JONES M A,et al.Generation of reactive oxygen species by fungal NADPH oxidases is required for rice blast disease[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2007,104(28):11772-11777.
[29] SKAMNIOTI P,HENDERSON C,ZHANG Z,et al.A novel role for catalase B in the maintenance of fungal cell-wall integrity during host invasion in the rice blast fungusMagnaporthegrisea[J].MolecularPlant-MicrobeInteractions,2007,20(5):568-580.
[30] HUANG K,CZYMMEK K J,CAPLAN J L,et al.HYR1-mediated detoxification of reactive oxygen species is required for full virulence in the rice blast fungus[J].PLoSPathogens,2011,7(4):e1001335.
[31] HUANG K,CZYMMEK K J,CAPLAN J L,et al.Suppression of plant-generated reactive oxygen species is required for successful infection by the rice blast fungus[J].Virulence,2011,2(6):559-562.
[32] TALBOT N J,EBBOLE D J,HAMER J E.Identification and characterization ofMPG1,a gene involved in pathogenicity from the rice blast fungusMagnaporthegrisea[J].PlantCell,1993,5(11):1575-1590.
[33] 李海娇,卢建平,刘小红,等.适用于稻瘟病菌基因敲除、过表达和荧光融合蛋白表达载体的构建和使用[J].农业生物技术学报,2012,20(1):94-104.
LI H J,LU J P,LIU X H,et al.Vectors building and usage for gene knockout,protein expression and fluorescent fusion protein in the rice blast fungus[J].JournalofAgriculturalBiotechnology,2012,20(1):94-104.(in Chinese with English abstract)
[34] WANG J,LI L,ZHANG Z,et al.One of three Pex11 family members is required for peroxisomal proliferation and full virulence of the rice blast fungusMagnaportheoryzae[J].PLoSOne,2015,10(7):e0134249.
MoSOK1,aputativegerminalcenterkinaseencodinggene,isrequiredforfungalgrowth,conidiationandpathogenicityinMagnaportheoryzae
FENG Xiaoxiao1,LI Haijiao2,LI Ling3,4,WANG Jiaoyu3,*,LIN Fucheng1,LU Jianping2,*
(1.StateKeyLaboratoryofRiceBiology,BiotechnologyInstitute,ZhejiangUniversity,Hangzhou310058,China;2.CollegeofLifeScience,ZhejiangUniversity,Hangzhou310058,China;3.InstituteofPlantProtectionandMicrobiology,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China;4.CollegeofAgricultureandFoodScience,ZhejiangAandFUniversity,Hangzhou311300,China)
Abstract:SOK1 is a Ste20 protein kinase of the germinal center kinase(GCK) that is activated by oxidant stress and chemical anoxia.It is unknown so far whetherSOK1 play roles in regulation of the fungal pathogenicity.Herein,we functionally characterized theSOK1 homologue in the rice blast fungusMagnaportheoryzae(MoSOK1).MoSOK1 was up-regulated during conidial germination and appressorial formation.Targeted gene replacement showed thatMoSOK1 acts as a regulator to fungal development and virulence inM.oryzae.Δmosok1 mutants showed decreased vegetative growth and conidiation,delayed conidial germination and a significant reduction in virulence.MoSOK1 was also found related to the sexual reproduction of the fungus.These data implicate thatSOK1 signaling is required for fungal development and pathogenicity in phytopathogenic fungi.
Key words:Magnaportheoryzae;fungal pathogenicity;MoSOK1
中图分类号:S435.111.4+1
A
文章编号:1004-1524(2018)06-0999-09
收稿日期:2018-01-05
基金项目:国家自然科学基金(31170136,31371891,31470249)
作者简介:冯晓晓(1982—),女,浙江玉环人,硕士,助理实验师,主要从事植物真菌病害致病机理及防控研究。E-mail:xxvon@zju.edu.cn
,卢建平,E-mail:jplu@zju.edu.cn;王教瑜,E-mail:wangjiaoyu78@sina.com
10.3969/j.issn.1004-1524.2018.06.16
(责任编辑张 韵)
