茶树根系XTHs和伸展蛋白对不同浓度铝的响应
2018-06-28宁秋燕石元值
宁秋燕,范 凯,王 敏,石元值,*
(1.中国农业科学院 茶叶研究所,农业农村部茶树生物学与资源利用重点实验室,浙江 杭州 310008;2.中国农业科学院 研究生院,北京100081)
茶树根系XTHs和伸展蛋白对不同浓度铝的响应
宁秋燕1,2,范 凯1,王 敏1,2,石元值1,*
(1.中国农业科学院 茶叶研究所,农业农村部茶树生物学与资源利用重点实验室,浙江 杭州 310008;2.中国农业科学院 研究生院,北京100081)
摘 要:为探索铝对茶树根系生长的影响,以一年生安吉白茶扦插苗为研究材料,比较不同铝浓度处理28d后茶树根系生长的表型差异、生长参数,以及细胞壁相关蛋白XTHs[木葡聚糖内转糖苷酶(XET)/水解酶(XEH)]和伸展蛋白(Expansins)的响应。结果表明,与无铝对照相比,加铝处理的茶树根系在表型、生长参数上均表现出了促进生长的现象,尤其是0.4、1.0mmol·L-1的铝处理下与对照差异显著(P<0.05),根系总长分别增加了206%和209%、根尖数分别增加了175%和166%、根系表面积分别增加了227%和286%、根系体积分别增加了246%和385%。相应地,茶树根系中CsEXPB14、CsEXLA8基因表达量在0.4mmol·L-1铝处理下显著(P<0.05)高于对照与4.0mmol·L-1铝处理组。Expansins活性也在0.4mmol·L-1铝浓度下最高,较不加铝处理提高了84.3%。CsXTH14基因表达量在0.4、1.0mmol·L-1铝浓度下较对照显著(P<0.05)上调,XET酶活性亦表现出随铝浓度升高而增加的趋势,直至4.0mmol·L-1的铝浓度下才受到显著抑制。XTHs和Expansins基因表达、XET和Expansins活性与根系生长呈正相关关系,表明一定浓度的铝(≤1mmol·L-1)处理,可以通过诱导XTHs和Expansins基因表达上调,提高XET和Expansins活性,促进茶树根系的生长。
关键词:环境胁迫;植物营养;饮料作物;基因表达;根系生长
铝是地壳中含量最丰富的金属元素之一,约占地壳总质量的7.5%,在土壤中含量比例可高达6.6%。铝对植物及环境的影响与其化学形态密切相关,固定态铝毒性最小,离子态铝毒性最大。通常铝的化学形态取决于环境pH值,在pH值低于4.5的酸性土壤中,Al3+是铝最常见的存在形态。有研究认为,铝毒是酸性土壤中限制作物生长的主要障碍因子[1]。茶树(Camelliasinensis)是一种典型的聚铝植物,在铝含量较高且活性较强的酸性土壤上可健康生长。大量研究表明,一定浓度的铝能促进茶树根系生长[2-3],课题组前期研究表明,当铝浓度为0.4~1.0mmol·L-1时,能显著促进茶树不定根的生长[4]。为阐明铝对茶树根系生长的影响机制,研究人员从生理和分子水平展开了广泛的研究,但大多数研究主要集中在茶树如何缓解根系铝毒害上[5-9]。随着组学技术的发展,研究者近年来从代谢、转录和翻译水平上进行了更加深入全面的研究[10-12]。
植物根系的伸长首先需要细胞壁的松弛和延展,其中木葡聚糖内转糖苷酶XET/水解酶XEH(统称XTHs)和伸展蛋白(Expansins)发挥着关键作用。XTHs是一类以木葡聚糖作为底物来催化木葡聚糖分子转移或水解的酶,可使木葡聚糖链之间的键断裂和再形成,在细胞壁的结构和延展性方面发挥着关键作用[13-14]。伸展蛋白(Expansins)最初是在生长活跃的黄瓜幼苗中鉴定出来的,其功能是破坏纤维素微纤丝和交联聚糖之间的氢键[15-16],从而使细胞壁疏松,以促进植物细胞生长。XTHs和Expansins均为多基因编码的基因家族,在根系的生长中发挥重要作用。在各种维管植物中,靠近根毛起始点及根伸长区都有高的 XET活性,能够疏松成熟的细胞,诱导根毛的发生[17]。对拟南芥相关突变体的研究表明,拟南芥根的伸长涉及AtXTH18表达[18]。大豆β-Expansin基因家族GmEXP1的特异性表达促进了大豆根的生长[19];玫瑰Expansin基因RhEXPA4的过表达使转基因拟南芥株系侧根增多[20]。在水稻中,OsEXPA17是根毛生长发育所必需的调控基因[21],OsEXPA8根组织特异基因的过表达可增加水稻根系生长[22],OsEXPB2参与了根毛的形成[23]。大量研究表明,铝对植物根系XTHs和Expansins基因的表达有重要影响。Yang等[24]的研究发现,50μmol·L-1铝处理显著抑制了拟南芥根系XTH14、XTH15、XTH31基因表达,XET酶活性明显下降,根系生长受到明显抑制。拟南芥XTH31基因缺失突变体,增强了根系对铝的抗性,铝胁迫下根系生长没有显著变化[25]。Che等[26]在水稻中的研究发现,铝处理诱导了水稻根系OsEXPA10的上调表达,敲除株系的根系生长受到显著抑制。由此可见,XTHs和Expansins基因在根系响应铝胁迫中发挥了重要作用。对于耐铝作物茶树来说,在不同铝浓度环境下,茶树根系中Expansins和XTHs的响应情况及对茶树根系生长的影响尚少见报道。
本研究通过测定不同铝浓度处理下茶树根系XET酶和Expansins蛋白活性及其对应编码基因的表达水平,结合茶树根系生长表型,探究茶树根系中的XTHs和Expansins蛋白及相关基因对铝的响应,为明确铝对茶树根系生长的促进机制提供理论依据。
1 材料与方法
1.1 实验材料与处理

1.2 根系形态构型测定
利用专业版的WinRHIZO2012根系分析软件获得根系扫描图像,获取根系总长、表面积、体积和根尖数,以及根系生长参数等参数。
1.3 茶树根系XET提取及活性测定
4℃下将1g新鲜茶苗嫩侧根剪切成小片段,放置到预冷的研钵内,加入3mL缓冲液B[200mmol·L-1琥珀酸盐(Na+),pH值5.5,添加3%(质量分数)的聚乙烯吡咯烷酮(PVPP)],4℃研磨5min形成匀浆,用1mL缓冲液将匀浆混合液转移至试管中,置于摇床中振荡3h以提取酶,4℃离心(10500g,45min),取上清液。添加1.569 g固体硫酸铵至3mL上清液中,充分溶解后得到80%饱和度的硫酸铵溶液,4℃静置过夜,离心(10500g,45min),弃去上清液,再次加入3mL 80%饱和度的硫酸铵溶液溶解沉淀,重复离心操作,再次弃去上清液,最后加入0.5mL 80%饱和度的硫酸铵溶解沉淀。取300μL硫酸铵蛋白质悬浮液样品,用微型离心机离心5min,弃去上清液。用400μL的25mmol·L-1吡啶缓冲液(用醋酸调pH至4.75)溶解沉淀,摇匀,-80℃保存待测。以3.5mL的1.0%(质量分数)450kBq木葡聚糖溶液为底物,添加等体积的200mmol·L-1的含10mmol·L-1CaCl2的琥珀酸钠盐缓冲液(pH值5.5),使[3H]XXXGol的含量为64kBq·mL-1。将底物分配至96孔板中,按每孔50μL,即3.2kBq·孔-1计。将待测蛋白酶在冰上解冻,摇动使蛋白重新形成悬浮液。每孔加入20μL的酶溶液并混匀(空白对照孔用蒸馏水替代)。每孔最终体积为70μL,包含有0.33%(质量分数)(2.3kBq)木葡聚糖。反应75min后取16μL的反应混合液(0.52kBq)加载于4cm×4cm Whatman 3 MM纸片上,干燥后用流动的水冲洗,纸晾干后进行3H分析,以计算XET酶活性。
1.4 茶树根系Expansins的提取及活性测定
提取方法参照文献[27]:取12株茶树新根样品10 g切段,用2mL的缓冲液A(15mmol·L-1磷酸钠,pH值6.0)研磨匀浆,4℃离心(6000g,5min),弃去上清液。沉淀再次用缓冲液A悬浮和离心,共重复4次,最终获得的沉淀用0.3~0.5mL的缓冲液B[50mmol·L-14-羟乙基哌嗪乙磺酸(Hepes),pH值7.0,1mol·L-1NaCl,2mmol·L-1EDTA,2mmol·L-1焦亚硫酸钠]再悬浮,静置至少1h后4℃离心(6000g,10min),取上清液,用于Expansins活性检测。
茶树根系Expansins活性检测采用酶联免疫分析试剂盒方法。分别设空白孔(不加样品及酶标试剂)、标准孔、待测样品孔。在酶标包被板上标准品准确加样 50μL,待测样品孔中先加样品稀释液 40μL、再加待测样品10μL(样品最终稀释度为5倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。用封板膜封板后,置37℃温育30min。将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。每孔加入酶标试剂50μL,空白孔除外。用封板膜封板后,置37℃温育30min,洗涤后,每孔先加入显色剂A 50μL,再加入显色剂B 50μL,轻轻振荡混匀,37℃避光显色10min后,每孔加终止液50μL,终止反应(此时蓝色立转黄色)进行测定。测定用空白调0,450 nm波长依序测量各孔的吸光度(D)。测定应在加终止液后15min以内进行。
1.5 茶树根系总RNA提取及cDNA合成
茶树根系总 RNA 提取方法参照天根公司提供的植物多糖多酚植物总 RNA 提取试剂盒说明书进行,其中试剂盒中的SL裂解液换为CTAB裂解液,且样品加入裂解液后65℃水浴30min。以RNA为模板,根据TaKaRa PrimeScriptTMRT Kit(with gDNase)提供的方法反转录成cDNA,作为荧光定量模板。
1.6 茶树根系XTH和Expansins基因荧光定量PCR分析
根据前期转录组测序获得的XTH和Expansins基因序列片段,使用Primer 5.0设计荧光定量特异性引物(表1)。以茶树GAPDH为内参基因,分析不同铝浓度处理安吉白茶茶树根系XTH和Expansins基因相对表达量。反应体系:SYBR Premix Ex Taq 10μL,ROX DyeⅡ0.4μL,上、下游引物(10μmol·L-1)各0.4μL,cDNA 2μL,加水至终体积20μL。反应程序:95℃预变性30 s;95℃变性5s,60℃退火延伸34s,40个循环。3次技术性重复。
1.7 数据处理
利用Excel 2010和SPSS 19.0统计软件对数据进行分析处理,对各处理采用单因素方差分析(one-way ANOVA)。
2 结果与分析
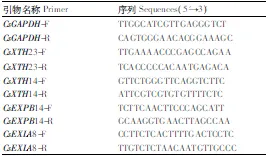
表1 实时荧光定量PCR引物
2.1 不同铝浓度对茶树根系生长的影响
不同铝浓度下,茶苗根系的生长产生了明显的表型差异(图1)。与CK相比,加铝处理下茶树新根系的生长量与生长速率显著(P<0.05)增加。无铝条件下,茶树根系生长势较弱,新生根少,且生长速率慢,根系颜色整体呈褐色;加铝后,茶树根系生长旺盛,新根数量多,生长速率快,根系整体颜色呈嫩白色,生长势强。但不同铝浓度对茶树根系生长的影响存在较大的差异,0.4、1.0mmol·L-1铝处理下茶树新根生长优于4.0mmol·L-1铝处理。表明一定浓度范围内的铝离子可促进茶树根系生长,但过高的铝浓度下,这种促进作用可能会减弱。
根系扫描结果(图2)进一步说明了不同铝浓度对茶树根系生长的影响差异。与CK相比,0.4、1.0mmol·L-1铝处理的茶树根系总长分别增加了206%和209%,根尖数分别增加了175%和166%,差异显著(P<0.05),表明0.4mmol·L-1和1.0mmol·L-1铝显著促进了茶树根系的伸长和不定根的形成,而在4.0mmol·L-1铝处理下,铝对茶树根系的伸长和不定根的形成无显著影响。0.4mmol·L-1和1.0mmol·L-1铝处理的茶树根系表面积较CK分别增加了227%和286%、根系体积分别增加了246%和385%,差异显著(P<0.05),推测0.4mmol·L-1和1.0mmol·L-1铝处理可能促进了根细胞的膨大,使根系表面积和体积增加。但4mmol·L-1铝处理的茶树根表面积和根体积与对照无显著差异。由此可见,0.4mmol·L-1和1.0mmol·L-1铝处理促进了茶树不定根的形成和根系的生长,表现为茶树根长、根尖数、根表面积及根体积的显著增加,当铝浓度达到4.0mmol·L-1时,无显著促进作用。
2.2 不同铝浓度对茶树根系XET酶与Expansins活性的影响
如图3所示:0.4mmol·L-1和1.0mmol·L-1铝处理下,茶树根系中的XET活性与对照无显著差异,4.0mmol·L-1铝处理下,茶树根系的XET活性显著(P<0.05)低于CK,说明4.0mmol·L-1铝浓度处理对茶树根系XET活性产生了显著的抑制作用。不同浓度铝处理茶树28d,0.4mmol·L-1铝处理的茶树根系伸展蛋白的活性较CK显著(P<0.05)增加。但1.0mmol·L-1和4.0mmol·L-1铝处理下,茶树根系伸展蛋白活性与CK无显著差异。上述结果表明,一定浓度的铝处理提高了茶树根系XET和Expansins活性,使细胞壁松弛、细胞膨大,有助于根系伸长、分生与膨大,促进茶树根系生长。
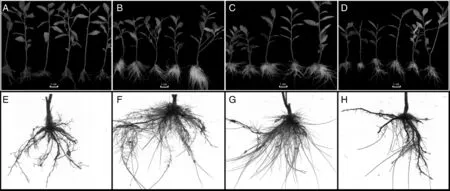
A,E,0mmol·L-1 Al3+;B,F,0.4mmol·L-1 Al3+;C,G,1.0mmol·L-1 Al3+;D,H,4.0mmol·L-1 Al3+.图1 铝对安吉白茶茶苗根系生长的影响Fig.1 Effects of Al on root growth of tea plants
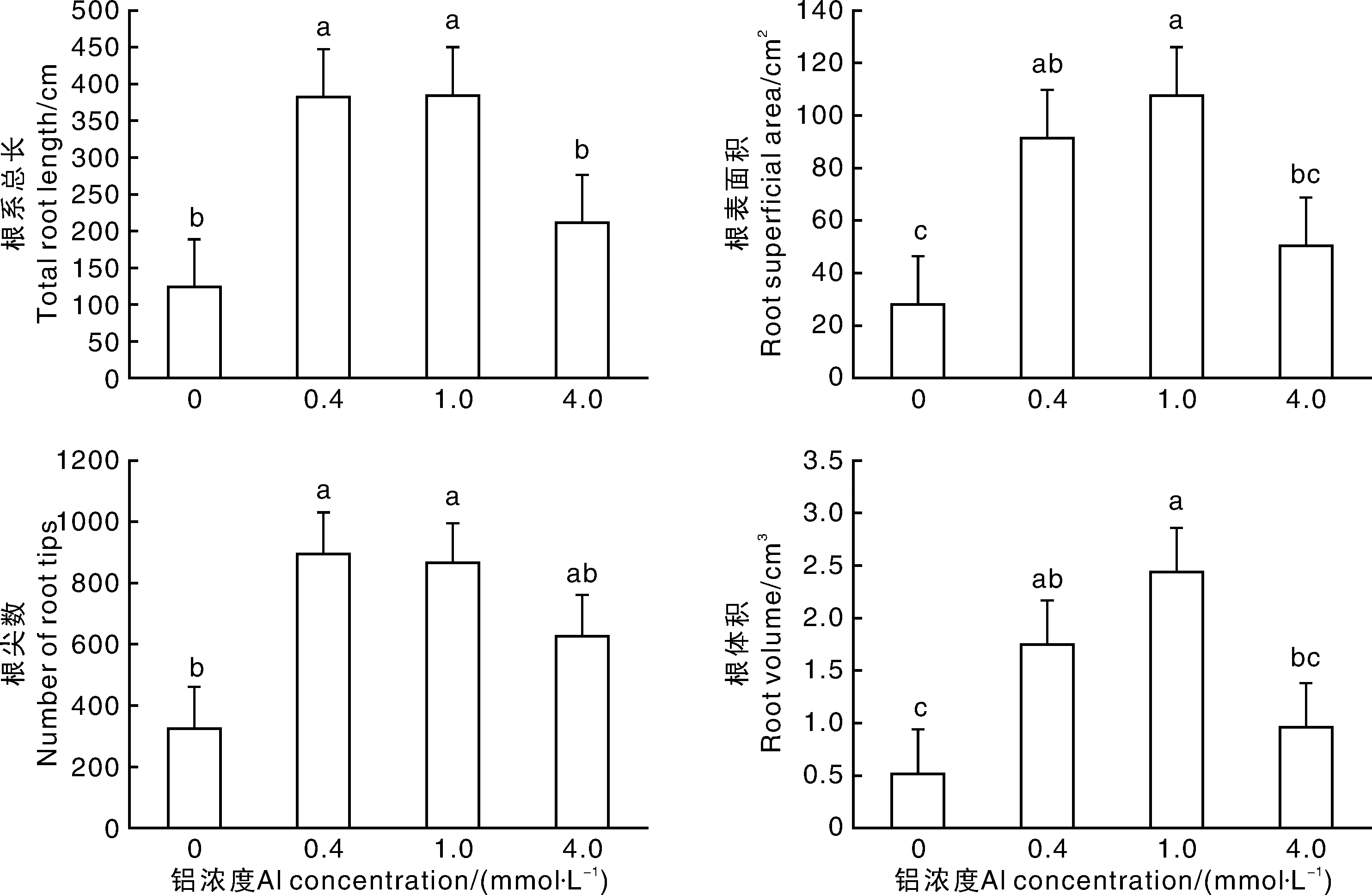
柱上无相同小写字母的表示处理间差异显著(P<0.05)。下同。Bars marked without the same letters indicated significant difference at P<0.05.The same as below.图2 铝对安吉白茶茶树根系总长、根表面积、根尖数、根体积的影响Fig.2 Effects of Al on total root length,root superficial area,roots tips,root volume of tea plants
2.3 不同铝浓度对茶树根系XTHs和Expansins基因表达量的影响
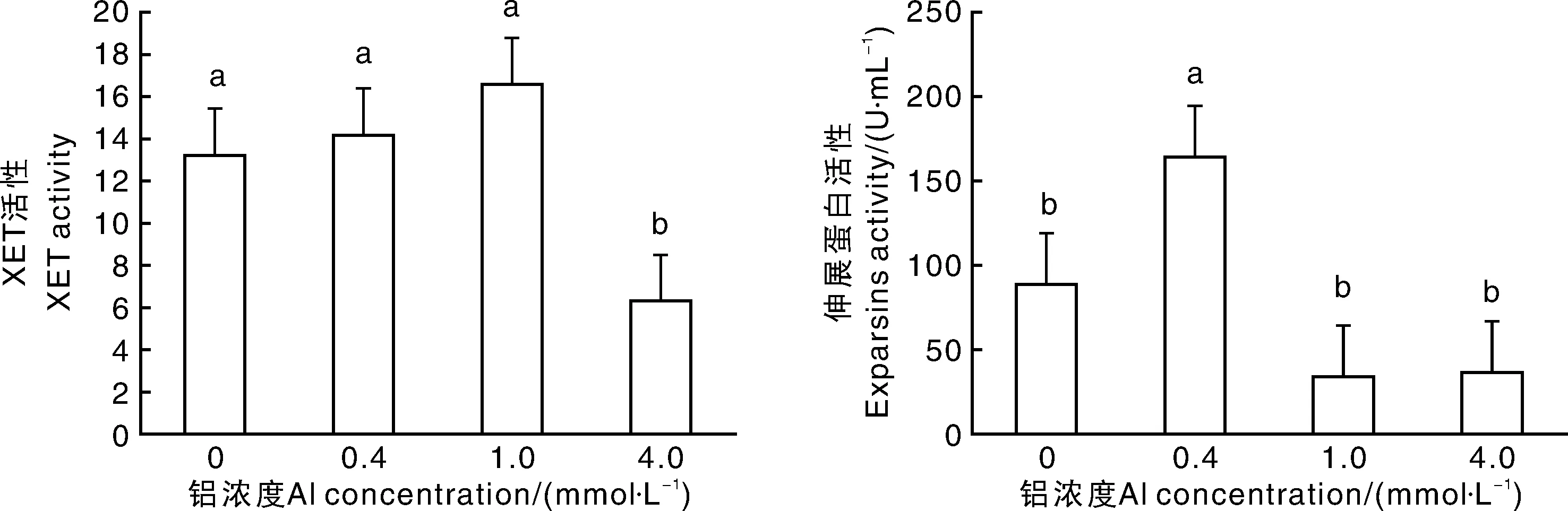
图3 不同铝浓度处理对茶树根系XET及Expansins活性的影响Fig.3 Effects of Al on XET and Expansins activities in root of tea plants
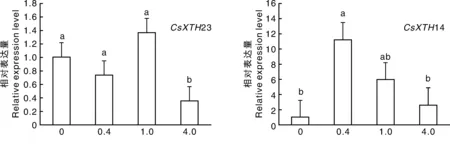
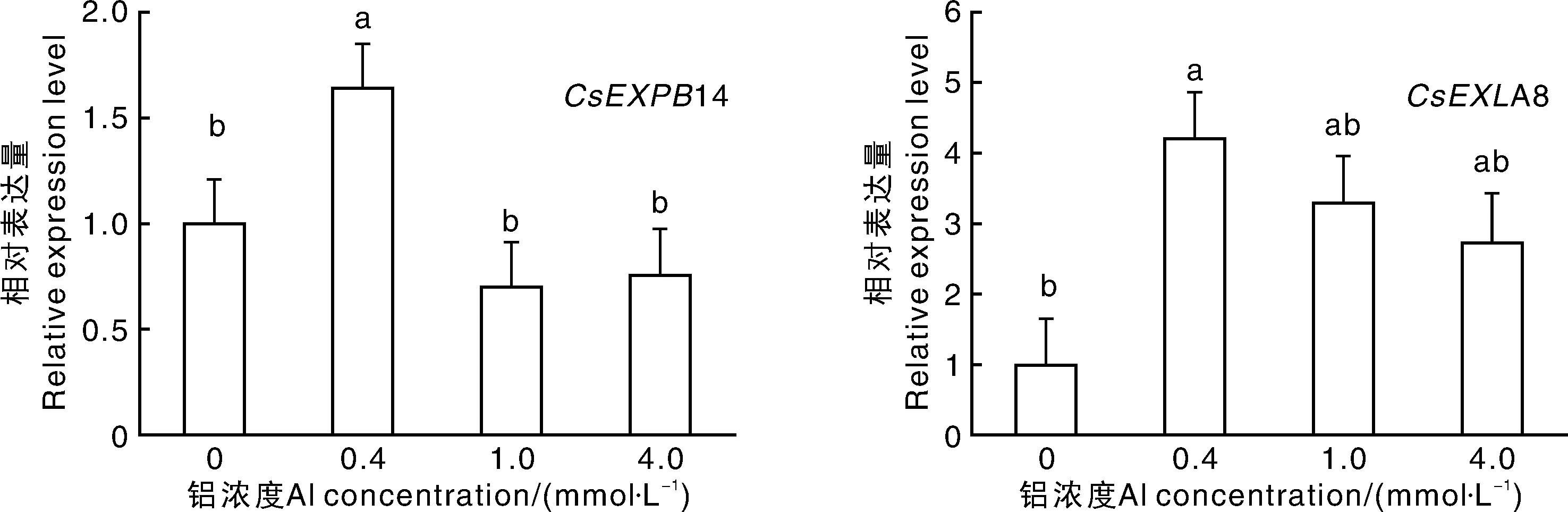
图4 铝对茶树根系XTHs和 Expansins基因表达的影响Fig.4 Effects of Al on XTHs and Expansins gene expression in root of tea plants
对不同铝浓度处理后的茶树根系转录组进行分析鉴定,发现4条unigenes分别与猕猴桃基因XTH14、番茄基因XTH23、水稻基因EXPB14、水稻基因EXLA8序列高度同源(>70%),将其分别命名为CsXTH14、CsXTH23、CsEXPB14、CsEXLA8,并对不同浓度铝处理后的根系表达进行实时荧光定量PCR分析。图4结果表明,0.4、1.0mmol·L-1铝处理的茶树根系中CsXTH23基因表达量与CK无显著差异,而4.0mmol·L-1铝处理的茶树根系CsXTH23基因的表达量则显著(P<0.05)低于CK,表明CsXTH23主要受高浓度铝的抑制作用。不同铝浓度处理28d后,与CK相比,0.4mmol·L-1铝处理的茶树根系CsXTH14基因表达量最高,但随着铝浓度进一步增加,CsXTH14基因表达量呈现降低趋势,但与CK无显著差异。由此可见,一定浓度的铝可以诱导CsXTH14基因表达,而高浓度铝则会抑制CsXTH14的表达。两个伸展蛋白基因的表达均表现为在0.4mmol·L-1铝处理下最高。但随铝浓度升高,CsEXPB14表达量显著(P<0.05)下调,而CsEXLA8表达量无显著变化。可以看出,铝可以诱导茶树伸展蛋白基因表达,且CsEXPB14对铝浓度的响应更敏感。
2.4 不同铝浓度茶树根系XTHs和Expansins基因表达、XET酶和Expansins蛋白活性与根系生长的相关性
如表2所示,CsXTH23基因表达量与茶树根系总长、根表面积、根体积、根尖数均无显著相关性。CsXTH14基因的表达量与茶树根系总长无显著相关性,与根表面积呈极显著(P<0.01)正相关,与根体积、根尖数呈显著(P<0.05)正相关。
表2不同铝浓度下茶树根系XTHs和Expansins基因表达量、XET酶和Expansins蛋白活性、根系生长的相关系数
Table2Correlation coefficients withinXTHsandExpansinsgene expression level,XET and Expansins activities and root growth under different Al concentrations in root of tea plants
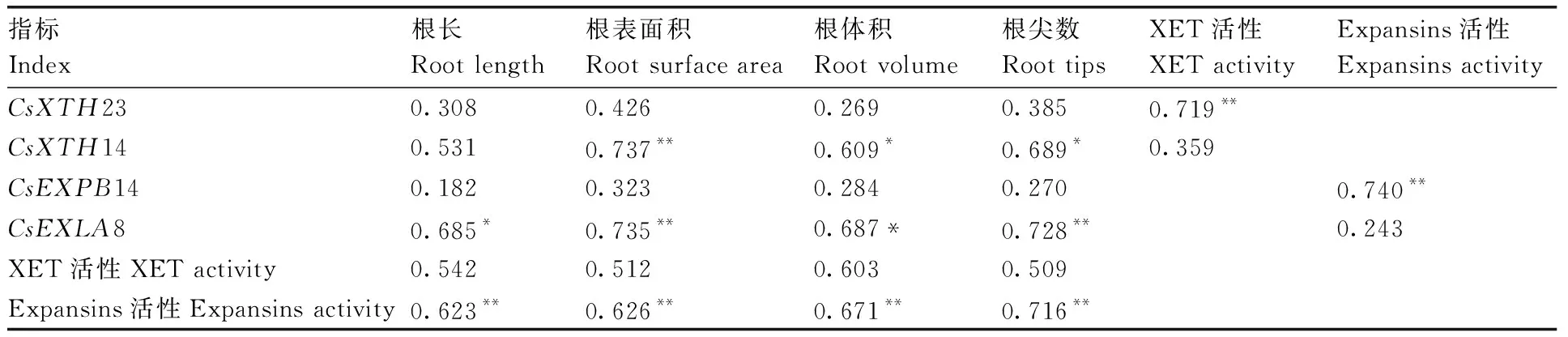
指标Index根长Root length根表面积Root surface area根体积Root volume根尖数Root tipsXET活性XET activityExpansins活性Expansins activityCsXTH230.3080.4260.2690.3850.719**CsXTH140.5310.737**0.609*0.689*0.359CsEXPB140.1820.3230.2840.2700.740**CsEXLA80.685*0.735**0.687*0.728**0.243XET活性XET activity0.5420.5120.6030.509Expansins活性Expansins activity0.623**0.626**0.671**0.716**
*,P<0.05;**,P<0.01.
XET活性与根系总长、根表面积、根体积、根尖数无显著相关性,但与CsXTH23基因的表达量呈极显著(P<0.01)正相关。CsEXPB14基因表达量与茶树根系总长、根表面积、根体积、根尖数无显著相关性。CsEXLA8基因表达量与茶树根系总长、根体积均呈显著(P<0.05)正相关,与根表面积、根尖数呈极显著(P<0.01)正相关。Expansins活性与根系总长、根表面积、根体积、根尖数均呈极显著(P<0.01)正相关,且与CsEXPB14基因表达量亦呈极显著(P<0.01)正相关。
3 讨论
铝作为地壳中分布最广的金属元素,在酸性土壤条件下,容易因土壤中的铝含量过高而对植物造成毒害,从而抑制植物根系的生长。研究报道,低浓度的铝即显著抑制水稻、玉米等作物根系的生长[28-29]。然而,植物对铝的抗性会因植物种类不同或基因型不同而有显著差异。茶树作为典型的聚铝植物,对铝具有很高的耐受性,其成熟叶片中的铝含量可高达2%,且已有的研究结果表明,一定浓度的铝可促进茶树根系的生长[2-4]。本实验结果显示,与无铝对照相比,加铝处理,尤其是0.4 、1.0mmol·L-1的铝处理,能够显著诱导根系的膨大、伸长、分生,从而促进茶树根系的生长。这与吴琼鸯等[2]、王敏等[4]的研究结果一致。表明适度的铝对茶树根系不仅没有产生毒害作用,反而有较好的促进作用。但随着铝浓度的增加(>1.0mmol·L-1),这种促进作用逐渐减弱,表明茶树根系对铝的响应存在生理阈值。
通过对根系生长相关细胞壁关键蛋白XET与Expansins蛋白活性的分析,发现低于1.0mmol·L-1铝浓度处理下,XET和Expansins蛋白活性显著增强,XET活性直到4.0mmol·L-1铝条件下才受显著抑制。对于不耐铝的拟南芥等植物来说,50μmol·L-1的铝即可使其根系中的XET酶钝化[24,30],由此可见,茶树根系中XET酶的铝耐受性要远高于拟南芥等,0.4mmol·L-1的铝处理不仅没有抑制XET酶和Expansins蛋白的活性,反而增强了其蛋白活性。推测茶树XET酶和Expansins蛋白对铝响应存在特异性的分子机制,这是今后应予研究的重点。大量研究表明,XET和Expansins活性与植物生长密切相关,在干旱胁迫下,伸展蛋白活性与小麦胚芽鞘长度之间的相关性达极显著水平[31],XET活性与生长速率呈现密切相关性[32-34]。本研究表明,Expansins活性与根系总长、根表面积、根体积、根尖数均呈显著正相关,可见茶树中Expansins活性的增强可起到促进茶树根系生长的作用。
通过对茶树根系XTHs和Expansins基因表达的分析,发现0.4mmol·L-1铝浓度下CsXTH14基因表达显著上调,而拟南芥中50μmol·L-1浓度铝即已抑制XTH14基因表达[30],可见茶树根系XTH14基因对铝的耐受性远高于拟南芥。杨亮[35]研究表明,XTH14在拟南芥根系、种子、幼苗、胚根中表达丰度较高,在其他组织器官中表达丰度均较低,推测XTH14可能在幼苗根系生长过程中具有重要作用。本研究显示,CsXTH14与茶树根尖数、根表面积和根体积存在显著的正相关关系,表明适当的铝处理可诱导XTH14基因的表达,以促进不定根的形成、根细胞的膨大,从而促进根系的生长。XTH23与根系生长无显著相关性,表明不同XTHs基因家族成员对铝的响应也具有差异性。与茶树根系生长相关的Expansins基因家族中,CsEXLA8与CsEXPB14基因表达量在0.4mmol·L-1的铝浓度下最高。Che等[26]在水稻中的研究发现,铝处理诱导了水稻根系OsEXPA10的上调表达,敲除株系的根系生长受到显著抑制,表明铝诱导OsEXPA10基因表达参与了根系生长。本研究表明,CsEXLA8基因表达量与茶树根系总长、根表面积、根体积、根尖数均呈显著正相关关系,这与在大豆、水稻、小麦上的研究结果EXP基因表达与生长密切相关[19,36-38]的结论是一致的。由此可见,铝可以诱导CsEXLA8基因表达,促进茶树根细胞膨大、伸长及不定根形成,从而促进茶树根系的生长。
综上,茶树对不同铝浓度的响应存在明显差异,0.4、1.0mmol·L-1的铝处理均能促进茶树根系的生长,当铝浓度增加至4.0mmol·L-1时,其对茶树根系生长的促进作用变弱。根系生长与XTHs和Expansins基因表达及相应的蛋白活性呈正相关关系,一定浓度的铝(≤1.0mmol·L-1)处理可诱导根系XTHs和Expansins基因表达上调,提高XET和Expansins活性,促进茶树根细胞膨大、伸长及不定根形成,从而促进茶树根系的生长。
:
[1] TAYLOR G J.Current views of the aluminum stress response:the physiological basis of tolerance[J].CurrentTopicsinPlantBiochemistryandPhysiology,1991,10:57-93.
[2] 吴琼鸯,郑伟伟,罗亮,等.铝对茶树根系生理的影响[J].湖北农业科学,2005(3):80-82.
WU Q Y,ZHENG W W,LUO L,et al.Effect of aluminum on the physiological characteristics of tea root system[J].HubeiAgriculturalSciences,2005(3):80-82.(in Chinese with English abstract)
[3] 于翠平,潘志强,陈杰,等.铝对茶树生长与生理特性影响的研究[J].植物营养与肥料学报,2012,18(1):182-187.
YU C P,PAN Z Q,CHEN J,et al.Effects of Al3+on growth and physiological characteristics of tea plant(Camelliasinensis)[J].PlantNutritionandFertilizerScience,2012,18(1):182-187.(in Chinese with English abstract)
[4] 王敏,宁秋燕,石元值.茶树幼苗对不同浓度铝的生理响应差异研究[J].茶叶科学,2017,37(4):356-362.
WANG M,NING Q Y,SHI Y Z.Study on physiological response of tea plant(Camelliasinensis) seedlings to different aluminum concentrations[J].JournalofTeaScience,2017,37(4):356-362.(in Chinese with English abstract)
[5] 潘根生,MASAKI TSUJI,小西茂毅.茶根尖细胞各胞器分部的分离及其铝的分布[J].浙江农业大学学报,1991,17(3):255-258.
PAN G S,MASAKI T,SHIGEKI K.Isolation of cell organelles from the tip-root cells of tea and their distribution of aluminum[J].ActaAgriculturacUniversitatisZhejiangensis,1991,17(3):255-258.(in Chinese with English abstract)
[6] 刘腾腾,郜红建,宛晓春,等.铝对茶树根细胞膜透性和根系分泌有机酸的影响[J].茶叶科学,2011,31(5):458-462.
LIU T T,GAO H J,WAN X C,et al.Impacts of aluminum on root cell membrane permeability and organic acids in root exudates of tea plant[J].JournalofTeaScience,2011,31(5):458-462.(in Chinese with English abstract)
[7] 小西茂毅.铝对茶树生长的促进作用[J].茶叶,1995,21(3):18-22.
SHIGEKI K.Promotion effect of aluminum on root growth of tea plant[J].JournalofTea,1995,21(3):18-22.(in Chinese)
[8] FUNG K F,CARR H P,ZHANG J H,et al.Growth and nutrient uptake of tea under different aluminum concentrations[J].JournaloftheScienceofFoodandAgriculture,2008,88(9):1582-1591.
[9] HAJIBOLAND R,BARCELO J,POSCHENRIEDER C,et al.Amelioration of iron toxicity:a mechanism for aluminum-induced growth stimulation in tea plants[J].JournalofInorganicBiochemistry,2013,128:183-187.
[10] XU Q S,WANG Y,DING Z T,et al.Aluminum induced metabolic responses in two tea cultivars[J].PlantPhysiologyandBiochemistry,2016,101:162-172.
[11] LI Y,HUANG J,SONG X W,et al.An RNA-Seq transcriptome analysis revealing novel insights into aluminum tolerance and accumulation in tea plant[J].Planta,2017,246(1):91-103.
[12] XU Q S,WANG Y,DING Z T,et al.Aluminum induced physiological and proteomic responses in tea(Camelliasinensis) roots and leaves[J].PlantPhysiologyandBiochemistry,2017,115:141-151.
[13] ROSE J K C,BRAAM J,FRY S C,et al.The XTH family of enzymes involved in xyloglucan endotransglucosylation and endohydrolysis:current perspectives and a new unifying nomenclature[J].PlantandCellPhysiology,2002,43(12):1421-1435.
[14] BRAY E A.Genes commonly regulated by water-deficit stress inArabidopsisthaliana[J].JournalofExperimentalBotany,2004,55(407):2331-2341.
[15] MCQUEEN-MASON S,COSGROVE D J.Disruption of hydrogen bonding between plant cell wall polymers by proteins that induce wall extension[J].ProceedingsoftheNationalAcademyofSciences,1994,91(14):6574-6578.
[16] MCQUEEN-MASON S,COSGROVE D J.Expansin mode of action on cell walls:analysis of wall hydrolysis,stress relaxation,and binding[J].PlantPhysiology,1995,107(1):87-100.
[17] VISSENBERG K,FRY S C,PAULY M,et al.XTH acts at the microfibril-matrix interface during cell elongation[J].JournalofExperimentalBotany,2005,56(412):673-683.
[18] OSATO Y,YOKOYAMA R,NISHITANI K.A principal role forAtXTH18 inArabidopsisthalianaroot growth:a functional analysis using RNAi plants[J].JournalofPlantResearch,2006,119(2):153-162.
[19] LEE D K,AHN J H,SONG S,et al.Expression of an expansin gene is correlated with root elongation in soybean[J].PlantPhysiology,2003,131(3):985-997.
[20] LÜ P T,KANG M,JIANG X Q,et al.RhEXPA4,a rose expansin gene,modulates leaf growth and confers drought and salt tolerance toArabidopsis[J].Planta,2013,237(6):1547-1559.
[21] YU Z M,KANG B,HE X W,et al.Root hair-specific expansins modulate root hair elongation in rice[J].ThePlantJournal,2011,66(5):725-734.
[22] MA N,WANG Y,QIU S,et al.Overexpression ofOsEXPA8,a root-specific gene,improves rice growth and root system architecture by facilitating cell extension[J].PloSOne,2013,8(10):e75997.
[23] ZOU H,WEN Y,ZANG G,et al.OsEXPB2,a β-expansin gene,is involved in rice root system architecture[J].MolecularBreeding,2015,35:41.
[24] YANG L J,ZHU X F,PENG Y X,et al.Cell wall hemicellulose contributes significantly to aluminum adsorption and root growth inArabidopsis[J].PlantPhysiology,2011,155(4):1885-1892.
[25] ZHU X F,SHI Y Z,LEI G J,et al.XTH31,encoding aninvitroXEH/XET active enzyme,regulates aluminum sensitivity by modulatinginvivoXET action,cell wall xyloglucan content,and aluminum binding capacity inArabidopsis[J].ThePlantCell,2012,24(11):4731-4747.
[26] CHE J,YAMAJI N,SHEN R F,et al.An Al-inducible expansin gene,OsEXPA10 is involved in root cell elongation of rice[J].ThePlantJournal,2016,88(1):132-142.
[27] COSGROVE D J,LI Z C.Role of expansins in cell enlargement of oat coleoptiles:analysis of developmental gradients and photocontrol[J].PlantPhysiology,1993,103:1321-1328.
[28] 鲍学敏,赵学强,肖作义,等.铝对不同耐铝水稻品种根系生长和养分吸收的影响[J].植物生理学报,2015,51(12):2157-2162.
BAO X M,ZHAO X Q,XIAO Z Y,et al.Effects of aluminum on the root growth and nutrient uptake of two rice varieties with different aluminum tolerances[J].PlantPhysiologyJournal,2015,51(12):2157-2162.(in Chinese with English abstract)
[29] 曾巧英,王蕴波,杨泉女,等.不同浓度铝胁迫对甜玉米幼苗生长的影响研究[J].佛山科学技术学院学报(自然科学版),2009,27(2):5-8.
ZENG Q Y,WANG Y B,YANG Q N,et al.Influence of different aluminum(Al) stress on the growth of sweet corn seedling[J].JournalofFoshanUniversity(NaturalScienceEdition),2009,27(2):5-8.(in Chinese with English abstract)
[30] 朱晓芳.拟南芥细胞壁半纤维素结合铝的机制及其调控[D].杭州:浙江大学,2014.
ZHU X F.The binding of aluminum by cell wall hemicelluloses and its regulation inArabidopsis[D].Hangzhou:Zhejiang University,2014.(in Chinese with English abstract)
[31] 赵美荣,李永春,刘辉,等.抗旱性不同的小麦扩展蛋白活性及基因表达分析[J].江苏农业科学,2016,44(1):108-110.
ZHAO M R,LI Y C,LIU H,et al.Analysis of expansins activity and gene expression with different drought resistance wheat[J].JiangsuAgriculturalSciences,2016,44(1):108-110.(in Chinese)
[32] WU Y J,JEONG B R,FRY S C,et al.Change in XET activities,cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential[J].Planta,2005,220(4):593-601.
[33] ALONSO-SIMON A,GARCIA-ANGULO P,ENCINA A E,et al.Increase in XET activity in bean(PhaseolusvulgarisL.) cells habituated to dichlobenil[J].Planta,2007,226(3):765-771.
[34] POTTER I,FRY S C.Changes in xyloglucan endotransglycosylase(XET) activity during hormone-induced growth in lettuce and cucumber hypocotyls and spinach cell suspension cultures[J].JournalofExperimentalBotany,1994,45:1703-1710.
[35] 杨亮.XET/XTH功能及基因家族表达模式的研究进展[J].吉林农业,2011(3):65-67.
YANG L.Study process of XET/XTH function and gene family expression patterns[J].JilinAgricultural,2011(3):65-67.(in Chinese)
[36] CHO H T,KENDE H.Expression of expansin genes is correlated with growth in deepwater rice[J].PlantCell,1997,9:1661-1671.
[37] GAO Q,ZHAO M R,LI F,et al.Expansins and coleoptile elongation in wheat[J].Protoplasma,2008,233:73-81.
[38] XING S C,LI F,GUO Q F,et al.The involvement of an expansin geneTaEXPB23 from wheat in regulating plant cell growth[J].BiologiaPlantarum,2009,53(3):429-434.
ResponsesofExpansinsandXTHstodifferentaluminumconcentrationainrootsofteaplant[Camelliasinensis(L.)O.Kuntze]
NING Qiuyan1,2,FAN Kai1,WANG Min1,2,SHI Yuanzhi1,*
(1.TeaResearchInstitute,ChineseAcademyofAgricultureSciences,KeyLaboratoryforTeaPlantBiologyandResourceUtilization,MinistryofAgricultureandRuralAffairs,Hangzhou310008,China;2.GraduateSchool,ChineseAcademyofAgriculturalSciences,Beijing100081,China)
Abstract:In order to investigate the effect of aluminium(Al) on root growth of tea plants [Camelliasinensis(L.) O.Kuntze],Anjibaicha tea plant was selected as study material with different Al concentrations for 28d.Then,the phenotypic differences and parameters of roots,activities of the Expansins and xyloglucan endotransglucosylase(XET),and the gene expression level ofExpansinsandXTHs,which were related with root growth and key proteins of cell wall were assayed.The results showed that the Al could promote the root growth of tea plant on phenotypic and parameters.The treatment with 0.4,1.0mmol·L-1Al showed significant(P<0.05) difference with control,as the root total length was increased by 206% and 209%,respectively,the number of root tips was increased by 175% and 166%,respectively,the root surface area was increased by 227% and 286%,respectively,and the root volume was increased by 246% and 385%,respectively.Correspondingly,the gene expression level ofCsEXPB14 and the expansins-like geneCsEXLA8 in the roots treated with 0.4mol·L-1Al were significantly(P<0.05) higher than those without Al or with 4.0mmol·L-1Al.The expansins activity in the roots with 0.4mmol·L-1Al was higher than other treatments and was increased by 84.3% as compared to the control.The expression level ofCsXTH14 in the roots with 0.4,1.0mmol·L-1Al were significantly(P<0.05) higher than the other treatments,and XET activity was increased with the elevated Al concentration,and was significantly(P<0.05) inhibited until the Al concentration reached up to 4.0mmol·L-1.The gene expression level ofExpansinsandXTHs,the activities of XET and Expansins showed a positive correlation with root growth of tea plant,which indicated that Al(≤1mmol·L-1) could increase XET and Expansins activity by promoting the gene expression ofExpansinsandXTHs,hence,promote root growth of tea plants.
Key words:environmental stress;plant nutrition;beverage crop;gene expression;root growth
中图分类号:S571.1
A
文章编号:1004-1524(2018)06-0961-09
收稿日期:2017-09-18
基金项目:国家自然科学基金(31572199);中国农业科技创新工程(CAAS-ASTIP-2017-TRICAAS)
作者简介:宁秋燕(1991—),女,河南商丘人,硕士研究生,主要从事茶树生理与营养方面的研究。E-mail:861731507@qq.com
,石元值,E-mail:shiyz@tricaas.com
10.3969/j.issn.1004-1524.2018.06.11
(责任编辑高 峻)
