尾状核−眶部内侧前额叶的功能连接与反应性攻击的关系:基于静息态功能磁共振研究
2018-06-22侯璐璐李长燃王焕贞
江 琦 侯璐璐,2 邱 江 李长燃 王焕贞
(1西南大学心理学部, 心理健康教育中心, 重庆 400715) (2南京大学社会学院心理学系, 南京 210023)(3西南大学心理学部, 认知与人格教育部重点实验室, 重庆 400715)
1 引言
反应性攻击(reactive aggression)是指在被激惹后产生的冲动的、不假思索的指向另一个人并对其造成伤害的行为(Anderson & Bushman, 2002)。由于反应性攻击会造成很大的社会危害, 因而受到社会学、心理学等多学科的广泛关注(Herpertz et al.,2017; McEwen & McEwen, 2017; Fite, Rubens,Preddy, Raine, & Pardini, 2014)。近年来, 研究者试图采用事件相关电位、脑成像等方法对反应性攻击的神经机制进行探讨。已有对具有较高攻击性的病人以及正常人进行的脑成像研究表明, 可能存在一个网络与反应性攻击相关, 这个网络包括杏仁核(Amygdala; McCloskey et al., 2016)、尾状核(Glenn& Yang, 2012)和 OMPFC (Beyer, Münte, Göttlich, &Krämer, 2015)。研究者进一步指出降低的前额叶皮层的活动与升高的皮层下脑区的活动(如杏仁核、尾状核) 可能共同导致了反应性攻击的发生(Rosell& Siever, 2015; Siever, 2008; Nelson & Trainor,2007), 也就是说反应性攻击的产生可能源于前额叶皮层与皮层下脑区的功能连接失调。
已有研究或者根据相关研究(如 Coccaro,McCloskey, Fitzgerald, & Phan, 2007), 或者通过对比攻击性较强的病人、罪犯与正常人群的大脑活动差异(如Motzkin, Newman, Kiehl, & Koenigs, 2011)来推论反应性攻击的神经机制, 这些探索虽然为揭示反应性攻击的神经机制起到了重要的启示作用, 但是尚不能提供直接的实证证据加以证实。究其原因, 在于反应性攻击的发生涉及多个心理过程(Bettencourt, Talley, Benjamin, & Valentine, 2006;Ramirez & Andreu, 2006), 这无疑为揭示其神经机制造成了很大的困难。因此, 近年来一些研究者开始尝试运用经典的攻击范式及其变式来探讨反应性攻击的神经机制, 其中, Taylor攻击范式(Taylor Aggression Paradigm, TAP; Taylor, 1967)是应用较为广泛的一种经典的攻击范式(Riva et al., 2017;Liu, Teng, Lan, Zhang, & Yao, 2015)。在经典的Taylor攻击范式中, 主试安排被试与另一个(虚假)对手进行反应时任务的竞赛, 每次竞争中速度快的一方可以为速度慢的一方施加电击(或噪音), 然后根据施加的电压或者噪音强度来判断被试的反应性攻击。已有研究表明, 该范式具有良好的效度(Giancola& Parrott, 2008)。2007 年, Krämer, Riba, Richter和Münte进而把Taylor攻击范式中的虚假对手增加为两个, 分别对应激发与非激发条件, 从而可以有效分析激发条件对被试反应性攻击的影响。但是, 综合分析近年来针对正常人群的利用 Taylor范式及其变式对反应性攻击的神经机制进行的研究(Beyer,Münte, Erdmann, & Krämer, 2014; Beyer et al., 2015;Krämer, Rib, Richter, & Münte, 2011; Krämer, Jansma,Tempelmann, & Münte, 2007; Lotze, Veit, Anders, &Birbaumer, 2007)可以发现, 这类研究的实验设置都各有不同, 甚至同一个课题组基于研究目的不同也对同一范式做了不同程度的修改, 因此得到的结论各不相同, 并且难以直接进行比较。那么, 是否可以找到一种稳定的指标, 通过找到其与反应性攻击的关系, 进而探讨反应性攻击的神经机制呢?已经较为成熟的静息态功能磁共振技术为我们提供了新的思路。
静息态功能磁共振具有不受实验任务的限制和制约、能够可靠地测量到大脑内在的自发活动等优势(Zuo et al., 2010), 被广泛应用于健康被试与病人的研究中, 以用于发现个体在静息状态下大脑活动情况与某些疾病、特质以及行为的关系(Fulwiler,King, & Zhang, 2012; Wu et al., 2011; Greicius et al.,2007)。功能连接的方法普遍被用来探索脑区之间的联系以及这种联系与某种特定的心理和行为之间的关系(Takeuchi et al., 2012; Zeng et al., 2012;Hahn et al., 2011)。近年来, 该方法在攻击性相关领域也获得了一些有意义的结果, 例如 Hoptman等(2010)的研究表明, 比起正常个体, 患有精神分裂症的病人的杏仁核与腹侧前额叶的功能连接降低,并且功能连接的强度与攻击性呈负相关关系。
然而, 上述研究均是采用相关分析的方法考察脑区之间的协同工作, 还不能反映脑区之间信息的输入输出方向等关系。因此, 有研究者进一步认为广义的功能连接应该分为(狭义的)功能连接(Functional Connectivity, FC)与效应连接(Effective Connectivity,EC)。关于效应连接的分析中, 格兰杰因果分析(Granger Causality Analysis, GCA)受到研究者们的广泛关注和青睐。它主要是利用多重线性回归的方法考察某个脑区在过去某一时间点的活动是否可以反映现在另外一个脑区的活动情况, 可以揭示脑区之间单向的因果关系(Hamilton, Chen, Thomason,Schwartz, & Gotlib, 2011; Chen, Hamilton, Thomason,Gotlib, & Saad, 2009)。
Coccaro, Sripada, Yanowitch 和 Phan (2011)基于以往研究指出, OMPFC与反应性攻击密切相关。OMPFC能对攻击冲动进行有效调控, Pietrini,Guazzelli, Basso, Jaffe和Grafman (2000)给被试呈现一系列的场景要求被试抑制或者表达对侵犯者的攻击, 结果显示当被试抑制攻击冲动时, OMPFC激活程度增强。而OMPFC损伤的病人不能对敌意反应进行调节(Koenigs & Tranel, 2007), 脾气变得暴躁(Damasio, Grabowski, Frank, Galaburda, & Damasio,1994)。OMPFC还与社会情绪信息加工相关, Beyer等(2015)的研究通过在TAP范式的决策阶段之前增加面孔(愤怒或者中性), 来考察愤怒在反应性攻击中的作用, 结果显示呈现愤怒面孔时, OMPFC的激活程度与反应性攻击负相关显著, 这表明 OMPFC对社会情绪信息(即, 情绪面孔)的反应可以预测其随后的反应性攻击行为。New等(2007)在比较有边缘人格障碍的个体与正常个体的大脑活动情况时发现, 比起那些有边缘性人格障碍的个体, 正常个体的OMPFC与杏仁核之间的“耦合”更强。此外, 比起正常的个体, 当看到愤怒的面孔时, 患有间歇性爆发障碍的个体(攻击性较强)OMPFC与杏仁核之间的功能连接下降(Coccaro et al., 2007)。da Cunha-Bang等(2017)研究显示, 比起正常人, 暴力罪犯在受到敌意激发后, 反应性攻击更强, 尾状核和杏仁核的激活强度升高, 并且尾状核−前额叶以及杏仁核−前额叶的功能连接降低。以上研究都显示OMPFC与反应性攻击密切相关, 可以对敌意反应以及攻击冲动进行抑制, 并且和杏仁核、尾状核等皮层下脑区的连接也在反应性攻击中起着重要作用。另外, TAP范式由于虚假对手的设置使得被试在实验过程中处于一种“竞争和人际对抗”的背景下(Giancola & Parrott, 2008), 具有较强的社会互动性, 而OMPFC在社会情绪信息加工、情绪性决策方面, 尤其是社会互动背景下发挥重要作用(Rudebeck,Bannerman, & Rushworth, 2008), 因此OMPFC可以作为本研究的种子点。
综上所述, 本研究拟选取OMPFC作为种子点,首先运用静息态功能连接方法探索眶部内侧前额叶−皮层下脑区的功能连接及其与反应性攻击的关系; 其次, 进一步运用格兰杰因果模型分析探讨静息状态下眶部内侧前额叶−皮层下脑区的效应连接及其与反应性攻击的关系。基于以往的研究结果(da Cunha-Bang et al., 2017; Coccaro et al., 2007; New et al., 2007), 我们假设OMPFC与皮层下脑区(例如,杏仁核、尾状核)的连接与反应性攻击负相关, 即当OMPFC与皮层下脑区的连接较强时, 个体反应性攻击较低; 反之, 当 OMPFC与皮层下脑区的连接较弱时, 个体反应性攻击较强。在理论层面, 本研究利用静息态功能磁共振技术的特点避开了任务态功能磁共振研究因受任务设置不同而导致的结论分歧的不足, 直接为前额叶皮层−皮层下脑区功能连接与反应性攻击的关系研究提供了新的实证证据, 为全面揭示反应性攻击的神经机制提供了重要的基线资料。在实践层面, 本研究可以为针对高反应性攻击倾向个体在认知神经层面的预测和诊断提供理论指导。
2 方法
2.1 被试
本研究随机选取了 43名健康右利手在校大学生, 其中男性 19名, 女性 23名, 年龄 18~22岁(20.05 ± 0.92)。所有被试视力或者校正视力正常,无色盲, 无精神疾病史和手术外伤史。本实验通过了西南大学脑成像中心伦理委员会批准, 与所有被试签订了知情同意书, 并在实验结束后给予一定的报酬。
2.2 范式
本研究采取了被广泛使用的 Taylor攻击范式(Taylor Aggression Paradigm, TAP), 行为学数据采集实验采用E-prime 2.0进行。图1呈现了单个试次的流程, 首先在屏幕上出现一个时间为8 s的注视点“+”, 然后屏幕上会出现此次的竞争对手(1号或者2号), 在此过程中, 被试需要通过按键做出为1~8的强度的噪音惩罚的选择1Level 1为70 db,Level 8为105 db,每级相差5 db。在练习阶段,被试已经听了Level 2、Level 5和Level 8的噪音强度。。接下来是竞争反应时任务, 即当屏幕上出现一个白色圆圈的时候被试必须尽可能快的按键, 紧接着被试会收到此回合的输赢的结果和对手为他选择的惩罚强度。
需要注意的是, 在整个实验过程中并没有真正的两位对手与被试共同完成竞争反应时任务, 所有的反馈都是电脑按如下参数进行设置的结果:对手1总是做出强度为1~4的选择, 平均为2.0, 为非激发条件; 对手 2总是做出 5~8的选择, 平均为 6.5,为激发条件。为了使实验更具有真实性, 将实验分为3个run进行, 每个run中包括20个trials, 被试成功的次数占一半。为了增加反馈结果的真实性,我们参考以往研究(Maren, 2001), 对反馈结果的出现做了如下设置:在第一个 run, 被试与 1号对手的竞争中胜利3次, 失败7次, 被试与2号对手的竞争中胜利7次, 失败3次; 在第二个run, 被试与1号对手的竞争中胜利 5次, 失败 5次, 被试与 2号对手的竞争中胜利5次, 失败5次; 在第三个run,被试与1号对手的竞争中胜利7次, 失败3次, 被试与2号对手的竞争中胜利3次, 失败7次, 即随着实验的进行, 被试受到的惩罚越来越大。
2.3 实验程序
被试进入实验室后, 首先签署知情同意书。然后由主试介绍实验程序, 被试在扫描室外完成练习实验, 确保被试了解指导语并且能正确做出反应,然后由扫描员将其送入扫描室, 依次进行静息态、任务态和结构像的扫描2由于篇幅所限,本文没有呈现任务态中的结果。。
2.4 数据采集
MRI数据采集使用西门子3.0T磁共振扫描仪(Siemens Medical, 德国), 被试的头部使用MRI兼容的泡沫垫固定以减少头动。扫描前, 让被试更换实验室专用服装, 以避免衣服上的金属物体对被试安全和成像质量的影响, 同时取下被试佩戴的金属首饰或者假牙等。在结构像和静息态扫描的过程中,都要求被试睁开眼睛看屏幕上的注视点, 保持头部不要发生移动, 不要想特殊的事情。
T1加权结构像使用磁化准备快递采集梯度回波序列(magnetization-prepared rapid acquisition gradient echo, MPRAGE)采集, 具体扫描参数为:重复时间(repetition time, TR) = 2600 ms, 回波时间(echo time, TE) = 3.02 ms, 反转角(flip angle) = 8°,层厚(slice thickness) = 1.0 mm, 矩阵(matrix) = 256 ×256, 体素大小(voxel size) = 1 mm × 1 mm × 1 mm,扫描176层覆盖全脑。

图1 实验流程图
静息态数据使用 EPI (gradient-echo planar imaging, EPI)序列采集, 具体扫描参数为:重复时间(repetition time, TR) = 2000 ms, 回波时间(echo time, TE) = 30 ms, 反转角(flip angle) = 90°, 层厚(slice thickness) = 3 mm, 层间距(slice gap) = 1 mm,矩阵(matrix) = 64 × 64, 体素大小(voxel size) =3.4 mm × 3.4 mm × 4 mm, 层数(slices) = 32, 扫描时间为8分钟零4秒, 共获得242个时间点的图像。
2.5 数据预处理
静息态数据使用 DPARSF软件(http://www.restfmri.net/forum/DPARSF)进行预处理(Yan & Zang,2010)。具体流程包括:第一步, 将原始DICOM数据转换为 NIFTI数据格式; 第二步, 为了避免磁共振信号开机时的不稳定和被试刚刚进入扫描仪的不适应带来的影响, 删除前10个时间点的数据, 最终剩余 232个时间点进行后续处理; 第三步, 时间层校正(slice timing), 参考层为每个全脑扫描过程中位于中间时间点的那一层; 第四步, 头动校正(realign), 将平动超过了 2 mm或者转动超过了 2°的被试进行排除; 第五步, 去除协变量(nuisance covariates regression), 包括6个头动参数和白质信号、脑脊液信号; 第六步, 采用DARTEL进行空间标准化(spatial normalization), 将图像配准到标准MNI (montreal neurological institute)空间; 第七步,高斯平滑(smoothing), 平滑核(FWHW) = 4 mm; 最后, 进行带通滤波(band filter), 范围为0.01~0.1 Hz。
2.6 数据分析
2.6.1 行为数据分析
为了检验激发条件实验操作的有效性, 将两种条件下被试为对手选择的惩罚强度进行配对样本 t检验, 然后将被试选择的惩罚等级的平均数作为被试反应性攻击的指标。
2.6.2 fMRI数据分析
利用SPM8 (http://www.fil.ion.ucl.ac.uk/spm/)下的 marsbar工具包(Brett, Anton, Valabregue, &Poline, 2002)选取 OMPFC作为种子点, 参考以往文献中的做法(Beyer et al., 2015; Tzourio-Mazoyer et al., 2002), 分别选取 AAL模板中左右两侧MNI_Frontal_Med_Orb和MNI_Rectus制作左右两侧OMPFC的感兴趣区(Region of Interest, ROI)。
利用REST (Song et al., 2011)的工具包下的FC工具计算 OMPFC与全脑的功能连接(voxel-wise),之后使用SPM8的多元回归(multiple regression)模型分析方法计算OMPFC与全脑的功能连接(voxelwise)与反应性攻击相关的脑区, 其中被试的性别、年龄作为协变量回归掉。接下来, 将上一步中显著的区域保存为ROI, 利用REST工具包下的FC工具计算双侧OMPFC与这些ROI的FC值(ROI-wise),计算 FC值与反应性攻击的Pearson相关系数; 最后, 利用REST工具包下的GCA工具计算这些ROI与OMPFC的GCA值(ROI-wise), 计算GCA值与反应性攻击的Pearson相关系数。
需要注意的是, 由于FC值不符合正态分布, 因此涉及到功能连接的两步, 我们均进行了 Fisher-z转换, 并且利用z转化后的值用于进一步的分析。另外, 由于脑成像数据分析过程中存在多重比较而使结果带有误差, 因此在全脑分析中, 使用体素水平p< 0.001, 团块水平p <0.05(使用FDR进行多重比较校正), 团块大小(cluster sizes) > 20体素作为阈值。
3 结果
3.1 行为实验结果
所有行为数据采用SPSS 16.0进行分析。对激发与非激发条件下被试选择的惩罚强度进行配对样本t检验的结果表明, 激发条件下被试为对手选择的惩罚强度显著高于非激发条件下选择的惩罚强度:激发条件:M= 3.91,SD= 1.71, 非激发条件:M= 3.11,SD= 1.49;t(38) = 3.44,p< 0.01, Cohen’d= 0.55。
3.2 脑成像数据结果
3.2.1 功能连接结果
将OMPFC与全脑的功能连接进行多元回归分析, 其中性别和年龄作为协变量控制。结果表明,左侧OMPFC与右侧角回、双侧尾状核以及双侧内侧前额叶的功能连接与反应性攻击相关显著, 右侧OMPFC与右侧尾状核以及右内侧前额叶的功能连接与反应性攻击相关显著, 见表 1。由于内侧前额叶不属于皮层下脑区, 因此后续的分析只针对左侧OMPFC与尾状核、角回以及右侧OMPFC与尾状核的功能连接与反应性攻击的关系。
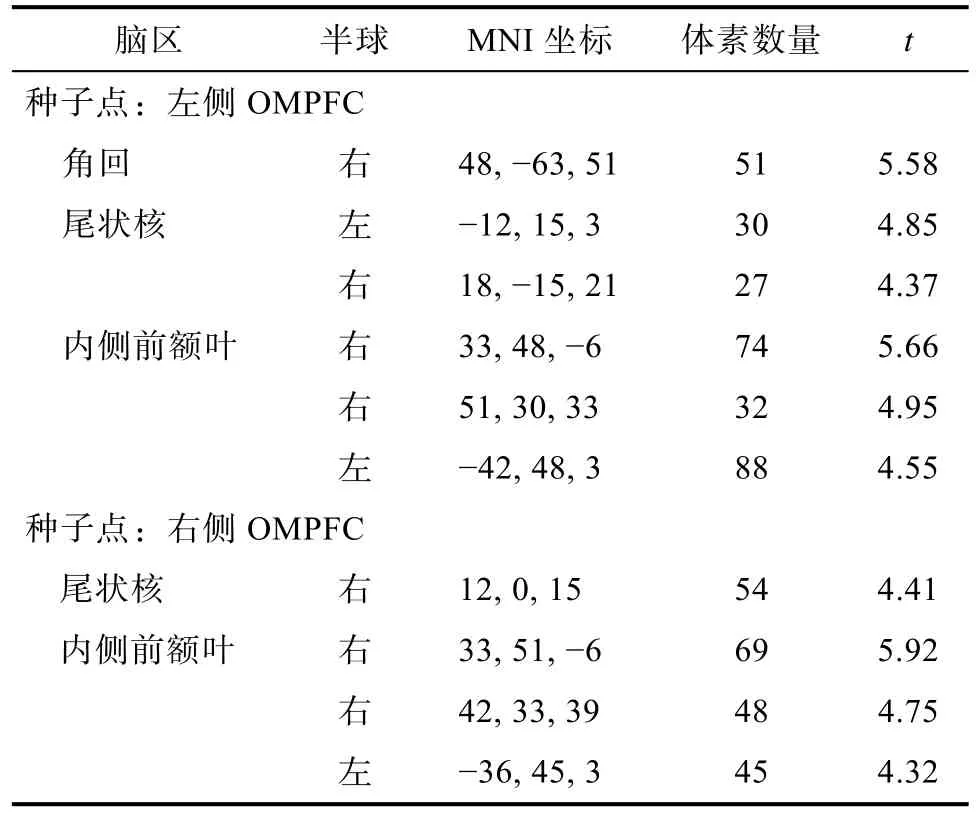
表1 双侧OMPFC功能连接结果
为了考察双侧OMPFC与皮层下脑区的功能连接与反应性攻击的关系, 我们进一步提取上一步中显著的皮层下脑区与OMPFC的功能连接值与反应性攻击做Pearson相关。结果显示, 左侧 OMPFC与右侧角回(r= −0.44,p< 0.005, 见图2)、左侧OMPFC 与左侧尾状核(r= −0.53,p< 0.001, 见图3)、左侧 OMPFC 与右侧尾状核(r= −0.59,p< 0.001,见图4)以及右侧OMPFC与右侧尾状核(r= −0.61,p< 0.001, 见图5)的FC值与反应性攻击均显著负相关, 并且不受激发条件的影响(即各功能连接值与两种激发条件下被试的反应性攻击负相关均显著,p< 0.05)。各功能连接值与反应性攻击的相关矩阵如表2所示。
3.2.2 格兰杰因果分析结果
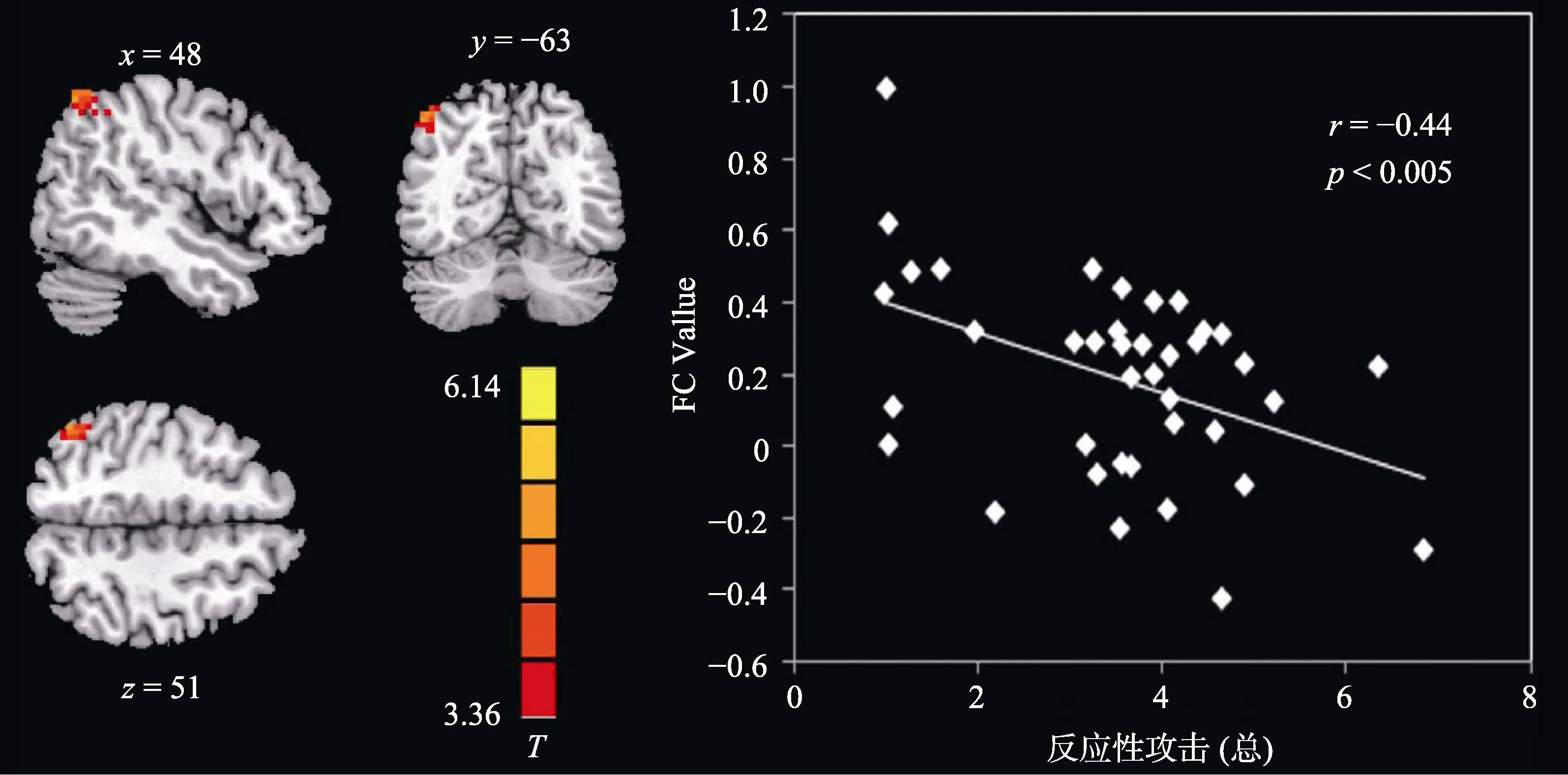
图2 左侧OMPFC−右侧角回的功能连接与反应性攻击相关显著(FC值使用z转化之后的值)

图3 左侧OMPFC−左侧尾状核的功能连接与反应性攻击相关显著(FC值使用z转化之后的值)

图4 左侧OMPFC−右侧尾状核的功能连接与反应性攻击相关显著(FC值使用z转化之后的值)

图5 右侧OMPFC−右侧尾状核的功能连接与反应性攻击相关显著(FC值使用z转化之后的值)

表2 功能连接值与反应性攻击的相关矩阵
由于功能连接反映的是脑区之间的相关关系,不能反映信息输入输出的方向, 因此我们进一步采用 GCA考察脑区之间效应连接的异常与反应性攻击之间的关系。由于ROI水平的GCA分两种情况,即信息输入和信息输出, 上述4个功能连接一共产生8种因果关系。即左侧OMPFC→左侧尾状核、左侧OMPFC→右侧尾状核、左侧OMPFC→右侧角回、右侧 OMPFC→右侧尾状核、左侧尾状核→左侧OMPFC、右侧尾状核→左侧OMPFC、右侧角回→左侧OMPFC以及右侧尾状核→右侧OMPFC。GCA分析的结果显示, 只有右侧尾状核→右侧OMPFC的效应连接与反应性攻击显著负相关(r=−0.36,p< 0.05), 其他效应连接与反应性攻击均不相关(ps > 0.05), 如图6所示。进一步对激发、非激发条件下的反应性攻击与右侧尾状核→右侧OMPFC的GCA值进行相关分析, 结果表明, 右侧尾状核→右侧OMPFC与激发条件下的反应性攻击显著负相关(r= −0.33,p< 0.05), 而与非激发条件下的反应性攻击相关不显著(r= −0.31,p> 0.05)。效应连接值与反应性攻击的相关矩阵如表 3所示,散点图如图6所示。

图6 右侧尾状核→右侧OMPFC的效应连接与反应性攻击相关显著(左为反应性攻击、右为激发条件下的反应性攻击)

表3 效应连接值与反应性攻击的相关性统计
4 讨论
研究通过采用 TAP变式, 运用高空间分辨率的功能磁共振成像技术, 探索性地对反应性攻击的神经机制进行了功能连接和效应连接分析, 为进一步理解反应性攻击的本质提供了实证支持。在功能连接分析中, 我们发现右侧角回、双侧尾状核与左OMPFC的功能连接以及右侧尾状核与右 OMPFC的功能连接与反应性攻击相关显著。在进一步的格兰杰因果分析中, 我们发现右侧尾状核到右侧OMPFC的效应连接在反应性攻击中起着重要的作用, 这与以往采用任务态功能磁共振技术的研究中发现前额叶皮层以及尾状核在反应性攻击中起着重要作用的结果相一致(Krämer et al., 2007), 并且使用静息态功能磁共振的手段对已有研究进行有益补充。
OMPFC在情绪相关的决策, 尤其在社会互动背景下的情绪性决策中起着重要的作用(Rudebeck et al., 2008), 如在Gage个案以及一些类似案例中,当 OMPFC受损之后, 个体变得暴躁、攻击性强(Blair, 2012; Damasio et al., 1994)。具体而言, OMPFC与攻击冲动、敌意反应的抑制有关(Koenigs & Tranel,2007; Pietrini et al., 2000)。在本研究中, 我们选取OMPFC作为种子点考察正常人群OMPFC与其他脑区的关系在反应性攻击中的作用, 结果发现OMPFC与尾状核的连接与反应性攻击相关显著,这说明不仅 OMPFC损伤的病人反应性攻击增多,而且在正常人群中, OMPFC与尾状核的连接也与反应性攻击密切相关。因此, 在本研究中选取OMPFC作为种子点, 有效地反映了前额叶皮质与其他脑区的协同作用在反应性攻击中的作用。
尾状核是确保个体灵活应对环境的重要区域,对奖赏的事件或者信号做出反应而对不带奖赏性质的信号则没有反应(Zink, Pagnoni, Martin-Skurski,Chappelow, & Berns, 2004)。然而, 有几种类型的非奖赏刺激也可以激活尾状核, 这表明尾状核能够编码所有显著刺激, 因为虽然这些刺激本身不具有奖赏的性质, 但是被个体认为是具有奖赏性质的(Zink,Pagnoni, Martin, Dhamala, & Berns, 2003)。研究者采用任务态功能磁共振技术探讨反应性攻击的神经机制时进一步发现了, 尾状核的激活可能与实施反应性攻击这一行为被个体认知为一种奖赏信号有关。例如, Krämer等人(2007)的研究采用TAP和任务态fMRI发现了尾状核的激活程度与被试为对手选择的惩罚强度成正相关关系, 也就是说当被试为虚拟对手选择了更大的惩罚等级时, 尾状核被显著激活。Beyer等人(2014)的研究也表明, 尾状核的激活程度与反应性攻击之间有着相关关系。另外一项研究发现早期反馈阶段尾状核的激活情况预测了后期决定阶段反应性攻击的强度(Krämer et al.,2011)。这些使用 TAP的研究一致地发现了尾状核在反应性攻击产生过程中的作用, 当反应性攻击行为被认为是受到奖赏时则尾状核得到激活。
其他研究采用奖赏相关的任务发现, 患有与攻击性增强有关的精神疾病或者人格障碍的个体对奖赏的敏感性增强。例如, Völlm等(2007)对有反社会人格或者边缘人格障碍的个体以及正常个体进行研究, 在任务中对被试的某些反应给予奖赏而对另外一部分反应则不给奖赏, 研究结果显示, 对比奖赏与非奖赏条件(即奖赏−非奖赏), 有人格障碍的个体比正常控制组的个体的尾状核活动更低。随后的两项研究进一步证明, 这种有人格障碍的人之所以在奖赏和非奖赏条件下的尾状核活动差异减小, 是由于其在非奖赏条件下的活动高于正常群体所导致的(Gatzke-Kopp et al., 2009; Finger et al.,2008)。也就是说, 对于正常被试来讲, 在奖赏条件下尾状核激活, 而在非奖赏条件下, 尾状核激活强度下降或者不被激活; 而对于患有人格障碍的个体(例如, 边缘性人格障碍等)来说, 在奖赏和非奖赏条件下尾状核都被激活。综上, 尾状核的激活与反应性攻击密切相关, 那些攻击性较强的个体对奖赏的敏感性增强, 当刺激不具有奖赏性质时, 尾状核仍然激活, 甚至, 当实施反应性攻击被认为“受到了奖赏”时, 尾状核也会相应地被更大程度激活。
在发现与反应性攻击相关的关键脑区的基础上, 越来越多的研究者指出反应性攻击的产生是由于前额叶皮层与皮层下脑区功能连接失调引起的(Rosell & Siever, 2015; Siever, 2008; Nelson &Trainor, 2007)。一项研究同时使用了正电子断层扫描(Positron Emission Tomography, PET)和任务态功能磁共振技术的技术发现了尾状核和执行功能区域之间在结构和功能上都存在着很强的联系(Grahn,Parkinson, & Owen 2009)。da Cunha-Bang 等人(2017)采用点减攻击范式(point subtraction aggression paradigm, PSAP)比较正常个体和暴力罪犯在受到敌意激发(输掉代金币)后大脑的活动情况, 结果显示比起正常个体, 暴力罪犯在受到敌意激发后, 反应性攻击更强, 尾状核的激活强度升高, 并且尾状核−前额叶的功能连接降低。我们的研究结果一致的发现了, 在正常群体中, 尾状核−前额叶(主要是OMPFC)的功能连接与反应性攻击负相关。
此外, 由于功能连接分析只能得到脑区之间的相关关系, 而无法确定影响方向的问题, 也就是说反应性攻击的增加到底是由于尾状核对OMPFC自下而上信息传递存在问题还是由于OMPFC对尾状核自上而下的调控功能不足导致的呢?因此, 在功能分析的基础上, 我们进一步使用格兰杰因果分析对效应连接与反应性攻击的关系进行探讨。结果表明, 右侧尾状核到右侧OMPFC的效应连接与反应性攻击呈显著的负相关关系, 右侧尾状核到右侧OMPFC的GCA值越大, 则反应性攻击越弱。因此,我们推测反应性攻击的增强是由于个体大脑内部尾状核对OMPFC的自下而上的信息传递出现问题导致的。鉴于没有直接的相关研究可以对此作出解释, Sagvolden, Johansen, Aase和Russell (2005)关于注意缺损障碍(Attention Deficit Hyperactivity Disorder,ADHD)的理论为我们提供了新的思路, 他们认为ADHD的发生与多巴胺系统的信号传递失调有关。后来该理论也被用来解释其他行为问题的产生, 如外部行为障碍(Externalizing Behavior Disorders;Shannon, Sauder, Beauchaine, & Gatzke-Kopp, 2009)。已有关于多巴胺系统的研究显示, 在大脑内部存在4条多巴胺回路, 其中两条回路与攻击行为相关:第一条包括尾状核、杏仁核、海马等皮层下脑区; 另外一条包括背外侧前额叶、前部扣带回、颞叶和OMPFC等脑区(Gatzke-Kopp & Beauchaine, 2007)。有研究者进一步指出, 综合考虑多条多巴胺回路之间的关系可能对于揭示目标导向行为更为准确和合理(Björklund & Dunnett, 2007)。由于尾状核和OMPFC都是多巴胺回路的一部分, 因此, 我们推测比起正常的个体, 那些反应性攻击较强的个体也有可能是由于大脑内部多巴胺系统存在问题, 使得某些行为与可能结果之间的关系不能被正确认识,从而导致在某些情境(如敌意情境)下, 皮层下那条回路被“误”激活, 致使尾状核对 OMPFC的自下而上的信息传递出现了问题。但是反应性攻击与ADHD以及外部行为障碍还存在很大的差异, 因此至于这种尾状核到右侧OMPFC的效应连接中出现的信息传递问题究竟是否是多巴胺系统的失调导致尚需采用PET等技术进一步研究来揭示和证明。另外, 该分析结果还显示这种相关关系在激发条件下显著,而在非激发条件下不显著, 这可能是由于激发条件下尾状核更容易被“误”激活引起的。
值得注意的是, 很多早期基于病人的研究提出杏仁核与反应性攻击相关, 例如, 在对癫痫病人的研究中, 一致地发现了电刺激杏仁核导致会攻击反应(Mark, Sweet, & Ervin, 1975), 切除杏仁核或者对杏仁核结构造成损伤则可以用来降低反应性攻击(Lee et al., 1998; Narabayashi, Nagao, Saito, Yoshida,& Nagahata, 1963)。近期一些研究也证明了杏仁核以及杏仁核−前额叶皮质的功能连接在反应性攻击中的作用, 例如上文提到的 da Cunha-Bang等人(2017)的研究结果也显示比起正常人, 暴力罪犯在受到敌意激发后, 反应性攻击更强, 尾状核和杏仁核的激活强度升高, 并且尾状核−前额叶以及杏仁核−前额叶的功能连接降低。比起普通罪犯, 患有精神疾病的罪犯在静息状态下杏仁核−内侧前额叶的功能连接较低(Motzkin et al., 2011)。而在本研究中, 却未能发现杏仁核−OMPFC之间的功能连接与反应性攻击相关, 据推测, 可能是由以下原因导致的:首先, 越来越多的研究者提出, 杏仁核不是一个功能单一的区域, 也就是说不同的区域可能功能存在差异, 其中被广泛认同的一个观点是杏仁核主要由基底外侧、中央内侧以及表面组成(Sah,Faber, Lopez de Lopez, & Power, 2003), 其中表面的作用很少得到揭示, 而基底外侧主要负责感觉信息的输入, 中央内侧主要是负责输出到其他脑区。就反应性攻击来讲, 外侧杏仁核负责整合输入的信息并激发中央核唤起“战或逃”的反应(Davis & Whalen,2001; Maren, 2001; LeDoux, 2000, 1998), 中央核则负责放大或抑制反应性攻击的倾向(Dębiec, 2005;Huber, Veinante, & Stoop, 2005)。以往关于脑形态学的研究也发现, 整个杏仁核的体积与特质攻击相关不显著, 而背侧杏仁核的体积则与特质攻击相关(Gopal et al., 2013), 因此, 在未来的研究中应该将杏仁核区分为不同的亚区来考察杏仁核−OMPFC的功能连接与反应性攻击的关系。其次, 在以往使用 TAP范式的任务态研究中一致地没有发现杏仁核的激活(Krämer et al., 2007; Lotze et al., 2007),因此, 是否 TAP范式不能很好检测到杏仁核的激活甚至TAP范式的行为指标也不能反映出杏仁核−前额叶皮质的功能连接与反应性攻击的关系也有待进一步研究。
当然, 本研究也存在一些不足。例如, 种子点的选取差异可能会对结果产生影响, 因此, 在未来的研究中可以选择其他的种子点考察其与其他脑区的协同作用在反应性攻击产生过程中的作用。另外, 本研究以普通大学生为被试, 得到的结论是否适用于暴力罪犯或者患有精神分裂症等精神疾病的个体, 还有待进一步的考察。
5 结论
本研究采用被广泛使用的TAP, 运用静息态功能成像技术对反应性攻击的脑机制进行了研究。功能连接的结果发现了双侧OMPFC与尾状核之间的功能连接与反应性攻击呈负相关。格兰杰因果分析的结果进一步表明右侧尾状核到右侧OMPFC的效应连接与反应性攻击负相关。与以往采用任务功能态的研究一致地发现了尾状核在反应性攻击中的作用, 为进一步揭示反应性攻击的神经机制提供了部分证据, 是首个利用静息态功能连接和效应连接对反应性攻击进行系统分析的研究。
Anderson, C. A., & Bushman, B. J. (2002). Human aggression.Annual Review of Psychology, 53(1), 27−51.
Bettencourt, B. A., Talley, A., Benjamin, A. J., & Valentine, J.(2006). Personality and aggressive behavior under provoking and neutral conditions: A meta-analytic review.Psychological Bulletin, 132(5), 751−777.
Beyer, F., Münte, T. F., Erdmann, C., & Krämer, U. M. (2014).Emotional reactivity to threat modulates activity in mentalizing network during aggression.Social Cognitive and Affective Neuroscience, 9(10), 1552−1560.
Beyer, F., Münte, T. F., Göttlich, M., & Krämer, U. M. (2015).Orbitofrontal cortex reactivity to angry facial expression in a social interaction correlates with aggressive behavior.Cerebral Cortex, 25(9), 3057−3063.
Björklund, A., & Dunnett, S. B. (2007). Dopamine neuron systems in the brain: An update.Trends in Neurosciences,30(5), 194−202.
Blair, R. J. R. (2012). Considering anger from a cognitive neuroscience perspective.Wiley Interdisciplinary Reviews:Cognitive Science, 3(1), 65−74.
Brett, M., Anton, J. L., Valabregue, R., & Poline, J. B. (2002).Region of interest analysis using the MarsBar toolbox for SPM 99.NeuroImage, 16(2), S497.
Chen, G., Hamilton, J. P., Thomason, M. E., Gotlib, I. H., Saad,Z. S., & Cox, R. W. (2009). Granger causality via vector auto-regression tuned for fMRI data analysis. InProceedings of the 17th annual scientific meeting and exhibition(Vol.17, p. 1718). Honolulu, Hawaii.
Coccaro, E. F., McCloskey, M. S., Fitzgerald, D. A., & Phan,K. L. (2007). Amygdala and orbitofrontal reactivity to social threat in individuals with impulsive aggression.Biological Psychiatry, 62(2), 168–178.
Coccaro, E. F., Sripada, C. S., Yanowitch, R. N., & Phan, K. L.(2011). Corticolimbic function in impulsive aggressive behavior.Biological Psychiatry, 69(12), 1153−1159.
da Cunha-Bang, S., Fisher, P. M., Hjordt, L. V., Perfalk, E.,Skibsted, A. P., Bock, C., ... Knudsen, G. M. (2017).Violent offenders respond to provocations with high amygdala and striatal reactivity.Social Cognitive and Affective Neuroscience, 12(5), 802−810.
Damasio, H., Grabowski, T., Frank, R., Galaburda, A. M., &Damasio, A. R. (1994). The return of Phineas Gage: Clues about the brain from the skull of a famous patient.Science,264(5162), 1102−1105.
Davis, M., & Whalen, P. J. (2001). The amygdala: Vigilance and emotion.Molecular Psychiatry, 6(1), 13−34.
Dębiec, J. (2005). Peptides of love and fear: Vasopressin and oxytocin modulate the integration of information in the amygdala.BioEssays, 27(9), 869−873.
Finger, E. C., Marsh, A. A., Mitchell, D. G., Reid, M. E., Sims,C., Budhani, S., ... Blair, J. R. (2008). Abnormal ventromedial prefrontal cortex function in children with psychopathic traits during reversal learning.Archives of General Psychiatry, 65(5), 586−594.
Fite, P. J., Rubens, S. L., Preddy, T. M., Raine, A., & Pardini,D. A. (2014). Reactive/proactive aggression and the development of internalizing problems in males: The moderating effect of parent and peer relationships.Aggressive Behavior, 40(1), 69−78.
Fulwiler, C. E., King, J. A., & Zhang, N. Y. (2012). Amygdalaorbitofrontal resting state functional connectivity is associated with trait anger.Neuroreport, 23(10), 606−610.
Gatzke-Kopp, L. M., & Beauchaine, T. P. (2007). Central nervous system substrates of impulsivity: Implications for the development of attention-deficit/hyperactivity disorder and conduct disorder. In D. Coch, G. Dawson, & K. W.Fischer (Eds.),Human behavior, Learning, and the developing brain: Atypical development(pp. 239−263). New York:Guilford.
Gatzke-Kopp, L. M., Beauchaine, T. P., Shannon, K. E.,Chipman, J., Fleming, A. P., Crowell, S. E., ... Aylward, E.(2009). Neurological correlates of reward responding in adolescents with and without externalizing behavior disorders.Journal of Abnormal Psychology, 118(1), 203−213.
Giancola, P. R., & Parrott, D. J. (2008). Further evidence for the validity of the Taylor aggression paradigm.Aggressive Behavior, 34(2), 214−229.
Glenn, A. L., & Yang, Y. L. (2012). The potential role of the striatum in antisocial behavior and psychopathy.Biological Psychiatry, 72(10), 817−822.
Gopal, A., Clark, E., Allgair, A., D'Amato, C., Furman, M.,Gansler, D. A., & Fulwiler, C. (2013). Dorsal/ventral parcellation of the amygdala: Relevance to impulsivity and aggression.Psychiatry Research: Neuroimaging, 211(1),24−30.
Grahn, J. A., Parkinson, J. A., & Owen, A. M. (2009). The role of the basal ganglia in learning and memory:Neuropsychological studies.Behavioural Brain Research,199(1), 53−60.
Greicius, M. D., Flores, B. H., Menon, V., Glover, G. H.,Solvason, H. B., Kenna, H., ... Schatzberg, A. F. (2007).Resting-state functional connectivity in major depression:Abnormally increased contributions from subgenual cingulate cortex and thalamus.Biological Psychiatry, 62(5), 429−437.
Hahn, A., Stein, P., Windischberger, C., Weissenbacher, A.,Spindelegger, C., Moser, E., ... Lanzenberger, R. (2011).Reduced resting-state functional connectivity between amygdala and orbitofrontal cortex in social anxiety disorder.NeuroImage, 56(3), 881−889.
Hamilton, J. P., Chen, G., Thomason, M. E., Schwartz, M. E.,& Gotlib, I. H. (2011). Investigating neural primacy in major depressive disorder: Multivariate Granger causality analysis of resting-state fMRI time-series data.Molecular Psychiatry, 16(7), 763−772.
Herpertz, S. C., Nagy, K., Ueltzhöffer, K., Schmitt, R.,Mancke, F., Schmahl, C., & Bertsch, K. (2017). Brain mechanisms underlying reactive aggression in borderline personality disorder—Sex matters.Biological Psychiatry,82(4), 257−266.
Hoptman, M. J., D'Angelo, D., Catalano, D., Mauro, C. J.,Shehzad, Z. E., Kelly, A. M. C., ... Milham, M. P. (2010).Amygdalofrontal functional disconnectivity and aggression in schizophrenia.Schizophrenia Bulletin, 36(5), 1020−1028.
Huber, D., Veinante, P., & Stoop, R. (2005). Vasopressin and oxytocin excite distinct neuronal populations in the central amygdala.Science, 308(5719), 245−248.
Koenigs, M., & Tranel, D. (2007). Irrational economic decision-making after ventromedial prefrontal damage:Evidence from the ultimatum game.Journal of Neuroscience,27(4), 951−956.
Krämer, U. M., Jansma, H., Tempelmann, C., & Münte, T. F.(2007). Tit-for-tat: The neural basis of reactive aggression.NeuroImage, 38(1), 203−211.
Krämer, U. M., Riba, J., Richter, S., & Münte, T. F. (2011). An fMRI study on the role of serotonin in reactive aggression.PLoS One, 6(11), e27668.
LeDoux, J. (1998). Fear and the brain: Where have we been,and where are we going?Biological Psychiatry, 44(12),1229−1238.
LeDoux, J. E. (2000). Emotion circuits in the brain.Annual Review of Neuroscience, 23, 155−184.
Lee, G. P., Bechara, A., Adolphs, R., Arena, J., Meador, K. J.,Loring, D. W., & Smith, J. R. (1998). Clinical and physiological effects of stereotaxic bilateral amygdalotomy for intractable aggression.The Journal of Neuropsychiatry and Clinical Neurosciences, 10(4), 413−420.
Liu, Y. L., Teng, Z. J., Lan, H. Y., Zhang, X., & Yao, D. Z.(2015). Short-term effects of prosocial video games on aggression: An event-related potential study.Frontiers in Behavioral Neuroscience, 9, 193.
Lotze, M., Veit, R., Anders, S., & Birbaumer, N. (2007).Evidence for a different role of the ventral and dorsal medial prefrontal cortex for social reactive aggression: An interactive fMRI study.NeuroImage, 34(1), 470–478.
Maren, S. (2001). Neurobiology of Pavlovian fear conditioning.Annual Review of Neuroscience, 24, 897−931.
Mark, V. H., Sweet, W., & Ervin, F. (1975). Deep temporal lobe stimulation and destructive lesions in episodically violent temporal lobe epileptics. In W. Fields & W. Sweet(Eds.),Neural bases of violence and aggression(pp.379−400). St. Louis: Warren H. Greem, Inc.
McCloskey, M. S., Phan, K. L., Angstadt, M., Fettich, K. C.,Keedy, S., & Coccaro, E. F. (2016). Amygdala hyperactivation to angry faces in intermittent explosive disorder.Journal of Psychiatric Research, 79, 34−41.
McEwen, C. A., & McEwen, B. S. (2017). Social structure,adversity, toxic stress, and intergenerational poverty: An early childhood model.Annual Review of Sociology, 43,445−472.
Motzkin, J. C., Newman, J. P., Kiehl, K. A., & Koenigs, M.(2011). Reduced prefrontal connectivity in psychopathy.Journal of Neuroscience, 31(48), 17348−17357.
Narabayashi, H., Nagao, T., Saito, Y., Yoshida, M., & Nagahata,M. (1963). Stereotaxic amygdalotomy for behavior disorders.Archives of Neurology, 9(1), 1−16.
Nelson, R. J., & Trainor, B. C. (2007). Neural mechanisms of aggression.Nature Reviews Neuroscience, 8(7), 536−546.
New, A. S., Hazlett, E. A., Buchsbaum, M. S., Goodman, M.,Mitelman, S. A., Newmark, R., ... Siever, L. J. (2007).Amygdala-prefrontal disconnection in borderline personality disorder.Neuropsychopharmacology, 32(7), 1629−1640.
Pietrini, P., Guazzelli, M., Basso, G., Jaffe, K., & Grafman, J.(2000). Neural correlates of imaginal aggressive behavior assessed by positron emission tomography in healthy subjects.American Journal of Psychiatry, 157(11), 1772−1781.
Ramirez, J. M., & Andreu, J. M. (2006). Aggression, and some related psychological constructs (anger, hostility, and impulsivity) Some comments from a research project.Neuroscience and Biobehavioral Reviews, 30(3), 276−291.
Riva, P., Gabbiadini, A., Lauro, L. J. R., Andrighetto, L.,Volpato, C., & Bushman, B. J. (2017). Neuromodulation can reduce aggressive behavior elicited by violent video games.Cognitive, Affective, and Behavioral Neuroscience, 17(2),452−459.
Rosell, D. R., & Siever, L. J. (2015). The neurobiology of aggression and violence.CNS Spectrums, 20(3), 254–279.
Rudebeck, P. H., Bannerman, D. M., & Rushworth, M. F. S.(2008). The contribution of distinct subregions of the ventromedial frontal cortex to emotion, social behavior,and decision making.Cognitive, Affective, and Behavioral Neuroscience, 8(4), 485−497.
Sagvolden, T., Johansen, E. B., Aase, H., & Russell, V. A.(2005). A dynamic developmental theory of attentiondeficit/hyperactivity disorder (ADHD) predominantly hyperactive/impulsive and combined subtypes.Behavioral and Brain Sciences, 28(3), 397−419.
Sah, P., Faber, E. S. L., Lopez de Lopez, M., & Power, J. P.(2003). The amygdaloid complex: Anatomy and physiology.Physiological Reviews, 83(3), 803−834.
Shannon, K. E., Sauder, C., Beauchaine, T. P., & Gatzke-Kopp,L. M. (2009). Disrupted effective connectivity between the medial frontal cortex and the caudate in adolescent boys with externalizing behavior disorders.Criminal Justice andBehavior, 36(11), 1141−1157.
Siever, L. J. (2008). Neurobiology of aggression and violence.American Journal of Psychiatry, 165(4), 429–442.
Song, X. W., Dong, Z. Y., Long, X. Y., Li, S. F., Zuo, X. N.,Zhu, C. Z., ... Zang, Y. F. (2011). REST: A toolkit for resting-state functional magnetic resonance imaging data processing.PLoS One, 6(9), e25031.
Takeuchi, H., Taki, Y., Hashizume, H., Sassa, Y., Nagase, T.,Nouchi, R., & Kawashima, R. (2012). The association between resting functional connectivity and creativity.Cerebral Cortex, 22(12), 2921−2929.
Taylor, S. P. (1967). Aggressive behavior and physiological arousal as a function of provocation and the tendency to inhibit aggression.Journal of Personality, 35(2), 297−310.
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello,F., Etard, O., Delcroix, N., ... Joliot, M. (2002). Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain.NeuroImage, 15(1), 273−289.
Völlm, B., Richardson, P., McKie, S., Elliott, R., Dolan, M., &Deakin, B. (2007). Neuronal correlates of reward and loss in cluster B personality disorders: A functional magnetic resonance imaging study.Psychiatry Research: Neuroimaging,156(2), 151−167.
Wu, Q. Z., Li, D. M., Kuang, W. H., Zhang, T. J., Lui, S.,Huang, X. Q., ... Gong, Q. Y. (2011). Abnormal regional spontaneous neural activity in treatment-refractory depression revealed by resting-state fMRI.Human Brain Mapping,32(8), 1290−1299.
Yan, C. G., & Zang, Y. F. (2010). DPARSF: A MATLAB toolbox for “pipeline” data analysis of resting-state fMRI.Frontiers in Systems Neuroscience, 413.
Zeng, L. L., Shen, H., Liu, L., Wang, L. B., Li, B. J., Fang,P., ... Hu, D. W. (2012). Identifying major depression using whole-brain functional connectivity: A multivariate pattern analysis.Brain, 135(5), 1498−1507.
Zink, C. F., Pagnoni, G., Martin, M. E., Dhamala, M., & Berns,G. S. (2003). Human striatal response to salient nonrewarding stimuli.Journal of Neuroscience, 23(22), 8092−8097.
Zink, C. F., Pagnoni, G., Martin-Skurski, M. E., Chappelow, J.C., & Berns, G. S. (2004). Human striatal responses to monetary reward depend on saliency.Neuron, 42(3), 509−517.
Zuo, X. N., Di Martino, A., Kelly, C., Shehzad, Z. E., Gee, D.G., Klein, D. F., ... Milham, M. P. (2010). The oscillating brain:Complex and reliable.NeuroImage, 49(2), 1432−1445.
