经颅直流电刺激对健康大学生反应抑制的影响*
2018-06-22王慧慧罗玉丹余凤琼
王慧慧 罗玉丹 石 冰 余凤琼 汪 凯
(安徽医科大学医学心理学系, 合肥 230000)
1 前言
看到红灯信号, 我们停止已经产生的过马路的冲动; 上课铃声响起, 我们抑制从事下一项娱乐活动的想法; 生活中有许多这样的实例, 我们称这种抑制已经形成的动作反应冲动为反应抑制(Andrés,2003)。反应抑制(response inhabition)是抑制住不符合当前需要的或不恰当的行为反应能力, 并使人们能够对变化的环境做出灵活的、目标指向的行为(Logan & Cowan, 1984), 是执行功能的核心成分。已有的许多反应抑制任务的研究, 均报告了以右半球为主的反应抑制网络(response inhabition network,RIN)的存在, RIN的关键脑区包括:背外侧前额叶皮层、右额下回、右额中回、前扣带皮层等(Menon,2011; Bari & Robbins, 2013)。
背外侧前额叶皮层(dorsolateral prefrontal cortex,dlPFC)是备受关注的一个区域, 它在反应抑制中的作用正受到越来越多研究者的重视, 已有的神经心理学研究阐明dlPFC在认知过程中扮演着重要角色,并与控制执行功能密切相关。如有研究者使用功能磁共振成像(functional magnetic resonance imaging,fMRI)技术对不同版本的Go-Nogo任务操作所激活的脑区进行了定位,他们发现在不同版本的Go-Nogo任务中,背外侧前额叶皮层被显著激活(Casey et al.,1997); 同样有人曾使用fMRI研究了dlPFC在反应抑制中的神经基础, 他们使用测量反应抑制的Go-Nogo任务, 通过屏幕呈现基于图形计算机的视觉刺激, 被试仰卧并通过棱形眼镜观看刺激, 并要求被试对 Go刺激做按键反应。实验结果发现, 在Nogo任务中, 右侧 dlPFC较左侧激活程度更强(Konishi et al., 1999); 在赌博成瘾患者存在反应抑制能力损毁的基础上, 比较了赌博成瘾患者与正常被试在 Go-Nogo任务中的血氧水平依赖(Blood Oxygenation Level Dependent, BOLD)强度, 发现在Nogo情境下, 赌博成瘾患者在双侧dlPFC脑区的血氧水平依赖强度低于正常被试(van Holst, van Holstein,van den Brink, Veltman, & Goudriaan, 2012); 以上研究均表明dlPFC是反应抑制的重要脑区。
根据既往关于dlPFC在反应抑制中发挥重要作用的研究基础, 有研究者采用重复经颅磁刺激(Repetitive Transcranial Magnetic Stimulation, rTMS)技术验证了dlPFC在反应抑制中的作用。他们对健康被试在间隔一天的时间内分别施加高频率真刺激和伪刺激, 观察被试在康纳斯连续性能测试中的行为变化:与伪刺激条件相比, 真刺激条件下被试行为水平有较显著变化, 即反应抑制得到提升(Hwang,Kim, Park, Bang, & Kim, 2010)。这一研究采用脑刺激(brain stimulation)的技术, 来改变目标皮层的活动水平, 从因果关系上探究了目标皮层区域与反应抑制之间的关联。
近些年来, 一种新兴的非侵入性的脑刺激技术—经颅直流电刺激(transcranial Direct current stimulation, tDCS)进入了研究者的视线。与 tDCS直接作用于目标皮层不同的是, rTMS是通过储存大量电荷的电容器在极短时间内放电, 使感应线圈产生磁场, 磁场穿透大脑颅骨并在脑内产生反向感生电流, 最终引起脑功能或皮层可塑性的变化。与rTMS相比, tDCS较好的避免了由于穿透颅骨而可能带来的能量衰减; 其次, 从安全性的角度分析,关于rTMS研究中的副反应报道略多, 更为严重的甚至会引发癫痫。tDCS仅有偶尔持续时间短暂的轻微刺痛、皮痒, 目前尚无tDCS诱发癫痫的报道,因此, tDCS是一种比较安全的经颅刺激方式。且相较rTMS, tDCS具有价格低廉、携带方便、操作简单等突出优势。
tDCS是通过海绵电极产生微弱电流直接刺激目标皮层(Palm, Hasan, Strube, & Padberg, 2016),共包括三种刺激类型:阳极刺激、阴极刺激和伪刺激; 研究者发现阳极刺激能增加皮质兴奋性, 阴极刺激降低皮质兴奋性(Nitsche & Paulus, 2000), 从神经元水平分析tDCS的作用机制发现阳极刺激产生去极化并起兴奋作用, 阴极刺激则产生超级化并起抑制作用。此技术越来越多的被应用在认知神经、临床研究及康复等多个领域, 其中也包括验证dlPFC在反应抑制中的作用, 近年来, 也有许多此领域的研究陆续涌现。如有研究者利用tDCS阴极作用于右侧dlPFC, 观察被试在Go-Nogo任务中的行为变化, 发现其虚报率增高, 提示被试抑制能力降低, 而tDCS阳极作用于右侧dlPFC却未能改善被试抑制能力(Beeli, Casutt, Baumgartner, & Jäncke,2008); 利用 tDCS作用于 dlPFC, 采用检索诱导遗忘测试考查被试接受刺激前后的行为变化, 发现阴极刺激能够降低抑制, 以此说明dlPFC脑区的抑制能够降低被试的抑制能力(Penolazzi, Stramaccia,Braga, Mondini, & Galfano, 2014); 使用tDCS激活左侧dlPFC, 并在 Stroop色词任务中发现真刺激组相比于伪刺激组, 反应时间显著降低, 进一步证实 dlPFC是反应抑制的重要脑区(Loftus, Yalcin,Baughman, Vanman, & Hagger, 2015; Brevet-Aeby,Brunelin, Iceta, Padovan, & Poulet, 2016); 在一项对正常人进行的研究中, 研究者使用 tDCS阳极分别作用于右侧dlPFC和左侧dlPFC, 发现在两种刺激下,被试的反应抑制能力均未能得到提升(Dambacher et al., 2015; Brevet-Aeby et al., 2016)。
到目前为止, tDCS刺激dlPFC改变反应抑制加工的研究仍然较少, 研究结果不一致, 主要归因于以下两方面。首先在目标脑区的选取上存在多样性,且有关右侧 dlPFC在反应抑制中的作用研究较少;其次, 在研究范式的选择上存在多样性, 研究反应抑制的常用范式包括Stroop色词任务、反向眼跳任务(anti-saccade task)和Go-Nogo任务、停止信号任务(stop-signal task, SST)等。研究指出Stroop色词任务更多反映对分心刺激的注意控制及选择性注意, 因此可能主要与认知抑制相关(Nigg, 2000); 在反向眼跳任务中, 正向眼跳与反向眼跳间产生的潜伏期差异经常为研究者采用, 并作为衡量抑制功能的指标, 但在反向眼跳任务中, 从提示反向眼跳到靶子出现间存在一段准备时间, 由此有研究者质疑该范式对随后抑制功能考察的可靠性; Go-Nogo任务相比于反向眼跳任务虽然避免了抑制任务前准备时间对随后抑制功能考查的影响, 但有研究者认为 Go-Nogo 任务中被试对 Nogo 刺激的反应可能是其通过选择性注意机制忽视了 Nogo刺激, 而不是被抑制了(Rubia, Smith, Brammer, & Taylor,2003); 相较反向眼跳任务和Go-Nogo任务, SST只包括Go刺激, 不含Nogo刺激, 因而可能是测量反应抑制能力更为纯净的方法。SST符合赛马模型理论, 赛马模型认为反应抑制和反应是两个相互独立而又相互竞争的加工过程, 先达到反应阈限者决定随后行为(王琰, 蔡厚德, 2010)。SST中包括一个较为重要的行为学指标, 即停止信号反应时(stop-signal reaction time, SSRT)。跟踪法设计的SST中SSRT均值等于Go RT均值减SSD均值。SSRT越短, 反应控制效率越高(王琰, 蔡厚德, 2010)。
最后, 在既往已有的相关研究基础上, 本研究选择了右侧dlPFC脑区, 选用了测量反应抑制能力更为纯净的范式。旨在采用 SST, 通过 tDCS阳极作用于右侧dlPFC皮层, 观察被试在刺激前后行为学水平上的变化。本研究假设, 阳极刺激右侧dlPFC会提高被试的反应抑制, 表现在行为学水平上即真刺激前后SSRT差值较伪刺激前后有显著差异。
2 方法
2.1 被试
自2016年12月至2017年8月, 排除脑损伤历史、精神类疾病史等, 使用汉密尔顿抑郁(Hamilton Depression Scale, HAMD)、汉密尔顿焦虑量表(Hamilton Anxiety Scale, HAMA), 排除大于7分的志愿者, 共招募34名(15名男性、19名女性)志愿者, 均为安徽医科大学在读学生(本科生、研究生),平均年龄22.06岁(从19岁~30岁), 平均受教育年限15.68年(从13年~20年), 所有被试均为右利手,身体健康, 无神经精神类疾病及脑损伤历史, 无癫痫或癫痫家族史, 视力正常或矫正后正常, 参与时完全自愿, 充分尊重被试的个人意愿, 实验开始前均签署实验知情同意书, 实验结束时予以一定的劳务费。
2.2 实验设计
实验采用被试内设计, 即同一被试需间隔7天随机接受两次刺激(一次真刺激、一次伪刺激), 在tDCS刺激前后分别完成 SST, 并在每次实验开始前使用HAMA、HAMD测查被试焦虑抑郁水平, 排除焦虑抑郁大于7分的被试; 刺激前后让被试分别完成Stroop色词任务、数字广度任务、词语流畅性,前测用以确保被试接受真刺激与伪刺激前在执行功能、工作记忆、思维流畅性等方面基线值无差异,排除个体差异对实验结果的影响; 同时对刺激前后的测试结果加以比较, 用以观察被试在接受刺激后在执行功能、工作记忆和思维流畅性方面的变化。
2.3 tDCS
本研究采用Starlab研发, NE (Neuroeletrics)公司生产的StarStim经颅直流电刺激仪。使用的是面积为 35 cm² (5 cm × 7 cm)的海绵电极, 并通过蓝牙信号控制电流刺激强度及类型。根据EEG10-20系统扩展的坐标和相关磁共振成像定位研究(Jurcak,Tsuzuki, & Dan, 2007)。将阳极电极固定放置在头皮F4位置, 阴极电极固定在FP1位置(见图1)。已有的tDCS研究通常刺激时长为5~30 min (Palm et al.,2016), 有研究报告称刺激5 min已经可以观察到相应的刺激效应(Boggio, Zaghi, & Fregni, 2009), 综合考虑到实验时长问题, 因此本研究中真刺激时长设置为25 min, 且出于安全性的考虑, 我们将电流强度设置为1.5 mA。伪刺激条件下, 采用1.5 mA的微弱直流电仅刺激被试30 s (Loftus et al., 2015),之后停止刺激(但并不将电极拆除, 电极佩戴在被试头皮上时间同样是25 min, 以确保被试不知道接受的是哪种条件刺激)。在每次实验结束后, 我们会询问被试对此次实验的具体感受, 对表示知道刺激类型的被试予以剔除, 被试均报告两次刺激无差异。真刺激和伪刺激条件下, 电流递增和递减的时间均为8 s。
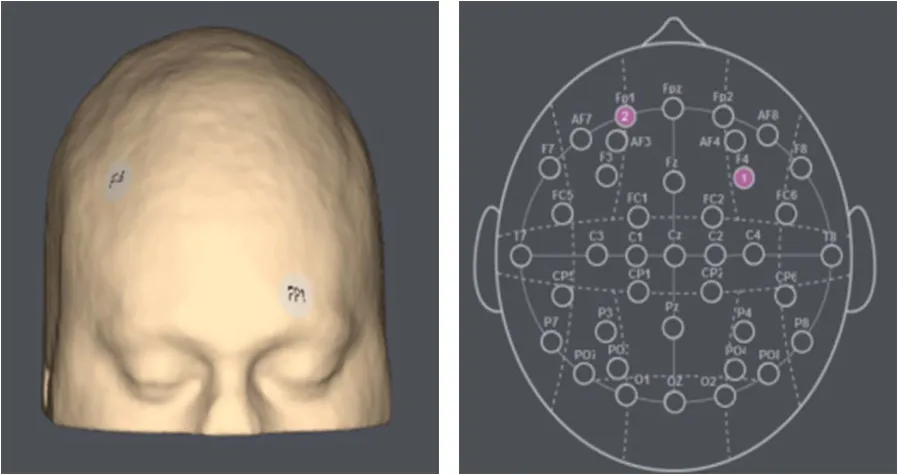
图1 电极片放置位置
2.4 SST
采用E-prime程序在电脑上呈现SST任务, 任务包括 199个 trial, 实验开始之前, 向被试说清指导语, 并予以练习, 使其充分理解任务内容。开始时, 黑色屏幕中央会先呈现白色圆圈作为注视点,200~400 ms后圆圈内出现白色朝左或朝右的箭头,作为Go信号(Go Signal),要求被试看到白色箭头快速按键反应, 箭头朝左按“F”键, 朝右按“J”键, 但其中有些白色箭头会变成红色,红色的箭头即为Stop信号(Stop signal),看到箭头变红要求被试抑制住按键冲动(见图2)。
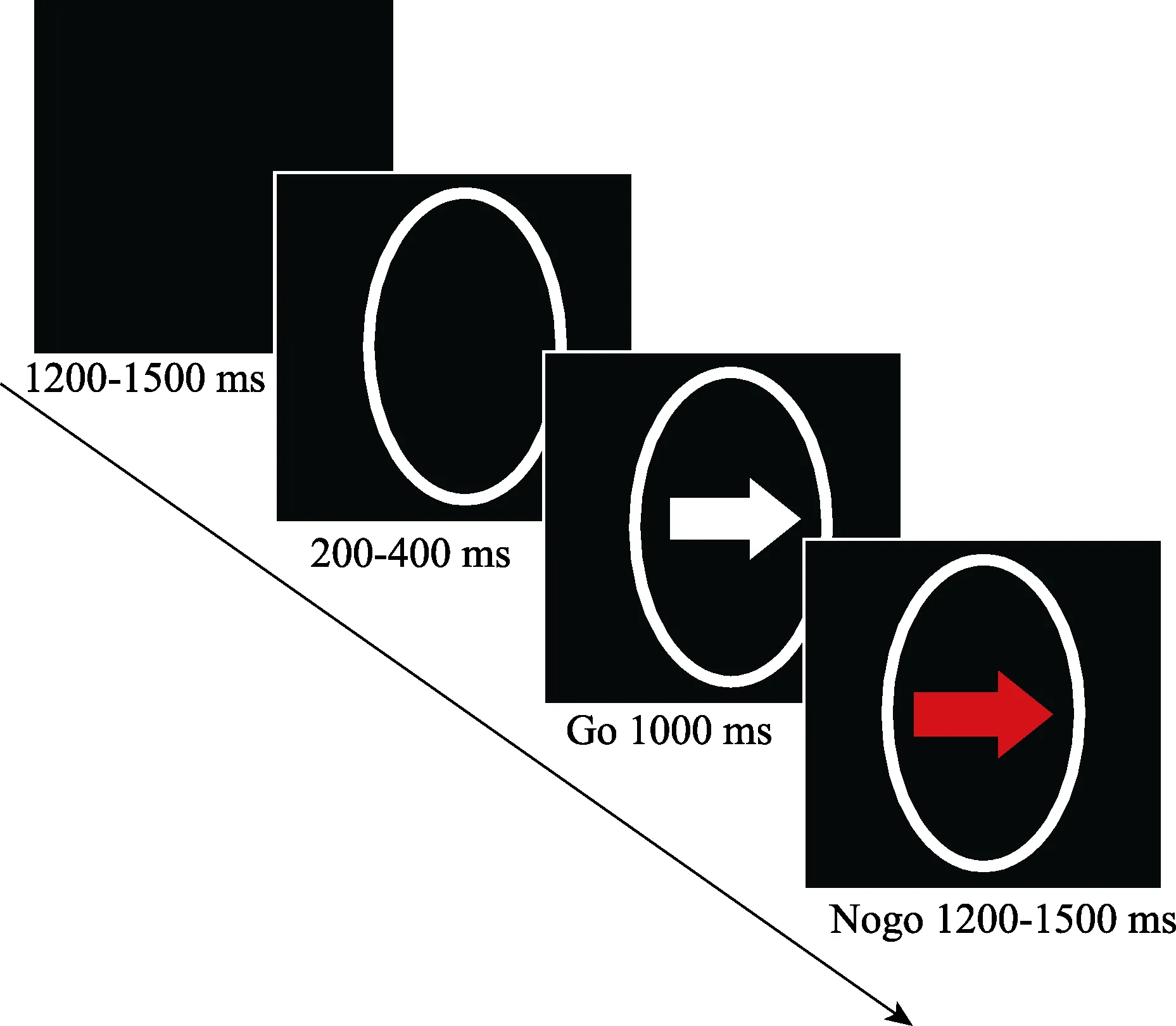
图2 停止信号任务流程图
3 结果
3.1 真伪刺激前后神经心理学测验结果比较
对真伪刺激前后的stroop效应量(stroop色字-stroop字)、数字广度(顺背、倒背)、词语流畅性, 及两种刺激前HAMA、HAMD, 分别使用SPSS 16.0进行配对样本
t
检验。结果显示真伪刺激前HAMA无显著差异,t
(33) = 0.32,p
> 0.05; 真伪刺激前HAMD无显著差异,t
(33) = 0.49,p
>0.05; 真刺激前后数字广度(倒背),t
(33) = 2.23,p
< 0.05, Cohen’d
= 0.22; 伪刺激前后数字广度(倒背),t
(33) = 3.65,p
< 0.01, Cohen’d
= 0.48; 真刺激前后词语流畅性,t
(33) = 4.86,p
< 0.001, Cohen’d
= 0.60; 伪刺激前后词语流畅性,t
(33) = 5.75,p
< 0.001, Cohen’d
=0.93; 均有统计学意义, 并达到显著性水平(见表1)。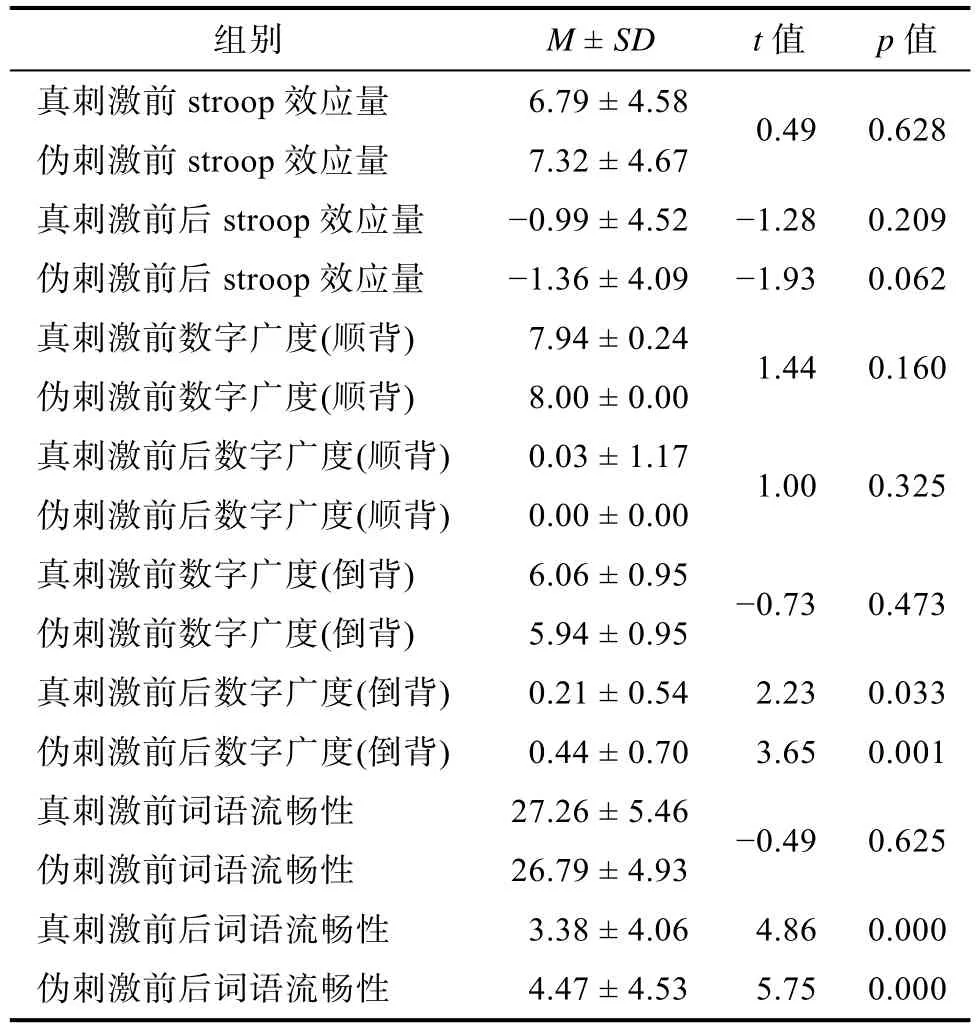
表1 真伪刺激前后神经心理学测验结果比较
3.2 SST任务行为学结果
使用ANALYZE-IT分析软件, 计算出 SSD和Go RT的均值, 得出SSRT值。
3.2.1 刺激前SSRT差异比较
对真刺激前与伪刺激前SSRT值使用SPSS 16.0进行配对样本
t
检验。结果显示真刺激前 SSRT(306.70 ± 44.78 ms)与伪刺激前 SSRT (291.57 ±33.21 ms)无显著差异,t
(33) = 1.84,p
> 0.05, 说明被试在接受真刺激前与伪刺激前反应抑制无差异。3.2.2 刺激前后SSRT差异比较
对真刺激前后和伪刺激前后SSRT值分别进行配对样本
t
检验。结果显示真刺激前后SSRT差异显著,t
(33) = −2.25,p
< 0.05, Cohen’d
= 0.38; 伪刺激前后SSRT无显著差异,t
(33) = 1.99,p
> 0.05 (见表2、图3)。为进一步探究tDCS作用是否存在性别差异, 对真刺激前后男女SSRT值进行重复测量方差分析。结果显示真刺激前后男女SSRT无显著差异,F
(2,32) = 0.50,p
> 0.05, 即tDCS的作用不存在性别差异(如图4、图5)。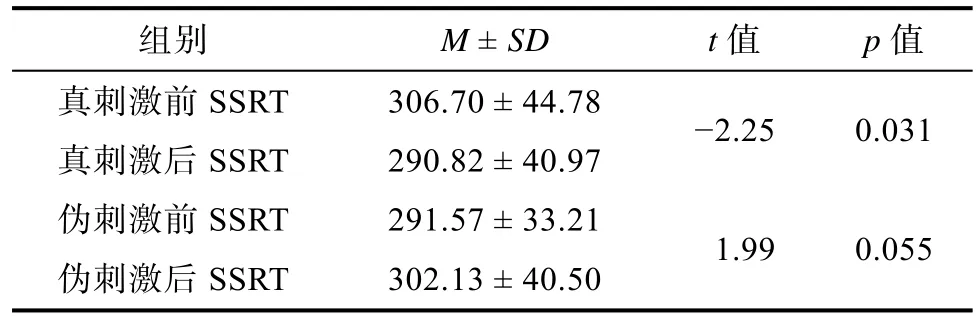
表2 刺激前后SSRT差异比较
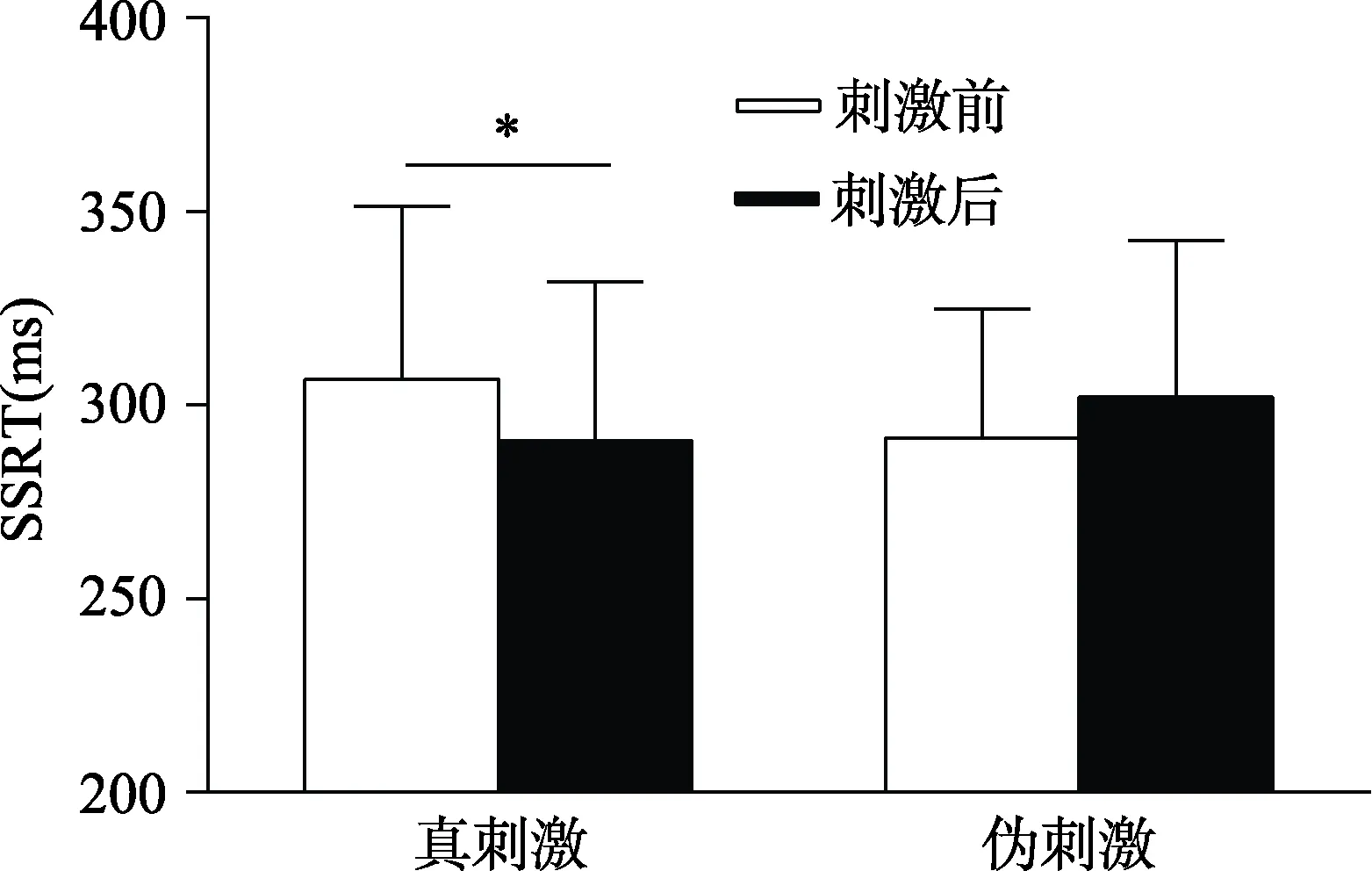
图3 刺激前后SSRT值
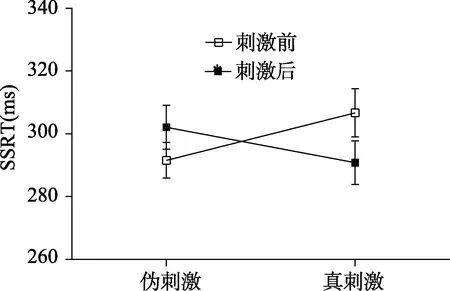
图4 真刺激和伪刺激前后SSRT值
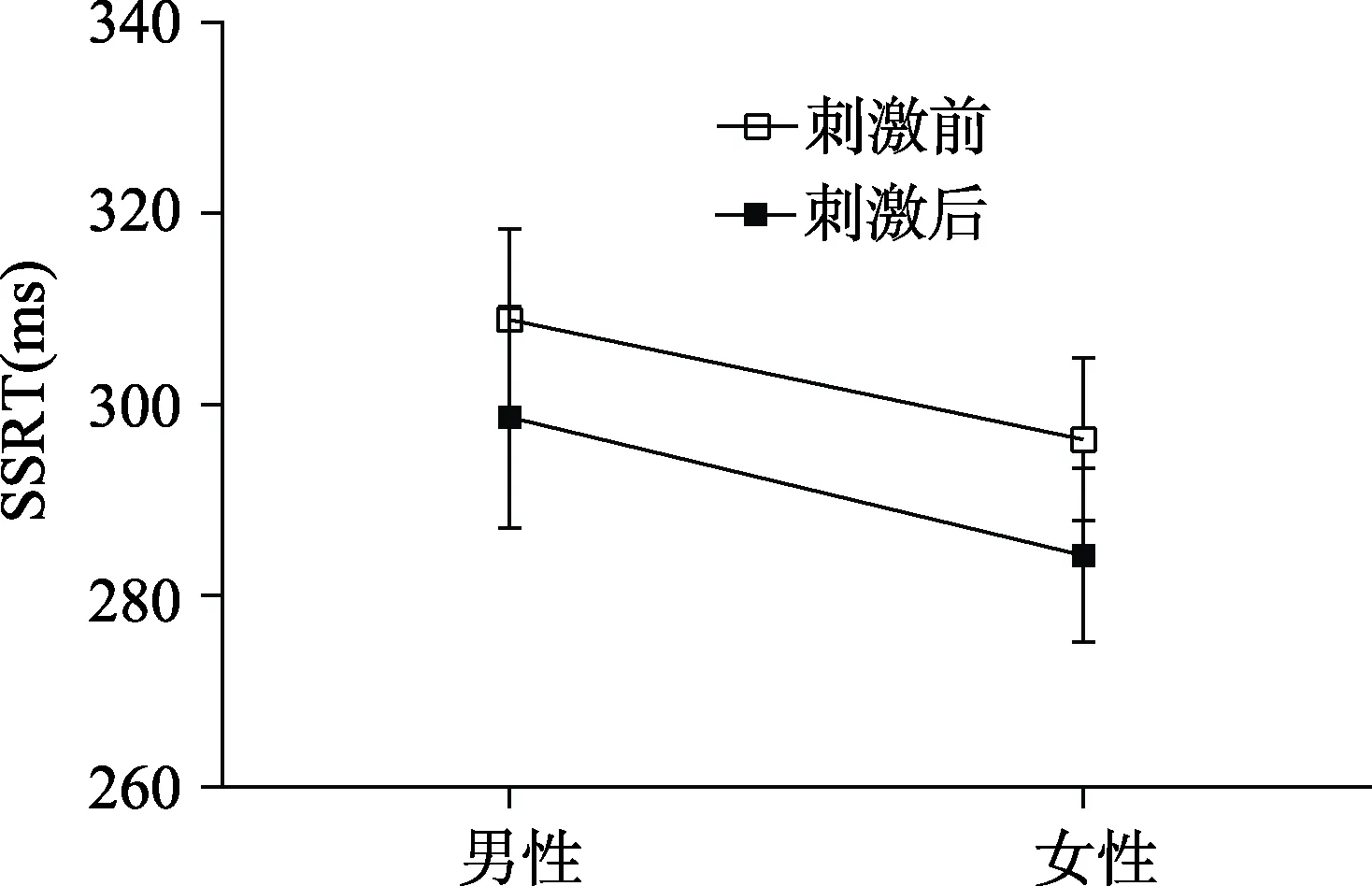
图5 真刺激前后男女SSRT值
3.2.3 刺激前后SSRT差值差异比较
对真刺激前后与伪刺激前后SSRT的差值进行配对样本
t
检验。结果显示真刺激前后SSRT差值(−15.88 ± 41.11 ms)与伪刺激前后 SSRT差值(10.56 ±30.98 ms)差异显著,t
(33) = −3.68,p
< 0.01, Cohen’d
=0.73。4 讨论
本研究通过观察tDCS作用于dlPFC前后, 健康大学生在SST任务中的行为改变。根据实验结果可知, 阳极tDCS真刺激右侧dlPFC后SSRT显著小于伪刺激, 表明tDCS刺激右侧dlPFC可以调节反应抑制能力, 与我们所提出的假设相符, 并进一步证实了dlPFC是反应抑制的重要脑区。
本研究采用tDCS阳极刺激右侧dlPFC后, 被试的停止信号反应时显著缩短。对存在多动症症状的成年人分别施加阳极tDCS刺激左侧dlPFC、阴极tDCS刺激左侧dlPFC, 实验中使用Stroop色词任务和Go-Nogo对被试的行为变化进行测量, 结果发现阳极tDCS作用于左侧dlPFC提高了被试在Go任务中的正确率, 即损毁被试的抑制能力, 而阴极tDCS作用于左侧 dlPFC改善了被试的反应抑制(Soltaninejad, Nejati, & Ekhtiari, 2015); 对情感冷漠、缺乏同理心的人群进行阴极 tDCS刺激右侧dlPFC, 并使用Go-Nogo任务测量被试的反应抑制,结果发现此类高分人群在接受刺激后反应抑制得到较好的改善, 表现在行为学水平上即 Nogo正确率的提高(Weidacke, Weidemann, Boy, & Johnston,2016)。因此, 本研究与以往的研究结果均证实了tDCS可以改变被试的反应抑制。对健康成年人进行10 Hz高频经颅磁刺激(high-frequency repetitive transcranial magnetic stimulation, HF-rTMS)分别作用于左侧dlPFC和右侧dlPFC, 并使用负性情感启动任务(Negative Affective Priming task, NAP)量化刺激前后被试对情绪信息抑制的强度, 结果发现HF-rTMS作用于右侧dlPFC后, 被试对负性信息能够进行更为有效的抑制(Leyman, De Raedt, Vanderhasselt, &Baeken, 2009); 强迫症患者的抑制能力存在损伤,对强迫症患者进行 rTMS治疗发现, 采用 100%静息运动阈值刺激患者的右侧 dlPFC, 能够改善被试的抑制能力(Zhou, Wang, Wang, Li, & Kuang, 2017;Nordmann, Azorina, Langguth, & Schecklmann, 2015)。与本研究结果相一致, 即通过刺激右侧dlPFC能够达到改变反应抑制的目的。目前tDCS作用于右侧dlPFC以观察被试反应抑制变化的研究匮乏, 而本研究将为物理干预技术能够改变反应抑制能力提供了进一步的证据。不同的脑区有着不一样的功能,不同的任务其加工机制也有所不同, 且脑区皮质兴奋性的改变将会影响被试在行为任务中的表现。在本次实验中, 从反应抑制的心理加工模型-赛马模型看, 阳极刺激后 SSRT值的降低, 表明在右侧dlPFC皮层兴奋性提高后, 被试在对停止信号进行抑制时, 反应抑制的加工过程相较反应过程率先达到反应阈限, 从而导致被试成功抑制动作冲动的内在反应时间的缩短(王琰, 蔡厚德, 2010; 方菁, 朱叶, 赵伟, 张蓓, 王湘, 2013)。与以上研究相比, 本研究采用了经典范式 SST, 更为纯净的测量了反应抑制能力的变化。
与本实验结果不同的是, 在 Davide等人一项研究中, 他们对20名健康成年人(3名男性, 17名女性)进行阳极tDCS作用于右侧dlPFC及阴极tDCS作用于右侧dlPFC, 刺激时长均为20分钟, 刺激结束15分钟后让被试完成SST, 结果显示两种形式的刺激均未改善被试的反应抑制能力(Stramaccia et al., 2015)。首先,这可能与tDCS刺激时长的不同有关, 一篇关于 tDCS治疗抑郁症的 meta分析指出,tDCS刺激时长会对其作用效果产生显著影响(Meron,Hedger, Garner, & Baldwin, 2015)。在本研究中, 刺激时长为 25分钟, 即对右侧 dlPFC脑区进行了更为持久的激活, 由此可能导致了右侧dlPFC脑区出现了更为显著的刺激效应, 进而表现在行为学上即SSRT值的降低, 即反应抑制能力的提高; 其次,可能与tDCS刺激后效应维持及消退有关, tDCS刺激后的持续效应与刺激时长、刺激强度有关, 且刺激后效应会随着时间而消退, 但是具体消退模式还不清楚(Nitsche & Paulus, 2000)。相较于Davide等人的研究, 本研究在刺激结束后即刻让被试完成SST,由此可能导致了两个研究中被试行为学表现上出现差异。与Davide等人的研究相比较, 本研究探索性的研究了tDCS作用于右侧dlPFC对反应抑制改善的即刻效应, 在之后的实验中, 我们将对 tDCS效应的持续时间展开进一步的研究。此外, 对健康大学生施加10 Hz、100%静息运动阈值的rTMS作用于左侧dlPFC, 连续7天, 每天1次, 在实验开始及结束时让被试完成 Stroop色词任务, 结果发现,真刺激组被试在Stroop色词任务表现更佳, 即抑制能力得到改善(Li et al., 2017); 采用5 Hz、100%静息运动阈值的rTMS对边缘型人格障碍患者的左侧dlPFC进行刺激, 使用巴拉特冲动性量表对患者的冲动性进行测评, 最后发现, 在接受了15次的rTMS治疗后, 患者在该量表上的得分显著下降, 冲动性降低、抑制能力改善(Reyes-López et al., 2017)。在2017年的一篇meta分析中也提到, Hz-rTMS作用于左侧 dlPFC, 能够改善强迫症患者的抑制能力(Zhou et al., 2017)。RIN的关键脑区包括左侧dlPFC,所以采用 rTMS作用于左侧 dlPFC, 也能够达到调节被试反应抑制的目的。在今后的实验中, 我们将对左侧dlPFC在反应抑制中的作用进行研究, 进一步探索左右侧dlPFC在反应抑制能力中发挥作用的大小。
采用fMRI对右侧dlPFC在反应抑制中的作用进行了研究, 他们采用Go-Nogo任务, 发现在Nogo情境下, 右侧dlPFC有着显著性的激活, 表明右侧dlPFC在反应抑制中扮演重要角色(Asahi, Okamoto,Okada, Yamawaki, & Yokota, 2004); Hughes对被试在Go-Nogo任务的表现进行了相关影像学分析, 同样发现在Nogo任务情境下, 被试的右侧dlPFC呈现持续性的激活, 进一步验证了右侧dlPFC脑区与反应抑制密切相关(Hughes et al., 2014)。本实验的结果也进一步证实了右侧dlPFC在反应抑制中起重要作用。
此外, Nigg的研究指出Stroop色词任务可能主要与认知抑制相关, 因此更多反映对分心刺激的注意控制及选择性注意, 因此相较 Stroop色词任务,SST能够更为有效的测量出反应抑制能力的变化(Nigg, 2000)。一篇meta分析指出, tDCS作用于健康成年人, 并不能改善被试在数字广度和言语流畅性任务中的表现(Horvath, Forte, & Carter, 2015),与本研究结果相一致。在本研究中, 真刺激与伪刺激后, 被试在数字广度(倒背)及言语流畅性任务中成绩均得到了提升, 介于本实验中被试在 tDCS刺激前后完成数字广度和言语流畅性任务, 间隔时间很短, 所以可能出现了练习效应, 由此导致了该实验结果。
人类需要在错综复杂的生活环境中, 对正确的行为做出反应, 并对不正确的或不必要的行为进行抑制, 这样才能适应环境, 更好的做出执行, 并抑制不必要的行为, 进而更好的生存下来, 因此反应抑制能力与我们的生活息息相关。本研究的结果显示, 在神经机制水平上, 右侧 dlPFC脑区与反应抑制能力紧密相关。已有的相关临床研究表明, tDCS对抑郁症、癫痫类疾病、脑卒中后神经康复、失语症、帕金森等多种疾病有效。根据此次实验的结果,提示tDCS在健康人群的执行功能中也有很大的应用价值。相关临床证据表明, 反应抑制能力的缺损存在于多类疾病中, 如强迫症、多动症等。tDCS本身具备的方便、经济、无创、无副作用等优势, 对于提高病患的反应抑制能力将有积极的应用前景。
本研究虽然为右侧dlPFC在反应抑制中的作用提供了重要证据, 但介于在本研究中并未对左侧dlPFC在反应抑制中发挥的作用做探讨, 所以无法说明左右侧dlPFC在反应抑制中哪一侧起了更大的作用, 为了进一步探究以上的问题, 将来的研究方向可进一步研究阳极tDCS作用于左侧dlPFC对于反应抑制的影响, 并结合神经电生理技术、功能磁共振成像等技术, 更为深入综合的探究反应抑制的神经机制。其次, 本研究样本量较小, 且招募的被试均是安徽医科大学在校学生, 从而使本研究结果推论到其他群体中缺乏可信度, 因此, 在今后的研究中, 我们将就此方面做出改善, 增大样本量, 以及丰富群体的多样性。
Andrés, P. (2003). Frontal cortex as the central executive of working memory: Time to revise our view.
Cortex,
39
(4–5),871–895.Asahi, S., Okamoto, Y., Okada, G., Yamawaki, S., & Yokota, N.(2004). Negative correlation between right prefrontal activity during response inhibition and impulsiveness: A fMRI study.
European Archives of Psychiatry and Clinical Neuroscience
,254
(4), 245–251.Bari, A., & Robbins, T. W. (2013). Inhibition and impulsivity:Behavioral and neural basis of response control.
Progress in Neurobiology,
108
, 44–79.Beeli, G., Casutt, G., Baumgartner, T., & Jäncke, L. (2008).Modulating presence and impulsiveness by external stimulation of the brain.
Behavioral and Brain Functions,
4
,33.Boggio, P. S., Zaghi, S., & Fregni, F. (2009). Modulation of emotions associated with images of human pain using anodal transcranial direct current stimulation (tDCS).
Neuropsychologia,
47
(1), 212–217.Brevet-Aeby, C., Brunelin, J., Iceta, S., Padovan, C., & Poulet,E. (2016). Prefrontal cortex and impulsivity: Interest of noninvasive brain stimulation.
Neuroscience & Biobehavioral Reviews,
71
, 112–134.Casey, B. J., Trainor, R. J., Orendi, J. L., Schubert, A. B.,Nystrom, L. E., & Giedd, J. N., … Rapoport, J. L. (1997).A developmental functional MRI study of prefrontal activation during performance of a Go-No-Go task.
Journal of Cognitive Neuroscience,
9
(6), 835–847.Dambacher, F., Schuhmann, T., Lobbestael, J., Arntz, A.,Brugman, S., & Sack, A. T. (2015). No effects of bilateral tDCS over inferior frontal gyrus on response inhibition and aggression.
PLoS One,
10
(7), e0132170.Fang, J., Zhu, Y., Zhao, W., Zhang, B., & Wang, X. (2013).Stop signal task and the related models of response inhibiton
. Chinese Journal of Clinical Psychology,
21
(5),743–746, 750.[方菁, 朱叶, 赵伟, 张蓓, 王湘. (2013). 停止信号任务及其相关反应抑制理论模型综述.
中国临床心理学杂志,21
(5), 743–746, 750.]Horvath, J. C., Forte, J. D., & Carter, O. (2015). Quantitative review finds no evidence of cognitive effects in healthy populations from single-session transcranial direct current stimulation (tDCS).
Brain Stimulation,
8
(3), 535–550.Hughes, M. E., Budd T. W., Fulham W. R., Lancaster S.,Woods W., Rossell S. L., & Michie P. T. (2014). Sustained brain activation supporting stop-signal task performance.
European Journal of Neuroscience,
39
(8), 1363–1369.Hwang, J. H., Kim, S. H., Park, C. S., Bang, S. A., & Kim, S.E. (2010). Acute high-frequency rTMS of the left dorsolateral prefrontal cortex and attentional control in healthy young men.
Brain Research,
1329
, 152–158.Jurcak, V., Tsuzuki, D., & Dan, I. (2007). 10/20, 10/10, and 10/5 systems revisited: Their validity as relative headsurface-based positioning systems.
NeuroImage, 34
(4),1600–1611.Konishi, S., Nakajima, K., Uchida, I., Kikyo, H., Kameyama,M., & Miyashita, Y. (1999). Common inhibitory mechanism in human inferior prefrontal cortex revealed by eventrelated functional MRI.
Brain,
122
(5), 981–991.Leyman, L., De Raedt, R., Vanderhasselt, M. A., & Baeken, C.(2009). Influence of high-frequency repetitive transcranial magnetic stimulation over the dorsolateral prefrontal cortex on the inhibition of emotional information in healthy volunteers.
Psychological Medicine,
39(6), 1019–1028.Li, Y., Wang, L., Jia, M., Guo, J., Wang, H., & Wang, M.(2017). The effects of high-frequency rTMS over the left DLPFC on cognitive control in young healthy participants.
PLoS One,
12
(6), e0179430.Loftus, A. M., Yalcin, O., Baughman, F. D., Vanman, E. J., &Hagger, M. S.. (2015). The impact of transcranial direct current stimulation on inhibitory control in young adults.
Brain and Behavior,
5
(5), e00332.Logan, G. D., & Cowan, W. B. (1984). On the ability to Inhibit thought and action: A theory of an act of control
.Psychoogical Review,
91
, 295–327.Menon, V. (2011). Large-scale brain networks and psychopathology: A unifying triple network model.
Trends in Cognitive Sciences,
15
(10), 483–506.Meron, D., Hedger, N., Garner, M. G., & Baldwin, D. S.(2015). Transcranial direct current stimulation (tDCS) in the treatment of depression: Systematic review and meta-analysis of efficacy and tolerability.
Neuroscience &Biobehavioral
Reviews,
57
, 46–62.Nigg, J. T. (2000). On inhibition/disinhibition in developmental psychopathology: Views from cognitive and personality psychology and a working inhibition taxonomy.
Psychological
Bulletin,
126
, 220–246.Nitsche, M. A., & Paulus, W. (2000). Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation.
The Journal of Physiology,527
(3), 633–639.Nordmann, G., Azorina, V., Langguth, B., Schecklmann, M.,(2015). A systematic review of non-motor rTMS induced motor cortex plasticity.
Frontiers in Human Neuroscience
,9
,416.Palm, U., Hasan, A., Strube, W., & Padberg, F. (2016). tDCS for the treatment of depression: A comprehensive review.
European Archives of Psychiatry and Clinical Neuroscience
,266
(8), 681–694.Penolazzi, B., Stramaccia, D. F., Braga, M., Mondini, S., &Galfano, G. (2014). Human memory retrieval and inhibitory control in the brain: Beyond correlational evidence.
The Journal of Neuroscience,
34
(19), 6606–6610.Reyes-López, J., Ricardo-Garcell, J., Armas-Castañeda, G.,García-Anaya, M., Arango-De Montis, I., González-Olvera,J. J., & Pellicer, F. (2017). Clinical improvement in patients with borderline personality disorder after treatment with repetitive transcranial magnetic stimulation: Preliminary results.
Revista
Brasileira
de
Psiquiatria,
doi:10.1590/1516-4446-2016-2112. (in Press)Rubia, K., Smith, A. B., Brammer, M. J., & Taylor, E. (2003).Right inferior prefrontal cortex mediates response inhibition while mesial prefrontal cortex is responsible for error detection.
NeuroImage,
20
, 351–358.Soltaninejad, Z., Nejati, V., & Ekhtiari, H. (2015). Effect of anodal and cathodal transcranial direct current stimulation on DLPFC on modulation of inhibitory control in ADHD.
Journal of Attention Disorders,
101
(4), 291–302.Stramaccia, D. F., Penolazzi, B., Sartori, G., Braga, M.,Mondini, S., & Galfano, G. (2015). Assessing the effects of tDCS over a delayed response inhibition task by targeting the right inferior frontal gyrus and right dorsolateral prefrontal cortex.
Experimental Brain Research,
233
(8),2283–2290.van Holst, R. J., van Holstein, M., van den Brink, W., Veltman,D. J., & Goudriaan, A. E. (2012). Response inhibition during cue reactivity in problem gamblers: An fmri study.
PLoS One
,7
, e30909.Wang, Y., & Cai, H. D. (2010). Mental processing models and neural mechanisms for response inhibition.
Advances in Psychological
Science, 18
(2), 220–229.[王琰, 蔡厚德. (2010). 反应抑制的心理加工模型与神经机制.
心理科学进展, 18
(2), 220–229.]Weidacker, K., Weidemann, C. T., Boy, F., & Johnston, S. J.(2016). Cathodal tDCS improves task performance in participants high in Coldheartedness
.
Clinical Neurophysiology
,127
(9), 3102–3109.Zhou, D. D., Wang, W., Wang, G. M., Li, D. Q., & Kuang, L.(2017). An updated meta-analysis: Short-term therapeutic effects of repeated transcranial magnetic stimulation in treating obsessive-compulsive disorder.
Journal of Affective Disorders,
215
, 187–196.