囊性前庭神经鞘膜瘤超微病理特性分析
2018-05-16严爽火子榕尹晓玲张治华
严爽 火子榕 尹晓玲 张治华
上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科上海交通大学医学院耳科学研究所上海市耳鼻疾病转化医学重点实验室
前庭神经鞘膜瘤(vestibular schwannoma,VS),即听神经瘤,起源于前庭神经鞘膜雪旺细胞,主要位于内听道及桥小脑角,占该区域良性肿瘤的80-90%[1]。受颅内空间的制约,瘤体在生长过程中压迫颅内重要结构,累及第V、VII-XI对颅神经,以及小脑、脑干等,产生严重中枢及颅神经压迫症状。早期研究发现,VS具有生长、静止和缩小三种典型生长方式,近年来,国内外临床研究发现并关注VS的第四种生长方式,即囊性变,占5.7-48%[2-6]。囊性前庭神经鞘膜瘤(cystic vestibular schwannoma,CVS)[5-7]具有特殊生物学行为和临床症状:1)生长更迅速、症状更严重:导致更多突发性耳聋、面瘫、脑积水等严重症状;2)更具侵袭性:肿瘤囊壁与毗邻颅神经、脑干严重粘连,术中神经解剖保留几率低,术后面听神经功能不可逆损伤;3)治疗策略单一且疗效不佳:其肿瘤全切率、术后并发症率及面听神经功能保留率等疗效指标均不佳,显著低于实性前庭神经鞘膜瘤(solid vestibular schwannoma,SVS)。阐明CVS的病理、发生机制具有重要的临床意义。
VS生物学特性受众多因素影响。肿瘤的生长受自噬的调控,自噬是维持细胞内稳态的重要机制,贯穿于生命活动中许多重要的病理生理过程[8]。生理水平的自噬对细胞的基因组完整性和内稳态维持是必需的,也参与了抗衰老、免疫及胞内病原体清除、癌变及神经系统退行性病变等生理或病理过程[9]。自噬功能正常及适度增强可维持细胞内环境的稳定,利于细胞生存,自噬失调则会导致细胞的变性坏死。
作为桥小脑角最常见的良性肿瘤,VS的发生和发展中是否有自噬的调控,目前尚无明确报道。基于该背景,为了探讨CVS和SVS超微病理及生物学特性的差异性,探究自噬在VS囊性变发展过程中的作用,本研究拟通过透射电子显微镜技术对30例前庭神经鞘膜瘤(CVS 15例,SVS 15例)超微结构进行观察分析,利用免疫组织化学技术标记特异性抗原,观察自噬标记蛋白LC3在肿瘤组织中的表达。
1 材料与方法
1.1 病例资料
收集2016年6月至2016年12月于上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科手术治疗的散发性VS患者,剔除神经纤维瘤病II型(NF2)、立体定向放射治疗或手术治疗后复发患者,所有患者临床诊断均依据内听道增强MRI中的特征性表现,术后常规病理结果为最终确诊依据。纳入研究的患者共计30例(CVS 15例,SVS 15例)。
1.2 标本准备及处理
所有标本均取自手术切除5分钟之内的新鲜肿瘤组织,取下后肿瘤组织分别置于盛有4%多聚甲醛和2.5%戊二醛的EP管中固定(CVS瘤体及囊壁分开取材并固定)。
1.3 透射电子显微镜技术
对2.5%戊二醛固定的肿瘤样本进行包埋:经0.1M的磷酸缓冲液清洗3次后,再用1%锇酸于4℃下振荡固定3 h;用磷酸盐缓冲液(PBS)清洗3次,乙醇逐级脱水,环氧丙烷置换,Spurr树脂浸透包埋;在70℃烘箱中聚合。切片染色观察:将包埋块置于超薄切片机上进行切片,超薄切片厚度70 nm,经醋酸双氧铀和柠檬酸铅染色,透射电子显微镜下观察、拍照。
1.4 免疫组织化学技术
取经4%多聚甲醛固定后的肿瘤样本进行石蜡包埋,分别切片,厚度为4μm。石蜡切片经二甲苯、梯度乙醇脱蜡水化。对切片用0.01mol/L柠檬酸缓冲液进行经抗原修复后使用免疫组化试剂盒(上海明睿生物技术有限公司)进行实验,LC3单克隆抗体购自上海优宁维生物科技股份有限公司,并按照1:50的比例稀释,4℃孵育过夜,PBS清洗后滴加生物素标记的二抗(浓度为1:100),37℃孵育30分钟,DAB显色15min,自来水冲洗,苏木素复染,二甲苯透明,树脂封片,光镜下观察、拍照。
自噬标记蛋白LC3阳性为细胞质(cytoplasm)或细胞间质(intercellular matrix)呈棕黄色染色,通过对表达强度与反应细胞的百分比对免疫反应进行半定量评估,即为10个高倍视野(约1000个细胞)中出现的LC3阳性细胞数(百分率表示)。强度评估:没有;轻:细胞<5O个/10 HPF;中:细胞5O~100个/10 HPF;强:细胞>100个/10 HPF。对没有及轻度表达认定为阴性,对中度表达及强表达认定为阳性。
1.5 统计学处理
本研究所有数据均录入SPSS 23.0软件进行处理分析,连续型变量用均值±标准差表示,非参数检验按实际情况采用卡方检验或Fisher确切概率法,以P<0.05表示结果具有统计学意义。
2 结果
2.1 一般临床资料
在30例患者中,男性11例(36.7%),女性16例(53.3%);患者平均年龄为33.2±9.4岁(21~59岁);肿瘤直径平均为26.7±8.4 mm(14~47 mm)。
2.2 电镜下超微病理组织学结果
电子显微镜观察超微病理,在电镜下,SVS瘤体细胞主要表现为细胞平行排列或散在分布,胞浆少,瘤细胞突起长,部分瘤细胞核形态异常、核仁大,未见自噬小体,见图1a。CVS瘤体细胞则表现为细胞散在分布,细胞线粒体肿胀,嵴消失,粗面内质网扩张,核周间隙扩大,呈水样变性改变,胞浆内可见空泡及大量脂滴,可见典型自噬溶酶体,自噬溶酶体也被称为晚期自噬小泡或降解型自噬小泡(degradative autophagic vacuole,AVd),由于与溶酶体融合,包裹的内容物及双层膜均已被溶酶体中的蛋白酶降解,见图1b。CVS囊壁可见到瘤细胞稀疏、大小不等,间质内存在血窦,窦内皮细胞肥大,毛细血管扩张,可见典型自噬小体,自噬小体也被称为起始自噬小泡(initial autophagic vacuoles,AVi),具有双层膜结构,自噬小体中包裹了胞浆中的内容物及细胞器,这些组分形态完整,与细胞中其他位置的胞浆内容物和细胞器形态相似。见图1c。
2.3 免疫组织化学结果
自噬标记蛋白LC3阳性为细胞质或细胞间质呈棕黄色染色,在各15例囊/实性前庭神经鞘膜瘤组织中,SVS中LC3表达阳性1例,CVS中,LC3在CVS瘤体中表达阳性11例,在CVS囊壁中表达阳性14例,LC3在SVS瘤体、CVS瘤体及CVS囊壁中的阳性率分别为13.3%,60.0%,和73.3%,SVS瘤体中,LC3表达量显著低于CVS瘤体(P=8×10-4)及CVS囊壁(P=1.2×10-5),光镜下典型表现如图2所示。
3 讨论
前庭神经鞘膜瘤囊性变机制至今未明,以往的学者[10-12]从组织形态学、细胞分布、蛋白表达等现象中进行分析,最新研究[13]通过cDNA芯片检测CVS和SVS组织中的差异基因表达谱提出差异表达基因在VS囊性变中具有重要作用。
本研究利用透射电子显微镜技术对30例VS(SVS 15例,CVS 15例)超微结构进行观察分析,通过免疫组织化学技术标记特异性抗原,观察自噬标记蛋白LC3在肿瘤组织中的表达,第一次提出并假设自噬与VS囊性变之间的关系。
自噬是细胞自己吞噬自己的一个过程,由双层或多层膜的小泡将细胞质成分包裹,运送到溶酶体进行降解。自噬是维持细胞内稳态的一个重要机制,贯穿于生命活动中许多重要的病理生理过程,在多种肿瘤中都存在着自噬水平的改变,不同肿瘤类型,肿瘤发生发展的不同阶段,自噬发挥的作用会有所不同[14-15]。自噬在肿瘤形成和演进过程中是一把双刃剑,可以发挥促进与抑制的不同作用。自噬抑制肿瘤功能的具体机制仍未阐明。自噬相关基因(autophagy-related gene,ATG)参与多条抑癌信号通路,清除细胞内代谢废物、长寿命蛋白及受损的细胞器以避免有害自由基及突变的发生,减少DNA损伤从而稳定细胞内环境,抑制细胞癌变[16-17]。自噬减少时,细胞内衰老的细胞器和功能丧失的长寿蛋白无法降解,使细胞内代谢障碍,直接或间接造成DNA损伤和基因突变,导致功能丧失致细胞恶变。此外,过度自噬能够作为一种细胞预死亡机制而导致肿瘤细胞的损伤。自噬水平过高时,自噬诱导凋亡性细胞死亡来抑制肿瘤的发生发展,被认为是Ⅱ型程序性细胞死亡[18],称为自噬性细胞死亡。有研究表明,通过抑制PI3K/Akt/mTOR通路来提高自噬流可以促进肿瘤细胞凋亡[19]。肿瘤的促癌机制主要是高水平的自噬会帮助肿瘤细胞利用自噬机制对抗由于快速分裂和供血不足引起的营养缺乏和缺氧。肿瘤生长过程中,由于肿瘤细胞快速增殖和代谢,而新生血管形成却相对滞后,容易出现缺氧、营养缺乏等状况,导致肿瘤细胞处于饥饿、缺氧状态。在这种情况下,肿瘤细胞能够通过自噬大量降解细胞内物质,循环利用营养物质,为代谢相关通路提供原料,促进低氧和营养受限的肿瘤细胞的存活[20]。
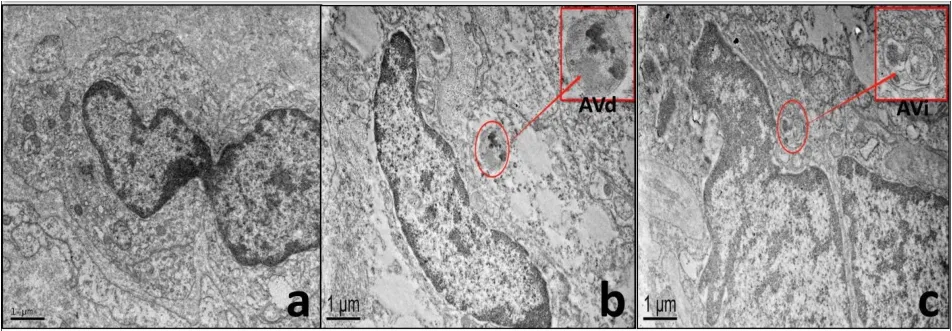
图1 电镜下前庭神经鞘膜瘤组织超微病理结构表现Fig.1 Ultrastructure of vestibular schwannoma under electron microscope

图2 光镜下前庭神经鞘膜瘤组织LC3免疫组化表现Fig.2 Immunohistochemical staining features of LC3 in ves-
目前关于前庭神经鞘膜瘤与自噬之间的关系尚未清楚,最新研究[21]在使用整合素连接激酶(integrin-linked kinase,ILK)抑制剂 OSU-T135对HEI193细胞进行处理后发现caspases-9与LC3-B的表达水平均增高,认为OSU-T135能够通过抑制听神经瘤AKT信号通路的活性以抑制肿瘤细胞增殖、使细胞分裂阻滞在G2期,并最终引起自噬失调而致细胞死亡。该团队亦指出[22]PAK抑制剂能够能通过引起HEI193细胞有丝分裂障碍而引起ATG5以及自噬体的增多并最终导致肿瘤细胞死亡。这均提示自噬可能在前庭神经鞘膜瘤发生发展以及治疗过程起调控作用。
本研究发现,与SVS瘤体相比,光镜下CVS瘤体及囊壁组织疏松,瘤细胞稀少,细胞内和细胞间有许多空泡,排列成稀疏的网状结构,呈退行性改变;透射电子显微镜下,CVS瘤体及囊壁均可见典型自噬体,SVS瘤体中未见;免疫组织化学技术标记特异性抗原后,亦证实自噬标记蛋白LC3在CVS中高表达。自噬水平的改变与多种病理生理过程相关,我们认为,自噬可能在前庭神经鞘膜瘤囊性变中也发挥着重要作用,但其中确切机制尚无定论,例如究竟自噬水平的改变造成VS囊性变的发生还是VS囊变后导致自噬水平的提高,以及自噬调控VS囊性变的具体信号通路。今后这些问题的解决可能为指导前庭神经鞘膜瘤的临床治疗提供更大价值,未来仍需更多研究来阐明如何有效利用自噬协助治疗前庭神经鞘膜瘤。
参考文献
1 Wong BY,Capper R.Incidence of Vestibular Schwannoma and Inci Dental Findings on the Magnetic Resonance Imaging and Computed Tomography Scans of Patients from a Direct Referral Audiology Clinic[J].The Journal of laryngology and otology.2012;126(7):658-662.
2 Huo Z,Zhang Z,Huang Q,et al.Clinical Comparison of Two Subtypes of Cystic Vestibular Schwannoma:Surgical Considerations and Outcomes[J].Head and Neck Surgery.2016;273(12):4215-4223.
3 Piccirillo E,Wiet MR,Flanagan S,et al.Cystic Vestibular Schwannoma:Classification,Management,and Facial Nerve Outcomes[J].Otology&neurotology.2009;30(6):826-834.
4 Sinha S,Sharma BS.Cystic Acoustic Neuromas:Surgical Outcome in a Series of 58 Patients[J].Journal of Clinical Neuroscience.2008;15(5):511-515.
5 Benech F,Perez R,Fontanella MM,et al.Cystic Versus Solid Vestibular Schwannomas:a Series of 80 Grade III-IV Patients[J].Neurosurgical Review.2005;28(3):209-213.
6 Fundova P,Charabi S,Tos M,et al.Cystic Vestibular Schwannoma:Surgical Outcome[J].The Journal of Laryngology and Otology.2000;114(12):935-939.
7 Zhang Z,Wang Z,Huang Q,et al.Removal of Large or Giant Sporadic Vestibular Schwannomas Via Translabyrinthine Approach:aAreport of 115 Cases[J].ORL.2012;74(5):271-277.
8 Galluzzi L,Baehrecke EH,Ballabio A.Molecular definitions of autophagy and related processes[J].2017;36(13):1811-1836.
9 Galluzzi LVitale I,Aaronson SA,et al.Molecular Mechanisms of Cell Death:Recommendations of the Nomenclature Committee on Cell Death 2018[J].Cell death and differentiation.2018;25(3):486-541
10 Moon KS,Jung S,Seo SK,et al.Cystic Vestibular Schwannomas:a Possible Role of Matrix Metalloproteinase-2 in Cyst Development and Unfavorable Surgical Outcome[J].Journal of Neurosurgery.2007;106(5):866-871.
11 Schober R,Vogeley KT,Urich H,et al.Vascular Permeability Changes in Tumours of the Peripheral Nervous System[J].Virchows Archiv A,Pathological Anatomy and Histopathology.1992;420(1):59-64.
12 Park CK,Kim DC,Park SH,et al.Microhemorrhage,a Possible Mechanism for Cyst Formation in Vestibular Schwannomas[J].Journal of Neurosurgery.2006;105(4):576-580.
13 Zhang Z,Wang Z,Sun L,et al.Mutation Spectrum and Differential Gene Expression in Cystic and Solid Vestibular Schwannoma[J].Genetics in Medicine.2014;16(3):264-270.
14 Levine B,Sinha S,Kroemer G.Bcl-2 Family Members:Dual Regulators of Apoptosis and Autophagy[J].Autophagy.2008;4(5):600-606.
15 Maycotte P,Jones KL,Goodall ML,et al.Autophagy Supports Breast Cancer Stem Cell Maintenance by Regulating IL6 Secretion[J].Molecular cancer research.2015;13(4):651-658.
16 Mathew R,Karp CM,Beaudoin B,et al.Autophagy Suppresses Tumorigenesis Through Elimination of p62[J].Cell.2009;137(6):1062-1075.
17 Cheong H.Integrating Autophagy and Metabolism in Cancer[J].Archives of pharmacal research.2015;38(3):358-371.
18 Su Z,Yang Z,Xu Y,et al.Apoptosis,Autophagy,Necroptosis,and Cancer Metastasis[J].Molecular Cancer.2015;14:48.
19 Singh BN,Kumar D,Shankar S,et al.Rottlerin Induces Autophagy Which Leads to Apoptotic Cell Death Through Inhibition of PI3K/Akt/mTOR Pathway in Human Pancreatic Cancer Stem Cells[J].Biochemical Pharmacology.2012;84(9):1154-1163.
20 Strohecker AM,Guo JY,Karsli-Uzunbas G,et al.Autophagy Sustains Mitochondrial Glutamine Metabolism and Growth of BrafV600E-driven Lung tumors[J].Cancer Discovery.2013;3(11):1272-1285.
21 Mercado-Pimentel ME,Igarashi S,Dunn AM,et al.The Novel Small Molecule Inhibitor,OSU-T315,Suppresses Vestibular Schwannoma and Meningioma Growth by Inhibiting PDK2 Function in the AKT Pathway Activation[J].Austin Journal of Medical oncology.2016;3(1):1025.
22 Mercado-Pimentel ME,Miller C,Rolph DN,et al.Inhibiting p21-Activated Kinase Induces Cell Death in Vestibular Schwannoma and Meningioma via Mitotic Catastrophe[J].Otology&neurotology.2017;38(1):139-146.
