枯草芽孢杆菌突变株的构建及其对猪肺泡巨噬细胞(MΦ3D4/2)免疫因子表达的影响
2018-04-12李天瑾杨明明龚月生
李天瑾,杨明明,龚月生
(西北农林科技大学 动物科技学院,陕西 杨凌712100)
枯草芽孢杆菌(B.subtilis)是一类耐热抗逆性强,普遍存在于自然环境中的杆状、兼性厌氧型革兰氏阳性菌。作为一种益生菌,能够改善动物肠道微生物环境,刺激免疫反应,促进免疫器官的发育,淋巴细胞数增多,从而提高家畜机体免疫水平。该菌株经由动物采食进入胃肠道,由于胃酸、胆盐和消化液的刺激,主要以芽孢的形式存在,并可在胃肠道中进行萌发和繁殖。枯草芽孢杆菌营养体对肠道环境敏感,容易被降解消除,而芽孢具有高稳定性,并且基本不受肠道环境的影响,因此B.subtilis调节肠道免疫主要形式为芽孢。目前,B.subtilis芽孢和营养体的免疫功能已引起人们的关注。Kosaka等[1]研究发现,当给小鼠饲喂B.subtilis芽孢,可显著增加小鼠体内自然杀伤细胞和巨噬细胞的活性,及血清中干扰素的水平。Inooka等[2]用B.subtilis饲喂雏鸡时,脾脏中T,B淋巴细胞数量显著增多。B.subtilis也可以通过诱导一种应激蛋白合成,促进肠系淋巴结的发育[3]。然而,关于芽孢调节动物肠道免疫的机制还尚不清楚。本试验拟研究B.subtilisPY79芽孢对巨噬细胞MΦ3D4/2免疫因子分泌的影响,从而为其调节机体免疫功能的机理提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1菌株、质粒与引物枯草芽孢杆菌PY79(B.subtilisPY79)、枯草芽孢杆菌168(B.subtilis168)和大肠杆菌(E.coli)DH5α由本实验室保存。本研究所有质粒和引物分别见表1和表2。猪肺泡巨噬细胞系MΦ3D4/2由浙江大学李卫芬教授惠赠。

表1 质粒Table 1 Plasmids

表2 引物Table 2 Primers
1.1.2主要试剂细菌基因组DNA提取试剂盒(康为试剂生物科技有限公司),琼脂糖凝胶回收试剂盒(康宁生物科学有限公司)。猪促炎细胞因子(IL-1β、IL-6、IL-8)和抗炎细胞因子(IL-10)ELISA测试盒(上海邦奕生物科技有限公司)。BHI生孢培养基、PRMI-1640细胞培养液。
1.2 试验方法
1.2.1细菌培养B.subtilis细菌悬液制备:将B.subtilis在LB培养基上37 ℃培养过夜。次日挑取单菌落接种于30 mL的LB培养基中,37 ℃培养12 h。12 000 r/min离心10 min收集菌体,0.01 mol/L PBS洗涤两次,重悬。
B.Subtilis芽孢:将B.subtilis在相应抗性的LB培养基,37 ℃培养过夜。次日挑取单菌落接种于30 mL相应抗性的LB培养基中,37 ℃培养12 h,5 000 g离心10 min,PBS洗涤2次,30 mL PBS重悬等体积接种于BHI生孢培养基中,37 ℃培养14 h。5 000 g离心10 min,收集菌体,PBS洗涤2次;加入溶菌酶37 ℃处理30 min,PBS洗涤2次;75 ℃处理30 min,PBS洗涤2次,悬浮。
1.2.2整合载体的构建以B.subtilisPY79的基因组DNA为模板,用引物clW-up/clW-down、gerD-up/ gerD-down分别扩增上下游同源臂clWf和gerDh;以pshuttleF质粒为模板,用引物Specb-up/Specb-down扩增抗性基因spec。以B.subtilisPY79的基因组DNA为模板,用引物spo0Af-up/spo0Af-down、spo0Ab-up/spo0Ab-down分别扩增上下游同源臂spo0Af和spo0Ab。
将片段clWf、gerDh和spec克隆至pBL18相应位点,构建质粒pYGJ-6。将片段spo0Af、spo0Ab和spec克隆至pBL18相应位点,构建质粒pYGJ-8。
1.2.3突变株的构建用EcoRI酶切整合载体pYGJ-6,使其线性化。采用化学转化法转化B.subtilisPY79感受态细胞,并在壮观抗性培养基中筛选转化子,转化子命名为B.subtilisclW-gerD-。设计引物Declw-up/Decrd-down 、Spec-up/Spec-down、 Decap-up/Decap-down和clW-up/gerD-down 检测突变株B.subtilisclW-gerD-。
用EcoRI酶切整合载体pYGJ-8,使其线性化。用化学转化法转化B.subtilisPY79感受态细胞,并在壮观抗性培养基中筛选转化子,转化子命名为B.subtilisspo0A-。设计引物spo0Af-up/spo0Ab-down,Spec-up/Spec-down和 Decap-up/Decap-down检测突变株B.subtilisspo0A-。
1.2.4Bacillus.subtilis突变株的生孢和萌发检测生长曲线检测:B.subtilisPY79、B.subtilisclW-gerD-和B.subtilisspo0A分别在相应抗性的LB培养基上,37 ℃培养过夜。挑取单菌落接种于30 mL相应抗性的LB培养基中,每隔2 h测其OD600nm值。
生孢率检测:B.subtilisPY79、B.subtilisclW-gerD-和B.subtilisspo0A-分别在相应抗性的LB培养基上,37 ℃培养过夜。挑取单菌落分别接种于8 mL相应抗性的LB培养基中,每隔8 h用革兰氏染色法检测。
萌发率检测:将B.subtilisPY79和B.subtilisclW-gerD-芽孢悬液按1:100接种于30 mL相应抗性的LB培养基中,每隔2 h测其OD600nm值。
1.2.5B.subtilisPY79突变株对巨噬细胞(MΦ3D4/2)细胞因子分泌的影响本试验共分为7个处理,每个处理3个重复。试验组:细胞培养至单层,PBS洗涤1次,每孔加1 mL无抗PRMI-1640培养液,再加入1 mLB.subtilisclW-gerD-和B.subtilisspo0A-芽孢悬液。对照组:细胞培养至单层,PBS洗涤1次,每孔加入1 mL无抗PRMI-1640培养液,第一组为没有做任何处理的MΦ3D4/2,其余四组分别加入1 mL PBS、1 mLB.subtilis168细菌悬液,1 mLB.subtilisPY79芽孢悬液和2 μL LPS(100 ng/mL),置于37 ℃,5% CO2培养箱中培养12 h,收集,离心(1000 g,15 min)上清液。细胞因子(IL-8、IL-1β、IL-6、IL-10)用ELISA方法检测。
1.2.4数据处理及分析 采用SPSS 20.0进行独立样本T检验。P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 突变株的构建检测
以B.subtilisPY79的基因组DNA做对照,用引物Declw-up/Decrd-down、Specb-up/Specb-down、Decap-up/Decap-down和clW-up/gerD-down进行PCR检测及酶切鉴定突变株B. subtilis clW-gerD-,结果与预期一致(图1)。
用引物spoAf-up/spoAb-down进行PCR检测及酶切鉴定突变株B.subtilisspo0A-,检测结果与预期一致(图2)。
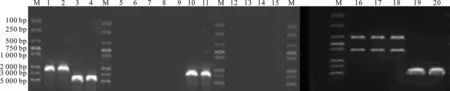
图1 B.subtilis clW-gerD- PCR及酶切鉴定Fig.1 PCR identification and enzymatic digestion of B. subtilis clW-gerD-M:DNA molecular mass markers; 1,2,3,4: PCR product of clW-up/gerD-down; Lanes 8,9,10,11: PCR product ofDeclw-up/Decrd-down; 12,13,14,15: PCR product of Decap-up/Decap-down;16,17,18: PCR production ofclW-up/gerD-down digested by BamHI
图2 B. subtilis spo0A-PCR及酶切鉴定Fig.2 PCR identification and enzymatic digestion ofB. subtilis spo0A-M:DNA molecular mass markers; Lanes 1,2,3,4: PCRproduct of spo0Af-up/spo0Ab-down; 6,7,8: PCR productionof spo0Af-up/spo0Ab-down digested by BamHI
2.2 B.subtilis突变株的生孢和萌发检测
生长曲线检测结果表明,突变株B.subtilisclW-gerD-的生长状况与野生型B.subtilisPY79基本一致。突变株B.subtilisspo0A-在生长后期OD值明显低于B.subtilisPY79(图3)。
B.subtilisPY79、B.subtilisclW-gerD- 和B.subtilisspo0A-生孢培养后,革兰染色检测结果表明,B.subtilisPY79和B.subtilisclW-gerD-正常生孢,B.subtilisspo0A-不生孢。萌发率检测结果表明,B.subtilisclW-gerD-芽孢完全丧失萌发能力(图4)。
2.3 B. subtilis突变株对MΦ3D4/2细胞因子分泌的影响
ELISA检测结果显示,B.subtilisclW-gerD-极显著的促进了细胞因子IL-6的表达量(P<0.01);.subtilis突变株对IL-1β、IL-8和IL-10的表达无显著性影响。
3 讨 论
芽孢是芽孢杆菌的一种特殊休眠体,具有较强的抗逆性。Duc[2]用鼠科的巨噬细胞与B.subtilis的芽孢做了一个体外试验,将两者共同培养,发现巨噬细胞(RAW264.7)能有效地吞噬芽孢。研究表明,芽孢杆菌营养体、芽孢均可激活巨噬细胞,并诱导细胞因子分泌。芽孢可刺激巨噬细胞分泌细胞因子IL-1α、TNF-α和IFN-γ[4]。坚强芽孢杆菌可分别在体外和体内激活巨噬细胞。有研究报道称,蜡样芽胞杆菌变种的芽孢能在家禽和猪的肠道中萌发[5-6],纳豆芽孢杆菌的芽孢也能在小鼠的胃肠道中萌发[7]。因此,有必要在分子水平对B.subtilis的基因进行改造,构建一株芽孢不萌发突变株和不生孢突变株,进一步研究芽孢和营养体对机体免疫功能的影响。本试验选用B.subtilisPY79作为工程菌。目前,已发现该菌株的芽孢萌发相关基因为clW、gerD和生孢早期基因为spo0A。 将萌发基因clW、gerD分别敲除后,还保留部分萌发能力,但将clW-gerD敲除后芽孢萌发能力丧失。因此,有利于进一步探究芽孢杆菌影响动物免疫功能的途径和机理,明确其作用方式。
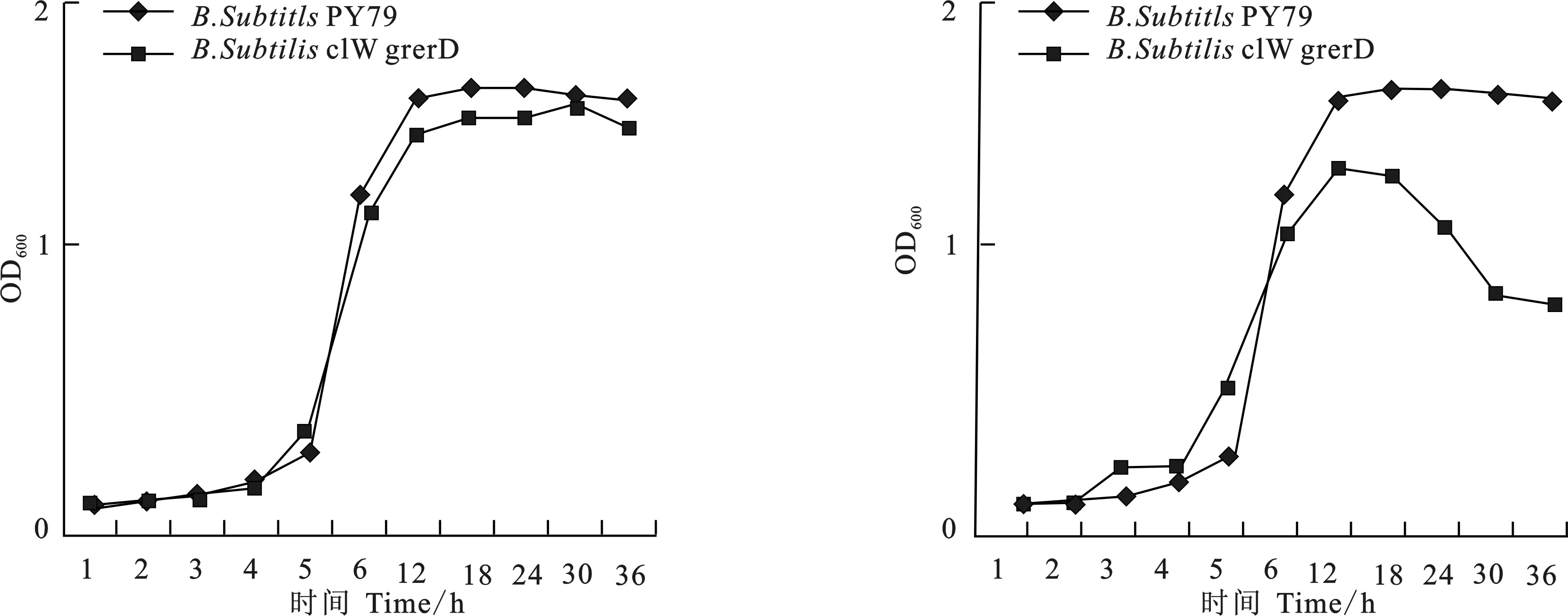
图3 突变株生长曲线检测Fig.3 The growth curves of mutant
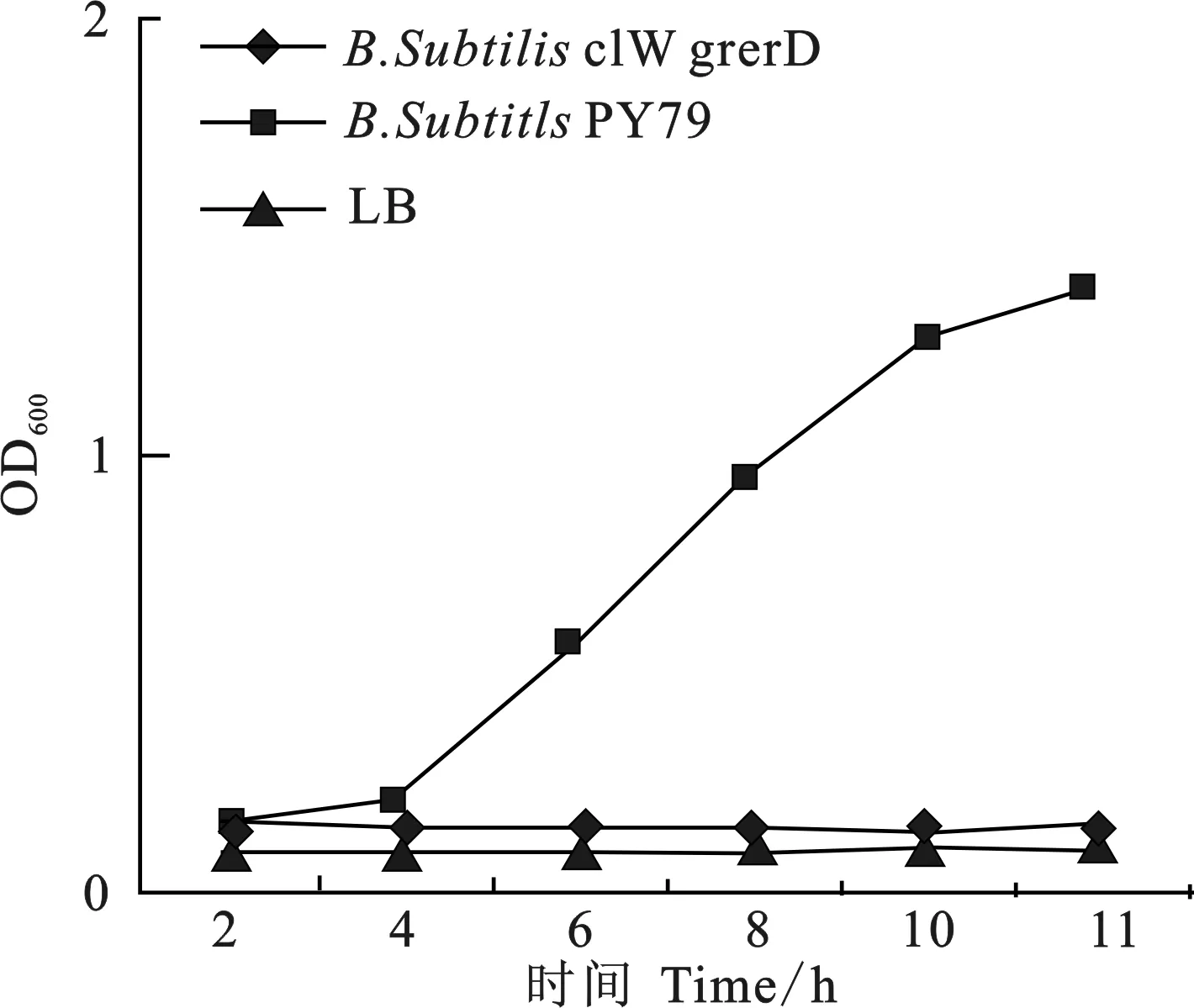
图4 萌发率检测Fig.4 The growth curves of mutant
细胞因子可改变细胞性质和行为,并具有免疫调节功能,是免疫应答重要的效应分子[8-9]。微生物
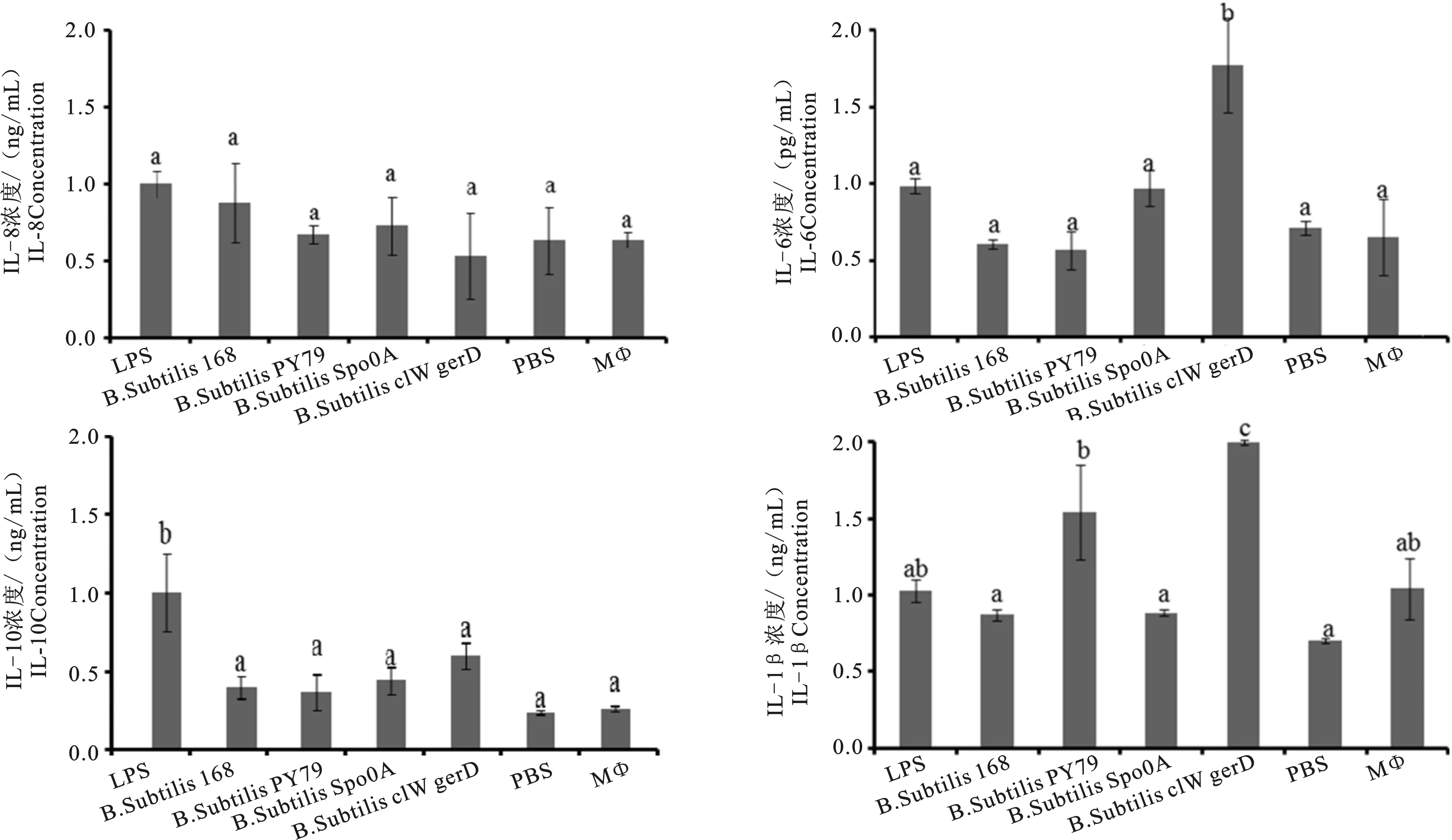
图5 突变株对巨噬细胞细胞因子表达检测Fig.5 Cytokine level in macrophage stimulated by mutant strains
刺激的细胞可通过释放细胞因子激活局部免疫和系统免疫,因此在免疫应答中扮演着重要的角色[10]。黄琴等[11]研究表明,B.subtilisB10芽孢可显著提高巨噬细胞促炎因子IL-6、IL-1β、TNF-α的分泌,并且显著性降低IL-10的含量。Lomakova等[12]研究结果显示,坚强芽孢杆菌可诱导小鼠巨噬细胞产生TNF-α、IL-1β和IL-10。本研究结果显示,B.subtilisclW-gerD-显著性提高了细胞因子IL-6的分泌(P<0.01),但对IL-1β、IL-8 和 IL-10的表达并无显著性影响。这可能是由于菌株特异性引起的。
4 结 论
B.subtilisclW-gerD-可刺激巨噬细胞分泌促炎因子IL-6,增强MΦ3D4/2细胞的炎症反应,提高机体的抗感染能力。本研究为进一步阐述芽孢杆菌对巨噬细胞的免疫调控机制奠定了基础。
参考文献:
[1]KOSAKA T,MAEDA T,NAKADA Y.Effect of Bacillus subtilis sporeadministration on activation of macrophages and natural killer cells inmice[J].Veterinary Microbiology,1998,60:215-225.
[2]INOOKA S,UEHARA S,KIMURA M.The effect of Bacillus natto on the T and B lymphocytes from spleens of feeding chickens [J].Journal of Poultry Science,1986,65:1 217-1 219.
[3]HONG H A,DUC LE H,CUTTING S M.The use of bacterial spore formers as probiotics [J].Fems Microbiology Reviews,2005,29(4): 813-835.
[4]HUANG J M,La RAGIONE R M, NUNEZ A,et al.Immunostimulatory activity of Bacillus spores [J].Fems Immunology and Medical Microbiology,2008,53(2): 195-203.
[5]JADAMUS A, VAHJEN W, SIMON O. Growth behaviour of a spore forming probiotic strain in the gastrointestinal tract of broiler chicken and piglets[J].Arch Fur Tierernahrung, 2001, 54:1-17.
[6]JADAMUS A, VAHJEN W, SIMON O. Influence of the probiotic strain Bacillus cereus var. toyoi on the development of enterobacterial growth and on selected parameters of bacterial metablism in dgests samples of piglets [J].Journal of Animal Physiology and Animal Nutrition, 2002, 86: 42-54.
[7]HOSOI T, AMETANI A, KIUCHI K,et al. Changes in fecal microflora induced by intubaton of mice with Bacillus subtilis (natto) spores are dependent upon dietary components [J]. Canadian Journal of Microbiol, 1999, 45: 59-66.
[8]STOYCHEVA M, MURDIEVA M. Dynamics of serum pro-inflammatory cytokines in patients with salmonella infection[J].Trakia Journal of Sciences,2005,3(3):56 -60.
[9]ARAI K I,LEE F,MIYAJIMA A,et al.Cytokines:coordinators of immune and inflammatory response [J].Annual Review Biochemistry,1990,59:7 833-7 836.
[10]TOSI M F.Innate immune responses to infection [J].Journal of Allergy and Clinical Immunology,2005,116(2):241-249.
[11]黄琴.芽孢杆菌影响Caco-2、RAW264.7细胞及小鼠免疫功能的研究[D].浙江杭州:浙江大学,2012.
[12]LOMAKOVA I,PETRASKOVA P,STERZL I,et al.Immunormodulatory effect of Bacillus firmus on mouse peritoneal cells in victor[J].Folia Microbiologica,2006,51(3):243-247.
