黄独胚性愈伤组织冻后黑暗培养及其再生植株半薄切片观察
2018-02-27洪森荣宁本松叶思雨张铭心占学林
洪森荣,宁本松,叶思雨,刘 燕,张铭心,占学林
(上饶师范学院 生命科学学院,江西 上饶 334001)
植物胚性愈伤组织是细胞悬浮培养、原生质体培养、基因转化和遗传育种的较好材料[1-2]。但胚性愈伤组织不宜诱导,一旦诱导出来后需要长期继代保持。研究表明,胚性愈伤组织多次继代易引起操作上的主观污染,而且继代时间越长,胚性愈伤组织也越易发生变异。目前,超低温保存是一种用液氮对植物材料进行长期保存的较佳方法[3]。在-196 ℃液氮中,植物材料的新陈代谢和生长发育几乎停止,且具有操作简单、保存时间长、遗传变异小等优点[4]。因此,对胚性愈伤组织进行超低温保存具有重要意义[5]。现有研究表明,在超低温保存后的再培养环节,如果先把冻后材料在黑暗中培养数天(冻后黑暗培养),再给予一定的光周期,可显著提高植物材料超低温保存后的成活率,而直接暴露于一定的光周期,则会显著降低其成活率[6-8]。
薯蓣科薯蓣属植物——黄独(DioscoreabulbiferaL.)的地下块茎在我国一般称为“黄药子”,是一味常用中药,可用来治疗多种癌症[9]。研究表明,冻后黑暗培养能显著提高黄独胚性愈伤组织的成活率[10-11],但冻后黑暗培养适宜时间以及其冻后再生植株的遗传稳定性还有待优化和进一步研究。本文对黄独胚性愈伤组织冻后黑暗培养的时间进行探讨,并对冻后黑暗培养胚性愈伤组织的显微结构及其再生植株进行半薄切片观察,旨在为黄独胚性愈伤组织的超低温保存提供形态解剖学依据。
1 材料与方法
1.1 材料
黄独胚性愈伤组织由上饶师范学院生命科学学院植物组织培养室提供。
1.2 方法
1.2.1 黄独胚性愈伤组织冻后黑暗培养及其半薄切片
为了保证黄独胚性愈伤组织的一致性,取同一个微型块茎切块诱导出胚性愈伤组织(能形成胚状体的愈伤组织),然后对胚性愈伤组织进行扩大增殖,最后用于后续试验。黄独胚性愈伤组织采用王子成等[11]的方法进行包埋玻璃化法超低温保存后,经化冻洗涤后置于再生培养基(MS+KT 2 mg·L-1+NAA 0.5 mg·L-1+30 g·L-1蔗糖+7.5 g·L-1琼脂)上培养,每处理接种冻后培养胚性愈伤组织块15个,每个胚性愈伤组织块约为0.2 g。冻后培养方式分2种:1)处理组,黑暗培养数天后再转入光周期培养,黑暗培养的时间分别为1、2、3、4、5、6、7、8、9、10、11、12、13、14和15 d,光周期14 h/10 h(L/D),光强2 000 lx;2)对照组,冻后不进行黑暗培养,直接光周期培养,光周期14 h/10 h(L/D),光强2 000 lx。采用以上2种方式培养40 d后进行成活率统计。超低温保存胚性愈伤组织均可生根发芽,说明冻后没有改变它的胚性。黄独胚性愈伤组织的成活以分化出小苗为标志。成活率=(分化出小苗的胚性愈伤组织/接种的冻后培养胚性愈伤组织总数)×100%。
筛选出适宜的冻后黑暗培养时间后,将处理组和对照组的材料切成小块,迅速放入2.5%戊二醛固定液中,0~4 ℃固定3 h以上;经0.1 mol·L-1的磷酸缓冲液清洗3次,丙酮逐级脱水,Epon树脂浸透包埋;最后在60 ℃烘箱中聚合。将不同材料的包埋块置于超薄切片机(Leica ultracut R)上进行切片,半薄切片厚度1 μm,用尖玻璃棒将切片挑至滴有双蒸水的干净载玻片上,再将载玻片置于70 ℃恒温电热板(Leica EMMP)上展片和干燥,将半薄切片用甲苯胺蓝染液染色,置于光学显微镜下(Leica DMLS)观察,用附带的成像系统(Canno Power Shot S70)拍照。
1.2.2 再生植株半薄切片
黄独胚性愈伤组织经包埋玻璃化法超低温保存[11]后,经化冻洗涤接种于再生培养基(MS+KT 2 mg·L-1+NAA 0.5mg·L-1+30 g·L-1蔗糖+7.5 g·L-1琼脂),黑暗培养3 d后再转入光周期培养,光周期14 h/10 h(L/D),光强2 000 lx。90 d后取其冻后再生植株(处理组)以及黄独常温继代再生植株(对照组,用带芽茎段进行常温继代再生的植株,无愈伤组织形成)进行半薄切片观察,方法同1.2.1节。
1.3 数据处理
以上实验均重复3次,本实验数据均以平均值±标准差来表示,数据采用SPSS 19.0软件进行One-Way ANOVA分析,再进行LSD法检验,P<0.05为有统计学差异显著性。
2 结果与分析
2.1 黄独胚性愈伤组织冻后黑暗培养时间
从图1可知,冻后黑暗培养时间对黄独胚性愈伤组织的成活率影响显著。冻后黑暗培养时间为0 d(直接光周期培养,对照组),黄独胚性愈伤组织的成活率仅为52.97%。冻后黑暗培养1 d,黄独胚性愈伤组织的成活率显著提高到63.28%。冻后黑暗培养时间继续延长,黄独胚性愈伤组织的成活率也显著增加,其中,冻后黑暗培养2~5 d,黄独胚性愈伤组织的成活率递增直至达到最高值,分别为75.35%、76.58%、78.34%和74.62%,这4个处理间无显著差异。冻后黑暗培养超过5 d,黄独胚性愈伤组织的成活率开始显著下降,冻后黑暗培养6~10 d,其成活率分别为62.43%、65.82%、63.44%、62.40%和63.55%,与冻后黑暗培养1 d无显著性差异。冻后黑暗培养11~15 d,成活率分别为55.36%、54.60%、54.28%、53.46%和52.69%,与冻后黑暗培养0 d无显著性差异。
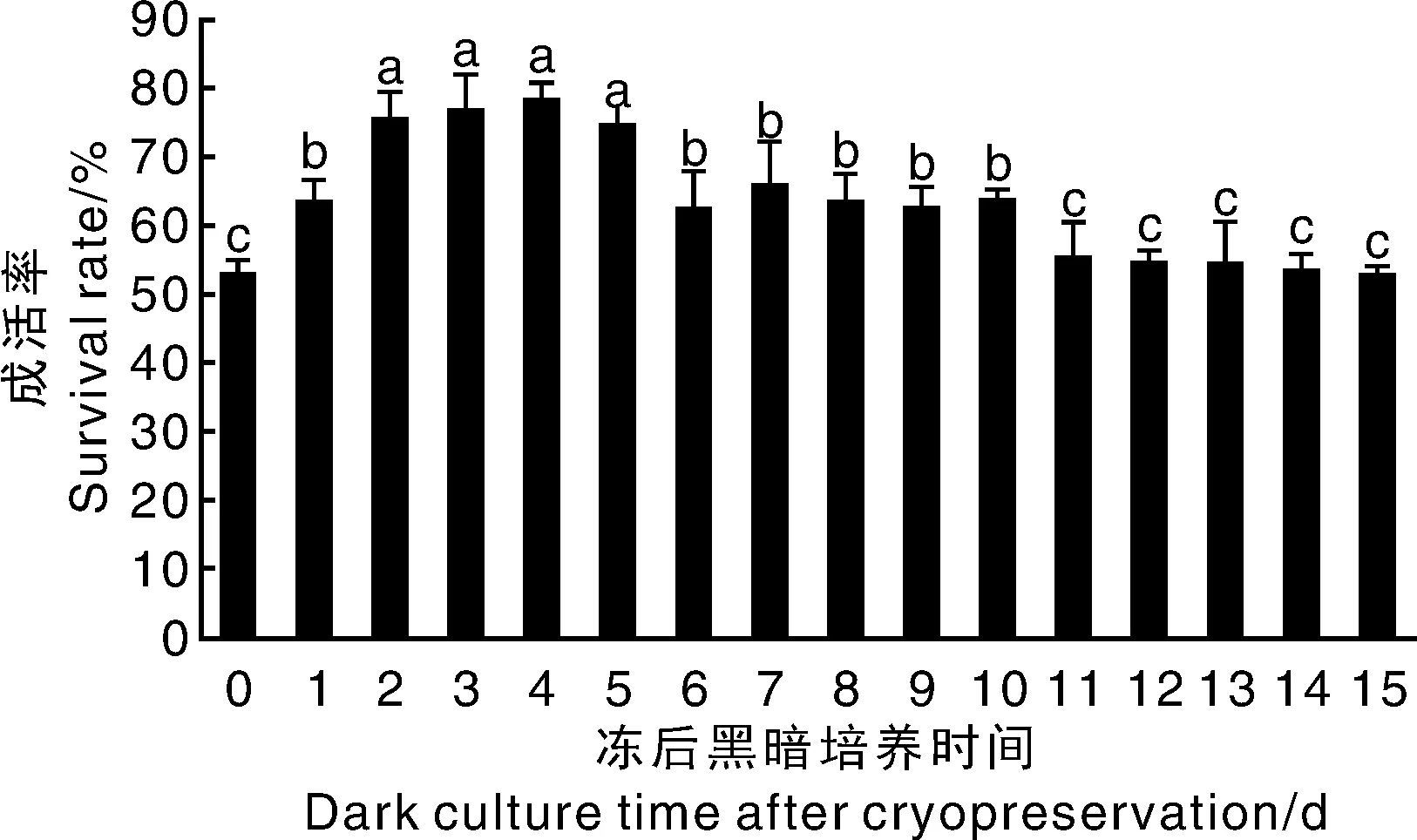
柱子上无相同小写字母表示处理间差异显著(P<0.05)。Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05.图1 冻后黑暗培养时间对黄独胚性愈伤组织成活率的影响Fig.1 Effect of dark culture time on the survival rate of Dioscorea bulbifera L. embryogenic callus after cryopreservation
2.2 黄独冻后黑暗培养胚性愈伤组织的半薄切片观察
未经冻后黑暗培养,直接置于光周期下培养7 d,会造成胚性愈伤组织细胞排列疏松,细胞外形及大小出现一定的变化,并且局部某些部位也会出现较大的细胞空隙(图2-A);冻后黑暗培养3 d,再置于光周期下培养4 d,胚性愈伤组织细胞排列比较紧密,细胞空隙较小(图2-B)。表明冻后黑暗培养可以在一定程度上保证胚性愈伤组织细胞结构的完整性,这也为冻后黑暗培养促进黄独胚性愈伤组织的成活提供了形态解剖学证据。
2.3 黄独冻后黑暗培养胚性愈伤组织再生植株遗传稳定性的半薄切片观察
对黄独冻后黑暗培养胚性愈伤组织(冻后黑暗培养3 d后再置于光周期下培养4 d)再生植株以及黄独常温继代再生植株进行半薄切片观察。结果表明:2种类型再生植株的根均由表皮、皮层和维管柱构成,维管柱外有一层明显的中柱鞘细胞,中央有大导管,大导管周围有小导管;另外,维管柱内有多个散生韧皮部(图3)。因此,黄独冻后黑暗培养胚性愈伤组织再生植株与常温继代再生植株的根结构相比较无显著性差异。2种类型再生植株的的茎均由1层表皮、1~4层皮层以及中央的木质部组成,木质部间有多个散生韧皮部,木质部和散生韧皮部外有1层有限维管束包围(图4)。因此,黄独冻后黑暗培养胚性愈伤组织再生植株与常温继代再生植株的茎结构相比较无显著性差异。2种类型再生植株的叶表皮细胞均呈不规则形,排列紧密,叶肉由排列紧密的栅栏组织和排列疏松的海绵组织组成;叶片上的气孔器均由保卫细胞组成,气孔下面有孔下室,有些孔下室下的叶肉细胞呈长条形;叶肉细胞内有叶绿体,叶绿体一般排列在叶片向阳面(图5)。黄独冻后黑暗培养胚性愈伤组织再生植株叶片细胞的平均叶绿体数为9.26,常温继代胚性愈伤组织再生植株叶片细胞的平均叶绿体数为8.82,两者无显著性差异。

A, 冻后光周期培养7 d; B, 冻后黑暗培养3 d,再光周期培养4 d。A, Cultured in the photoperiod for 7 d after cryopreservation; B, Cultured in the dark for 3 d and then in the photoperiod for 4 d after cryopreservation.图2 黄独胚性愈伤组织的半薄切片观察(×40)Fig.2 Semi thin section observation of embryogenic calli from Dioscorea bulbifera L. (×40)

A和C, 黄独冻后黑暗培养3 d再光周期培养4 d胚性愈伤组织再生植株; B和D, 常温继代再生植株。下图同。A and C, Plantlet regenerated from Dioscorea bulbifera L. embryogenic calli cultured in the dark for 3 d and then in the photoperiod for 4 d after cryopreservation; B and D, Plantlet regenerated from Dioscorea bulbifera L. embryogenic calli subcultured at room temperature. The same as bellow.图3 黄独胚性愈伤组织再生植株根(×10)及其维管柱(×40)的半薄切片观察Fig.3 Semi thin section observation of the root (×10) and vascular cylinder (×40) of plantlet regenerated from Dioscorea bulbifera L. embryogenic calli
3 讨论
研究表明,冻后黑暗培养时间对超低温保存材料的后期恢复影响很大。王子成等[12]研究表明,超低温保存后,黑暗培养1~9 d,马铃薯茎尖的存活率随着培养时间的延长而增大;冻后黑暗培养时间超过11 d,马铃薯茎尖的存活率反而显著下降。本研究也表明,包埋玻璃化法超低温保存后,黑暗培养1~5 d,黄独胚性愈伤组织的成活率随着培养时间的延长而增大;冻后黑暗培养超过5 d,黄独胚性愈伤组织的成活率显著下降。本实验结果与李红民等[13]对匍匐翦股颖胚性愈伤组织、简令成等[14]对甘蔗胚性愈伤组织、苏新等[15]对浙贝母愈伤组织的研究结果相一致,推测冻后黑暗培养对细胞的恢复是必需的,有助于修复受损伤的膜[16],恢复活性氧防御系统功能[17],减少褐变[18],从而提高成活率;但冻后黑暗培养时间过长,不利于成活率的增加,可能是暗培养时间过长,光照不足,细胞分裂和分化受到抑制所致[12。同时,本实验的半薄切片观察结果也表明,冻后未经黑暗培养直接置于光周期下培养,会造成细胞排列疏松,局部某些部位会出现较大的细胞空隙;冻后经过适宜时间的黑暗培养,再置于光周期下培养,细胞排列比较紧密,细胞空隙较小。因此,推测冻后黑暗培养在一定程度上保证了胚性愈伤组织细胞结构的完整性,从而提高了愈伤组织的成活率。

图4 黄独胚性愈伤组织再生植株茎(×10)和维管束(×40)的半薄切片观察Fig.4 Semi thin section observation of the stem (×10) and vascular bundle (×40) of plantlet regenerated from Dioscorea bulbifera L. embryogenic calli
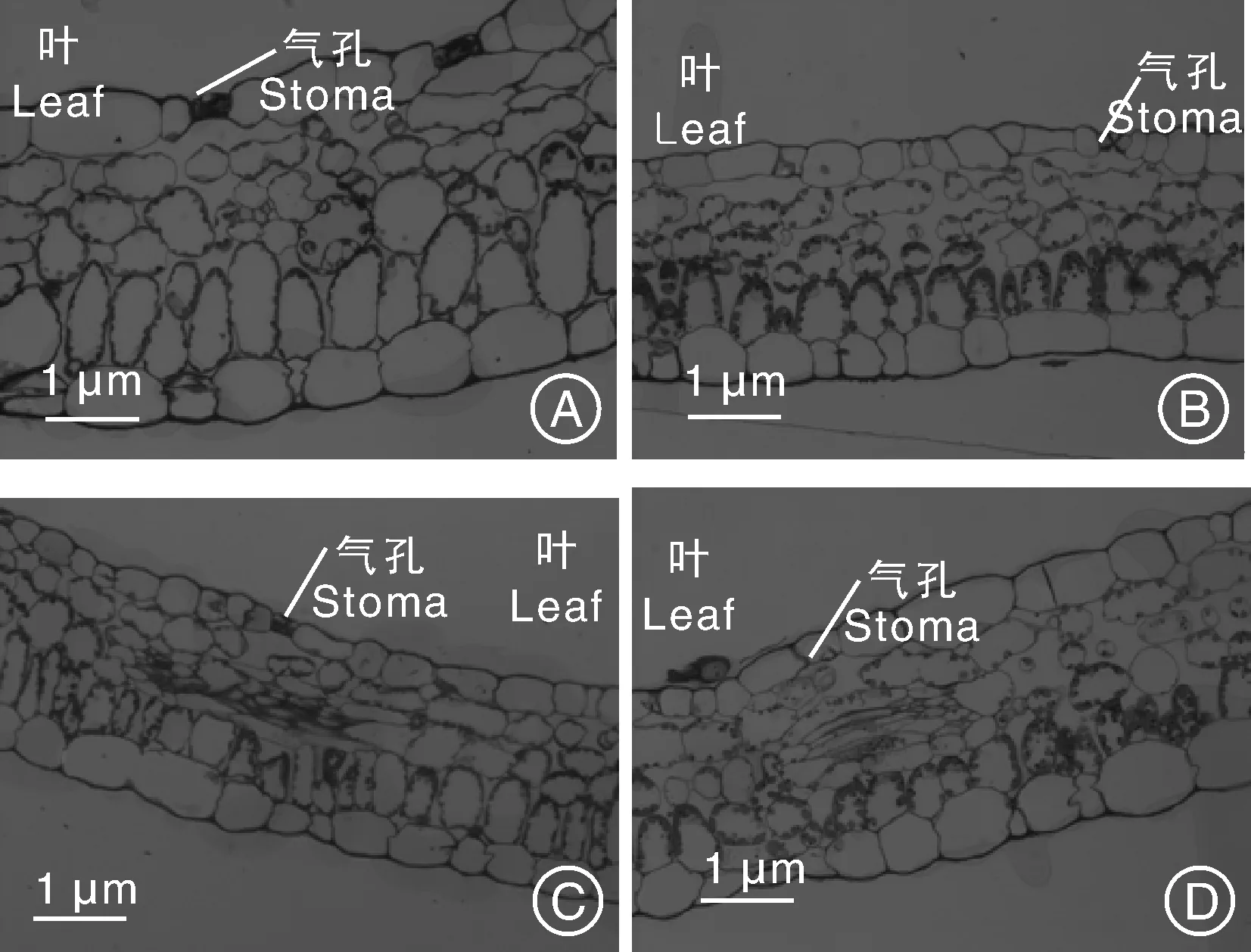
图5 黄独胚性愈伤组织再生植株叶(×10)和气孔器(×40)的半薄切片观察Fig.5 Semi thin section observation of the leaf (×40) and stomatal apparatus (×40) of plantlet regenerated from Dioscorea bulbifera L. embryogenic calli
由于超低温保存过程是一种逆境处理,在此过程中,材料会经历渗透胁迫、氧化胁迫、干旱胁迫和低温胁迫等各种胁迫,这些胁迫对植物的遗传信息会产生较大的影响[12]。因此,对胚性愈伤组织冻后再生植株的遗传稳定性进行检测是植物种质资源超低温保存的一个必要步骤。目前,关于冻后再生植株遗传稳定性的检测主要是通过形态学、细胞学[19]、同工酶[20]和DNA分子标记[21]的手段来实现的。本实验对黄独冻后黑暗培养胚性愈伤组织再生植株以及黄独常温继代再生植株的形态解剖学结构进行半薄切片观察发现,黄独冻后黑暗培养胚性愈伤组织再生植株的茎结构、叶肉细胞的平均叶绿体数量均与常温继代再生植株无显著性差异。黄独胚性愈伤组织的超低温保存可保证其形态学结构的一致性,为黄独胚性愈伤组织的超低温保存提供了显微结构依据。本实验结果与李艳娜等[22]对香蕉胚性细胞悬浮系、陈冠群等[23]对百子莲胚性愈伤组织的研究结果相一致。
[1] SANDOVAL-CANCINO G, SENZ L, CHAN J L, OROPEZA C. Improved formation of embryogenic callus from coconut immature inflorescence explants[J].InVitroCellular&DevelopmentalBiology-Plant, 2016, 52(4): 367-378.
[2] HUGO P F F, LEILA N V, CATARINA C P, et al. High-efficiency cryopreservation ofAraucariaangustifolia(Bertol.) Kuntze embryogenic cultures: ultrastructural characterization and morpho-physiological features[J].PlantCellTissueandOrganCulture, 2016, 66(2): 1-12.
[3] HOFER M. Cryopreservation ofinvitroshoot tips of strawberry by the vitrification method-establishment of a duplicate collection ofFragariagermplasm[J].Cryo-Letters, 2016, 37(3): 163-172.
[4] GUPTA S. Cryopreservation of shoot tips ofFragariaspp. and virus elimination through cryotherapy[J].Cryobiology, 2016, 73(3): 404.
[5] ENGELMANN F, LARTAUD M, CHABRILLANGE N, et al. Cryopreservation of embryogenic calluses of two commercial clones ofHeveabrasiliensis[J].Cryo-Letters, 1997, 18(2): 107-116.
[6] PRUDENTE D O, PAIVA R, PAIVA P D O, et al. Cryopreservation of shoot tips excised from zygotic embryos ofAraucariaangustifolia(Bertol.) Kuntze[J].ActaHorticulturae, 2016 (1113): 257-264.
[8] 蔡月琴, 王艳平, 庄君娥, 等. 紫参薯的包埋玻璃化超低温保存[J]. 西南大学学报(自然科学版), 2016, 38(9): 58-64.
CAI Y Q, WANG Y P, ZHUANG J E, et al. Cryopreservation of purple yam (Dioscoreaalata) by encapsulation-vitrification[J].JournalofSouthwestUniversity(NaturalScienceEdition), 2016, 38(9): 58-64. (in Chinese with English abstract)
[9] 曲晓宇, 周利婷, 张四喜, 等. 黄独素B致小鼠肝损伤过程中对肝外排型转运体Mrp2表达的影响[J]. 中国医院药学杂志, 2016, 36(19): 1633-1636.
QU X Y, ZHOU L T, ZHANG S X, et al. Changs of expression of liver afflux transporter Mrp2 during diosbulbin B induced liver injury in mice[J].ChineseJournalofHospitalPharmacy, 2016, 36(19): 1633-1636. (in Chinese with English abstract)
[10] HONG S, YIN M, SHAO X, et al. Cryopreservation of embryogenic callus ofDioscoreabulbiferaby vitrification[J].CryoLetters, 2009, 30(1): 64-75.
[11] YIN M H, HONG S R. A simple cryopreservation protocol ofDioscoreabulbiferaL. embryogenic calli by encapsulation-vitrification[J].PlantCellTissueandOrganCulture, 2010, 101(3): 349-358.
[12] 王子成, 曲先, 薄涛. 超低温保存脱除两种马铃薯病毒[J]. 河南大学学报(自然科学版), 2011, 41(6): 609-614.
WANG Z C, QU X, BO T. Elimination of two potato virus by cryopreservation[J].JournalofHenanUniversity(NaturalScienceEdition), 2011, 41(6): 609-614. (in Chinese with English abstract)
[13] 李红民, 马晖玲. 玻璃化法超低温保存匍匐翦股颖胚性愈伤组织及其植株再生[J]. 甘肃农大学报, 2009, 44(4): 62-66.
LI H M, MA X L. Cryopreservation of creeping bentgrass embryogenic callus by vitrification and its plant regeneration[J].JournalofGansuAgriculturalUniversity, 2009, 44(4): 62-66. (in Chinese with English abstract)
[14] 简令成, 孙德兰, 孙龙华. 甘蔗愈伤组织超低温保存中一些因素的研究[J]. 植物生态学报(英文版), 1987, 29(2): 123-131.
JIAN L C, SUN D L, SUN L H. Studies on factors in cryopreservation of sugarcane calluses[J].ActaBotanicaSinica, 1987, 29(2): 123-131. (in Chinese with English abstract)
[15] 苏新, 方坚. 浙贝母愈伤组织超低温保存的研究[J]. 中药材, 1990, 13(12): 3-5.
SU X, FANG J. Cryopreservation of calli ofFritillariathunbergiiMiq[J].JournalofChineseMedicinalMaterials, 1990, 13(12): 3-5. (in Chinese)
[16] 文彬. 植物种质资源超低温保存概述[J]. 植物分类与资源学报, 2011, 33(3): 311-329.
WEN B. An introduction to cryopreservation of plant germplasm[J].PlantDiversityandResources, 2011, 33(3): 311-329. (in Chinese with English abstract)
[17] WEN B, CAI C, WANG R, et al. Cytological and physiological changes in recalcitrant Chinese fan palm (Livistonachinensis) embryos during cryopreservation[J].Protoplasma, 2012, 249(2): 323-335.
[18] KHODDAMZADEH A A, SINNIAH U R, LYNCH P, et al. Cryopreservation of protocorm-like bodies (PLBs) ofPhalaenopsisbellina, (Rchb.f.) christenson by encapsulation-dehydration[J].PlantCellTissueandOrganCulture, 2011, 107(3): 471-481.
[19] 艾鹏飞, 罗正荣. 柿和君迁子试管苗茎尖玻璃化法超低温保存及再生植株遗传稳定性研究[J]. 中国农业科学, 2004, 37(12): 2023-2027.
AI P F, LUO Z R. Cryopreservation ofinvitroshoot-tips of persimmon and date plum by vitrification and genetic stability of regenerated plantlets[J].ScientiaAgriculturaSinica, 2004, 37(12): 2023-2027. (in Chinese with English abstract)
[20] 赵喜亭, 蒋丽微, 宋萍萍, 等. 怀黄菊微滴玻璃化超低温保存再生植株的生理和同工酶分析[J]. 河南农业科学, 2016, 45(5):111-114.
ZHAO X T, JIANG L W, SONG P P, et al. Analysis of physiology and isoenzyme of regenerated plantlets ofChrysanthemummorifolium‘Huaihuang’ cryopreserved by droplet vitrification[J].JournalofHenanAgriculturalSciences, 2016, 45(5): 111-114. (in Chinese with English abstract)
[21] 邵丽, 王子成. 植物种质超低温保存遗传稳定性的研究进展[J]. 植物生理学报, 2010, 46(11): 1109-1113.
SHAO L, WANG Z C. Review of genetic stability research for plant germplasm cryopreservation[J].PlantPhysiologyJournal, 2010, 46(11): 1109-1113. (in Chinese with English abstract)
[22] 李艳娜, 尉义明, 胡桂兵, 等. 香蕉胚性细胞悬浮系玻璃化法超低温保存及再生植株遗传稳定性分析[J]. 园艺学报, 2010, 37(6): 899-905.
LI Y N, WEI Y M, HU G B, et al. Plant regeneration via somatic embryogenesis after cryopreservation of embryogenic cell suspensions of banana (Musaspp. AAA) by vitrification and the genetic stability of regenerated plant[J].ActaHorticulturaeSinica, 2010, 37(6): 899-905. (in Chinese with English abstract)
[23] 陈冠群, 李晓丹, 申晓辉. 百子莲胚性愈伤组织玻璃化法超低温保存体系建立及遗传稳定性分析[J]. 上海交通大学学报(农业科学版), 2014, 32(5): 76-83, 94.
CHEN G Q, LI X D, SHEN X H. Vitrification-based cryopreservation of embryogenic callus ofAgapanthuspraeconssp. Orientalis and analysis of genetic stability by AFLP[J]. JournalofShanghaiJiaotongUniversity(AgriculturalScience), 2014, 32(5): 76-83, 94. (in Chinese with English abstract)
