转基因水稻中转人乳铁蛋白的抗氧化及免疫作用
2018-02-27吕国英张作法
秦 毅,吕国英,张作法,*
(1.浙江大学 技术转移中心,浙江 杭州 310058;2.浙江省农业科学院 园艺研究所,浙江 杭州 310021)
人乳铁蛋白(human lactoferrin, hLF)是一种分子量约为80 ku的多肽蛋白,主要存在于乳汁、眼泪、唾液等外分泌液或血浆、中性粒细胞中。hLF在人初乳中含量较高,达到6~8 mg·mL-1[1]。hLF具有广泛的生物学活性,如防止新生儿败血症,促进哺乳动物细胞生长,防辐射,抗菌,抗病毒,宿主防御和免疫调节功能,抗肿瘤等[2-6],被认为是一种新型的抗菌、抗癌药物和极具开发潜力的食品和饲料添加剂。
乳铁蛋白的多种生物学功能使其具有广阔的应用前景,以前乳铁蛋白主要从动物乳中提取,但由于天然乳铁蛋白在乳汁中含量低,高昂的成本限制了其大规模的应用。hLF更是由于缺乏原料,不能大量生产。在这种情况下,植物转基因技术为生产乳铁蛋白提供了新的技术手段。近年来,hLF基因被成功地转入马铃薯、番茄、烟草和水稻等植物中,以提高作物的营养保健品质[7-10]。Anzai等[11]把人乳铁蛋白基因置于水稻谷蛋白启动子的控制下,再转入水稻中,成功获得了特异性表达的转基因水稻植株。最近我国浙江大学的Lin等[12]也将人乳铁蛋白基因成功转入主栽水稻秀水110号,结果表明,转基因水稻中的hLF含量达到24.7 mg·kg-1,是其父本铁含量的2倍。胡贻椿[13]研究发现,转人乳铁蛋白基因水稻对健康没有副作用,而且营养学质量优于父代品种。相比其他植物,hLF在水稻中表达量最高(是其他植物的25~40倍)[14],所以从转基因水稻中提取hLF是获取此种蛋白较为经济有效的一种方式。与其他作物相比,水稻有以下3个优势: (1)稻米可以贮藏多年而营养物质不会损失,因此乳铁蛋白的获得不依赖于生长季节[15];(2)稻米致敏性低,因此利用水稻生产转基因蛋白是可靠的[16,17];(3)水稻是自花授粉的作物,交叉授粉的几率很低[18]。
本研究在获得转基因水稻的基础上,按照饱和硫酸铵盐沉淀、弱阳离子交换层析、分子筛层析等方法提取和纯化rhLF,并对纯化后蛋白进行清除自由基和免疫活性分析。
1 材料与方法
1.1 材料
rhLF由浙江大学转基因研究中心提供,采用农杆菌介导法将hLF基因导入粳稻秀水110号获得,乳铁蛋白的含量占种子干质量的0.5%,其提取过程按吴景欢等[19]报道的方法进行。
RAW264.7巨噬细胞株购于中科院上海生命科学研究院;DMEM(高糖)培养基购于Gibco公司、胎牛血清购于上海四季青公司;DPPH (1,1-二苯基-2-苦基肼)、 ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)]、PBS,青霉素、链霉素、脂多糖、0.25%胰蛋白酶-EDTA和Griess试剂盒购于Sigma 公司。其余试剂均为分析纯试剂。
1.2 蛋白检测方法
分离纯化后的rhLF浓度的测定采用SDS-PAGE法。用10%的分离胶和5%的积层胶,对收集到的蛋白样品进行电泳,考马斯亮蓝染色法显色蛋白条带。
1.3 rhLF清除自由基实验
1.3.1 清除DPPH自由基
不同浓度的各样品1.0 mL,加入到3 mL DPPH(5 mmol·L-1)中,摇匀,25 ℃放置30 min,然后在515 nm下测定其吸光度,以抗坏血酸为对照,DPPH清除活性可用以下公式来计算样品的清除率:
清除率(%)=[(D空白-D样品)/D空白]×100。
式中:D样品为样品溶液的吸光值;D空白为空白溶液的吸光值。
1.3.2 清除ABTS+自由基
ABTS+混合液的制备:将7 mmol·L-1ABTS水溶液与2.45 mmol·L-1过硫酸钾水溶液混合,将混合液在室温条件下避光放置12~16 h,形成ABTS+自由基储备液。将此工作液用磷酸缓冲液稀释,在734 nm下调其吸光度为0.700±0.02,得到ABTS+混合液,于30 ℃下预热备用。取0.5 mL溶液加入1 mL ABTS+混合液混合均匀,室温下避光静置30 min后于波长734 nm下测定吸光值,以去离子水作为空白对照。
ABTS+清除率(%)=(1-D样品/0.7)×100。
式中D样品为样品溶液的吸光值。
1.3.3 清除羟基自由基活性
1mL 样品液中加入6 mmol·L-1FeSO4溶液1 mL,混匀后加入6 mmol·L-1H2O2溶液1 mL,混匀后静置10 min, 加入6 mmol·L-1水杨酸1 mL,混匀后37 ℃水浴反应30 min, 3 000 r·min-1离心10 min, 取上清液于510 nm处测定吸光值,以蒸馏水作为空白对照组,计算清除率。
清除率(%)=[(D空白-D样品)/D空白]×100。
式中:D样品为样品溶液的吸光值;D空白为空白溶液的吸光值。
1.4 rhLF对RAW264.7细胞的作用研究
1.4.1 小鼠巨噬细胞系RAW264.7细胞培养
采用DEME培养基(100 U·mL-1青霉素和100 μg·mL-1链霉素、10% FBS), 于37 ℃,5% CO2条件下培养,细胞生长至90%时,用0.25%胰蛋白酶-EDTA消化细胞,传代,取对数生长细胞进行实验。
1.4.2 RAW264.7细胞增殖的检测
调整细胞密度为1×104mL-1,接种于96孔板,体积为100 μL, 于37 ℃、5% CO2下培养24 h,加入100 μL不同浓度的rhLF,使最终浓度为0.062 5,0.125 0,0.250 0,0.500 0,1.000 0和2.000 0 mg·mL-1,设空白对照组。以100 μg·mL-15-FU为阳性对照,培养48 h后加入CCK-8,轻轻振荡,继续培养2~4 h。酶标仪于490 nm处检测吸光值,每个平行浓度设3个重复。
1.4.3 RAW264.7细胞吞噬活性的检测
调整细胞密度为3×105mL-1,接种于96孔板,体积为100 μL,于37 ℃,5%CO2下培养24 h后,加入100 μL不同浓度的测试样品,使最终浓度为0.25~3.00 mg·mL-1,设空白对照组。培养48 h后弃去上清,每孔加入100 μL 0.072%中性红试剂,于37 ℃,5% CO2下培养箱孵育30 min, 弃去中性红,用PBS清洗3次,每次100 μL,并甩干。每孔加入醋酸-乙醇(体积比1∶1)细胞裂解液100 μL,4 ℃过夜,用酶标仪于570 nm检测吸光值,每个平行浓度设3个重复。
2 结果与讨论
2.1 纯化后的rhLF SDS-PAGE 纯度检测
从转基因水稻中经硫酸铵分级沉淀、弱阳离子交换层析、分子筛层析及膜包脱盐浓缩后,获得较高纯度的rhLF(图1)。
2.2 rhLF的抗氧化实验
2.2.1 rhLF的DPPH清除活性
DPPH是一种非常稳定的自由基,在517 nm处有强吸收,当遇到自由基清除剂时,其分子上的单电子被配对而使颜色变浅,可以用此来评价试样的抗氧化能力[20]。
从图2可知,随着浓度的增加, rhLF对DPPH自由基的清除率逐渐升高,其浓度与清除度有良好的量效关系。在0.125~4.000 mg·mL-1浓度下,rhLF的DPPH清除率在18.32%~78.90%。与阳性对照抗坏血酸相比,rhLF的清除率偏低。抗坏血酸在测试浓度范围内一直显示了很强的抗氧化活性,即使在最低浓度下(0.125 mg·mL-1),DPPH清除率也达到了84.36%。
2.2.2 rhLF的清除ABTS自由基活性
由图3可知,rhLF对ABTS清除率随着浓度的增加逐渐增大,总体上变化不剧烈,浓度与清除率存在很好的线性关系。在浓度为4 mg·mL-1时,rhLF对ABTS 的清除率达到了86.5%。阳性对照组抗坏血酸显示了很强的抗氧化活性。在所测试的浓度范围内,抗坏血酸的ABTS清除率都非常高,最低也接近于90%。
2.2.3 rhLF清除羟基自由活性
在所有的氧自由基中,羟基自由最强,危害也最大,所以对清除羟基自由基的研究非常重要。羟基自由基清除的原理是抗氧化剂通过与H2O2争夺金属离子进而抑制羟基自由基的产生。如图4所示,rhLF对羟基自由基的清除率随浓度的增加逐渐增大,总体上变化不剧烈。 抗坏血酸对羟基自由基的清除率随浓度增大,先缓慢升高,当达到某一阈值后急速升高,表现出很强的对羟基自由基的清除效果。相对于阳性对照抗坏血酸, rhLF的抗羟基自由基的活性很低,在测试浓度范围内,4 mg·mL-1的浓度下,羟基自由基的清除率也仅为41.1%。而抗坏血酸在最低浓度(0.125 mg·mL-1)时,清除率就已达到了69.4%。本实验通过研究rhLF对DPPH、ABTS及羟基自由基的清除效果来检验其抗氧化能力。结果显示,rhLF对DPPH、ABTS 和羟基自由基具有一定的清除能力,并呈现剂量依赖型。
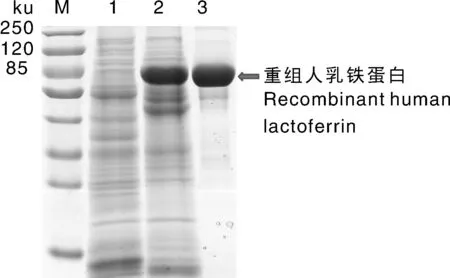
M, 蛋白质Marker; 泳道1, 水稻常规种子阴性对照; 泳道2, 重组人乳铁蛋白纯化前; 泳道3, 蛋白纯化后。M, Marker of protein; Lane 1, negative control; Lane 2, recombinant human lactoferrin before purification; Lane 3, recombinant human lactoferrin after purification.图1 水稻转人乳铁蛋白的SDS-PAGE分析Fig.1 The SDS-PAGE analysis for the recombinant human lactoferrin from transgenic rice

图2 水稻转人乳铁蛋白清除DPPH活性Fig.2 Scavenging effects of recombinant human lactoferrin on DPPH

图3 水稻转人乳铁蛋白清除ABTS活性Fig.3 Scavenging effects of recombinant human lactoferrin on ABTS
2.3 rhLF的免疫调节作用
2.3.1 rhLF对RAW264.7细胞增殖的影响
由图5 可知,随着rhLF浓度的增加,RAW264.7细胞增殖率有所增高,当浓度达到0.5mg·mL-1时,增加极显著。当浓度达到1 mg·mL-1时,rhLF促进细胞增殖率最高(62.41%)。随着浓度的增加,对细胞的增殖有所下降。这说明,当rhLF在低浓度时,显著地促进RAW264.7细胞的增殖,但是当浓度增加到一定值时,会对细胞的生长产生抑制作用。综上所述,rhLF在0.062 5~1.000 0 mg·mL-1浓度范围内对RAW264.7细胞具有良好的增殖作用,能提高巨噬细胞的密度和活力,对于提高机体免疫力具有很大的作用。
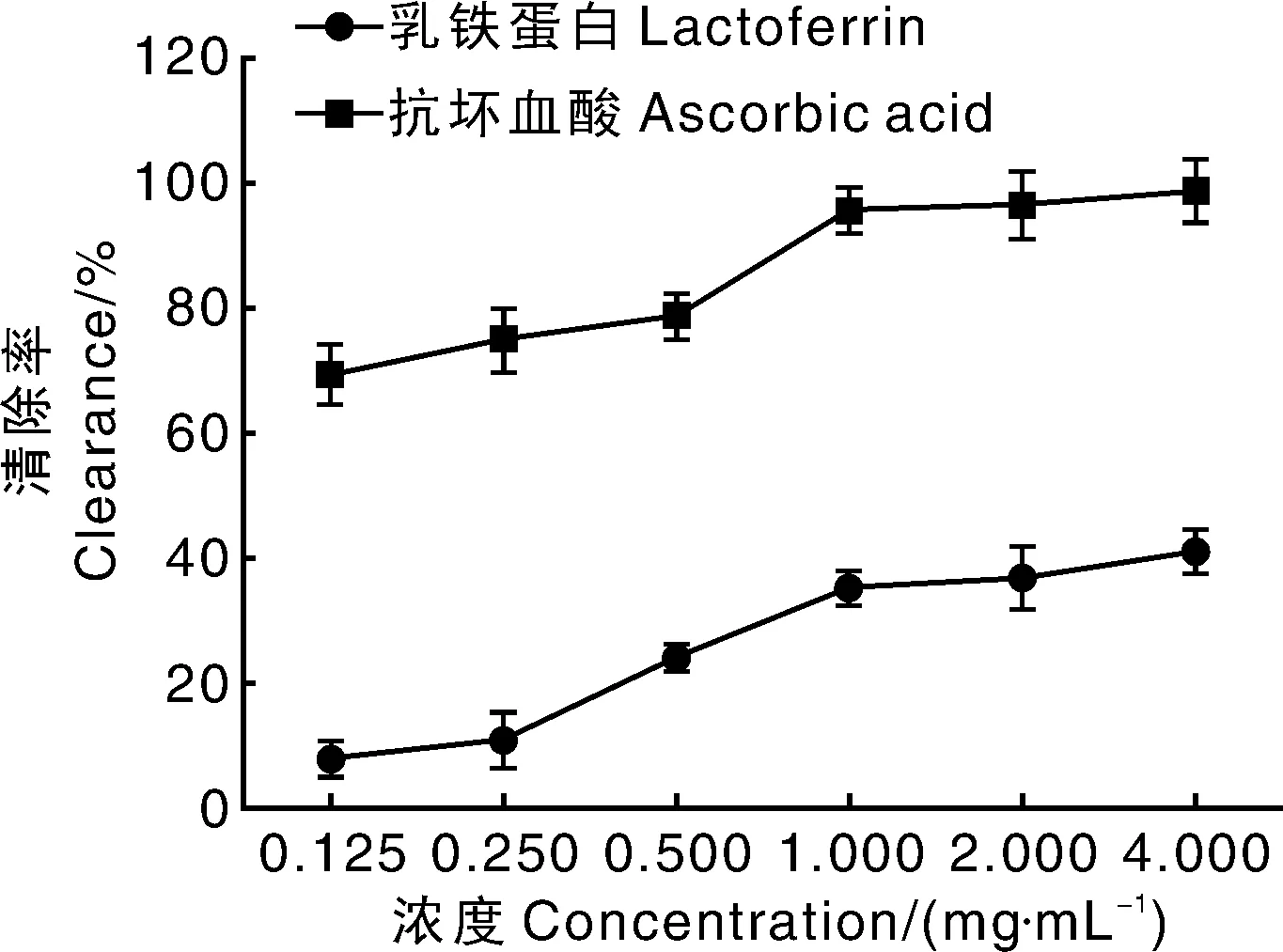
图4 水稻转人乳铁蛋白的清除羟基自由基活性Fig.4 Scavenging effects of recombinant human lactoferrin on hydroxyl radical
2.3.2 rhLF对RAW264.7吞噬活性的影响
由图6可知,当浓度小于1 mg·mL-1,RAW264.7 吞噬活性呈较快的升高,随着浓度的升高,吞噬活性变化不大。整体上剂量关系依赖不强烈。在浓度为2 mg·mL-1时,吞噬活性最高达到了69.89%。综上所述,rhLF在测试浓度范围内对RAW264.7细胞吞噬活性有明显的提高作用,它能增强RAW264.7 细胞对抗原的吞噬,进而加快巨噬细胞将抗原递呈给其他免疫细胞,加速引发免疫反应。本实验研究了rhLF对RAW264.7细胞增殖及吞噬能力的影响,发现其能够促进细胞增殖分裂,刺激免疫细胞增殖分裂,在对应外来抗原和自身癌变中具有重要的意义。rhLF提高了RAW264.7的吞噬活性,进而提高了其捕捉抗原的能力,这对于提高机体免疫应答有重要意义。rhLF对免疫细胞因子分泌的促进,对于免疫力的提高和癌症抵抗方面不可或缺[21]。

图5 水稻转人乳铁蛋白对RAW264.7细胞增殖的影响Fig.5 Effects of recombinant human lactoferrin on cell proliferation in RAW264.7 cells by MTT assay

图6 水稻转人乳铁蛋白对RAW264.7细胞吞噬活性的影响Fig.6 Effects of recombinant human lactoferrin on phagocytic activity of RAW 264.7 cells
前期对乳铁蛋白的抗氧化和免疫活性已有研究,李婷等[22]利用牛乳中提取的乳铁蛋白来研究其抗氧化活性,认为乳铁蛋白能够结合铁离子来实现抗氧化活性;戴亚妮等[23]则研究了转基因牛乳中的乳铁蛋白的抗氧化活性,认为其可以作为天然抗氧化剂添加到保健品或化妆品中。安清聪等[24]研究发现,牛乳中分离的乳铁蛋白能提高断奶仔猪的血清抗氧化指标及组织中抗氧化基因的表达。在提高免疫力方面,胡志和等[25]研究发现乳铁蛋白能够显著提高小鼠的免疫力。但是,以上研究主要集中在牛乳中分离到的乳铁蛋白或转乳铁蛋白,而对水稻中的转人乳铁蛋白的清除自由基和免疫活性却没有任何报道。
动物实验表明,乳铁蛋白安全可靠,无副作用,能够促进新生儿铁吸收,具有抗菌、调节机体免疫力的作用,因此可以作为新生儿奶粉的营养配方[26],保护新生儿健康,促进其生长发育。乳铁蛋白可以作为新型的功能型配料用于保健食品,提高免疫力,改善影响性贫血,延缓衰老,还可以作为食品抗氧化剂及食品防腐剂。转人乳铁蛋白可以作为动物饲料添加剂,从而减少抗生素的应用[27],乳铁蛋白中有各种黏膜病菌的受体被发现预示了其在开发为药物治疗的应用[28]。总之,转人乳铁蛋白对DPPH、ABTS和羟基自由基具有一定的清除能力,并能促进免疫细胞的增殖和增强免疫细胞的吞噬活性。本实验研究结果对于开发以转人乳铁蛋白为原料的保健食品有重要指导意义。
[1] MASSON P L, HEREMANS J F. Lactoferrin in milk from different species[J].ComparativeBiochemistryandPhysiologyPartB:ComparativeBiochemistry, 1971, 39(1): 119-129.
[2] CHRISTIE G T, ALONSO Z V, ALONSO P, et al. Lactoferrin for prevention of neonatal sepsis[J].Biometals, 2014, 27(5): 1007-1016.
[3] HUANG N, BEHHELL D, CARD C, et al. Bioactive recombinant human lactoferrin, derived from rice, stimulates mammalian cell growth[J].InVitroCellular&DevelopmentalBiology-Animal, 2008, 44(10): 464-471.
[4] FREIBURGHAUS C, LINFMSTK-MSNDDONi H, PSULDDON M, et al. Reduction of ultraviolet light-induced DNA damage in human colon cancer cells treated with a lactoferrin-derived peptide[J].JournalofDairyScience, 2011, 95(10): 5552-5560.
[5] NANDI S, SUZUKI Y A, HUANG J, et al. Expression of human lactoferrin in transgenic rice grains for the application in infant formula[J].PlantScience, 2002, 163(4): 713-722.
[6] WARD P P, PAZ E, CONNEELY O M. Lactoferrin: Multifunctional roles of lactoferrin: a critical overview[J].CellularandMolecularLifeSciences, 2005, 62: 2540-2548.
[7] SALMON V, LEGRAND D, SLOMIANNY M C, et al. Production of human lactoferrin in transgenic tobacco plants[J].ProteinExpression&Purification, 1998, 13(1): 127-135.
[8] RACHMAWATI D, MORI T, HOSAKA T, et al. Production and characterization of recombinant human lactoferrin in transgenic Javanica rice[J].BreedingScience, 2005, 55(2): 213-222.
[9] CHONG DK, LANGRIDGE WH. Expression of full length bioactive antimicrobial human lactoferrin in potato plants[J].TransgenicResearch, 2000, 9: 71-78.
[10] 赵伊英,刘峰,郑回勇,等. 转人乳铁蛋白基因番茄的表达及其生物活性[J]. 农业生物技术学报,2006, 14(2):299-300.
ZHAO Y Y, LIU F, ZHENG H Y, et al. Expression and bioactivity of human-lactoferrin gene in transgenic tomato[J].JournalofAgriculturalBiotechnology, 2006,14(2): 299-300. (in Chinese)
[11] ANZAI H, TAKAIWA F, KATSUMATA K. Production of human lactoferrin in transgenic plants[C]// International Conference on Lactoferrin: Structure, Canada, 1999.
[12] LIN J Z, ZHOU B, YANG Y Z, et al. Piercing and vacuum infiltration of the mature embryo: a simplified method forAgrobacterium-mediated transformation of indica rice[J].PlantCellReports, 2009, 28: 1065-1074.
[13] 胡贻椿.转高赖氨酸基因、转人乳铁蛋白基因水稻的食用安全性评价与转豇豆胰蛋白酶抑制剂水稻的外源蛋白表达纯化[D].北京:中国疾病预防控制中心营养与食品安全所, 2010.
HU E C. Safety accessment of genetically modified rice with lysine-rich gene and genetically modified rice with human lactoferrin gene and expression and purification of exogenous protein in genetically modified rice with cowpea trypsin inhibitor gene[D]. Beijing: National Institute of Nutrition and Health Chinese Center for Disease Control and Prevention, 2010.
[14] BETHELL D R, HUANG J M. Recombinant human lactoferrin treatment for global health issues: Iron deficiency and acute diarrhea[J].Biomethals, 2004,17(3):337-342.
[15] TWYMAN R M, STOGER E, SCHILLBERG S, et al. Molecular farming in plants: Host systems and expression technology[J].TrendsinBiotechnology, 2003, 21(12): 570-578.
[16] BHAN M K, ARORA N K, KHOSHOO V, et al. Comparion of a lactose-free cereal-based fromular and cow’s milk in infants and children with acute gastroenteritis[J].JournalofPediatricGastroenterology&Nutrition, 1988, 7(2):208-213.
[17] GASTANADUY A, CORDANO A, GRAHAM G G. Accept ability, tolerance and nutritional value of a rice-based infant formula[J].JournalofPediatricGastroenterology&Nutrition, 1990, 11(2): 240-246.
[18] MESSEGUER J, FOGHER C, GUIDERDONI E, et al. Field assessment of gene flow from transgenic to cultivated rice (OryzasativaL.) using a herbicide resistance gene as tracer marker[J].Theoretical&AppliedGenetics, 2001, 103(8):1151-1159.
[19] 吴景欢,杨丽琛,刘改革,等. 转基因水稻中重组人乳铁蛋白的分离纯化及其抑菌活性研究[J]. 卫生研究,2013,42(3):399-404.
WU J H, YANG L C, LIU G G, et al. Isolation and purification of recombinant human lactoferrin (rhLF) from transgenic rice and its antibacterial activities[J].JournalofHygieneResearch, 2013, 42(3):399-404. (in Chinese with English abstract)
[20] ZHANG Z F, LV G Y, PAN H J, et al. Antioxidant and hepatoprotective potential of endo-polysaccharides fromHericiumerinaceusgrown on tofu whey[J].InternationalJournalofBiologicalMacromoleculars, 2012, 51(5): 1140-1146.
[21] MILLER C H, MAHER S G, YOUNG H A. Clinical use of interferon-gamma[J].AnnalsoftheNewYorkAcademyofSciences, 2009,1182(1): 69-79.
[22] 李婷,王彩云,闫序东,等.乳铁蛋白体外抗氧化性的研究[J].食品科学,2012, 33(21): 111-113.
LI T, WANG C Y, YAN X D, et al. Antioxidant activity of lactoferrininvitro[J].FoodScience, 2012, 33(21):111-113. (in Chinese with English abstract)
[23] 戴亚妮,于添,朱松,等.重组人乳铁蛋白抗氧化活性研究[J].中国食品卫生杂志,2017,29(3): 251-256.
DAI Y N,YU T, ZHU S, et al. Study on the antioxidant activity of recombinant human lactoferrin[J].ChineseJournalofFoodHygiene, 2017, 29(3): 251-256. (in Chinese with English abstract)
[24] 安清聪,李岑曦,张春勇,等.乳铁蛋白对滇撒配套系断奶仔猪生产性能、血清抗氧化指标及组织抗氧化基因表达的影响[J].动物营养学报,2015,27(7): 2018-2026.
AN Q C, LI C X, ZHANG C Y, et al. Effects of lactoferrin on growth performance, serum antioxidant indices and tissue antioxidant gene expressions of Diansa weaned piglets[J].ChineseJournalofAnimalNutrition, 2015,27(7): 2018-2026. (in Chinese with English abstract)
[25] 胡志和,李娜,刘传国, 等.乳铁蛋白免疫增强作用评价[J].食品科学,2010,31(11): 244-247.
HU Z H, LI N, LIU C G, et al. Evaluation on immune-enhancement effect of lactoferrin[J].FoodScience, 2010,31(11): 244-247. (in Chinese with English abstract)
[26] NAIDI S, SUZUKI A, HUANG J, et al. Expression of human lactoferrin in transgenic rice grains for the application in infant formula[J].PlantScience, 2002, 163(4):713-722.
[27] HUMPHREY B D, HUANG N, KLASING K C. Rice expressing lactoferrin and lysozyme has antibiotic-like properties when fed to chicks[J].JournalofNutrition, 2002,132(6):1214-1218.
[28] SCHYVER A B. Identification of transferrin-and lactoferrin-binding proteins inHaemophilusinfluenzae[J].JournalofMedicalMicrobiology, 1989, 29(2):121-130.
