p16INK4a/Ki67免疫细胞化学双染在检出宫颈癌及癌前病变中的作用*
2018-01-24张睿怡郭红燕游珂郭艳利李子健耿力
张睿怡, 郭红燕, 游珂, 郭艳利, 李子健, 耿力
100191 北京, 北京大学第三医院 妇产科(张睿怡、郭红燕、游珂、郭艳利、耿力),内科(李子健)
宫颈癌的发病率居世界女性肿瘤中的第4位,是发展中国家妇女第2常见肿瘤,严重危害女性健康及生命[1]。我国患有宫颈癌的妇女人数高达13万,且患者发病年龄具有年轻化趋势[2-3]。宫颈癌的筛查主要通过细胞学检查进行。近年来,越来越多的学者发现影响细胞学检查的因素较多,并有假阴性的问题存在[4]。Schmidt等[5]用细胞周期依赖激酶抑制剂2A(cyclin-dependent kinase inhibitor 2A,CDKN2A)又称p16INK4a和细胞增殖标记抗原Ki67(p16INK4a/Ki67)的免疫细胞化学双染的方法检测宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)及宫颈癌,发现p16INK4a和Ki67同时表达可用作为宫颈鳞状上皮细胞瘤变的一个指标,提示宫颈高级别鳞状上皮病变。为了探究宫颈上皮细胞p16INK4a/Ki67免疫细胞化学双染在检出≥CIN2病变中的作用,我们选择了2016年在我院门诊进行检查的妇女作为研究对象,分别使用p16INK4a/Ki67免疫细胞化学双染色、宫颈细胞学和高危型HPV检测进行宫颈病变检测,并以组织病理学诊断为金标准,对3种方法在检出高级别宫颈鳞状上皮病变中的作用进行了比较。
1 资料和方法
1.1 患者选择
随机选择2016年6月至2017年1月在北京大学第三医院妇科门诊就诊妇女153例,年龄20~73岁,平均年龄(39±10.74)岁,对每位妇女行宫颈细胞p16INK4a/Ki67免疫细胞化学双染检测、宫颈细胞学检查和高危型HPV检测,并具有宫颈活检组织病理学检查结果。所有患者需遵循纳入标准:1)年龄大于20岁;2)有性生活史,但无妊娠;3)无子宫或子宫颈切除术史;4)无妇科肿瘤病史。排除标准:1)曾因宫颈病变进行治疗者;2)无细胞学检查结果,或无高危型HPV检测结果;3)无宫颈组织病理学诊断结果者。最终入组131位患者。
该研究已通过伦理委员会审查。入组患者均签署知情同意书。
1.2 实验方法
宫颈上皮细胞p16INK4a/Ki67免疫细胞化学双染检测采用CINtec PLUS细胞学试剂盒(Roche诊断产品公司,Newjersey,USA),应用BenchMark XT全自动免疫组化染色仪(Roche诊断产品公司,Newjersey, USA)进行检测,宫颈细胞学采用Thinprep(Hologic 公司,Massachusetts,USA)或Surepath(BD公司,Maryland, USA)液基薄片法,高危型HPV检测采用Cobas 4800检测系统(Roche诊断产品公司,Newjersey, USA)。以组织病理诊断为金标准,分别计算3种方法检出组织病理学为CIN2及以上病变的灵敏度、特异度、假阳性率(误诊率)及假阴性率(漏诊率)。根据灵敏度及特异度合成ROC曲线,计算曲线下面积(area under curve, AUC)。其中该研究中涉及的联合检测采用并联试验方法进行诊断。
1.3 诊断标准
p16INK4a/Ki67双染阳性细胞表现为细胞核呈红色染色,且细胞质呈棕色染色,仅细胞核显色、仅细胞质显色或细胞均未显色表示p16INK4a/Ki67双染阴性,当涂片中出现一个或多个双染阳性细胞时,即为该病例p16INK4a/Ki67双染检测阳性[6]。细胞学检查采用巴氏染色法,遵循TBS诊断标准[7],当细胞学检查为无明确意义的非典型鳞状细胞(atypical squamous cells of undetermined significance, ASC-US)及以上诊断结果时,判断细胞学检查阳性。高危型HPV检测[8]包括HPV16型,HPV18型,和其他12型HPV(31,33,35,39,45,51,52,56,58,59,66和68)。当任意型别HPV阳性时,判断为高危型HPV检测阳性。
1.4 统计学方法
统计分析采用SPSS 23.0软件进行,计数资料采用n(%)表示,灵敏度、特异度、误诊率及漏诊率采用McNemarχ2检验。采用MedCalc软件比较p16INK4a/Ki67细胞双染、宫颈细胞学及高危型HPV检测的AUC。所有检验结果以双侧P<0.05为差异有统计学意义。
2 结 果
2.1 p16INK4a/Ki67免疫细胞化学双染检测、宫颈细胞学检查及高危型HPV检测检出≥CIN2病变的比较
该研究共入组131位妇女,平均年龄(39±10.73)岁,其中慢性炎症5例,CIN1患者29例,CIN2患者64例(包括局灶CIN2病变29例),CIN3患者27例(包括局灶CIN3病变3例),宫颈鳞癌6例。其中双染阳性患者共104例,阳性率为79.4%。双染阳性结果如图1所示。
分别计算3种方法检出宫颈癌前病变及宫颈癌的灵敏度、特异度、漏诊率、误诊率、阳性预测值和阴性预测值,以组织病理诊断CIN2为金标准,计算三种检测方法的AUC,AUC值越高,说明该方法诊断越准确(表1)。双染检出CIN2及以上病变的灵敏度及特异度(92.8%,58.8%)均高于细胞学检查(82.5%,44.1%),差异具有统计学意义(P<0.05)。虽然其灵敏度与高危型HPV检测相近(94.8%),但检出≥CIN2病变的特异度明显高于高危型HPV检测(17.6%),差异具有统计学意义(P<0.01)。双染检测相比细胞学检查和高危型HPV检测,其阳性预测值(84.5%)和阴性预测值(74.1%)最高。双染的AUC为0.773,细胞学检查AUC为0.633,高危型HPV检测AUC为0.562,双染与细胞学检查、高危型HPV检测相比差异具有统计学意义(P<0.05)(图2)。提示双染检测检出CIN2及以上病变的识别能力更好。
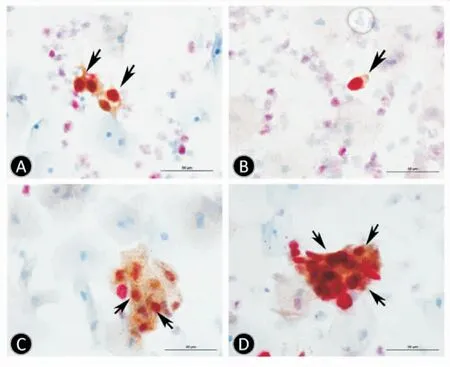
图1 子宫颈脱落上皮细胞p16INK4a/Ki67免疫细胞化学双染图片(×400)双染阳性细胞:胞质呈棕色且胞核呈红色染色(箭头所示)A、B:双染阳性的单个细胞;C、D:双染阳性的细胞团

表1 p16INK4a/Ki67免疫细胞化学双染、宫颈细胞学检查及高危型HPV检测检出宫颈病变的比较
注:*与p16INK4a/Ki67双染相比,P<0.05,**与p16INK4a/Ki67双染相比,P<0.01。

图2 以组织病理诊断CIN2为金标准的 p16INK4a/Ki67双染,细胞学及高危型HPV检测的ROC曲线A. p16INK4a/Ki67双染检测ROC曲线; B. 细胞学检测ROC曲线; C. 高危型HPV检测ROC曲线
2.2 联合检测检出≥CIN2病变的比较
联合检测采用并联试验方法,即当两种检测方法有一种为阳性时,诊断结果即为阳性,当两种检测方法均为阴性时,诊断结果为阴性。包括双染联合细胞学检查、双染联合高危型HPV检测、细胞学联合高危型HPV检测,分别计算联合检测检出≥CIN2病变的结果(表2)。
双染联合细胞学检查检出全部≥CIN2病变的漏诊(0/97)低于双染联合高危型HPV检测(2/97)。虽然其检出率与细胞学联合高危型HPV检测相等,但双染联合细胞学检查对CIN2及以上病变过度诊断(25/34)最少。同时研究发现,在32例细胞学无异常样本中,高危型HPV阳性率为90.9%(30/32),其中仅2例细胞学无异常样本的HPV为阴性;双染检测≥CIN2病变的检出率为94.1%(16/17),特异性为66.7%(10/15)。结果提示双染联合细胞学检查检出≥CIN2病变的漏诊率和误诊率最低。
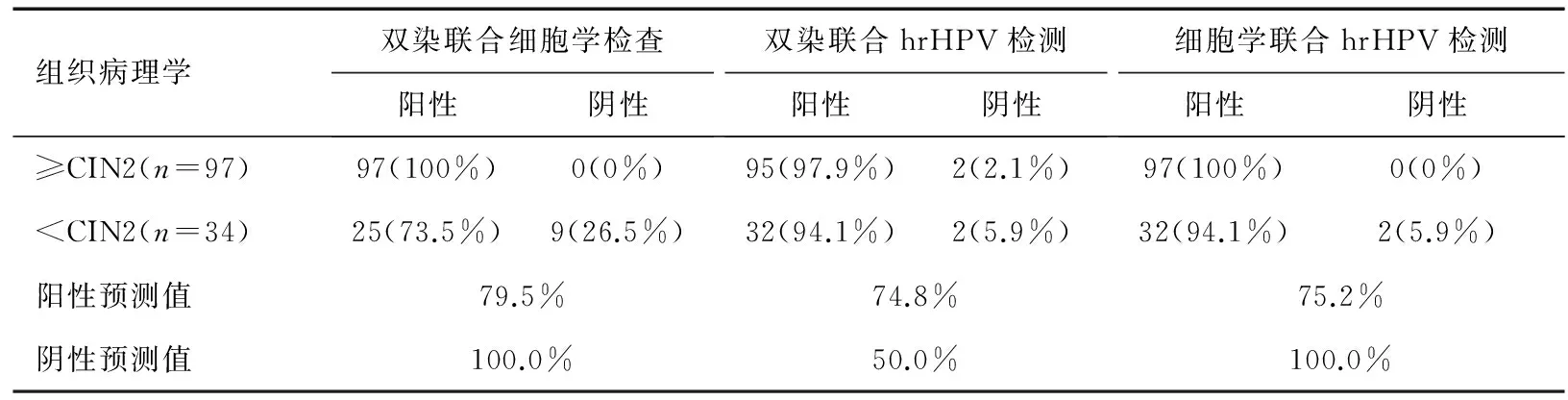
表2 联合检测检出CIN2及以上宫颈病变的比较
注: hrHPV: High risk HPV,高危型HPV。
3 讨 论
3.1 p16INK4a/Ki67免疫细胞化学双染提高检出CIN2及以上病变的特异度
p16INK4a是一种细胞周期依赖性激酶抑制剂,参与细胞周期的调控。p16抑制细胞周期蛋白依赖性激酶介导的视网膜母细胞瘤蛋白(retinoblastoma protein,pRB)的磷酸化激活,活化的pRB与转录因子E2F发生解离,游离的E2F参与细胞周期G1-S期的转换,激活细胞周期蛋白及细胞增殖核抗原等,加速DNA复制,促进细胞分裂[9]。在细胞分裂间期,细胞低水平表达p16蛋白,有利于pRB与E2F重新结合,进而使细胞周期停滞。但此时通过免疫化学方法在终末分化的上皮细胞中不能检测p16表达水平[10]。当机体持续高危型HPV病毒感染时,HPV基因与宿主基因发生整合,产生病毒致癌蛋白E7,E7蛋白能够抑制pRB的活性,扰乱其与E2F的结合能力,破坏细胞周期循环,导致不受控制的细胞增殖,使得p16发生过表达[10-11]。Ki67是细胞增殖抗原,表达于细胞有丝分裂期,但在细胞间期不表达[12]。当p16INK4a与Ki67蛋白在同一宫颈上皮细胞中同时检出的时候,则提示细胞周期循环破坏,细胞异常增殖,可作为提示宫颈高级别鳞状上皮病变的指标[13]。我们的结果显示,p16INK4a/Ki67免疫细胞化学双染检出CIN2及以上宫颈病变灵敏度较高,且其特异度明显高于细胞学检查和高危型HPV检测,能够降低误诊率,提高诊断阳性预测值。Wentzensen等[14]研究报导p16INK4a/Ki67双染检出子宫颈高级别鳞状上皮病变灵敏度83.4%,特异度为58.9%,与我们的结果一致。
从20世纪50年代开始,细胞学检查方法开始应用于宫颈癌筛查,使得宫颈癌导致的病死率明显下降。虽然细胞学检查的方法和手段不断改进,但越来越多的研究发现其检出率并不十分令人满意。因此,在全世界范围,近10年来应用高危型HPV检测作为辅助筛查的手段改善筛查质量,提高灵敏度。ATHENA实验[15]的数据提示采用HPV检测可以更好地提高筛查灵敏度。但是,与大部分其他感染微生物(如沙眼衣原体或病菌)不同,感染HPV并不意味着患病,80%性活跃女性都可以感染HPV,且大多数HPV感染是一过性的。Schmidt等[5]研究表明,HPV检测CIN2及以上病变灵敏度为96.4%,但特异度仅为19.1%。而年轻女性宫颈病变过度治疗可能存在影响生育等问题,对年轻女性的精神心理造成影响。据文献[16]报导,宫颈病变组织中p16INK4a的过表达与HPV感染有关,主要是由于HPV DNA整合于宿主基因,同时HPV癌基因E7诱导pRB功能失活从而使p16INK4a过表达。McLaughlin-Drubin等[17]的研究也证明HPV E7表达可触发p16INK4a的表达,进而抑制细胞周期依赖蛋白4/6 (cyclin-dependent kinases 4 and 6, CDK4/6)使细胞发生过度增殖。因此,与细胞学检测和高危型rHPV检测相比,p16INK4a/Ki67双染能够提示宫颈高级别鳞状上皮病变,同时其p16过表达也可能提示HPV DNA与宿主细胞整合,从而排除HPV一过性感染,提高诊断的灵敏度与特异度。
3.2 p16INK4a/Ki67免疫细胞化学双染的联合检测能够降低检出CIN2及以上病变的漏诊率
在入组的131位妇女中,p16INK4a/Ki67免疫细胞化学双染联合细胞学检查检出全部97例≥CIN2病变,明显降低病变检出的漏诊率,与双染联合高危型HPV检测及细胞学联合高危型HPV检测相比,双染与细胞学的联合检测降低了病例的过度诊断。PALMS的研究数据[18]显示,在ASC-US及LSIL患者中,p16INK4a/Ki67双染检出CIN2及以上病变敏感度与HPV检测相近,但其特异度高于高危型HPV检测,并且双染阳性预测值有显著升高。Yu等[19]研究报道,在高危型HPV阳性妇女中,p16INK4a/Ki67双染检出高级别宫颈病变的敏感度及特异度(92.7%,52.7%)略低于细胞学检查(94.5%,53.5%),但两者无统计学差异。我们的研究通过比较联合检测的效果,发现双染联合细胞学检测特异度高于细胞学联合HPV检测,结果与上述文献报导相一致。在细胞学检查阴性的病例中,p16INK4a/Ki67双染能够更好地鉴别CIN2及以上病变,减少漏诊和过度诊断,进而减少过度医疗,减少医疗资源浪费。因此,在检出CIN2及以上病变中,p16INK4a/Ki67双染联合细胞学检测具有更高的灵敏性,降低了子宫颈高级别鳞状上皮病变的漏诊率,可以弥补单纯细胞学检查的不足。
3.3 p16INK4a/Ki67免疫细胞化学双染出现漏诊或误诊的影响因素
虽然免疫细胞双染检测能够提高≥CIN2病变的检出,但仍有一定的漏诊率和误诊率。Edgerton等[20]的研究说明实验过程中的制片方法及质量可能影响判读结果,本研究双染制片中存在细胞稀疏和细胞团块,因此可能造成假阴性或假阳性结果。同时由于阅片经验不足,也可能导致双染误判[21]。本研究中共有32例组织病理诊断为局灶病变(其中29例为局灶性CIN2病变,3例为局灶性CIN3病变),其中细胞学检查为阴性8例,双染检测阴性3例。双染的漏诊率小于细胞学检查,提示在检出局灶病变中,双染可能具有一定的优势。其漏诊的原因可能由于病变部位较小,刷取的双染异常细胞数量较少或缺失导致双染假阴性。因此在实验过程中应注意制片质量,同时阅片医生需要进行一定培训,并由多位医生重复阅片,以增加双染结果判读的正确性。
本研究尚存在一定局限性,入组病例数还不足且只是综合医院门诊病例,其代表性有限,需要大样本量研究的支持与验证。同时所有阳性病例中,仅1位患者为腺上皮病变(未入组),其双染结果为阳性,其他入组病例均为鳞状上皮病变,因此,尚不能说明p16INK4a/Ki67免疫细胞双染的方法对于宫颈腺癌的检出作用。综上所述,本研究提示,与细胞学检查相比,p16INK4a/Ki67免疫细胞化学双染在检出宫颈高级别鳞状上皮病变及宫颈鳞癌时具有较高的灵敏度、特异度;与HPV检测相比,p16INK4a/Ki67细胞双染误诊病例数更少;同时在联合检测中,双染联合细胞学检测能够提高宫颈高级别鳞状上皮病变及宫颈鳞癌检出的敏感度及特异度。因此,p16INK4a/Ki67免疫细胞化学双染有助于减少宫颈病变检出的过度诊断,弥补诊断不足,提高宫颈病变的辨识度,减少过度医疗。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] Fitzmaurice C, Dicker D, Pain A, et al. The global burden of cancer 2013[J]. JAMA Oncol, 2015, 1(4): 505-527.
[3] 黎科, 任丽萍, 许海霞. 宫颈浸润癌及癌前病变与女性年龄关系的研究 [J]. 肿瘤预防与治疗, 2015, 28(1): 22-26.
[4] 郭艳利, 游珂, 张睿怡,等. 宫颈细胞学联合高危型HPV检测在子宫颈癌及癌前病变检出中的作用[J]. 中国妇产科临床杂志, 2017, 18(1): 3-6.
[5] Schmidt D, Bergeron C, Denton KJ, et al. p16/ki-67 dual-stain cytology in the triage of ASCUS and LSIL papanicolaou cytology: results from the European equivocal or mildly abnormal Papanicolaou cytology study[J]. Cancer Cytopathol, 2011, 119(3): 158-166.
[6] Luttmer R, Dijkstra MG, Snijders PJ, et al. p16/Ki-67 dual-stained cytology for detecting cervical (pre)cancer in a HPV-positive gynecologic outpatient population[J]. Mod Pathol, 2016, 29(8): 870-878.
[7] 潘秦镜. TBS 子宫颈细胞学报告系统回顾及新版解读[J]. 中国妇产科临床杂志, 2017, 18(1): 95-96.
[8] 崔晓莉, 王纯雁, 王红,等. cobas 4800 HPV 检测在宫颈癌筛查中的应用价值[J]. 中国肿瘤临床, 2013, 40(6): 341-344.
[9] Korenjak M, Brehm A. E2F-Rb complexes regulating transcription of genes important for differentiation and development[J]. Curr Opin Genet Dev, 2005, 15(5): 520-527.
[10] Wentzensen N, von Knebel Doeberitz M. Biomarkers in cervical cancer screening[J]. Dis Markers, 2007, 23(4): 315-330.
[11] Tsoumpou I, Arbyn M, Kyrgiou M, et al. p16(INK4a) immunostaining in cytological and histological specimens from the uterine cervix: a systematic review and meta-analysis[J]. Cancer Treat Rev, 2009, 35(3): 210-220.
[12] Isacson C, Kessis TD, Hedrick L, et al. Both cell proliferation and apoptosis increase with lesion grade in cervical neoplasia but do not correlate with human papillomavirus type[J]. Cancer Res, 1996, 56(4): 669-674.
[13] Reuschenbach M, Seiz M, von Knebel Doeberitz C, et al. Evaluation of cervical cone biopsies for coexpression of p16INK4a and Ki-67 in epithelial cells[J]. Int J Cancer, 2012, 130(2): 388-394.
[14] Wentzensen N, Fetterman B, Castle PE, et al. p16/Ki-67 dual stain cytology for detection of cervical precancer in HPV-positive women[J]. J Natl Cancer Inst, 2015, 107(12): djv257.
[15] Stoler MH, Wright TC, Sharma A, et al. High-risk human papillomavirus testing in women with ASC-US cytology: results from the ATHENA HPV study[J]. Am J Clin Pathol, 2011, 135(3): 468-475.
[16] Drayton S, Brookes S, Rowe J, et al. The significance of p16INK4a in cell defenses against transformation[J]. Cell Cycle, 2004, 3(5): 611-615.
[17] McLaughlin-Drubin ME, Park D, Munger K. Tumor suppressor p16INK4A is necessary for survival of cervical carcinoma cell lines[J]. Proc Natl Acad Sci U S A, 2013, 110(40): 16175-16180.
[18] Bergeron C, Ikenberg H, Sideri M, et al. Prospective evaluation of p16/Ki-67 dual-stained cytology for managing women with abnormal Papanicolaou cytology: PALMS study results[J]. Cancer Cytopathol, 2015, 123(6): 373-381.
[19] Yu LL, Guo HQ, Lei XQ, et al. p16/Ki-67 co-expression associates high risk human papillomavirus persistence and cervical histopathology: a 3-year cohort study in China[J]. Oncotarget, 2016, 7(40): 64810-64819.
[20] Edgerton N, Cohen C, Siddiqui MT. Evaluation of CINtec PLUS(R) testing as an adjunctive test in ASC-US diagnosed SurePath(R) preparations[J]. Diagn Cytopathol, 2013, 41(1): 35-40.
[21] Allia E, Ronco G, Coccia A, et al. Interpretation of p16(INK4a) /Ki-67 dual immunostaining for the triage of human papillomavirus-positive women by experts and nonexperts in cervical cytology[J]. Cancer Cytopathol, 2015, 123(4): 212-218.
