盐酸川芎嗪联合顺铂对Lewis肺癌细胞侵袭转移能力的影响*
2018-01-24迟笑怡胡凯文周天迟佳琦王琳杨新阶
迟笑怡, 胡凯文, 周天, 迟佳琦, 王琳, 杨新阶
100078 北京,北京中医药大学东方医院 肿瘤科
肿瘤的转移和侵袭已成为恶性肿瘤最显著的生物学特征,是导致临床多数肿瘤患者治疗失败和死亡的主要原因。超过60%的患者在诊断明确时已经有显性或隐性的转移灶存在。原发肿瘤可通过手术切除、放射治疗或其他局部治疗加以有效控制,但已播散的肿瘤用上述手段治疗往往难以控制病情的进一步发展。确切的证据表明:超过90%的癌症患者死于肿瘤转移[1]。因此能否有效阻止肿瘤的侵袭和转移是恶性肿瘤治疗成败的关键。
随着肿瘤诊疗水平的不断提高,对于处理肿瘤原发灶方面已经取得了较大的进展,但对于肿瘤转移方面目前尚未发现有效可靠的药物和方法,随着细胞生物学及分子生物学的深入研究及新的肿瘤治疗途径和靶点的发现,中医药在抗转移研究领域的独特优势逐渐凸显,而其中活血化瘀中药的应用占了相当比例。盐酸川芎嗪是从中药川芎中提取的一种活性生物碱-四甲基吡嗪,具有活血化瘀、抗血小板凝集、改善微循环等多种功效,近年抗肿瘤作用也日益受到关注[2-3]。顺铂是传统的化疗药物, 应用于多种肿瘤, 但单独使用后期易出现耐药。有研究研究表明, 化疗药物与川芎嗪联合应用, 可提高治疗恶性肿瘤的疗效。实验研究盐酸川芎嗪(TMP)联合顺铂(DDP)对Lewis肺癌细胞侵袭转移能力的影响。
1 材料与方法
1.1 材料
1.1.1 细胞株 绿色荧光蛋白(GFP)标记的小鼠Lewis肺癌细胞株(LLC-GFP)购于安泰康(北京)生物技术有限公司。
1.1.2 药物与试剂 注射用盐酸川芎嗪(TMP),哈尔滨三联药业股份有限公司,购自北京中医药大学第三附属医院(产品批号:151004E2);注射用顺铂(DDP),齐鲁制药(海南)有限公司, 购自北京中医药大学东方医院药剂科(产品批号:2A1A1511018B);青链霉素混合液(100×)、胰蛋白酶-EDTA混合液购于Invitrogen公司(货号:15140122、25200056);4%多聚甲醛购于索莱宝公司(货号:P1110-500);结晶紫染色液购于Genebio公司(货号:bw-g0046);CCK-8检测试剂盒购于同仁化学(货号:CK04);MTT细胞增值及细胞毒性检测试剂盒购于索莱宝公司(货号:M1020-500);Transwell小室购于Corning公司(货号:3422);Basement Membrane Matrix、Fibronectin购于BD公司(货号:356234、354008);Laminin购于sigma公司(货号:L2020-1MG);BCA蛋白浓度测定试剂盒购于索莱宝公司(货号:CA1020、PC0020);GAPDH monoclonal antibody、E-cadherin polyclonal antibody购于proteintech公司(货号:60004-1-Ig、2087-1-AP);Goat Anti-Rabbit IgG H+L、Goat Anti-Mouse IgG H+L购于中杉金桥公司(货号:ZB-2301、ZB-2305)。
1.1.3 主要仪器 HDL洁净工作台:购自北京东联哈尔仪器制造有限公司;CO2恒温培养箱:Thermo公司;台式低温高速离心机:3K15型,购自德国SIGMA公司;光谱扫描多功能酶标仪:Promega公司;倒置相差显微镜:购自OLYMPUS公司;电泳仪:购自BIORAD公司;Tanon全自动化学发光图像分析系统:4200型,购自上海天能科技有限公司。
1.2 方法
1.2.1 细胞培养 绿色荧光蛋白标记(GFP)的小鼠Lewis肺癌(LLC-GFP)细胞采用含10%胎牛血清、1%双抗的DMEM(高糖)培养基置37℃、5%CO2培养箱中培养,每日观察其生长情况,取对数生长期细胞用于实验。
1.2.2 药品配制 盐酸川芎嗪的配制:用PBS将注射用盐酸川芎嗪配制成浓度100mg/mL的储存液,4℃保存备用,用前稀释至所需浓度。顺铂的配制:用PBS将注射用顺铂配制成浓度1mg/mL的储备液,4℃保存备用,用前稀释至所需浓度。
1.2.3 分组 根据药物浓度,分别将细胞分为空白对照组(control)、阳性药物顺铂组(DDP)、盐酸川芎嗪高、中、低剂量组(TMP)、盐酸川芎嗪联合顺铂高、中、低剂量组(TMP+DDP)。其中顺铂药物浓度通过前期预实验已确定为1μg/mL,以下用(DDP,1μg/mL)表示。盐酸川芎嗪药物浓度根据CCK-8实验结果确定。药物处理时间24h。
1.2.4 CCK-8法检测TMP对小鼠Lewis肺癌细胞增殖的影响,确定TMP给药浓度 待细胞融合度达到90%后弃培养瓶中的培养液,用胰蛋白酶消化细胞,以含10%胎牛血清的完全培养基重悬细胞,调整细胞密度至5×104个/mL,将上述细胞悬液加入96孔板,每孔100μL。细胞贴壁后,各实验组孔分别加入含500μg/mL、1000μg/mL、1500μg/mL、2000μg/mL、2500μg/mL的TMP进行干预,每个药物浓度设置3个平行孔,37℃、5%CO2培养24h后进行增殖能力的检测。检测时每孔加入CCK-8溶液10μL,继续置于细胞培养箱中1h。采用酶标仪在450nm波长处测定各孔OD值,计算各组抑制率。细胞增殖抑制率=[(对照组平均OD值-实验组平均OD值)/(对照组平均OD值-空白组平均OD值)] ×100%。根据实验结果确定TMP高、中、低剂量组及TMP+DDP高、中、低剂量组药物浓度。
1.2.5 TMP联合DDP对小鼠Lewis肺癌细胞形态的影响 取对数生长期的LLC-GFP细胞,以5×105个细胞/孔的密度接种于6孔板中,待细胞贴壁生长融合至75%以上时,加入TMP及DDP处理细胞。实验分为(1)空白对照组(control):不加药物处理;(2)DDP组;(3)TMP组:分为TMP高、中、低剂量三组;(3)TMP+DDP组:分为TMP+DDP高、中、低剂量三组。各组细胞加入不同浓度药物干预,置于37℃、5%CO2培养箱培养24h后,倒置显微镜下(放大倍数为200倍)观察细胞形态的变化并拍照。
1.2.6 Transwell小室检测细胞的侵袭能力 在Transwell小室上室面加入100μL用DMEM培养基稀释的Matrigel(体积稀释比例为1:8),下室面用移液枪头涂抹Fibronectin(浓度0.5mg/mL),置于37℃培养箱中包被2h,使Matrigel凝固成胶,4℃过夜风干。取对数生长期的LLC-GFP细胞,加入TMP及DDP处理细胞(分组情况参考2.3),用药干预24h。接种细胞前拿出小室,吸出小室中残余液体,每小室加入100μL DMEM,37℃孵育30min,水化基底膜。收集各组细胞,重悬于不含胎牛血清的DMEM培养液中,调整细胞浓度为5×104个细胞/mL。将各组细胞接种于Transwell小室的上室中,接种体积为200μL(1×104个细胞),下室中加入600μL含10%胎牛血清的DMEM培养液。37℃、5%CO2培养24h后取出小室,PBS洗2次,加入4%多聚甲醛,室温固定15min,PBS洗2次,用棉签擦拭小室上室面未穿过小室膜的细胞,用结晶紫染色15min后,在倒置显微镜(放大倍数为200倍)下观察穿膜细胞数,每小室选择上下左右中共10个视野,对每组的10个视野的图片进行细胞计数,取平均值。实验独立重复2次。
1.2.7 人造基底膜实验检测小鼠Lewis肺癌细胞的黏附能力 分别用Matrigel(用DMEM培养基稀释,体积稀释比例为1:8)、Fibronectin(0.5mg/mL)、Laminin(40ug/mL)、BSA(10g/L)包被96孔板,置于37℃培养箱包被2h,后放入4℃过夜风干备用,BSA为对照基底。取对数生长期的LLC-GFP细胞,加入TMP及DDP处理细胞(分组情况参考2.3),用药干预24h。接种前吸出96孔板中残余液体,每孔加入50μL DMEM,37℃孵育30min,水化基底膜。收集各组细胞,重悬于不含胎牛血清的DMEM培养液中,调整细胞浓度为5×104个细胞/mL。将各组细胞悬液接种于96孔板中,接种体积为100μL(5×103个细胞),每组设3个平行孔。37℃、5%CO2培养120min后取出96孔板,用移液枪吸出培养液,PBS洗3遍,除去未黏附的肿瘤细胞。分别加入MTT 100μL/孔,37℃温箱内孵育4h,吸弃MTT,加入DMSO 200μL/孔溶解甲臜,于振荡器上轻轻震荡10min,酶标仪490nm波长处检测每孔OD值。计算各组细胞在Matrigel、Fibronectin、Laminin上的黏附率。计算公式:黏附率%=[(Matrigel或Fibronectin或Laminin组细胞OD值/BSA组细胞OD值)-1] ×100%。实验独立重复2次。
1.2.8 Western Blot检测E-cadherin的蛋白表达 取培养至对数生长期的LLC-GFP细胞,调整细胞密度为5×105个细胞/mL接种于6孔板中,待细胞贴壁生长融合至75%以上时,按分组要求(分组情况参考2.3)加入相应浓度的TMP及DDP干预细胞,置于37℃、5%CO2培养箱培养24h。各组细胞加入细胞裂解液(RIPA:PMSF=100:1),用细胞刮刀刮下,收集至离心管,冰上裂解25min后,12000g,4℃,离心10min,取上清液为蛋白样品,采用BCA蛋白浓度测定试剂盒检测蛋白浓度,将蛋白样品加入5×蛋白上样缓冲液,置于100℃水浴中变性5min。SDS-PAGE分离蛋白,根据目的蛋白的相对分子量配制相应的分离胶浓度(10%)。加样后分别进行蛋白电泳、电转移,5%脱脂奶粉常温封闭1.5h后,分别加入一抗GAPDH(1:5000)、E-cadherin(1:1000)4℃反应过夜。TBST洗膜7次,5min/次;根据一抗的种属选择相应的二抗(山羊抗小鼠、山羊抗兔IgG,稀释比例为1:10000)室温孵育1.5h。最后ECL发光、显影、拍照。相对蛋白含量用各蛋白条带灰度值/内参蛋白条带的灰度值来表示。实验独立重复2次。
1.3 统计学分析

2 结 果
2.1 TMP对LLC-GFP细胞增殖的影响,确定TMP给药浓度
CCK-8结果显示,TMP对细胞增殖的抑制作用呈现浓度依赖性,随着TMP药物浓度的升高,其增殖的抑制率也增高。TMP浓度为500μg/mL~2000μg/mL时,与对照组相比,LLC-GFP细胞的增殖受到抑制,差异具有统计学意义(P<0.01);TMP浓度为2500μg/mL时,与对照组相较,差异亦具有统计学意义(P<0.001),细胞增殖活性受到明显抑制。因此,在后续实验中,分别选择TMP 500μg/mL、1000μg/mL、2000μg/mL三个浓度作为TMP低、中、高剂量组。见图1、表1。以下TMP低、中、高剂量组分别用(TMP 500)、(TMP 1000)、(TMP 2000)表示。TMP+DDP低、中、高剂量组分别用(TMP+DDP 500+1)、(TMP+DDP 1000+1)、(TMP+DDP 2000+1)表示。
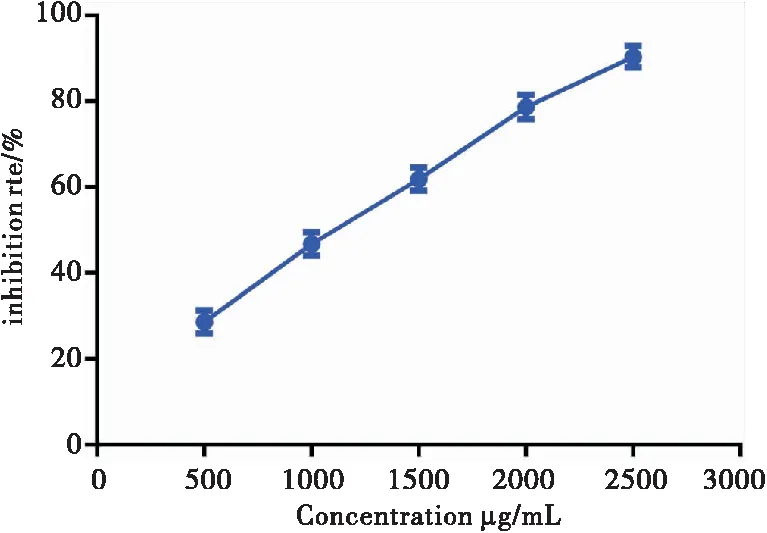
图1 CCK-8测定TMP对LLC-GFP细胞增殖的抑制作用
2.2 TMP+DDP对LLC-GFP细胞形态的影响
各组细胞经培养24h后,可见对照组LLC-GFP细胞生长状况良好,细胞呈细长梭形,细胞间排列紧密,可融合成集落。实验组细胞随药物浓度的增高细胞逐渐变为圆形,突起减少,轮廓变模糊;其中TMP 500组、TMP 1000组、TMP+DDP 500+1组细胞形态基本正常,仅有少量细胞变为圆形;DDP组、TMP 2000组、TMP+DDP 1000+1组及TMP+DDP 2000+1组细胞形态明显改变,由具有较高侵袭能力的细长梭形变为侵袭能力较弱的圆形,细胞体积缩小,部分细胞见细胞核固缩,胞体折光性降低,胞浆浓缩,胞浆内可见颗粒和碎片,细胞生长明显受到抑制,GFP荧光强度明显减弱。见图2。

表1 CCK-8测定TMP对LLC-GFP细胞增殖的抑制作用
注:与对照组相比,**P<0.01,***P<0.01

图2 倒置光学显微镜下观察不同处理组细胞的形态学变化(×200)横向第一行、第三行代表control组及经DDP、TMP 500、TMP 1000、TMP 2000、TMP+DDP 500+1、TMP+DDP 1000+1、TMP+DDP 2000+1药物干预后细胞在明场中的形态变化;横向第二行、第四行代表各组细胞GFP的表达情况
2.3 TMP+DDP对LLC-GFP细胞侵袭能力的影响
Transwell小室法检测结果显示,对照组与各实验组细胞均能够穿过铺有人工基质Matrigel的滤膜,且各实验组穿过滤膜的细胞数与对照组相比,差异明显(P<0.01)。实验可见,随着TMP浓度的增高,细胞侵袭数逐渐减少,侵袭抑制作用逐渐增强,TMP+DDP组较单独使用DDP及TMP组侵袭抑制作用更为明显, TMP+DDP 组穿过膜面细胞不但数量减少,细胞形态也有较大改变,多数呈圆形,正常细胞形态缺失。见图3、表 2。

图3 不同浓度TMP联合DDP对于LLC-GFP细胞侵袭能力的影响(×200)
图A为各组细胞Transwell小室倒置显微镜视野下所见结果;图B为Transwell小室结果分析;可见随着药物浓度的增高,细胞侵袭数逐渐减少,TMP+DDP组较单独使用DDP及TMP组侵袭抑制作用更为明显,与对照组相比,**P<0.01,n=2

表2 TMP联合DDP对于LLC-GFP细胞侵袭能力的影响
注: 与对照组相比,**P<0.01
2.4 TMP+DDP对LLC-GFP细胞黏附的影响
肿瘤细胞与细胞外基质的相关成分(如Laminin、Fibronectin)的相互黏着,是肿瘤转移过程中的重要环节[4]。人工基底膜胶Matrigel、Fibronectin及Laminin具有促进肿瘤细胞黏附的作用。结果显示,各实验组黏附抑制率均高于对照组,不同基底膜成分(Matrigel、Fibronectin、Laminin)在TMP低、中剂量组与对照组比较差异无统计学意义(P>0.05);DDP组黏附抑制率在不同基底膜成分与对照组相比差异均有统计学意义(P<0.05);TMP联合DDP剂量组与单独应用DDP及TMP相比较,黏附抑制率更加明显(P<0.01),说明TMP及DDP均对LLC-GFP细胞的黏附产生抑制作用,联合应用比单独应用效果更佳,且呈剂量依赖性。见图4、表3。

图4 TMP联合DDP对于LLC-GFP细胞黏附能力的影响
A.各组细胞在Matrigel基底膜成分对于细胞黏附能力的影响;B.各组细胞在Fibronectin基底膜成分对于细胞黏附能力的影响;C.各组细胞在Laminin基底膜成分对于细胞黏附能力的影响;与对照组相比,**P<0.01,n=2
2.5 TMP+DDP对LLC-GFP细胞E-cadherin蛋白表达的影响
本研究采用蛋白印迹法检测了肿瘤细胞转移相关蛋白的表达。蛋白印迹法结果显示,TMP中、高剂量组可明显上调E-cadherin蛋白的表达(与对照组相比,中剂量组P<0.05,高剂量组P<0.05),而TMP联合DDP各剂量组均可上调E-cadherin蛋白表达(P<0.01),TMP+DDP组在上调E-cadherin蛋白表达方面优于单独应用DDP及TMP组。见图 5、表4。

表3 TMP联合DDP对于LLC-GFP细胞黏附能力的影响
注: 与对照组相比,*P<0.05,**P<0.01
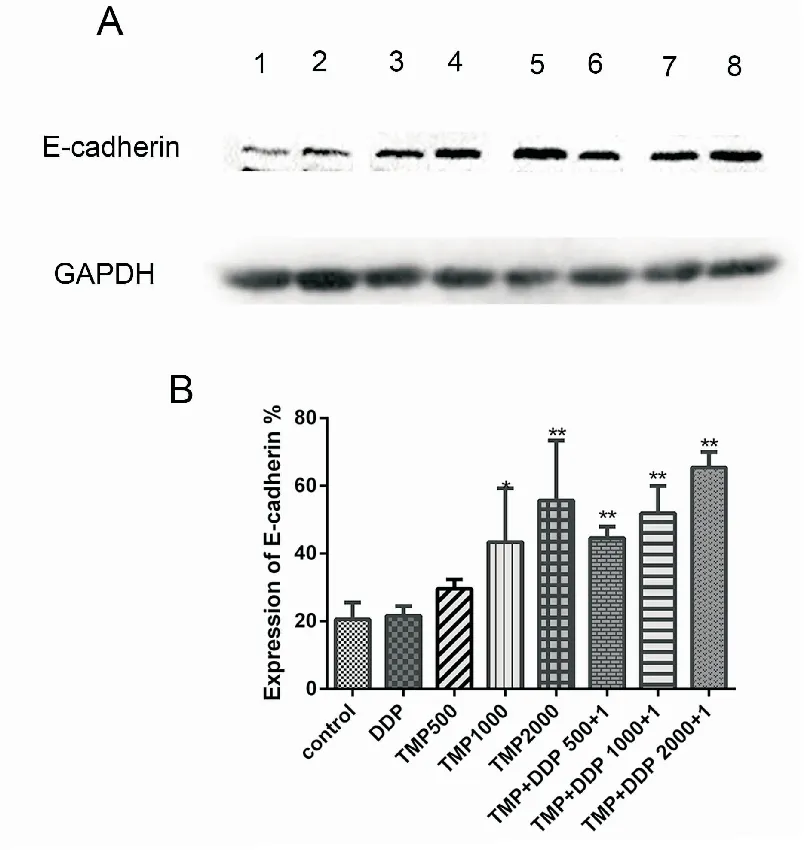
图5 TMP联合DDP对于LLC-GFP细胞转移相关蛋白E-cadherin表达的影响
TMP中、高剂量组可明显上调E-cadherin蛋白的表达,而TMP联合DDP各剂量组均可上调E-cadherin蛋白表达;*P<0.05,**P<0.01;n=2(1.control; 2.DDP; 3.TMP 500; 4.TMP 1000; 5.TMP 2000; 6.TMP+DDP 500+1; 7.TMP+DDP 1000+1; 8.TMP+DDP 2000+1)

表4 TMP联合DDP对于LLC-GFP细胞转移相关蛋白E-cadherin表达的影响
注: 与对照组相比,*P<0.05,**P<0.01
3 讨 论
恶性肿瘤转移是一个多步骤、多阶段、多基因参与的过程,目前认为,主要包括以下几个连续的过程:首先,肿瘤细胞脱离原发灶,通过细胞表面受体与基底膜(BM)及细胞外基质(extracellular matrix, ECM)中的蛋白质黏附,黏连侵袭基底膜并在周围间质中浸润生长;然后与局部毛细血管内皮细胞密切接触并穿过ECM和脉管壁进入血液或者淋巴循环,在循环中运行并逃避免疫系统攻击;再穿出脉管壁达到继发部位,与继发部位组织黏附,形成克隆并增生生长,继而促发微血管生成,最终形成转移灶[4]。
上皮源性的肿瘤细胞发生上皮间质转化(EMT)是肿瘤转移发生所需的起始事件[5-6]。具有极性的上皮细胞失去其上皮形态,转换成具有活动能力、能够在细胞基质间自由移动的间质细胞的过程,这种表型的转换使得肿瘤细胞摆脱细胞-细胞间连接而表现得更具侵袭性。这一过程同时伴随细胞形态的改变、细胞间黏附作用的减弱等改变,肿瘤细胞由此获得从原位向周围侵袭的能力,最终通过血液和淋巴途径转移到远处形成新的病灶[7-8]。在此过程中,E-钙黏素(E-cadherin)发挥着尤为重要的作用。E-cadherin是维持上皮表型的重要粘附分子,在细胞间粘附与维持细胞极性方面起着重要的作用。E-cadherin的表达量及稳定性是EMT发生的关键[9],正常组织中的E-cadherin表达相对稳定,但在恶性肿瘤组织中其表达与肿瘤侵袭转移能力成负相关,E-cadherin表达的下调使肿瘤细胞同质性黏附以及锚定能力下降,以肿瘤细胞浸润并穿透基底膜为表现获得运动及向远处侵袭的能力。多项研究显示,上调E-cadherin,中断或逆转EMT,可以抑制肿瘤细胞的侵袭,降低肿瘤细胞的转移率[10]。
在肿瘤的成因及防治方面,中国医学也不断地在进行深入的思考及有益的猜想。殷商时代的“瘤”字即体现了当时人们对于肿瘤“瘀阻积滞留聚不去,难以自行消散”特点的认知。因此,活血化瘀的中药在中医治疗恶性肿瘤中的应用十分广泛,中药川芎即是其中的代表药物之一。盐酸川芎嗪是传统中医药川芎的有效提取物,除具有抗血栓、改善微循环及血液流变学等作用外,近年来研究表明,也可作用于肿瘤细胞,促进其细胞凋亡,抑制细胞增殖,从而发挥抗肿瘤作用。贾秀红等[11]研究发现,沉默内源性凋亡抑制基因Apollon可抑制白血病细胞K562的增殖,促进其凋亡,与川芎嗪联合使用后作用显著增强。张加军等[12]的研究结果显示,川芎嗪可有效抑制人肝癌细胞株HepG2的增殖,且此抑制作用呈时间及剂量依赖性,其机制可能与抑制突变型p53蛋白的表达有关。降解基底膜是肿瘤细胞脱离原病灶和向间质浸润的必要条件,是肿瘤侵袭和转移发生的起始事件。殷娟等[13]发现,外源性白介素-8(IL-8)有促进人卵巢癌细胞SKOV3迁移能力的作用,而川芎嗪可通过下调MMP-9及E-cadherin的蛋白表达抑制此作用。
本研究采用盐酸川芎嗪联合顺铂共同干预小鼠Lewis肺癌细胞,前期的预实验已确定顺铂的用药浓度,及给药时间。通过CCK-8实验确定盐酸川芎嗪的用药浓度,实验分为对照组、顺铂组、盐酸川芎嗪组及盐酸川芎嗪联合顺铂组,用药24小时后观察各实验组药物对于肿瘤细胞侵袭转移能力的作用。肿瘤细胞具有体积大、胞核增大等特点,而本实验观察到经TMP及DDP干预24小时后,与对照组相比各实验组Lewis细胞形态发生了明显的变化,由具有较高侵袭能力的细长梭形变为侵袭能力较弱的圆形,细胞体积缩小,部分细胞见细胞核固缩,胞体折光性降低,胞浆浓缩,胞浆内可见颗粒和碎片,细胞生长明显受到抑制,尤以DDP与TMP联合组抑制作用更为明显。
肿瘤细胞的黏附与侵袭包括肿瘤细胞之间的同质性黏附、肿瘤细胞与基底膜和毛细血管内皮细胞之间的异质性黏附,一方面肿瘤细胞必须先从原黏附的原发灶脱离,才能发生侵袭转移;另一方面,肿瘤细胞需要黏附在基质和血管内皮细胞上,进入血液循环,才可发生远处转移。因此,增加肿瘤之间的同质性黏附,降低肿瘤细胞的异质性黏附,可能是抑制肿瘤细胞发生侵袭转移的有效机制[14]。本实验运用Transwell小室侵袭实验直接观察盐酸川芎嗪联合顺铂对Lewis肺癌细胞侵袭能力的影响,同时运用人造基底膜实验观察药物对于肿瘤细胞异质性黏附的影响,间接反映药物对于肿瘤细胞侵袭能力的作用。结果显示单独使用TMP及DDP均可抑制Lewis肺癌细胞的侵袭能力(P<0.01),而将两药联合使用,效果优于单独用药,不但可明显抑制侵袭转移细胞的数量,还明显改变了侵袭细胞的形态,进一步降低其侵袭转移的能力。而人造基底膜实验观察到,单独应用DDP可有效抑制肿瘤细胞异质性黏附(P<0.05),单独使用TMP则需将浓度提高至2 000μg/mL才可明显的抑制肿瘤细胞的异质性黏附,而DDP联合TMP在低剂量组即可观察到对肿瘤细胞的异质性黏附有明显的抑制作用(P<0.01),因此我们可以推断,盐酸川芎嗪联合顺铂具有抑制肿瘤侵袭能力的作用,较单独应用盐酸川芎嗪或顺铂对肿瘤细胞侵袭抑制作用效佳,且呈现剂量依赖性。
肿瘤细胞之间的黏附称为同质性黏附,同质性黏附下降可促进肿瘤细胞从瘤体上脱落进而发生肿瘤的早期转移,E-cadherin在此过程中发挥了重要的作用,E-cadherin在细胞分裂黏附和肿瘤早期浸润中有调控作用,其表达下调或缺失会导致肿瘤细胞失去接触抑制,细胞间连接松散,易脱落,表现出较强的侵袭能力[15-18]。因此我们利用蛋白免疫印迹(Western Blotting)的方法检测TMP与DDP干预后Lewis肺癌细胞E-cadherin的表达情况。结果显示单独应用盐酸川芎嗪中、高剂量组可上调E-cadherin的表达,且呈浓度依赖性,高剂量组较中剂量组上调E-cadherin的程度更为明显(P<0.01);单独应用DDP上调E-cadherin的程度与对照组相比无统计学意义;而两药联合则能明显上调E-cadherin的水平(P<0.01),可见中药联合阳性药物组对于E-cadherin的上调作用整体优于单独应用中药及阳性药物组。因此,我们推测盐酸川芎嗪联合顺铂可以改变Lewis肺癌的细胞形态、抑制其增殖,降低细胞穿透细胞外基质和基底膜的能力, 同时上调黏附分子E-cadherin的蛋白表达,抑制肿瘤细胞间的同质性黏附能力,增强肿瘤细胞与基底膜、细胞外基质之间的异质性黏附,从而达到抑制肿瘤细胞侵袭转移能力的目的。
综上所述,盐酸川芎嗪联合顺铂可在多个环节发挥抑制癌细胞侵袭转移的作用,这为活血化瘀中药抗肿瘤转移及其作用机制提供了重要依据,为防治肿瘤转移展示了良好的前景。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Marx V. Tracking metastasis and tricking cancer[J]. Nature, 2013, 494(7435): 133-136.
[2] 王生,赵杨,陶丽,等. 川芎嗪对肿瘤介导的血液高凝的影响[J]. 中国药理学通报,2012,28(5): 709-715.
[3] 张会军,阎蕴力, 阴梅云. 川芎嗪对依托泊苷诱导小细胞肺癌细胞凋亡的增敏作用[J].实用肿瘤杂志, 2004, 19(3): 229-232.
[4] Steeg PS.Tumor metastasis: mechanistic insights and clinical challenges [J]. Nat Med. 2006, 12(8):895-904.
[5] Kang Y, Massague J. Epithelial-mesenchymal transitions: twist indevelopment and metastasis [J]. Cell, 2004, 118(3):277-279.
[6] 闫婉君,马兴聪,高晓燕,等.黄芩素抑制乳腺癌肺转移作用机制的体内研究[J].肿瘤预防与治疗, 2015,28(6): 310-316.
[7] 惠起源, 魏晓萍. 上皮间质转化在肿瘤发生发展中的作用[J].中国肿瘤, 2013,22(3): 219.
[8] 洪伦. 生长因子诱导的上皮-间质转化在人结肠癌细胞中的研究[D]. 长沙: 中南大学, 2011.
[9] Lamouille S, Subramanyam D, Blelloch R, et al. Regulation of epithelial-mesenchymal and mesenchymal-epithelial transitions by microRNAs[J].Cell Biology, 2013, 25(2): 1-8.
[10] Yu J, Ebert MPA, Miehlke S, et al. A-catenin expression is decreased in human gastric cancers and in the gastric mucosa of frist degree relatives[J].Gut, 2000, 46(5): 639-644.
[11] 贾秀红, 孝飞飞, 李建厂. Apollon siRNA联合川芎嗪对白血病细胞增殖及凋亡的影响[J]. 中国当代儿科杂志,2014, 16(2): 135-140.
[12] 张加军,邢国辉,王继伟,等. 川芎嗪对人肝癌HepG2细胞的影响及与突变型p53蛋白表达的影响[J]. 中国中医药现代远程教育, 2013, 11(17): 157-159.
[13] 殷娟,于超,杨竹. 川芎嗪抑制IL-8诱导人卵巢癌SKOV3细胞的迁移作用[J]. 重庆医科大学学报, 2011, 36(4): 401-404.
[14] 陈惠,渠景连,龚婕宁. 现代医学对恶性肿瘤转移相关机制的研究进展[J]. 中国中药杂志,2014,39(15): 2823-2828.
[15] Hermiston ML, Wong MH, Gordon JI. Forced expression of E-cadherin in the mouse intestinal epithelium slows cell migration and provides evidence for nonautonomous regulation of cell fate in a self-renewing system [J]. Genes Dev, 1996, 10(8): 985-996.
[16] 任弘毅,王艳霞,吴江. 上皮-间质转化与肿瘤转移的相关进展[J]. 四川解剖学杂志,2012, 20(1): 27-35.
[17] 徐娟,唐敏,曹亚. 上皮-间质转化与肿瘤的浸润和转移[J]. 国际病理科学与临床杂志,2008, 28(6): 504-507.
[18] 张满,特木热,郭占林. 上皮间质转化(EMT)与肺癌的关系[J]. 内蒙古医学杂志,2014, 46(12): 1472-1474.
