HIV病毒库清除策略研究进展
2018-01-11张和倩常文仙焦艳梅张纪元王福生
张和倩,常文仙,焦艳梅,张纪元,王福生
·导向与述评·
HIV病毒库清除策略研究进展
张和倩,常文仙,焦艳梅,张纪元,王福生
HIV病毒库的长期存在是HIV患者持续感染和难以彻底治愈的重要原因。目前以高效抗反转录病毒疗法为核心的治疗手段还难以将病毒库彻底清除。研究证实HIV病毒库存在于多种类型的CD4+T细胞内,包括中心记忆CD4+T细胞、CCR4+CCR6+和CXCR3+CCR6+CD4+T细胞、干细胞样记忆CD4+T细胞、Vγ9Vδ2 T细胞及近期证实的滤泡辅助性T细胞等,而且有研究发现巨噬细胞、B细胞中也可能存在病毒库。当前HIV病毒库清除的策略主要有CCR5基因缺陷造血干细胞移植,基因编辑及激活然后杀死等,但这些方法仍然不能有效清除HIV病毒库。最新研究发现HIV潜伏的CD4+T细胞表面CD32a分子特异性高表达,这为病毒库的清除带来新的希望。本文旨在综述可能存在HIV病毒库的免疫细胞及HIV病毒库清除策略的研究进展。
HIV病毒库;免疫细胞;清除策略
1997年,Chun等[1]首次发现HIV存在于CD4+T细胞中,并以一种前病毒形式整合在其中形成病毒库。正是因为病毒库的持续稳定存在,使得艾滋病治愈仍是医学难题。在治疗方面,蛋白酶抑制剂的广泛应用极大地降低了艾滋病病死率[2]。1997年,有研究者采用蛋白酶抑制剂联合2种核苷类似物治疗艾滋病患者,该类患者血浆病毒载量显著降低至不可检测水平。强有力的新非核苷类反转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors,NNRTI)也得到了发展并应用于艾滋病的治疗[3],3种或更多的抗反转录病毒药物的不同组合会对HIV的复制产生持久的抑制作用,这种治疗HIV感染的方法被称为高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART)。HAART可以控制患者病情,使其血浆病毒载量下降到检测不到水平,在一定程度上实现免疫重建,极大地改善HIV感染者的生活质量,但仍不能彻底清除病毒库。完整的HIV基因组整合在静息CD4+T细胞中以前病毒形式稳定存在,很少表达甚至不表达病毒RNA和病毒蛋白[4-5],HAART只能清除活跃复制的病毒,而潜伏的病毒由于缺乏蛋白表达不能被免疫系统及HAART清除,在停止治疗2~3周后又会再度进行复制。病毒可以在这些细胞内潜伏数十年,一旦宿主细胞被激活,它们就可以产生感染性的病毒颗粒。病毒库在感染早期就已形成并且其半衰期达44个月,而要想通过HAART完全清除HIV,须要连续抗病毒治疗60~80年[6]。因此,清除病毒库是艾滋病治愈的一大难题,想要通过清除病毒库治愈艾滋病必须明确HIV病毒库的潜伏感染细胞。本文对病毒库所潜伏的免疫细胞进行具体分析,并对近年一些病毒库清除策略进行总结。
1 HIV病毒库的定义及形成机制
病毒库是HIV在细胞或组织器官的聚集,这些病毒须同时具有复制能力和稳定性。有缺陷的HIV基因序列或衰退的病毒颗粒(不具有复制能力),可被机体免疫系统清除的感染细胞,HAART可清除的病毒,表面蛋白gp120和gp41,分离及活跃复制的HIV均不属于病毒库[7]。目前研究认为,已确定的HIV潜伏及维持的机制主要包括:①宿主缺乏转录因子;②HIV DNA在宿主内异常整合位点阻碍转录;③转录在宿主细胞核内停滞;④表观遗传特征导致转录沉默;⑤病毒完整序列不完全转录;⑥miRNA 对病毒蛋白翻译的限制等。多重互补机制导致HIV在静息CD4+T细胞中长期潜伏。HIV持续存在和潜伏感染主要是由于HIV长末端重复序列(long terminal repeat,LTR)启动子存在于抑制性环境中,导致HIV前病毒DNA转录水平受到抑制。这种抑制性环境包括:组蛋白乙酰酶和其他调节蛋白活性的激活;病毒转录宿主因子的缺失,如核因子κB和转录延伸因子b[8-9]。
2 病毒库检测方法
艾滋病患者经HAART后,血浆病毒载量基本检测不到,但静息CD4+T细胞中仍然潜伏少量的整合的HIV DNA,形成HIV病毒库,这是HIV清除的主要障碍。病毒库很小,每106个CD4+T细胞仅有1~10个感染HIV,形成病毒库[10]。所以,提高检测的敏感性和精确性,有助于识别潜伏HIV病毒库的特征并采取干预措施进行清除[10]。目前,通过检测HIV DNA和RNA寻找病毒库的方法主要有5种。①定量病毒生长测定法(quantitative viral outgrowth assay,Q-VOA)是病毒库检测的金标准。该方法通过定量可被诱导的并有复制能力的HIV DNA检测病毒库,但该法需血量为120~180 ml,劳动强度大,耗时长,测试成本高[11]。②应用较广泛的检测方法是实时定量 PCR(quantitative real-time PCR,qPCR)。 在DNA扩增反应过程中,以荧光化学物质检测每次PCR循环后产物总量的方法。通过内参或者外参法对待测样品中的特定DNA序列进行定量分析,最后通过标准曲线对未知模板进行定量分析,须采用荧光染料,对引物要求高。③液滴数字PCR是一种精确度和灵敏度都高于qPCR的病毒库检测方法,通过在热稳定性油中乳化水性PCR反应实现微分区。这种方法的优势在于可以精确定量基因拷贝数变异情况[12]。④TZA是一种较新的HIV病毒库检测方法,主要利用TZM-bl细胞系,这种细胞稳定表达CD4、CCR5和CXCR4受体,并且在HIV LTR启动子控制下携带整合的β-gal基因。细胞系可以量化诱导静息CD4+T细胞中具有复制能力的HIV。这种方法灵敏度高,需血量少,劳动强度小,测试成本低[13]。对HIV潜伏量检测比Q-VOA检测估量高出多达70倍。⑤目前一种最新的检测方法是用潜伏感染激活剂(latencyreversing agents,LRA)诱导HIV病毒库活化,通过荧光原位杂交检测HIVgag-polmRNA,同时检测HIV Gag蛋白。这种方法检测灵敏度比单独检测 HIV Gag蛋白高1000倍[14]。
3 病毒库在免疫细胞中的分布情况
3.1 病毒库在CD4+T细胞中的分布 患者经HAART后,血浆中的病毒载量下降至检测不到水平,活跃复制的感染细胞被清除,最后只剩少量的潜伏HIV病毒库的感染细胞,CD4+T细胞是HIV潜伏的主要场所。根据细胞表面CD45RA、CCR7和CD27表达情况将记忆细胞分类,中心记忆CD4+T细胞(central memory T cells,TCM)(CD45RA−CCR7+CD27+)和转移记忆 CD4+T 细胞(transfer memory T cells,TTM)(CD45RA−CCR7−CD27+)被认为是主要的病毒库[15]。将记忆CD4+T细胞按CXCR5、PD-1和Bcl-6归类,认为CXCR5+PD-1+Bcl-6+亚群对应的主要是滤泡辅助性T细胞(follicular helper T cell,Tfh),在所有的CD4+T细胞中Tfh包含的HIV DNA最多,体外实验证实Tfh内的HIV可以进行高效复制感染[16]。Tfh是HIV持续感染及潜伏的重要靶标,并成为HIV功能性治愈的主要障碍[17]。近期,有研究表明一种低分化具有很强自我更新能力的长寿命细胞——干细胞样记忆T细胞,也被认为是病毒库存在的主要位置[18]。此外,分别表达CCR6和CCR3的Th17和Th1Th17 CD4+T细胞也具有储存病毒库的能力[19]。有研究认为外周Vγ9Vδ2 T细胞也是HIV潜伏感染的病毒库[20]。
CD4+T细胞是HIV潜伏的主要场所,经HAART后,CD4+T细胞几个不同亚群中稳定存在着具有复制能力的HIV。幼稚CD4+T细胞是一类平均寿命1~8年的长寿命病毒库,记忆CD4+T细胞是一类平均半衰期为1~12个月的短寿命病毒库[16,21],在接受HAART的患者体内,大多数前HIV DNA存在于记忆CD4+T细胞,其次才是幼稚或效应CD4+T细胞亚群[22]。根据细胞表面CD45RA、CCR7和CD27的表达情况,将CD4+T细胞分为幼稚T细胞(naive T cells,TN)(CD45RA+CCR7+CD27+)、TCM、效应记忆T细胞(effect memory T cells,TEM)(CD45RA-CCR7-CD27-)、TTM。HIV病毒库在各类细胞分布情况为TCM占51.7%,TTM占34.3%,TEM占13.9%,TN仅占1.9%。实验证实这些整合HIV前病毒的细胞被激活后可以产生感染性的病毒颗粒。以上数据表明TCM中稳定并持续存在HIV,这与它极低的增殖率及较长的半衰期有很大关系[16]。相较而言,TTM具有较低的病毒载量。
有研究者根据CD4+T细胞表型表达将其分为CCR4+CCR6+、CCR4+CCR6-、CXCR3+CCR6+及CXCR3+CCR6-T细胞,通过表达细胞因子和转移因子分别识别 Th17、Th2、Th1Th17和Th1。在体外实验中,CCR4+CCR6+和 CXCR3+CCR6+表达CCR5和CXCR4复合受体,允许R5和X4型HIV复制,而CCR4+CCR6-T细胞表达CXCR4仅允许X4型HIV复制,CXCR3+CCR6-T细胞表达CCR5和CXCR4,却抑制R5和X4型HIV表达。在未经治疗的HIV感染者中,总的CCR6+T细胞相较于CCR6-T细胞可以储存更多的整合前HIV DNA。在抗病毒治疗的慢性HIV感染者体内,总的CCR6+T细胞、CCR4+CCR6+T细胞和CXCR3+CCR6+T细胞均有下降。因此,研究者认为外周血中CCR4+CCR6+和CXCR3+CCR6+T细胞中存在大量HIV[19]。
干细胞样记忆T细胞被认为是一个重要病毒库。干细胞样记忆T细胞是低分化记忆T细胞群,是通过表达CD45RA、CCR7、CD27和CD62L定义的,具有分化成不同TCM、TEM、终末分化T细胞的能力及自我更新的能力。增殖和自我更新的潜能使干细胞样记忆T细胞能相对的抵消细胞凋亡,因此提供了一个稳定的长期存在的细胞群[18]。
外周 Vγ9Vδ2 T细胞被认为是HIV潜伏感染的病毒库。研究者通过检测18例经长期抗病毒治疗患者的DNA序列,从14例患者体内纯化出Vγ9Vδ2 T细胞,并发现具有复制能力的HIV,据此认为外周 Vγ9Vδ2 T细胞可能是一个没有被发现的潜伏病毒库[20]。
将记忆CD4+T细胞按CXCR5、PD-1和Bcl-6表型归类,有CXCR5+PD-1+Bcl-6+、CXCR5-PD-1-Bcl-6-、 CXCR5+PD-1-Bcl-6-、CXCR5-PD-1+Bcl-6-和 CXCR5+PD-1+Bcl-6+几种表达,CXCR5+PD-1+Bcl-6+T细胞亚群对应的是Tfh,因为病毒主要存在于Tfh中,Tfh和CXCR5-PD-1+细胞群是HIV特异性分布的主要CD4+T细胞亚群,并且在HIV感染的患者中Tfh和CXCR5-PD-1+细胞亚群相较于健康人比例明显增高。CD4+T细胞中Tfh亚群携带HIV DNA的比例最高,该类细胞也是体外最有效的具有活跃复制能力的感染细胞,具有复制能力的病毒很容易从一些非进展期和低病毒载量(<1000 copies/ml)患者Tfh内分离获得[23]。在慢性无临床症状的HIV-1感染者体内,HIV RNA在生发中心Tfh的频率比在非生发中心Tfh频率高。分离HIV感染者的淋巴结后发现,CXCR5+CD4+T细胞群储存的HIV RNA是CXCR5-CD4+T细胞群的11~66倍[24]。
3.2 巨噬细胞作为潜在的病毒库
HIV也可感染巨噬细胞,通过对人源性骨髓瘤小鼠进行实验,Honeycutt等[25]研究发现HAART可以很快抑制巨噬细胞中的HIV,表现为血浆病毒载量迅速下降,治疗停止7周,67%的小鼠未出现病毒反弹,在这些动物的组织巨噬细胞中未获得有复制能力的病毒。但是,在其余的动物体内观察到了病毒存在,并且延迟反弹与组织巨噬细胞持续感染的建立是一致的。这些观察结果成为首次表明体内巨噬细胞中HIV持续存在的直接证据。然而缺乏辅助蛋白Vpx的HIV-2/猴免疫缺陷病毒在巨噬细胞中的复制能力是相当低。研究表明Vpx能解除宿主细胞中SAMHD1的限制,而后者能通过消耗体内的DNA阻止HIV基因的反转录[26-27]。因此在Vpx存在的情况下,巨噬细胞可能是一个主要的病毒库[28-29]。研究证实,尽管人类HIV的Vpx的表达缺乏,但HIV仍然可以在人单核细胞源性巨噬细胞中复制,也可在人类扁桃体组织及阴道黏膜外植体中复制。巨噬细胞作为病毒库一直处于争论中,髓系细胞中大多数HIV DNA表现出的是重排T细胞受体序列,表明髓系细胞中的病毒DNA主要还是通过吞噬感染的T细胞获得[30]。
有研究者利用人源性小鼠证实,即使经HAART后,在小鼠成熟的巨噬细胞中仍然能检测到HIV的DNA和RNA,这些证据说明成熟的巨噬细胞可能是潜在的病毒库[31]。
Bim是巨噬细胞线粒体内的一种促凋亡的负性调控因子。通过分析促凋亡和抗凋亡途径,发现在HIV感染的巨噬细胞内Bcl-2、Mcl-1、Bak、Bax或caspase都没有明显的变化,而Bim表达上调并进入线粒体内。实验结果表明,Bim可能是巨噬细胞作为HIV病毒库抑制细胞凋亡的新机制,或者说进入线粒体的Bim可以作为病毒库的标志物[32]。
3.3 B细胞作为潜在的病毒库 激活的B细胞可能作为潜在的病毒库。有研究证实CD40可介导B细胞表面CD4和CXCR4受体的表达,使B细胞更易感染HIV,成为潜在病毒库[33]。
以上是国内外近年关于病毒库在不同类型细胞类型中分布的研究结果(图1),是否存在于其他类型细胞有待进一步研究。
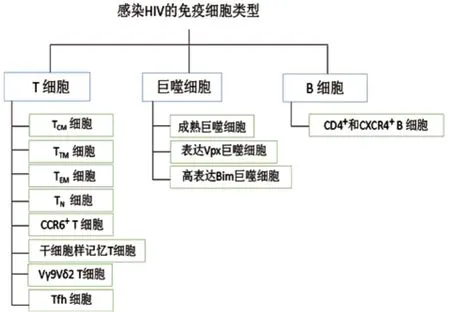
图1 HIV在免疫细胞中的分布情况Figure 1 Distribution of HIV in immune cells
4 病毒库清除策略
4.1 CCR5基因缺陷造血干细胞移植 CCR5基因缺陷造血干细胞移植可能是一种有效的方法,通过强大的清髓疗法将感染和未感染的细胞一起清除,将具有HIV抵制功能的人造血干细胞(表达CCR5受体基因缺陷)移植给患者,使患者的免疫系统重新注入具有HIV抵制功能的成熟细胞,“柏林病人”就是一个成功案例。在2次骨髓移植后成功治愈了白血病并且检测不到HIV,供者是CCR5Δ32纯合子基因型[34-35]。“柏林病人”没有清髓,也没有出现移植物抗宿主反应,很可能是因为这些治疗让“柏林病人”产生了长期的药物性病毒控制,或者是一个功能性治愈,而不是HIV病毒库的彻底清除[36]。但这种方法潜在的风险、高额费用以及治疗相关的后续问题使绝大多数HIV感染者放弃选用此方法并寻求相对安全的方法。目前对骨髓移植方面缺乏关注和研究,仍存在一定的治疗风险。
4.2 基因编辑 减少潜在的病毒库最直接的方法是使没有表达的潜伏病毒库永久的失活。近年,一些关于基因编辑的方法可以实现这一目标。基因编辑手段主要包括使用工程核酸酶如锌指核酸酶、TAL效应器核酸酶或短回文重复序列等,它们可以阻断细胞系或活化的原代细胞中的HIV前病毒。但将这些方法应用于体内静息T细胞时却面临很多挑战,包括如何在静息CD4+T细胞中表达可以编码编辑酶的外显型DNA或RNA。递呈有效量的具有治疗功能的蛋白质进入静息CD4+T细胞并产生作用是一个难题。纳米粒子介导的递送系统可以在体内递送过程中对治疗性的DNA、RNA、蛋白质起保护性作用,并帮助它们穿过质膜进入细胞[38-39]。工程化T细胞受体或嵌合抗原受体疗法(chimeric antigen receptor,CAR)对某些肿瘤的治疗效果显著。目前也有一些科研人员针对HIV开发CAR-T细胞技术,利用类似的方法修饰免疫细胞达到清除病毒库的目的[39]。
直接编码潜伏的HIV基因还存在另一个难题,潜伏的前病毒可以整合在染色体DNA不能接近的区域,这就可以让HIV免于DNA编辑酶的作用,例如,HIV前病毒整合在异染色质上这样一个DNA不表达的区域[40]。此外,HIV基因多样性是其治疗的一大难题,这一点在HIV治疗性抗体的研究方面最为显著,HIV基因的多样性是HIV逃避免疫系统监视及抵制抗病毒药物的重要原因。DNA编辑疗法对病毒的保守区域和同时编辑多个区域的病毒基因组是可行的,但HIV基因多样性成为通过DNA编辑清除原代细胞病毒库的阻碍。直接编辑不表达的HIV基因仍然是一个很大的挑战。总体来说,编辑潜伏的前HIV DNA 是一种十分有潜力的病毒库清除方式。
4.3 赶尽杀绝(kick and kill)主要是激活潜伏的病毒库让其表达相应的病毒蛋白,一旦相应病毒蛋白被表达,则认为这种宿主细胞是储存有病毒库的感染细胞,免疫效应机制和抗病毒治疗就可以杀伤这一类产生病毒蛋白的细胞。如果病毒的激活过程有HAART的介导,那么新一轮的病毒复制将会被抑制。目前待解决的问题是如何安全有效的诱导潜伏HIV 表达相应的病毒蛋白。
安全有效的诱导潜伏HIV表达的方法仍在研究中。抗体(抗CD-3)、细胞因子(IL-2)以及组蛋白去乙酰化酶抑制剂(丙戊酸)等方法已应用于接受抗病毒治疗的患者[41-43],这些方法为激活潜伏病毒提供了重要的信息,虽然它们对HIV病毒库的表达和大小有不同程度的影响效果,但是在HAART停止的情况下,没有一种方法能彻底清除病毒库并阻止病毒库的反弹。是否存在其他可以诱导潜伏HIV表达的因素也还在研究之中,例如蛋白激酶这样的小分子。在潜伏感染的细胞中,免疫抗体包括抗PD-1和抗CTLA4都有可能克服抑制信号的作用,因此其在激活宿主细胞诱导潜伏病毒表达方面起到很大作用[44-46]。
如果潜伏的病毒反转录产生高水平的病毒,那么相应的宿主细胞会被细胞病变效应杀死,然而在病毒表达蛋白很低的情况下,天然免疫不能很好的识别这类细胞,这种杀伤方法并不是很有效,尤其是病毒库内含有抵抗细胞毒性淋巴细胞(cytotoxic lymphocyte,CTL)表位的病毒。因此可以通过注入能特异性识别HIV的CTL表位来扩大细胞杀伤,或者将CTL设计为具有T细胞受体能特异性识别HIV的特异性细胞[47],对病毒库的清除将会有一定的帮助。
HIV表面蛋白表达在感染的宿主细胞表面,因此,要想快速的杀死潜伏感染的细胞就可以通过诱导病毒蛋白表达,如HIV gp120,并用相应的抗体介导细胞杀伤[48]。这种扩大范围的杀伤是很值得研究的。当患者在进行HAART过程中,如果病毒正在进行复制,那么在潜伏感染的细胞诱导病毒表达的同时,HAART则能将其清除,并有可能实现病毒库的彻底清除。
4.4 病毒库标志物CD32a Descours等[49]最新研究发现,低亲和力受体CD32a可能是一种可靠的潜伏HIV基因CD4+T 细胞的表面特征性标志物。研究者首先在体外建立HIV潜伏感染模型,用HIV感染静息CD4+T细胞,后经分析发现CD32a表达明显上调。于是他们从经HAART的HIV感染患者体内分离外周血,结果发现一群CD32a高表达的CD4+T细胞,在所有感染CD4+T细胞中表达CD32a的可达80%以上,并且这一群CD32a+CD4+T细胞内HIV载量是CD32a-CD4+T细胞的1000倍,这部分细胞内的HIV载量可占所有CD4+T细胞病毒储存量的50%以上。这些结果说明了CD32a+CD4+T细胞是一个重要的病毒储存库。如果能被证实,CD32a的发现将会是寻求HIV治愈路上的重要突破。将来,CD32a+CD4+T细胞频率可能作为HIV治疗过程中临床疗效的诊断指标,或是通过这样的标志物设计出具有靶向杀伤的药物,从而达到清除病毒库治愈艾滋病的目的。此项研究不足之处是缺乏不同性别、种族、年龄以及其他组织(肠道、淋巴结、骨髓等)是否存在差异的相关研究。
5 展 望
在过去的几十年里,国内外学者对HIV病毒库进行了大量的研究,主要有HIV病毒库在细胞以及解剖结构中的分布,病毒库的清除策略及免疫疗法。然而病毒库的持续存在依然是艾滋病治愈的一大难题。HIV前病毒整合到宿主染色体上长期稳定存在,复杂的细胞结构及解剖结构使感染HIV的宿主细胞逃脱免疫系统识别[50-51]。本文对国内外近年HIV病毒库研究工作进行总结,便于相关研究工作者了解HIV病毒库存在位置并寻求有效的方法将其彻底清除。CD32a的发现可以准确定位病毒库并将其清除,这一发现为艾滋病的攻克带来了新的曙光。
[1]Chun TW,Carruth L,Finzi D,et al.Quantification of latent tissue reservoirs and total body viral load in HIV-1 infection[J].Nature,1997,387(6629):183-188.
[2]Michaels SH,Clark R,Kissinger P.Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection[J].N Engl J Med,1998,339(6):405-406.
[3]Staszewski S,Morales-Ramirez J,Tashima KT,et al.Efavirenz plus zidovudine and lamivudine,efavirenz plus indinavir,and indinavir plus zidovudine and lamivudine in the treatment of HIV-1 infection in adults.Study 006 Team[J].N Engl J Med,1999,341(25):1865-1873.
[4]Chun TW,Stuyver L,Mizell SB,et al.Presence of an inducible HIV-1 latent reservoir during highly active antiretroviral therapy[J].Proc Natl Acad Sci U S A,1997,94(24):13193-13197.
[5]Finzi D,Hermankova M,Pierson T,et al.Identification of a reservoir for HIV-1 in patients on highly active antiretroviral therapy[J].Science,1997,278(5341):1295-1300.
[6]Kulkosky J,Nunnari G,Otero M,et al.Intensification and stimulation therapy for human immunodeficiency virus type 1 reservoirs in infected persons receiving virally suppressive highly active antiretroviral therapy[J].J Infect Dis,2002,186(10):1403-1411.
[7]Blankson JN,Persaud D,Siliciano RF.The challenge of viral reservoirs in HIV-1 infection[J].Annu Rev Med,2002,53:557-593.
[8]Deeks SG,Lewin SR,Ross AL,et al.International AIDS Society global scientific strategy:towards an HIV cure 2016[J].Nat Med,2016,22(8):839-850.
[9]Tyagi M,Pearson RJ,Karn J.Establishment of HIV latency in primary CD4+cells is due to epigenetic transcriptional silencing and P-TEFb restriction[J].J Virol,2010,84(13):6425-6437.
[10]Strain MC,Lada SM,Luong T,et al.Highly precise measurement of HIV DNA by droplet digital PCR[J].PLoS One,2013,8(4):e55943.
[11]Bruner KM,Hosmane NN,Siliciano RF.Towards an HIV-1 cure:measuring the latent reservoir[J].Trends Microbiol,2015,23(4):192-203.
[12]Hindson BJ,Ness KD,Masquelier DA,et al.High-throughput droplet digital PCR system for absolute quantitation of DNA copy number[J].Anal Chem,2011,83(22):8604-8610.
[13]Sanyal A,Mailliard RB,Rinaldo CR,et al.Novel assay reveals a large,inducible,replication-competent HIV-1 reservoir in resting CD4+T cells[J].Nat Med,2017,23(7):885-889.
[14]Baxter AE,Niessl J,Fromentin R,et al.Multiparametric characterization of rare HIV-infected cells using an RNA-flow FISH technique[J].Nat Protoc,2017,12(10):2029-2049.
[15]Riou C,Yassine-Diab B,Van Grevenynghe J,et al.Convergence of TCR and cytokine signaling leads to FOXO3a phosphorylation and drives the survival of CD4+central memory T cells[J].J Exp Med,2007,204(1):79-91.
[16]Chomont N,El-Far M,Ancuta P,et al.HIV reservoir size and persistence are driven by T cell survival and homeostatic proliferation[J].Nature Medicine,2009,15(8):893-900.
[17]杨鸿鸽,焦艳梅,王福生.滤泡细胞毒性T细胞参与HIV感染进程的研究进展[J].传染病信息,2016,29(6):321-323,344.
[18]Buzon MJ,Sun H,Li C,et al.HIV-1 persistence in CD4+T cells with stem cell-like properties[J].Nat Med,2014,20(2):139-142.
[19]Gosselin A,Monteiro P,Chomont N,et al.Peripheral blood CCR4+CCR6+and CXCR3+CCR6+CD4+T cells are highly permissive to HIV-1 infection[J].J Immunol,2010,184(3):1604-1616.
[20]Soriano-Sarabia N,Archin NM,Bateson R,et al.Peripheral Vγ9Vδ2 T cells are a novel reservoir of latent HIV infection[J].PLoS Pathog,2015,11(10):e1005201.
[21]Farber DL,Yudanin NA,Restifo NP.Human memory T cells:generation,compartmentalization and homeostasis[J].Nat Rev Immunol,2014,14(1):24-35.
[22]Jaafoura S,de Goer DHM,Hernandez-Vargas EA,et al.Progressive contraction of the latent HIV reservoir around a core of less-differentiated CD4(+) memory T Cells[J].Nat Commun,2014,5:5407.
[23]Perreau M,Savoye AL,De Crignis E,et al.Follicular helper T cells serve as the major CD4 T cell compartment for HIV-1 infection,replication,and production[J].J Exp Med,2013,210(1):143-156.
[24]Kohler SL,Pham MN,Folkvord JM,et al.Germinal center t follicular helper cells are highly permissive to HIV-1 and alter their phenotype during virus replication[J].J Immunol,2016,196(6):2711-2722.
[25]Honeycutt JB,Thayer WO,Baker CE,et al.HIV persistence in tissue macrophages of humanized myeloid-only mice during antiretroviral therapy[J].Nat Med,2017,23(5):638-643.
[26]Lahouassa H,Daddacha W,Hofmann H,et al.SAMHD1 restricts the replication of human immunodeficiency virus type 1 by depleting the intracellular pool of deoxynucleoside triphosphates[J].Nat Immunol,2012,13(3):223-228.
[27]Hrecka K,Hao C,Gierszewska M,et al.Vpx relieves inhibition of HIV-1 infection of macrophages mediated by the SAMHD1 protein[J].Nature,2011,474(7353):658-661.
[28]Micci L,Alvarez X,Iriele RI,et al.CD4 depletion in SIV-infected macaques results in macrophage and microglia infection with rapid turnover of infected cells[J].PLoS Pathog,2014,10(10):e1004467.
[29]Ortiz AM,Klatt NR,Li B,et al.Depletion of CD4(+) T cells abrogates post-peak decline of viremia in SIV-infected rhesus macaques[J].J Clin Invest,2011,121(11):4433-4445.
[30]Calantone N,Wu F,Klase Z,et al.Tissue myeloid cells in SIV-infected primates acquire viral DNA through phagocytosis of infected T cells[J].Immunity,2014,41(3):493-502.
[31]Arainga M,Edagwa B,Mosley RL,et al.A mature macrophage is a principal HIV-1 cellular reservoir in humanized mice after treatment with long acting antiretroviral therapy[J].Retrovirology,2017,14(1):17.
[32]Castellano P,Prevedel L,Eugenin EA.HIV-infected macrophages and microglia that survive acute infection become viral reservoirs by a mechanism involving Bim[J].Sci Rep,2017,7(1):12866.
[33]Moir S,Lapointe R,Malaspina A,et al.CD40-Mediated induction of CD4 and CXCR4 on B lymphocytes correlates with restricted susceptibility to human immunodeficiency virus type 1 infection:potential role of B lymphocytes as a viral reservoir[J].J Virol,1999,73(10):7972-7980.
[34]Hutter G,Nowak D,Mossner M,et al.Long-term control of HIV by CCR5 Delta32/Delta32 stem-cell transplantation[J].N Engl J Med,2009,360(7):692-698.
[35]Allers K,Hutter G,Hofmann J,et al.Evidence for the cure of HIV infection by CCR5Delta32/Delta32 stem cell transplantation[J].Blood,2011,117(10):2791-2799.
[36]Marsden MD,Zack JA.Experimental approaches for eliminating latent HIV[J].For Immunopathol Dis Therap,2015,6(1-2):91-99.
[37]Qin XF,An DS,Chen IS,et al.Inhibiting HIV-1 infection in human T cells by lentiviral-mediated delivery of small interfering RNA against CCR5[J].Proc Natl Acad Sci U S A,2003,100(1):183-188.
[38]Buehler DC,Marsden MD,Shen S,et al.Bioengineered vaults:self-assembling protein shell-lipophilic core nanoparticles for drug delivery[J].ACS Nano,2014,8(8):7723-7732.
[39]Kovochich M,Marsden MD,Zack JA.Activation of latent HIV using drug-loaded nanoparticles[J].PLoS One,2011,6(4):e18270.
[40]Jordan A,Bisgrove D,Verdin E.HIV reproducibly establishes a latent infection after acute infection of T cellsin vitro[J].EMBO J,2003,22(8):1868-1877.
[41]Chun TW,Engel D,Mizell SB,et al.Effect of interleukin-2 on the pool of latently infected,resting CD4+T cells in HIV-1-infected patients receiving highly active anti-retroviral therapy.[J] Nat Med,1999,5(6):651-655.
[42]Archin NM,Eron JJ,Palmer S,et al.Valproic acid without intensified antiviral therapy has limited impact on persistent HIV infection of resting CD4+T cells[J].AIDS,2008,22(10):1131-1135.
[43]Archin NM,Liberty AL,Kashuba AD,et al.Administration of vorinostat disrupts HIV-1 latency in patients on antiretroviral therapy[J].Nature,2012,487(7408):482-485.
[44]Porichis F,Kaufmann DE.Role of PD-1 in HIV pathogenesis and as target for therapy[J].Curr HIV/AIDS Rep,2012,9(1):81-90.
[45]Halper-Stromberg A,Lu CL,Klein F,et al.Broadly neutralizing antibodies and viral inducers decrease rebound from HIV-1 latent reservoirs in humanized mice[J].Cell,2014,158(5):989-999.
[46]Marsden MD,Zack JA.Neutralizing the HIV reservoir[J].Cell,2014,158(5):971-972.
[47]Joseph A,Zheng JH,Follenzi A,et al.Lentiviral vectors encoding human immunodeficiency virus type 1 (HIV-1)-specific T-cell receptor genes efficiently convert peripheral blood CD8 T lymphocytes into cytotoxic T lymphocytes with potentin vitroandin vivoHIV-1-specific inhibitory activity[J].J Virol,2008,82(6):3078-3089.
[48]Halper-Stromberg A,Lu CL,Klein F,et al.Broadly neutralizing antibodies and viral inducers decrease rebound from HIV-1 latent reservoirs in humanized mice[J].Cell,2014,158(5):989-999.
[49]Descours B,Petitjean G,Lopez-Zaragoza JL,et al.CD32a is a marker of a CD4 T-cell HIV reservoir harbouring replicationcompetent proviruses[J].Nature,2017,543(7646):564-567.
[50]Henrich TJ,Hanhauser E,Marty FM,et al.Antiretroviral-free HIV-1 remission and viral rebound after allogeneic stem cell transplantation:report of 2 cases[J].Ann Intern Med,2014,161(5):319-327.
[51]Persaud D,Gay H,Ziemniak C,et al.Absence of detectable HIV-1 viremia after treatment cessation in an infant[J].N Engl J Med,2013,369(19):1828-1835.
Research advance in the strategies for the eradication of HIV reservoir
ZHANG He-qian,CHANG Wen-xian,JIAO Yan-mei,ZHANG Ji-yuan*,WANG Fu-sheng*
Department of Clinical Medicine,Bengbu Medical College,233000,China
*Corresponding authors.WANG Fu-sheng,E-mail:fswang302@163.com; ZHANG Ji-yuan,E-mail:uniquezjy@163.com
The persistence of HIV reservoir is an important cause of persistent infection and difficult to cure in HIV patients.It is difficult to completely remove the viral reservoir with HAART at present.Studies have confirmed that HIV reservoir exists in various types of CD4+T cells,including central memory CD4+T cells,CCR4+CCR6+and CXCR3+CCR6+CD4+T cells,stem cell like memory CD4+T cells,Vγ9Vδ2 T cells and recently confirmed Tfh cells.In addition,studies have also found that macrophages and B cells also couple with viral reservoir.Currently,HIV reservoir eradication strategies mainly include CCR5 gene defective hematopoietic stem cell transplantation,gene editing and activation then killing.These methods still can not effectively remove HIV reservoir.Recent studies have shown the specifically high expression of CD32a molecules on the surface of HIV latent CD4+T cells,which provides new marker for the elimination of viral reservoir.We review the possible immunocytes with HIV reservoir and the research progress on the eradication strategies of HIV reservoir.
HIV reservoirs; immunocytes; eradication strategies
R512.91
A
1007-8134(2017)06-0321-06
10.3969/j.issn.1007-8134.2017.06.002
首都特色基金(Z161100000516011)
233000,蚌埠医学院临床医学系(张和倩、常文仙);100039 北京,解放军第三○二医院感染性疾病诊疗与研究中心(焦艳梅、张纪元、王福生)
王福生,E-mail:fswang302@163.com;张纪元,E-mail:uniquezjy@163.com
(2017-09-25收稿 2017-10-20修回)
(本文编辑 胡 玫)
