辐射花粉授粉诱导西瓜单倍体
2018-01-06杨红顾妍张朝阳孙玉东罗德旭
杨红+顾妍+张朝阳+孙玉东+罗德旭


摘要: 以Bonbon、嘉年华二号、先甜74、超玉4个西瓜品种为试验材料,采用辐射花粉授粉结合胚挽救技术,研究其对西瓜单倍体的诱导效果,结果表明,授粉11~12 d的西瓜果实相对较好,能得到较多的幼嫩种子;采用西瓜表面灼烧消毒再取种的方法简便易行,污染率极低。
关键词: 单倍体;辐射花粉;胚挽救;授粉;诱导效果;西瓜
中图分类号: S651.036 文献标志码: A
文章编号:1002-1302(2017)22-0159-03
γ射线是辐射花粉授粉诱导葫芦科蔬菜作物单倍体的有效辐射源。近年来,通过辐射花粉诱导雌核发育获得单倍体技术已应用于育种中,并培育出黄瓜、西瓜、甜瓜等多种葫芦科植物单倍体植株[1-3]。西瓜种子由雌花中的胚珠发育而来,一般普通种子是经授粉后双受精产生,而用辐射处理过的花粉进行授粉无法完成双受精过程而产生瘪种,及时对其进行胚挽救,可以更快得到单倍体。采用化学试剂处理可使雌花不经授粉直接膨大,形成的种子就是单倍体。本试验采用辐射花粉授粉结合胚挽救技术,探讨西瓜辐射花粉经不同胚挽救处理对坐果和单倍体胚产生的影响,为西瓜单倍体材料的获得奠定良好的基础。
1 材料与方法
1.1 试验材料
试验于2012—2014年在江苏徐淮地区淮阴农业科学研究所进行,供试西瓜品种Bonbon、嘉年华二号、先甜74、超玉。Bonbon为日本引进西瓜品种,超玉为江苏徐淮地区淮阴农业科学研究所育成,这2个西瓜品种的种子略大;嘉年华二号和先甜74由先正达公司提供,均为小籽西瓜品种。
1.2 试验方法
1.2.1 γ射线辐照花粉授粉对西瓜种子形成的影响 用辐射处理过的花粉进行授粉,标明花粉辐射剂量及授粉时间;授粉后8~20 d,分别采集正常生长的未成熟果实进行胚挽救试验,调查种子发育情况,同时,尝试用0.1%氯吡脲(重庆诺意)处理部分雌花,使其直接膨大,处理后8 d采集正常生长的未成熟果实进行胚挽救试验。胚挽救以MS培养基为基础添加2%蔗糖、2% D-甘露醇、7%琼脂固化,pH值为 5.8;继代培养以MS培养基为基础添加3%蔗糖、7%琼脂固化,pH值为5.8。
1.2.2 不同消毒方式对西瓜幼胚的消毒效果 将未成熟西瓜果实中的种子取出,放入灭菌烧杯中,用0.1%氯化汞(HgCl2)溶液和不同浓度次氯酸钠(NaClO)溶液分别浸泡 2~30 min(表1);灭菌水冲洗5~6次,置于灭菌纸上吸干水分,接种于灭菌培养基上培养3~5 d,观察是否污染以确定消毒效果。
将取回的西瓜果实用75%乙醇擦拭表面,放于铁盘中,用少量的95%乙醇淋湿西瓜表面,用灼烧方法进行灭菌;无菌手术刀切开西瓜,将西瓜中的未成熟种子接种于灭菌培养基上培养3~5 d,观察是否污染以确定消毒效果。
1.2.3 不同接种方法的接种效果 试验设4个处理:切去种子远胚端约1/3后,将近胚端朝下插入培养基;切去种子远胚端约1/3后,将胚平放于培养基上;种子近胚端朝下插入培养[HJ1.4mm]基;种子平放于培养基上。接种时种子为白色或淡黄色,待种子转绿,转接至普通MS培养基上培养2~5周,种子鼓起、表皮变褐或子叶长出时去除种皮,转接至分化培养基上。
1.2.4 6-BA浓度对西瓜未成熟胚生长的影响 将消毒西瓜种子接种于含有不同浓度6-BA的培养基上培养4 d,观察并记录种子转绿过程及萌发状态。
1.2.5 西瓜种子幼胚观察及倍性鉴定 西瓜种子萌发前,对 种子幼胚进行切片观察;种子萌发至子叶展开,切取顶芽,转接入含有6-BA的MS培养基上进行增殖培养,每个品种扩繁3~4瓶;取部分芽、叶,采用醋酸洋红法进行倍性鉴定。
1.2.6 不同西瓜品种胚挽救效果 调查不同西瓜品种的胚挽救效果,对胚已萌发但未成苗进行统计分析。
2 结果与分析
2.1 γ射线辐照处理对西瓜种子形成的影响
分别用授粉后8~20 d的西瓜种子进行胚挽救试验,结果表明,授粉后10 d内的西瓜种子过于幼嫩,接种时损伤较大,而授粉超过15 d的西瓜种子未成熟胚基本死亡,发育趋于成熟的又都是二倍体种子;授粉11~12 d的西瓜種子相对较好,可得到较多的幼嫩种子用于胚挽救。经氯吡脲处理的西瓜雌花,坐果率较低,但获得的可用种子数较多,而氯吡脲的效果受温度影响较大,试验效果不明显。
2.2 不同消毒方式对西瓜幼胚的消毒效果
由表1可见,各浓度的次氯酸钠溶液对西瓜幼胚的消毒效果不理想,污染率为21.1%~86.5%;随消毒时间的延长,氯化汞溶液对西瓜幼胚的消毒效果较次氯酸钠有显著提高,污染率显著降低(P<0.05);灼烧外皮的消毒方法也相对较好,污染率较低,为2.6%。
2.3 不同接种方法的接种效果
试验表明,由于培养基中加入琼脂后具有一定的弹性,种子插入培养基后会慢慢滑出,成为平放于培养基的状态;种子插入过深,则因组培瓶内水分较大,形成无氧状态,种子迅速死亡。切去种子远胚端约1/3后接种,因组培瓶内水分较大,种子极易变黑死亡;将完整种子直接接种,在种子种皮变白或变褐、种子中间膨起或看到子叶时,将种子去除种皮进行转接,该方法接种效率相对较高,污染较少,但也会出现有部分种子因无法撑破种皮或种子内水分较高而死亡。
2.4 6-BA浓度对西瓜未成熟胚生长的影响
由表2可见,Bonbon、嘉年华二号、先甜74、超玉在6-BA浓度为5 μmol/L时的种子转绿比例相对最高,分别为44.70%、43.48%、20.11%、60.28%;种子转绿与萌发之间没有明显关系,大部分转绿的种子并没有萌发,萌发的种子大多从种皮已褐变的种子萌发而来;嘉年华二号在6-BA为 10 μmol/L 时种子萌发比例相对最高,为7.19%。endprint
2.5 西瓜种子幼胚观察及幼苗倍性鉴定
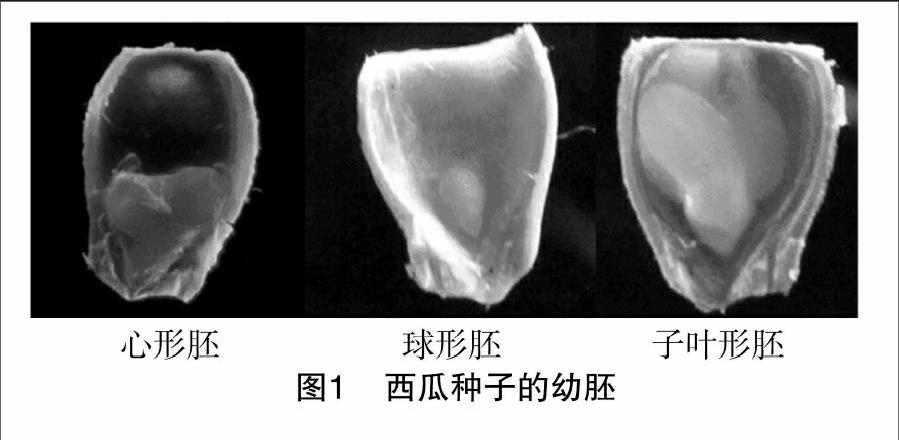
对西瓜种子幼胚进行观察发现,西瓜种子幼胚存在不同形态,由于西瓜种子相对较小,种皮较硬,在剥种子的时候极易损伤幼胚,目前得到心形胚、球形胚、子叶形胚3种形态的西瓜种子幼胚(图1)。普通二倍体西瓜的染色体为2n=22。由图2可见,组培苗根尖组织细胞内含有11条染色体,确定该组培苗材料为单倍体。
2.6 不同西瓜品种胚挽救效果及胚萌发但未成苗原因统计分析
由表3可见,嘉年华二号西瓜种子的萌发率及成苗率明显高于其他品种,而Bonbon西瓜品种的种子却没有1个萌发
成苗。由表4可见,萌发的胚没有生长点是其不能继续生长的主要原因,其异常常见为萌发后的胚异常膨大、表面布满白色绒毛等;嘉年华二号未成苗原因相对最为复杂,除胚无生长点外,还有扩繁失败及培养时玻璃化、褐化、污染、生长异常等现象发生。
3 结论与讨论
试验结果表明,以辐射花粉授粉11~12 d的西瓜果实相
对较好,可得到较多的幼嫩种子,且西瓜果实须当天采当天用,否则无论是室温还是低温条件下储存,都不能保证试验材料的鲜活。目前,已知成功获得西瓜的单倍体植株是由花药培养或胚珠培养[4-7]得来,其消毒方法均采用药剂消毒。本试验发现,西瓜未成熟种子的胚较幼嫩,种皮很薄,用试剂消毒对西瓜未成熟种子损伤较大,且消毒不彻底;完好的西瓜幼瓜内部近似于无菌状态,采用75%乙醇浸泡并灼烧外皮法消毒并取种,其污染率极低。由于花粉辐射受环境限制较大,本试验尝试用氯吡脲处理西瓜,使其不经授粉直接膨大,其幼胚一旦萌发得到的便是单倍体,但采用氯吡脲处理西瓜雌花坐果率较低,接种数千粒种子仅得到几个单倍体材料,加上其过于娇嫩,未能获得加倍材料。氯吡脲处理西瓜并进行胚挽救,获得西瓜单倍体的方法只需静待其萌发,前期处理和接种工作量相对较大,但筛选工作量大大减少。
适用于葫芦科作物的培养基配方多不适于西瓜,而在基础MS培养基中适当增加盐酸硫胺素含量有助于西瓜的生长。西瓜幼嫩种子在含有5~10 μmol/L 6-BA、添加2%蔗糖和2%甘露醇的MS培养基上生长3~7 d,转至无6-BA而添加2~3%蔗糖、1~2%甘露醇的MS培养基上继续生长(添加6-BA含量会影响种子生长)而产生愈伤组织;待西瓜种子的子叶长出可在含有1~10 μmol/L 6-BA、添加3%蔗糖的MS培养基上进行增殖(6-BA 1 μmol/L和5 μmol/L交替使用可防止玻璃化苗的出现),在含有5 μmol/L IBA、添加3%蔗糖的1/2 MS培养基上进行生根培养。吲哚乙酸(IAA)、萘乙酸(NAA)不适用于西瓜单倍体培养,而在培养基中加入0.1%~0.2%的活性炭可能够促进其生长。
Ertan等对南瓜种子的幼胚进行观察,得出8种形态的南瓜种子幼胚,且认为球形胚和心形胚能够培养得到的是单倍体材料,子叶形胚培养得到的是二倍体材料,而其他形态的胚则无法正常发育[8]。本试验结果表明,西瓜种子球形胚经培养得到的是单倍体材料,子叶形胚得到的是二倍体材料,而其他形态的胚则没有发育。
参考文献:
[1] Sauton A,Vaulx R D. Obtention de plantes haploides chez le melon(Cucumis melo L.)par gynogenèse induite par du pollen irradié[J]. Agronomie,1987,7(2):141-148.
[2]Sari N,Abak K,Pitrat M,et al. Induction of parthenogenetic haploid embryos after pollination by irradiated pollen in watermelon[J]. HortScience,1994,29(10):1189-1190.
[3]Abak K,Sari N,Paksoy M,et al. Genotype response to haploid embryo induction with pollination by irradiated pollens in melon,obtaining of dihaploid lines,determination of haploid and diploid plants by different techniques[J]. Turkish Journal of Agriculture and Forestry,1996,20(5):425-430.
[4]薛光榮,余文炎,杨振英,等. 西瓜花粉植株的诱导及其后代初步观察[J]. 遗传,1988,10(2):5-8,49.
[5]王建设,杨 颖,裴晓利,等. 西瓜单倍体的生产方法及其专用培养基:L201010178184[P]. 2010-05-14.
[6]王 静,乔 飞,江雪飞,等. 不同倍性西瓜原生质体制备与低温耐受性分析[J]. 江苏农业科学,2015,43(10):206-209.
[7]王玉书,王 欢,高美玲,等. 小型西瓜花药愈伤组织诱导条件[J]. 江苏农业科学,2015,43(3):30-32.
[8]Kurtar E S,Balkaya A. Production of in vitro haploid plants from in situ induced haploid embryos in winter squash (Cucurbita maxima Duchesne ex Lam.) via irradiated pollen[J]. Plant Cell Tissue and Organ Culture,2010,102(3):267-277.endprint
