富血小板纤维蛋白提取液对经TNF-α刺激下人牙周膜细胞的影响
2017-11-30许晶晶罗子源雷蕾
许晶晶 罗子源 雷蕾
富血小板纤维蛋白提取液对经TNF-α刺激下人牙周膜细胞的影响
许晶晶 罗子源 雷蕾
目的检测富血小板纤维蛋白提取液(PRFe)对肿瘤坏死因子α(TNF-α)刺激下的人牙周膜细胞(hPDLCs)成骨分化能力的影响。方法组织块法分离培养hPDLCs,免疫组化鉴定其来源;Choukroun法制取PRFe;实验分为空白对照组、TNF-α(10 ng/ml)组、PRFe组和PRFe+TNF-α(10 ng/ml)组。碱性磷酸酶试剂盒检测ALP活性;茜素红染色观察细胞矿化功能;Western blotting检测Runx2、Osterix蛋白含量。结果ALP活性检测、茜素红染色和Western blotting结果显示TNF-α组各项指标均低于空白对照组(Plt;0.05),PRFe组各项指标均高于空白对照组(Plt;0.05),PRFe+TNF-α组各项指标均高于TNF-α组(Plt;0.05),PRFe组各项指标均高于PRFe+TNF-α组(Plt;0.05)。结论PRFe可促进经TNF-α刺激的hPDLCs成骨分化。
富血小板纤维蛋白提取液(PRFe); 肿瘤坏死因子α(TNF-α); 人牙周膜细胞(hPDLCs); 成骨分化
2000 年法国学者Choukroun[1]发明了第二代血小板浓缩制品-富血小板纤维蛋白(platelet-rich fibrin extract, PRF),其内包含可促进组织再生的生长因子,有学者用PRFe替代PRF膜进行实验,发现PRFe亦包含大量生长因子[2],可促进细胞增殖及成骨分化[3-5]。肿瘤坏死因子α(TNF-α)是牙周炎发生的关键病理因子[6],可显著抑制细胞成骨分化[7-10]。国内外文献报道多将PRF作用于正常培养的细胞,尚未见将PRF作用于炎症环境中以观察细胞活性的实验研究。本实验通过观察PRFe对经TNF-α刺激后的hPDLCs成骨分化及矿化能力的影响。
1 材料与方法
1.1 材料
DMEM 培养液、0.25%胰蛋白酶、青霉素、链霉素(Gibco,美国);胎牛血清FBS(四季青,杭州);兔抗人波形丝蛋白、角蛋白ck14(中杉金桥,北京);免疫组化试剂盒(博士德,武汉);TritonX-100、地塞米松、β-甘油磷酸钠、维生素C、DMSO(Sigma,美国);人重组TNF-α(Peprotech,美国),碱性磷酸酶试剂盒(南京建成),茜素红(上海源叶),BCA蛋白含量测定试剂盒(凯基生物),鼠抗人Runx2抗体(CST,美国),兔多克隆Osterix抗体(Abcam,美国)。
1.2 方法
1.2.1 hPDLCs的原代培养及鉴定 收集因正畸拔除的新鲜且无牙周炎症的前磨牙,实验在志愿者签署知情同意书后进行。用生理盐水冲洗根面血污后立即置于预冷的DMEM培养液中(含500 U/ml青霉素、500 mg/L链霉素)保存备用。快速转移至超净台中,组织块法行细胞培养。取第2代细胞行波形丝蛋白、角蛋白的免疫组化鉴定。
1.2.2 PRFe的制备 4 名健康志愿者在签署知情同意书后进行血液采集,具体步骤如下:使用2 支无抗凝剂的5 ml一次性真空采血管抽取上肢静脉血,立即以400 g离心力离心10 min,静置后分为4 层,中间层即为PRF。在超净台中将PRF取出,无菌纱布轻压10 s成膜状,浸泡于5 ml新鲜DMEM培养基内,置于37 ℃培养箱中,于第7天后取出浸出液,400 g离心力离心5 min沉淀红细胞,0.22 μm无菌滤器过滤除菌,分装,获得PRFe原液,-80 ℃低温保存备用。每次换液均现配现用,DMEM培养液稀释PRFe原液至50%体积分数即为本实验所用PRFe[2-5]。
1.2.3 实验分组 ①空白对照组:矿化诱导液 (0.1 μmol/L地塞米松,10 mmol/L β-甘油磷酸钠、50 μg/ml维生素C、10%FBS);②TNF-α组:10 ng/ml TNF-α的矿化诱导液;③PRFe组:PRFe矿化诱导液;④PRFe+TNF-α组:10 ng/ml TNF-α的PRFe矿化诱导液。
1.2.4 碱性磷酸酶活性测定 将细胞计数约2×104个/ml的细胞悬液接种至12 孔板(1 ml/孔),每组3 复孔。按照上述实验分组加入相应培养基,分别培养7、14 d后,每孔加入200 μl 1%TritonX-100裂解细胞,4 ℃过夜。按照碱性磷酸酶试剂盒以及BCA蛋白含量检测试剂盒说明书检测各组ALP活性。
1.2.5 茜素红染色法 将细胞计数约2×104个/ml的细胞悬液接种至12 孔板(1 ml/孔)。按照上述实验分组加入相应培养基,分别培养7、14、21 d后,适量多聚甲醛固定后加入适量无菌0.1%茜素红,37 ℃孵箱内放置30 min,双蒸水清洗,拍照。Image-Pro Plus 6.0图像分析软件随机选取3 个视野进行扫描以测定染色矿化结节的积分吸光度A值。
1.2.6 Western blotting检测蛋白含量 将细胞计数约4×104个/ml的细胞悬液接种至6 孔板(2 ml/孔)。按照上述实验分组加入相应培养基,培养14 d后,提取细胞蛋白,通过BCA法确定蛋白的浓度。蛋白变性后,经SDS-PAGE电泳分离目的蛋白,通过湿转法印迹到PVDF膜上,封闭,Runx2、OSX一抗4 ℃敷育过夜,与HRP所标记的二抗结合,加入ECL发光液,凝胶成像系统曝光成像。实验结果经Alpha Ease FC软件进行定量分析。
1.3 统计学分析
图像分析用Image Pro-Plus 6.0、AlphaEaseFC软件。定量指标用SPSS 19.0 软件进行统计学处理,运用方差分析和组间两两比较的LSD检验,检验水准均取双侧α=0.05,分析结果是否具有统计学意义。
2 结 果
2.1 hPDLCs的原代培养以及免疫组化鉴定结果
14 d左右可见长梭形细胞从组织块边缘爬出(图 1A);免疫组化鉴定结果显示:波形丝蛋白染色阳性(图 1B),角蛋白14染色阴性(图 1C),证实细胞为间充质而非上皮性来源。

A: 相差显微镜观察(×100); B: 波形丝蛋白染色阳性(免疫组化染色,×100); C: 角蛋白14染色阴性(相差显微镜观察,×100)
A: Phase contrast microscope(×100); B: Positive reaction of cells to antibodies against vimentin(IHC,×100); C: Negative reaction of cells to antibodies against keratin 14(IHC,×100)
Fig 1 The morphology and identification staining of human periodontal ligament cells
2.2 PRFe的制备
见图 2。

图 2 PRF和PRFe的制备
2.3 碱性磷酸酶法检测ALP活性
根据重复测量的方差分析,ALP活性随着时间的变化与处理因素有关 (F=469.300,P=0.000),在各时间点经组间两两比较ALP活性发现:TNF-α组lt;空白对照组;PRFe组gt;空白对照组;PRFe组gt;PRFe+TNF-α组; PRFe+TNF-α组gt;TNF-α组,且差别均具有统计学意义(Plt;0.05)(表 1)。
2.4 茜素红染色
空白对照组、PRFe、PRFe+TNF-α组在细胞培养第21天均形成不透光的矿化结节,镜下可见重叠生长的细胞呈结节状,胶原堆积。其中PRFe组形成结节时间早,面积大,数量多。而TNF-α组第21天仍未见细胞复层生长,也无矿化结节形成(图 3)。
运用Image Pro-Plus 6.0进行定量分析,根据重复测量的方差分析,各组A均值随着时间的变化与处理因素有关(F=6 041.989,P=0.000),在各时间点经组间两两比较A均值发现:TNF-α组lt;空白对照组;PRFe组gt;空白对照组;PRFe组gt;PRFe+TNF-α组;PRFe+TNF-α组gt;TNF-α组,且差别均具有统计学意义(Plt;0.05)(表 2)。

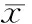
Tab 1 ALP activity of hPDLCs in different groups (±s, n=3)
注: ①与TNF-α组相比,Plt;0.05; ②与PRFe组相比,Plt;0.05; ③与空白对照组相比,Plt;0.05

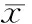
Tab 2 Integrate optical density of hPDLCs in different groups after Alizarin red staining (A, ±s, n=3)
注: ①与TNF-α组相比,Plt;0.05; ②与PRFe组相比,Plt;0.05; ③与空白对照组相比,Plt;0.05
2.5 Western blotting检测蛋白表达
用AlphaEase FC软件进行定量分析。经组间两两比较Runx2、OSX蛋白表达发现,TNF-α组lt;空白对照组;PRFe组gt;空白对照组;PRFe组gt;PRFe+TNF-α组;PRFe+TNF-α组gt;TNF-α组,且差别均具有统计学意义(Plt;0.05)(图 4)。
3 讨 论
牙周炎是累及牙周支持组织的炎症性、破坏性疾病。近年来,牙周组织再生成为国内外学者研究热点,其三大基本要素包括:种子细胞、信号分子和支架材料。
本实验通过使用hPDLCs作为种子细胞,以PRF内生长因子作为信号分子,观察细胞活性。其中,hPDLCs增殖能力强,具有干细胞特性[11];PRF中富含各种生长因子如血小板源性生长因子(platelet-derived growth factor, PDGF)、转化生长因子-β(transforming growth factor β, TGF-β)、胰岛素生长因子(Insulin-like growth factors, IGF)等[2],这些生长因子比例接近人体正常生理状态,解决了外源性生长因子难以配伍、价格昂贵等问题。国内外学者发现,PRFe可促进细胞增殖,上调ALP活性,增强矿化能力,上调成骨相关基因表达[3-5],本实验参考现有文献[2-5]制备PRFe,发现PRFe组各项指标均大于空白对照组,可认为PRF可上调正常培养状态下的hPDLCs成骨效能。

图 3 茜素红染色(×40)
Fig 3 Alizarin red staining(×40)

图 4 实验各组第14天成骨相关蛋白
TNF-α是牙周炎症发生发展及牙槽骨吸收过程中重要的炎症因子[6],国内外学者发现TNF-α可显著抑制hPDLCs及间充质干细胞增殖及ALP活性[7-8],亦可通过激活NF-κB信号,抑制外源性BMP2-Samds信号通路诱导的下游转录因子Runx2的表达,从而抑制成骨[9]。Yang等[10]利用TNF-α(10 ng/ml)构建炎症微环境,发现牙龈间充质干细胞和牙周膜干细胞的成骨效能均下降。本实验参考现有文献[7-10]模拟体外炎症微环境,发现TNF-α组(10 ng/ml)的ALP活性、矿化能力、Runx2蛋白表达均弱于空白对照组,与上述文献结果一致[7-10]。可见运用TNF-α建立体外炎症微环境具有可行性。
本研究利用TNF-α模拟体外炎症微环境,并加入PRFe,观察hPDLCs在炎症刺激状态下的成骨效能。ALP活性的高低可反映细胞成骨方向转化的趋势大小,茜素红染色形成的矿化结节是成骨细胞分化成熟的标志。Runx2是调控细胞成骨分化的特异性转录因子,在多个成骨信号通路中起着核心的作用[12]。Osterix是一种锌指结构的成骨特异性转录因子,研究表明在Osterix基因缺失的小鼠中,无骨形成发生[13]。本实验通过检测各组细胞ALP的活性,矿化结节形成和Runx2、OSX表达,判断各组细胞的成骨能力。通过比较PRFe组和PRFe+TNF-α组各项指标发现,PRFe组的ALP活性强于PRFe+TNF-α组;茜素红染色可见2 组均有明显的矿化结节形成,但PRFe组染色更深,面积更大,形成更早;Western blotting结果显示PRFe组蛋白表达强于PRFe+TNF-α组,说明TNF-α(10 ng/ml)在有PRFe作用的实验组中亦可起到抑制作用。同样,比较TNF-α和PRFe+TNF-α组各项指标发现,PRFe+TNF-α组的ALP活性强于TNF-α组;茜素红染色结果直观显示出TNF-α组不仅细胞密度低,也未见矿化结节形成,而PRFe+TNF-α组镜下可见矿化结节染色深,面积大,密度高,其A值甚至高于空白对照组;Western blotting结果显示PRFe+TNF-α组蛋白表达强于TNF-α组。可见,即使在有炎症因子刺激的前提下,PRFe培养的hPDLCs仍具有良好的增殖活性、成骨分化及矿化能力。其机制可能由于PRFe中所包含的生长因子拮抗TNF-α对细胞产生的抑制作用,如TGF-β1可磷酸化Samd2/Samd3上调Runx2转录[14],从而拮抗TNF-α激活NF-κB信号通路下调Runx2的作用。综上,PRFe不仅对于正常培养的hPDLCs具有成骨作用,且运用TNF-α模拟炎症微环境的前提下,PRFe仍可促进hPDLCs成骨。
PRF是否具有抗炎能力仍值得探讨与研究。Dohan等[15]提出PRF可作为免疫节点增强机体抗感染能力,PRF能否减轻局部免疫反应仍有待进一步验证。此外,本实验采用单一炎症因子模拟牙周微环境,具有一定的局限性,PRF能否促进在其他炎症因子刺激下的hPDLCs成骨分化,待后续实验进一步探索。
[1] Choukroun J,Adda F,Schoeffler C,et al. Une opportunitéen Paro-implantologie: Le PRF[J]. Implantodontie, 2001,42:55-62.
[2] He L, Lin Y, Hu X, et al. A comparative study of platelet-rich fibrin (PRF)and platelet-rich plasma(PRP)on the effect of proliferation and differentiation of rat osteoblastsinvitro[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2009,108(5): 707-713.
[3] Kang YH, Jeon SH, Park JY, et al. Platelet-rich fibrin is a Bioscaffold and reservoir of growth factors for tissue regeneration[J]. Tissue Eng Part A, 2011, 17 (3-4): 349-359.
[4] Clipet F, Tricot S, Alno N, et al.Invitroeffects of Choukroun's platelet-rich fibrin conditioned medium on 3 different cell lines implicated in dental implantology[J].Implant Dent, 2012,21(1):51-56.
[5] 董凯,柳忠豪,张晓洁,等. 富血小板纤维蛋白提取液对成骨细胞影响的实验研究[J].实用口腔医学杂志, 2013,29(4): 472-476.
[6] Górska R, Gregorek H, Kowalski J, et al. Relaitionship between clinical parameters and cytokine profiles in inflamed gingival tissue and serum samples from patients with chronic periodontitis[J]. J Clin Periodontal, 2003, 30(12): 1046-1052.
[7] 牛忠英,史俊南,肖明振,等. 肿瘤坏死因子-α对人牙周膜纤维细胞碱性磷酸酶活性的抑制效应[J]. 中华口腔医学杂志, 1996,31(4):217-219.
[8] Lacey DC, Simmons PJ, Graves SE, et al. Proinflammatory cytokines inhibit osteogenic differentiation from stem cells: Implications for bone repair during inflammation[J]. Osteoarthritis Cartilage, 2009, 17(6): 735-742.
[9] Li W, Yu B, Li M, et al. NEMO-binding domain peptide promotes osteoblast differentiation impaired by tumor necrosis factor alpha[J]. Biochem Biophys Res Commun, 2010,391(2): 1228-1233.
[10]Yang H, Gao LN, An Y, et al. Comparison of mesenchymal stem cells derived from gingival tissue and periodontal ligament in different incubation conditions[J].Biomaterials, 2013, 34(29): 7033-7047.
[11]Nagatomo K, Komaki M, Sekiya I, et al. Stem cell properties of human periodontal ligament cells[J]. J Periodont Res, 2006, 41(4): 303-310.
[12]Franceschi RT, Xiao G. Regulation of the osteoblast-specific transcription factor, Runx2: Responsiveness to multiple signal transduction pathways[J]. J Cell Biochem, 2003, 88(3): 446-454.
[13]Nakashima K, Zhou X, Kunkel G, et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation[J]. Cell, 2002, 108(1):17-29.
[14]Piek E, Ju WJ, Heyer J, et al. Functional characterization of transforming growth factor β signaling in Samd2-and Smad3-deficient fibroblasts[J]. J Biol Chem, 2001, 276(23): 19945-19953.
[15]Dohan DM, Choukroun J, Diss A, et al. Platelet-rich fibrin(PRF): A second-generation platelet concentrate. Part III: Leucocyte activation: A new feature for platelet concentrates[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006, 101(3): e51-55.
(收稿: 2016-08-27 修回: 2016-12-14)
Theeffectsofplatelet-richfibrinextractonhumanperiodontalligamentcellsstimulatedbyTNF-αinvitro
XUJingjing1,LUOZiyuan2,LEILei1.
1. 510632Guangzhou,DepartmentofStomatology,MedicalCollege,Ji'nanUniversity,China; 2.DepartmentofStomatology,ShenzhenPeople'sHospital
Objective: To investigate the effects of platelet-rich fibrin extract (PRFe) on the osteogenetic differentiation and mineralization of human periodontal ligament cells(hPDLCs) stimulated by tumor necrosis factor-α(TNF-α)invitro.MethodshPDLCs were cultured and identified. PRFe was obtained by Choukroun's protocols. The cells were treated as the 4 groups: ① the blank control group, ②TNF-α(10 ng/ml), ③ PRFe and ④PRFe +TNF-α(10 ng/ml) respectively. Alkaline phosphatase activity was detected by the ALP kit. The alizarin red dye was used to observe the mineralization of the cells. Runx2 and Osterix expression was quantified by Western blotting.ResultsThe ALP activity, mineralization level and the expression of Runx2 and Osterin of the TNF-α group were lower that those of the control group(Plt;0.05). The examined indexs of PRFe group were higher than that of the control group(Plt;0.05). The indexs of the PRFe+TNF-α group were higher than that of TNF-α group(Plt;0.05) . The indexs of PRFe group were higher than that of PRFe+TNF-α group(Plt;0.05).ConclusionPRFe may promote the osteogenetic differentiation of hPDLCs stimulated by TNF-αinvitro.
Platelet-richfibrinextract(PRFe);Tumornecrosisfactor-α(TNF-α);Humanperiodontalligamentcells(hPDLCs);Osteogeneticdifferentiation
广东省自然科学基金(编号: 8151063201000065)
510632 广州, 暨南大学医学院口腔医学系(许晶晶 雷蕾); 深圳市人民医院口腔科(罗子源)
雷蕾 020-85220266 E-mail: tleil@jun.edu.cn
Q813.1+1
A
10.3969/j.issn.1001-3733.2017.02.018
