化疗药物所致肝损伤128例临床分析
2017-11-13金明贵刘凯军文良志孙文静崔红莉陈东风颜綦先
金明贵,刘凯军,文良志,王 斌,孙文静,崔红莉,陈东风,颜綦先
化疗药物所致肝损伤128例临床分析
金明贵,刘凯军,文良志,王 斌,孙文静,崔红莉,陈东风,颜綦先
目的分析化疗药物所致药物性肝损伤(drug induced liver injury, DILI)的临床特点,为有效降低DILI发病率,减少病死率提供临床依据。方法根据2015年版《药物性肝损伤诊治指南》,收集我院2012年1月—2016年12月128例化疗药物所致 DILI住院患者临床资料,分析化疗药物种类,出现DILI的时间、严重程度、治疗方式及临床效果。结果本组患者共128例,男性46例(30.51%),女性82例(69.49%),其中最小年龄24.0岁,最大82.0岁,平均(53.2±5.4)岁。使用化疗药物到发生肝损伤时间从2.0~30.0 d,平均(16.3±2.4)d。引起DILI的化疗药物主要有紫杉醇、铂类、环磷酰胺、阿霉素等,联合使用化疗药物可增加肝损伤的发生率及程度。本组患者中DILI的程度:1级(轻度肝损伤)74例(57.81%),2级(中度肝损伤)44例(34.38%),3级(重度肝损伤)8例(6.25%),4级(肝衰竭)1例(0.78%),5级(死亡)1例(0.78%)。治疗方式根据2007年版《急性药物肝损伤诊治建议》(草案):1级肝损伤患者继续使用化疗药物,同时应用口服多烯磷脂酰胆碱胶囊及甘草酸二铵肠溶胶囊;2级肝损伤给予多烯磷脂酰胆碱注射液、异甘草酸镁注射液静脉滴注;3级肝损伤给予多烯磷脂酰胆碱注射液、异甘草酸镁注射液、丁二磺腺苷蛋酸注射液静脉滴注,必要时使用激素及血浆置换。4级、5级除患者给予上述常规治疗外,适时给予激素及血浆置换。多数患者预后良好,治愈117例( 91.40% ),死亡1例(0.78%),慢性化发展为肝硬化2例(1.50%),放弃治疗8例(6.25%)。结论化疗药物所致DILI并不少见,接受化疗的患者常规监测肝功能,及时发现DILI并积极有效处理,绝大多数化疗所致DILI可治愈且预后良好。
化疗药物; 药物性肝损伤;临床分析
近年来我国肿瘤的发生率明显增加,2012年全国新发恶性肿瘤病例约358.6万例,死亡病例218.7万例,全国恶性肿瘤发病率为264.85/10万[1]。恶性肿瘤治疗除手术、放疗外,化疗是临床上应用最为广泛的治疗方式。然而在临床使用中,化疗药物易发生骨髓移植、过敏反应及各器官损伤,药物性肝损伤(drug-induced liver injury, DILI)已引起学者及临床医生的高度重视。李平等[2]报道化疗药物引起的DILI占全部DILI患者的15%以上,为提高对化疗药物所致DILI的诊治水平,本文回顾我院128例化疗药物所致的DILI病例的临床特征、诊断和治疗情况,以期对临床医生有所裨益。
1 对象与方法
1.1 病例选择 对象来源于第三军医大学大坪医院野战外科研究所消化内科128例化疗药物所致的DILI病例。纳入标准:2012年1月—2016年12月经病理检查明确诊断为恶性肿瘤的患者,化疗前均无肝损伤证据,给予化疗药物后出现不同程度临床症状及肝功能异常,根据2015年版《药物性肝损伤诊治指南》(指南)[10],明确诊断为化疗药物所致DILI。
1.2 DILI严重程度分级判断 根据指南对DILI严重程度进行分级,具体分级如下。1级(轻度肝损伤):血清ALT和/或ALP呈可恢复性升高,TBIL < 2.5×ULN(2.5 mg/dl或 42.75 μmol/L),国际标准化比值(international normalized ratio,INR)<1.5,多数患者可适应。患者可有或无乏力、虚弱、恶心、厌食、右上腹痛、黄疸、瘙痒、皮疹或体质量减轻等症状。2级(中度肝损伤):血清ALT和/或ALP升高,TBIL>2.5×ULN,或虽无TBIL升高但INR>1.5,上述症状可有加重。3级(重度肝损伤):血清ALT和/或ALP升高,TBIL升高>5.0×ULN,伴或不伴INR>1.5,患者症状进一步加重,须要住院治疗或住院时间延长。4级(肝衰竭):血清ALT和/或ALP升高,TBIL>10.0×ULN(10.0 mg/dl或 171.00 μmol/L)或每日上升大于 1.0 mg/dl(17.10 μmol/L),INR > 2.0或凝血酶原活动度<40%,可同时出现腹水或肝性脑病;或与DILI相关的其他器官功能衰竭。5级(死亡):因DILI死亡,或须接受肝移植才能存活。
1.3 研究方法 收集128例化疗药物所致DILI患者的病历资料,记录性别、年龄、原发肿瘤类型、化疗药物种类、临床表现、嗜肝病毒感染情况、实验室检查、发生肝损伤时间及严重程度、治疗方法、保肝药物种类、给药方式以及患者预后情况。1.4 统计学处理 采用state 12.0软件进行统计分析,计量资料呈正态分布,用x±s表示。用描述性统计方法计算频数、率或构成比。
2 结 果
2.1 患者性别与年龄 本组128例化疗药物所致的DILI患者中,男性46例(30.51%),女性82例(69.49%),男、女比例为1∶2.3,其中最小年龄24.0岁,最大82.0岁,平均年龄(53.2±5.4)岁。2.2 本组患者中原发肿瘤类型及使用化疗药物情况 128例患者中,乳腺癌28例(21.88%),使用多西紫杉醇+环磷酰胺+阿霉素方案化疗;胃癌14例(10.93%)、结肠癌13例(10.16%),使用奥沙利铂+氟尿嘧啶方案化疗;卵巢癌12例(9.38%)、宫颈癌11例(8.59%),使用紫杉醇+奈达铂方案化疗;胰腺癌20例(15.63%),使用吉西他滨+奈达铂方案化疗;淋巴瘤16例(16.13%),使用吡柔比星+环磷酰胺+长春新碱方案化疗;肺癌14例(14.11%)使用多西紫杉醇+奈达铂方案化疗(见表1)。
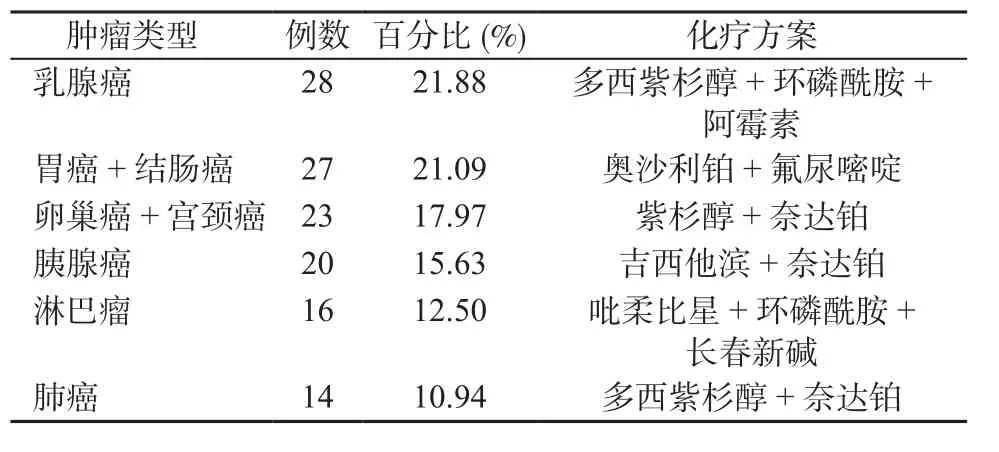
表1 128例肿瘤患者的分类及化疗方案Table 1 Classification and chemotherapy protocols of 128 patients with tumor
2.3 本组患者化疗药物使用例数 本组128例患者中,使用化疗药物最多的是奈达铂57例,占19.00%;环磷酰胺44例,占14.67%;多西紫杉醇42例,占14.00%;阿霉素28例,占9.33%;氟尿嘧啶27例,占9.00%;紫杉醇23例,占7.67%;吉西他滨20例,占6.67%;长春新碱及吡柔比星均为16例,占5.33%(见表2)。
2.4 化疗药物导致DILI的严重程度 128例患者中,1级(轻度肝损伤)74例,占57.81%;2级(中度肝损伤)44例,占34.38%;3级(重度肝损伤)8例,占6.25%;4级(肝衰竭)1例,占0.78%;5级(死亡)1例,占0.78%。其中3级的患者中,合并HBV感染5例,化疗前2周均给予恩替卡韦片0.5 mg/d,2例合并肿瘤肝转移。4级和5级共2例,均有大量饮酒史,未合并乙型肝炎及肿瘤肝转移(见表3)。
2.5 治疗及预后 74例1级肝损伤患者在密切监测下,继续使用化疗药物,同时给予多烯磷脂酰胆碱胶囊,2粒,3次/d,口服,甘草酸二铵肠溶胶囊100 mg,3次/d,口服,68例在1~2周内复查AST、ALP恢复正常,6例患者复查时AST、ALP未恢复,给予多烯磷脂酰胆碱注射液10 mg, 1次/d,静脉滴注,异甘草酸镁注射液150 mg,1次/d, 静脉滴注,2~4周后恢复正常。44例2级肝损伤患者,停用化疗药物,并给予多烯磷脂酰胆碱注射液10 mg,1次/d,静脉滴注 ,异甘草酸镁注射液150 mg,1次/d,静脉滴注 ,26例在1~2周内复查AST、ALP、INR恢复正常,14例复查AST、ALP、INR未恢复正常,继续原方案保肝治疗2~4周,其中13例恢复正常,3例ALP、INR恢复正常,但AST仍未恢复正常,出院后给予多烯磷脂酰胆碱胶囊,2粒,3次/d,口服,甘草酸二铵肠溶胶囊100 mg,3次/d,口服,4~6周后AST恢复正常。4例因原发肿瘤病情加重,患者放弃治疗。
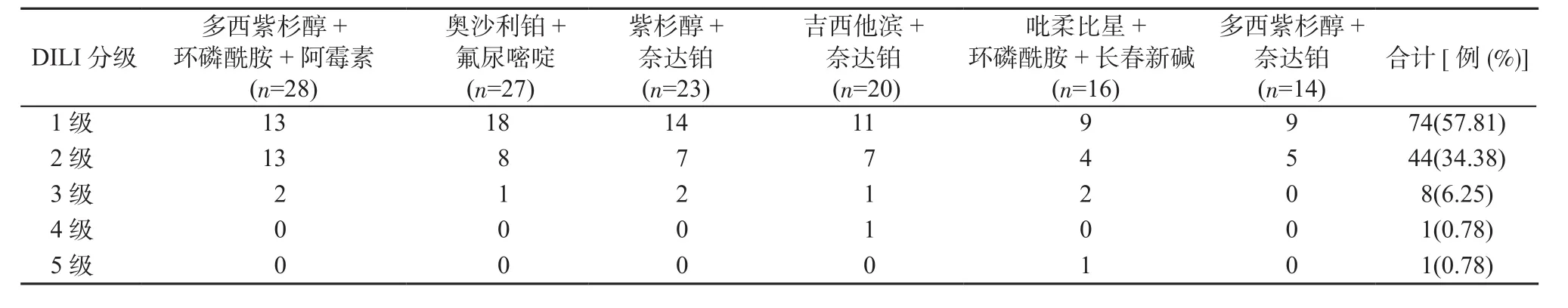
表3 化疗药物性肝损伤肝功严重程度Table 3 Severity of liver injury caused by chemotherapy drug
8例3级肝损伤患者,停用化疗药物,给予多烯磷脂酰胆碱注射液10 mg,1次/d,静脉滴注,异甘草酸镁注射液150 mg,1次/d,静脉滴注,丁二磺腺苷蛋酸注射液1.0 g,1次/d,静脉滴注。3例因原发肿瘤病情加重,患者家属放弃治疗。2例患者2~4周复查AST、ALP、TBIL、INR逐渐恢复正常,另3例4~8周肝功能未恢复正常,给予加服甲泼尼龙20 mg/d,连续2周,1例患者AST、ALP、TB、INR逐渐恢复正常后逐渐减量,2例患者表现为慢性活动性DILI,2年后发展为肝硬化。1例4级肝损伤患者,停用化疗药物,给予多烯磷脂酰胆碱注射液10 mg ,1次/d,静脉滴注,异甘草酸镁注射液150 mg,1次/d,静脉滴注,丁二磺腺苷蛋酸注射液1.0 g,1次/d,静脉滴注,血浆置换治疗1周,患者病情加重,并出现肺部感染,患者家属放弃治疗。
1例5级肝损伤患者,为NK/T细胞淋巴瘤,给予吡柔比星+环磷酰胺+长春新碱治疗后2 d,患者出现急性肝衰竭,积极给予药物及血浆置换等治疗仍无效,6 d后患者死亡。
3 讨 论
我国是恶性肿瘤的高发国家,近年来肿瘤发病率呈上升趋势。临床上化疗药物应用十分广泛,其不良反应已成为肿瘤治疗的常见临床问题[3]。我们通过分析128例化疗药物所致DILI患者的临床资料,发现女性82例,明显多于男性,占69.49%,男、女比例为1∶2.3,与文献报道一致[4]。本组发生化疗药物所致DILI患者年龄24.0~84.0岁,提示该类患者年龄跨度大,可发生于任何年龄,值得临床重视。分析128例DILI患者肿瘤的类型,其主要化疗方案均可发生DILI,女性乳腺癌、卵巢癌及宫颈癌患者化疗易出现化疗相关DILI,消化系统肿瘤如胃癌、结肠癌及胰腺癌化疗时也易出现DILI[5]。有趣的是虽然我国肺癌的发病率最高,但本组中肺癌患者出现DILI仅14例,占本组10.94%,可能与多西紫杉醇的肝毒性相对较小有关。分析本组各种化疗药物的例数,使用最多的化疗药物排序依次为奈达铂、环磷酰胺、多西紫杉醇、阿霉素、氟尿嘧啶、奥沙利铂、紫杉醇、吉西他滨、长春新碱、吡柔比星,提示这些化疗药物诱发DILI的几率各不相同,同时还注意到紫杉醇和环磷酰胺的联合用药导致的DILI患者多达28例,这提示多种化疗药物联合使用时更易发生DILI,这值得临床医生高度重视[6]。
肝脏是人体内进行药物代谢的主要器官。DILI的发生机制主要包括:药物对肝细胞的直接毒性作用、人体对某些药物的特异反应及药物对肝脏血流的干扰等方面。临床上,根据DILI发病机制的差异,DILI分为中毒型和变态反应型[7]。某些药物本身就具有明显的肝毒性作用,可直接或间接地引起肝损伤,例如四氯化碳、对乙酰氨基酚等,这些药物均属于细胞毒性药物,在肝内经过代谢过程后转化为毒性产物,这些毒性产物可以与肝细胞内蛋白质、核酸或脂质等重要分子相结合,进而干扰肝细胞的代谢过程,并破坏肝细胞膜的完整性及细胞内外环境的离子稳态,最终导致肝细胞的变性、坏死及胆汁淤积[8]。药物对肝脏的这种直接毒性作用往往和给药剂量有很大关系。在临床使用这些药物时要高度重视其肝损伤作用,应密切监测患者肝功能,宜每周检测肝功能,若出现肝酶谱升高,更应适时缩短检测时间,动态观察并及时给予处理[9]。
关于DILI的治疗方面从本组资料可以看出化疗药物所致DILI程度一般较轻,本组患者中1级肝损伤患者44例,占57.81%,此类DILI患者病情轻,治愈率高,并不须停化疗药物。根据指南推荐意见:DILI的首要治疗措施是及时停用导致肝损伤的可疑药物,对固有型DILI可停药或减少剂量。但为避免冒然停药可能导致原发疾病加重的风险,该指南提出当出现下列情况之一时应考虑停药:①血清ALT或AST>8×ULN;②ALT或AST>5×ULN,持续2周;③ALT或AST>3×ULN,且TBIL>2 ULN或INR>1.5;④ALT或AST>3×ULN,伴疲劳及消化道症状等逐渐加重,和/或嗜酸性粒细胞增多(>5%)[10]。故化疗药物所致的DILI中2级以上患者均应停用化疗药物,根据指南积极给予保肝治疗。本组患者中2级肝损伤患者44例,除4例原发肿瘤病情加重放弃治疗外,其余40例患者经治疗后肝功能均恢复正常。本组中有8例3级肝损伤患者经治疗后4周内2例患者肝功能恢复,另6例患者中有4例合并转移性肝癌,经抗炎保肝等治疗效果不佳。4级、5级肝损伤各1例,分别为胰腺癌及NK/T细胞淋巴瘤,此两种肿瘤恶性程度高,病情进展快,加之患者有长期饮酒史,给予化疗后出现难以控制的肝衰竭,1例患者放弃治疗,1例患者死亡。故对于存在肝脏基础疾病、原发疾病恶性程度高、进展快的患者,化疗可能会使肝功能急剧恶化,发生肝衰竭甚至死亡[11]。因此临床医生在决定行化疗前应该详细询问患者病史,包括乙型肝炎、丙型肝炎、饮酒史、服药史,并充分评估化疗药物所致DILI的风险,并在化疗前后密切观察其临床症状、实验室指标,一旦发生DILI后,根据指南确定是否停止化疗或是减量使用化疗药物,并给予积极保肝、对症治疗,以促进肝功能尽快恢复,从而提高患者的生活质量,延长患者的生存期[13]。
化疗药物所致DILI并不少见,化疗前评估和预判DILI的风险,治疗期间密切观察肝功能、凝血象[13]。若出现肝损伤,以RUCAM DILI评分表为基础,在排除其他肝损伤原因前提下,尽早明确化疗药物所致DILI的诊断,结合指南与临床综合判断是否停用化疗药物,并及时给予保肝降酶及有力的支持对症治疗,多数患者肝功能会恢复正常,预后较好[14]。
[1]Chen WQ, Zheng RS, Peter D, et al. Cancer statistics in China[J].CA Cancer J Clin, 2016, 66(2):115-132.
[2]李平,谢同柄. 132 例药物性肝损伤临床分析[J]. 实用肝脏病杂志,2010,13(1):48-50.
[3]Miguel A, Azevedo LF, Araujo M, et al. Frequency of adverse drug reactions in hospitalized patients: a systematic review and metaanalysis[J]. Pharmacoepidemiol DrugSaf, 2012, 21(11):1139-1154.
[4]Leise MD, Poterucha JJ, Talwalkar JA. Drug-induced liver injury[J]. Mayo Clin Proc, 2014, 89(1):95-106.
[ 5]Björnsson ES. Drug-induced liver injury: an overview over the most critical compounds[J]. Arch Toxicol, 2015, 89(3):327-334.
[6]李保森,孙颖. 药物性肝损伤的研究现状及存在问题[J]. 传染病信息,2013,26 (5):263-265.
[7]白文元,刘娜. 药物性肝损伤的防范与思考[J]. 临床肝胆病杂志,2011,27 (3):245-247.
[8]唐玉珍,陈竹,吴蓓,等. 169例急性药物性肝损伤的临床特征及易感因素分析[J]. 中国肝脏病杂志:电子版,2014,(2):31-34.
[9]Hayashi PH, Fontana RJ. Clinical features, diagnosis, and natural history of drug-induced liver injury[J]. Semin Liver Dis, 2014,34(2):134-144.
[10]中华医学会肝病学分会药物性肝病学组. 药物性肝损伤诊治指南[J]. 临床肝胆病杂志,2015,31(11):1752-1769.
[11]中国抗癌协会癌症康复与姑息治疗专业委员会. 肿瘤药物相关性肝损伤防治专家共识[M]. 北京:中国协和医科大学出版社,2014:3,32.
[12]Björnsson ES, Bergmann OM, Björnsson HK, et al. Incidence,presentation, and outcomes in patients with drug-induced liver injury in the general population of Iceland[J]. Gastroenterology,2013, 144(7):1419-1425.
[13]Chalasani NP, Hayashi PH, Bonkovsky HL, et al. ACG clinical guidelines: the diagnosis and management of idiosyncratic druginduced liver injury[J]. Am J Gastroenterol, 2014, 109(7):950 -966.
[14]蔡晓娟. 异甘草酸镁与甘草酸二铵治疗慢性乙型肝炎对照观察[J]. 齐齐哈尔医学院学报,2012,33(17):2329-2331.
Clinical analysis of 128 cases with liver injury caused by chemotherapy drugs
JIN Ming-gui, LIU Kai-jun, WEN Liang-zhi, WANG Bin, SUN Wen-jing, CUI Hong-li, CHEN Dong-feng, YAN Qi-xian*
Qijiang Center for Disease Control and Prevention, 401420, China
ObjectiveTo analyze the clinical characteristics of drug-induced liver injury (DILI) caused by chemotherapeutic drugs, and to provide clinical data for effectively reducing the incidence and mortality of DILI.MethodsAccording to the 2015 edition of Guidelines of Diagnosis and Treatment of Drug-Induced Liver Injury, 128 DILI cases from January 2012 to December 2016 in our hospital were included and their clinical data were collected. Type of chemotherapy drugs, DILI onset time, severity, treatment and clinical outcome were analyzed.ResultsThere were 128 patients in this analysis, including 46 males (30.51%) and 82 females(69.49%). The minimum age was 24-year, and the maximum age was 82-year, with an average of (53.2±5.4) year-old. The DILI onset time was from 2 to 30 days, with an average of (16.3±2.4) days. The main chemotherapeutic agents that caused DILI included paclitaxel,platinum, cyclophosphamide, adriamycin and so on. The combination of chemotherapy drugs increased the incidence and severity of liver injury. The severity of DILI included grade 1 (mild liver injury) in 74 cases (57.81%), grade 2 (moderate liver injury) in 44 cases(34.38%), grade 3 (severe liver injury) in 8 cases (6.25%), grade 4 (liver failure) in 1 case (0.78%), and grade 5 (death) in 1 case (0.78%).According to the 2015 edition of Guidelines of Diagnosis and Treatment of DILI, patients with grade 1 liver injury continued to use chemotherapuetic drugs, and meanwhile
oral polyene phosphatidylcholine capsule and diammonium glycyrrhizinate entericcoated capsules. Patients with grade 2 liver injury were given intravenous injection of polyene phosphatidylcholine and magnesium isoglycyrrhizinate. Patients with grade 3 liver injury were intravenously injected with polyene phosphatidylcholine, magnesium isoglycyrrhizinate, and butadisulfonate adenosine. Glucocorticoid and plasma replacement can be also used if necessary. Patients in grade 4 and 5 were given glucocorticoid and plasma replacement besides conventional treatment. The majority of patients had good prognosis, of which 117 cases cured (91.40%), 1 case died (0.78%), 2 cases developed into chronic cirrhosis (1.5%), and 8 cases gave up the treatment (6.25%).ConclusionsDILI caused by chemotherapy drugs is not uncommon. Liver function should be routinely monitored for patients receiving chemotherapy. DILI should be detected and treated actively and effectively. DILI caused by most chemotherapy can be cured and the prognosis is satisfied.
chemotherapy drugs; drug-induced liver injury; clinical analysis
R575
A
1007-8134(2017)05-0298-04
10.3969/j.issn.1007-8134.2017.05.013
国家自然科学基金面上项目(81170382)
401420,綦江区疾病预防控制中心(金明贵);400042 重庆,第三军医大学大坪医院野战外科研究所消化内科(刘凯军、文良志、王斌、孙文静、崔红莉、陈东风、颜綦先)
颜綦先,E-mail: 402010444@qq.com
*Corresponding author, E-mail: 402010444@qq.com
(2017-08-05收稿 2017-09-12修回)
(本文编辑 胡 玫)
