补阳还五汤对脑缺血再灌注损伤大鼠线粒体分裂蛋白Drp1、Fis1及细胞色素C表达的影响*
2017-11-01王士雷孔宪刚藏圆圆
韦 辰,王士雷,孔宪刚,藏圆圆,李 瑜△
1.青岛大学附属医院麻醉科(青岛266000),2.山东省济宁市人民医院麻醉科(济宁272001)
·实验研究·
补阳还五汤对脑缺血再灌注损伤大鼠线粒体分裂蛋白Drp1、Fis1及细胞色素C表达的影响*
韦 辰1,王士雷1,孔宪刚2,藏圆圆1,李 瑜1△
1.青岛大学附属医院麻醉科(青岛266000),2.山东省济宁市人民医院麻醉科(济宁272001)
目的:观察补阳还五汤对脑缺血再灌注损伤大鼠线粒体分裂蛋白Drp1、Fis1及细胞色素C表达的影响。方法:将45只健康SD大鼠分为正常对照组、模型对照组、补阳还五汤组各15只,模型对照组以及补阳还五汤组给予Bannister's颈动脉引流法以建立大鼠缺血再灌注脑损伤的动物模型,补阳还五汤组于造模造模后腹腔给药补阳还五汤0.4ml/(kg·d) 1次,共用药7d,其余两组给予使用方式、剂量及使用频率和补阳还五汤组相同至实验结束。比较各组大鼠情况、神经功能缺损评分、海马神经细胞凋亡率、Drp1,Fis1和cyt-c的表达水平、Ca2+荧光强度、钙调神经磷酸酶活性比较。结果:治疗后,与正常对照组相比,模型对照组及补阳还五汤组Drp1、Fis1及cyt-c表达水平较高(P<0.05),神经功能评分较高(P<0.05),海马神经元细胞凋亡率较高(P<0.05),Ca2+浓度及钙调神经磷酸酶活性较高(P<0.05);与模型对照组相比,补阳还五汤组Drp1、Fis1及cyt-c表达水平较低(P<0.05),神经功能评分较低(P<0.05),海马神经细胞凋亡率较低(P<0.05),Ca2+浓度及钙调神经磷酸酶活性较低(P<0.05)。结论:补阳还五汤可在一定程度上下调缺血再灌注脑损伤大鼠Drp1、Fis1、cyt-c的表达水平以及海马神经细胞凋亡率,抑制线粒体分裂减轻大鼠海马神经元缺氧复氧损伤,缓解脑缺血进一步损伤,有望为临床治疗方面提供新的干预方法。
心脑血管疾病是威胁人类健康的重要疾病[1-2],本病的发病率、死亡率以及致残率均呈逐年升高趋势。研究发现,脑组织对缺血缺氧较为敏感,一般缺血再灌注患者多存在加重脑功能损伤[3],使患者学习记忆功能下降,为本人及其家庭以及社会带来沉重的经济、心理负担。临床处理缺血后再灌注损伤,一般应用多种药物进行预处理以及后处理。综合近年来脑缺血再灌注损伤方面的临床研究发现,中医药治疗缺血再灌注脑损伤中获得一定的进展。补阳还五汤是治疗缺血性脑血管疾病和其后遗症的理想中药制剂,由黄芪、当归尾、川芎、赤芍、桃仁、红花以及地龙等中药组成,具有补气活血、通络祛瘀之功效,在机体代谢过程中能够产生自由基和脂类过氧化物[4],改善微循环,加速脑缺血损伤修复。有研究显示,补阳还五汤能够扩张血管,使心率及血压水平降低,减缓心肌细胞代谢,使心肌细胞氧耗水平降低[5],线粒体ATP储存量降低,以缓解缺血再灌注脑损伤。此外,海马区脑组织是缺氧缺血反应较为敏感区域,线粒体分裂相关蛋白Drpl及Fisl的共定位结合能够促进线粒体分裂,使脑损伤加重[6]。临床针对本方面的报道较少,因此本文利用缺血再灌注脑损伤模型大鼠,以探究补阳还五汤对脑缺血再灌注损伤大鼠线粒体分裂蛋白Drp1、Fis1及细胞色素C表达的影响。
材料与方法
1 材 料 补阳还五汤(由黄芪、赤芍各30 g,当归尾15 g,川芎、桃仁、红花、地龙各10 g组成,上药水煎煮过滤取上清液,调药浓度至200%,采用高压灭菌于4℃环境内保存待用,取汁50ml),药物及煎煮设备由辽宁中医药大学附属医院院内制剂室提供;注射用异戊巴比妥钠,规格:每支0.25 g,批号:20160112,上海新亚药业有限公司;10%甲醛溶液、4%多聚甲醛、4%甲醇、10%水合氯醛、胰酶、苏木素以及伊红染料等由西恩(大连)生物技术有限公司提供;DMEM F12 10 X 500 ml,上海意杰生物科技有限公司;碘化丙啶及Annexin-V,北京泰泽瑞达科技有限公司;Fluo3-AM以及Pluronic F127,西宝生物科技(上海)股份有限公司。
美国Buxco公司的FinePointe小动物通用呼吸机,北京拜安吉科技有限公司;小动物行为活动记录系统,香港友诚生物科技有限公司;HM525冰冻切片机,北京华兴科仪科技发展有限公司;Storm多功能图像分析仪,通用电气医疗系统贸易发展(上海)有限公司(GE);MIA-V型生物显微图像分析系统,杭州万深检测科技有限公司;Apogee A50 Micro流式细胞仪,香港伯齐科技有限公司;鼠抗Drpl单克隆抗体一抗、鼠抗Cyt C单克隆抗体一抗、鼠抗Cyt C单克隆抗体一抗,北京百奥莱博科技有限公司;尼康 Nikon C1Si激光共聚焦显微镜,上海衡浩仪器有限公司;Annexin V-FITC Apoptosis Detection试剂盒,北京永泰兴成商贸有限公司。
2 实验方法
2.1 实验分组:选择45只健康SD大鼠SPF级,体重(300±35) g,大鼠由南京君科生物工程有限公司提供,货号:J007。医动字第19~2050号。动物许可证号:SYXK(京)2017-0113。将45只大鼠随机分为正常对照组、模型对照组及补阳还五汤组,每组各15只。分笼饲养,大鼠使用的笼具、饲料及垫料等均高压消毒,能够正常自由饮水,标准饲料喂养,大鼠应用物品每隔3 d进行消毒。实验室温度维持于21℃~23℃,适应性喂养1周。
2.2 模型建立:所有大鼠造模前均接受10 h禁食水。模型对照组及补阳还五汤组采用Bannister's颈动脉引流法[7],脑缺血再灌注模型制作方式如下:健康Wistar大鼠仰面固定于手术台上,予以3%注射用异戊巴比妥钠50 mg/kg腹腔注射实施麻醉,肝素100 U/kg尾静脉注射抗凝,行气管插管,小动物呼吸机辅助呼吸,以60 次/min,潮气量15 ml/kg,将两侧颈总动脉及右侧颈浅静脉进行分离,夹闭左侧颈总动脉并结扎右侧颈总动脉近心端与右侧颈浅静脉远心端,将右侧颈总动脉和颈浅静脉间采用导管搭桥,令基底动脉的血流从右侧颈内动脉以及颈总动脉逆流至颈静脉形成脑缺血,潮气量降低为10 ml/kg,15 min后打开夹闭的颈总动脉,将右侧颈总动脉回流切断,如此反复缺血再灌注3次,最后回复血供,缝合皮肤。正常对照组只分离动脉但不插线。苏醒后根据Longa’s 的5级标准评分标准对神经功能进行评分,选择1~3分的大鼠进行实验。
2.3 给药方法:模型建立成功后,补阳还五汤组予以腹腔注射补阳还五汤1 ml /100(mg·d),共用药7 d,其余两组均给予等量0.9%氯化钠,使用方法、剂量及使用频率和补阳还五汤组完全相同至实验结束。每日喂养全价饲料,自由饮水,保证充足饮水,维持每日人工排尿3次。
3 观察指标 研究期间,观察并记录大鼠活动、饮食饮水以及毛色情况,测量体质量。
所有受试大鼠均于用药第7日进行神经功能缺损评分,参考Garcia标准[7]对大鼠自发性活动、四肢运动对称、前脚伸展、攀登、对双侧躯干的接触反应以及触须反应进行评定,各项评分1~3分,总评分最低分3分,最高分18分。
10%水合氯醛(3.5ml/100g)腹腔注射麻醉后,心脏灌注生理盐水及4%多聚甲醛,灌注完毕后在0℃下迅速断头取脑,获取海马组织,加入0.5%的胰酶在37℃下恒温水浴消化20 min,消化完全后置入10%血清DMEM-F12培养基内终止消化,将海马组织消化悬液过滤并于1200r/min-1离心15 min,弃上清液洗涤,将其置于4%甲醛溶液内固定保存,便于免疫组化检测以及细胞凋亡检测。采用Western blot法检测线粒体分裂相关1(Drp1)、线粒体分裂蛋白1(Fis1)以及细胞色素c (cyt-c)表达水平。消化、离心收集神经元细胞,并稀释为1×106/L细胞悬液,与碘化丙啶及Annexin-V混合,震荡室温避光孵育15 min,应用流式细胞仪以及统计分析软件检测细胞凋亡率;采用24孔板爬片培养的神经元,利用Hank冲洗液冲洗3~5遍,置入Fluo3-AM以及Pluronic F127工作液体避光染色45 min,利用Hank冲洗液冲洗3~5遍,4%多聚甲醇固定,甘油防淬灭封片后,采用激光共聚焦显微镜检测Ca2+荧光强度为Ca2+浓度;进行细胞刮除、离心收集神经元后,裂解细胞并提取蛋白,应用BCA法检测蛋白浓度,并应用CaN detection试剂盒检测钙调神经磷酸酶活性。

结 果
1 各组大鼠情况 实验过程中严格遵守无菌操作,正常对照组大鼠毛色光亮,活动正常,能够正常饮水饮食,前腿伸展情况良好,四肢能够正常爬行,平均体重为(310.45±36.54)g;模型对照组大鼠毛色暗,活动度显著降低,进食困难,肢体行动极度无力甚至不能运动,四肢攀爬困难,反应弛缓,平均体重为(252.53±27.39)g;补阳还五汤组造模期间大鼠毛色暗,但应用补阳还五汤皮下注射后,部分大鼠毛色恢复光亮,症状有所缓解,活动正常,饮食饮水正常,肢体行动活动较模型对照组好转,四肢能够正常攀爬,反应较模型组迅速,平均体重为(281.39±33.70) g。
2 各组大鼠海马神经原相关蛋白表达水平比较 治疗后,与正常对照组相比,模型对照组及补阳还五汤组Drp1、Fis1及cyt-c表达水平较高(P<0.05);与模型对照组相比,补阳还五汤组Drp1、Fis1及cyt-c表达水平较低(P<0.05),见表1。
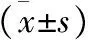
表1 各组大鼠海马神经原相关蛋白表达水平比较
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05
3 各组大鼠神经功能评分比较 正常对照组神经功能评分为0,模型对照组为(1.89±0.24)分,补阳还五汤组为(1.07±0.16)分, 治疗后,与正常对照组相比,模型对照组以及补阳还五汤组神经功能评分较高(P<0.05);与模型对照组相比,补阳还五汤组神经功能评分较低(P<0.05)。
4 各组大鼠海马神经元细胞凋亡率比较 治疗后,与正常对照组细胞凋亡率(2.30±0.35)%相比,模型对照组细胞凋亡率(50.39±7.08)%及补阳还五汤组海马神经元细胞凋亡率(29.39±4.02)%较高(P<0.05);与模型对照组相比,补阳还五汤组海马神经细胞凋亡率较低(P<0.05)。
5 各组大鼠海马组织神经元各指标比较 治疗后,与正常对照组相比,模型对照组及补阳还五汤Ca2+浓度及钙调神经磷酸酶活性较高(P<0.05);与模型对照组相比,补阳还五汤组Ca2+浓度及钙调神经磷酸酶活性较低(P<0.05),见表2。
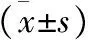
表2 各组大鼠海马组织神经元各指标比较
注:与正常对照组比较,*P<0.05;与模型对照组比较,#P<0.05
讨 论
心血管病发病人数持续增加,其中发病最高的即为缺血性脑血管病[8]。脑缺血发生时脑组织内生物电发生改变,产生病理性慢波并经过一定时间发生再灌注,慢波持续并加重,随缺血损伤时间不断延长,兴奋性递质水平下降[9],缺血期的可逆性损伤经恢复血流后加重或转化,出现不可逆损伤,即脑缺血再灌注损伤[10]。脑缺血所引起的脑功能损伤对患者生活质量及其家庭造成恶劣影响。为此寻求改善脑缺血再灌注的治疗药物是当前医学界的关键课题之一,补阳还五汤是一种具有补气活血、通经活络作用的汤剂,已有研究证实,补阳还五汤中黄芪能够扩张血管、降低血压[11];川芎能够活血行气、祛风之痛,其所含主要成分生物碱川芎嗪能通过诱导血栓素A2样物质从而抑制血小板聚集[12];当归、赤芍、桃仁、红花以及地龙等药物均能够改善微循环,抑制血小板聚集。
现代研究显示,海马脑区是脑缺血再灌注的选择性易损区,细胞凋亡是一个持续动态变化过程[13],同时伴有大鼠海马皮层及海马神经细胞核固缩、退化、变形、坏死甚至消失,使海马细胞排列不规则存在凹陷,海马神经元细胞凋亡率增高[14]。此外钙超载是诱发脑缺血再灌注损伤的关键机制之一,钙调神经磷酸酶活性和细胞内钙离子的浓度具有紧密联系,能够直接或间接激活线粒体分裂相关蛋白Drpl(Drp1),以促进Drp1由细胞质转位至线粒体外膜,并与Fis1相结合诱发线粒体分裂。自1850年人类发现线粒体,对其结构和认识不断进展,现今我们对线粒体的定义已不是静止而是不断融合-分裂的动态网状系统亚细胞结构,能够维持线粒体膜电位,对心肌纤维具有重要的影响作用[15]。现代研究显示,线粒体参与线粒体生物再生、细胞氧化代谢、细胞坏死以及凋亡等多种细胞的生理过程,其中Drp1是加速细胞分裂的主要蛋白,分布于细胞浆内,是街道线粒体分裂的主要分子,其表达水平较高能够诱发线粒体网状结构受损。曾有研究显示,线粒体动力相关蛋白Drpl水平升高,线粒体的分裂加速,网状结构受损从而抑制线粒体动力相关蛋白,加速线粒体融合以及延长网状结构,加速线粒体损伤的修复。细胞色素c (cyt-c)是一种重要的水溶性氧化还原血红蛋白,是电子呼吸链重要的成员,分布于原核生物以及真核生物细胞的线粒体内膜内,是参与氧化还原反应电子传递中的重要物质。近年来曾有研究人员对cyt-c进行研究发现,以cyt-c为代表的氧化还原蛋白质和酶的直接电化学不仅与机体内在的热力学以及动力学性质具有紧密联系,还能够加速电极物质和具有高催化、传感性的生物大分子结合作用,是机体物质代谢及能量转换的关键环节。我们研究显示,治疗后,与正常对照组相比,模型对照组及补阳还五汤组Drp1、Fis1及cyt-c表达水平,神经功能评分,海马神经元细胞凋亡率,Ca2+浓度及钙调神经磷酸酶活性较高;与模型对照组相比,补阳还五汤组Drp1、Fis1及cyt-c表达水平,神经功能评分,海马神经元细胞凋亡率,Ca2+浓度及钙调神经磷酸酶活性较低。提示补阳还五汤通过抑制Drp1、Fis1及cyt-c表达发挥了对脑缺血再灌注大鼠的脑保护作用,降低海马神经元细胞凋亡率,可能是补阳还五汤防止缺血性脑血管疾病的主要机制之一。
综上所述:补阳还五汤可在一定程度上下调缺血再灌注脑损伤大鼠Drp1、Fis1、cyt-c的表达水平以及海马神经细胞凋亡率,抑制线粒体分裂减轻大鼠海马神经元缺氧复氧损伤,缓解脑缺血进一步损伤,有望为临床治疗方面提供新的干预方法。
[1] Alshraideh H,Otoom M,Alaraida A,etal.A Web Based Cardiovascular Disease Detection System[J].Journal of Medical Systems,2015,39(10):1-6.
[2] 罗胜勇,叶寿山,李 睿,等.抗血小板溶栓素对局灶性脑缺血/再灌注大鼠脑损伤的作用观察[J].中国临床药理学与治疗学,2015,20(3):274-278.
[3] 苏峻峰,胡小辉,夏烈新.姜黄素对新西兰大白兔脑缺血再灌注损伤保护作用及缺氧诱导因子-1α表达的影响[J].山西医药杂志,2015,44(5):511-514.
[4] 李 嫦.针刺联合补阳还五汤治疗脑中风后遗症随机平行对照研究[J].实用中医内科杂志,2015,29(11):154-156.
[5] 苏 平,黄建华.补阳还五汤配合康复疗法治疗脑梗塞疗效观察[J].陕西中医,2013,34(7):805-806.
[6] Cheng G,Kong R H,Zhang L M,etal.Mitochondria in traumatic brain injury and mitochondrial-targeted multipotential therapeutic strategies.[J].British Journal of Pharmacology,2012,167(4):699-719.
[7] Zhang Jianfeng.Ultrastructural changes of rat cortical neurons following ligustrazine intervention for cerebral ischemia/reperfusion injury[J].Neural Regeneration Research,2008,3(1):41-43.
[8] 刘 群,赵 冬,王 薇,等.中国35-64岁人群白细胞计数与心血管病发病危险的前瞻性研究[J].中华心血管病杂志,2008,36(5):453-457.
[9] 陶 宸,李梦阳,曲 鹏.脑缺血-再灌注损伤时兴奋性递质谷氨酸的释放机制[J].科技资讯,2015,13(24):244-245.
[10] 张 婧,邹玉安,董晓华.缺血预处理对脑缺血再灌注损伤保护作用的研究进展[J].神经药理学报,2015,5(5):57-64.
[11] 陈 柯.黄芪注射液治疗高血压肾损害研究进展[J].实用中医药杂志,2014,30(2):166-167.
[12] 王 菲,王广生,强 辉,等.川芎嗪对皮质神经元在氧糖剥夺损伤中的保护作用[J].陕西中医,2011,32(1):108-111.
[13] 刘 斌,董晓柳,张文彦,等.急性脑缺血再灌注大鼠海马CA1区细胞凋亡与β-catenin、GSK-3β蛋白表达的关系[J].山东医药,2012,52(17):28-31.
[14] 孟红旗,蒲 凡.脑缺血致痴呆大鼠海马神经元的病理改变[J].陕西医学杂志,2010,39(12):1579-1581,1588.
[15] 陶 元,彭凯歌,但国蓉,等.线粒体融合/分裂对线粒体的质量控制作用[J].现代生物医学进展,2015,15(23):4588-4590.
*国家自然科学基金资助项目(81371448)
△通讯作者
脑缺血/中西医结合疗法 补阳还五汤 再灌注损伤 线粒体分裂蛋白1 线粒体分裂基因动态相关蛋白 细胞色素C 动物,实验
R743.31
A
10.3969/j.issn.1000-7369.2017.10.080
(收稿:2017-04-28)
